酵母菌菌株对普洱茶主要功能成分的影响
2017-11-03李雪玲陈华红张金丽王波周红杰
李雪玲,陈华红,*,张金丽,王波,周红杰
(1.楚雄师范学院化学与生命科学学院,云南楚雄675000;2.云南农业大学普洱茶学院,云南昆明650201)
酵母菌菌株对普洱茶主要功能成分的影响
李雪玲1,陈华红1,*,张金丽1,王波1,周红杰2
(1.楚雄师范学院化学与生命科学学院,云南楚雄675000;2.云南农业大学普洱茶学院,云南昆明650201)
从渥堆普洱茶样中分离纯化得到一个酵母菌菌株,使用该菌株对普洱茶生茶样进行发酵,对发酵前后茶叶中的重要风味化学成分(氨基酸、茶多酚、咖啡碱、黄酮、儿茶素和茶色素)的变化进行了分析。研究表明,经过酵母菌发酵,茶样中的茶多酚、儿茶素、茶黄素的含量增加,而氨基酸、咖啡碱、黄酮、茶红素、茶褐素的含量减少,与渥堆发酵普洱茶有一定差异,因此酵母菌对普洱茶的品质形成具有较大影响。
酵母菌;发酵;风味化学成分
普洱茶作为云南的特色产品,不仅具有独特的风味,而且具有多重保健功效[1]。现代的普洱茶是以云南大叶种茶(Camellia sinensis(var.)assamica)的鲜叶制成的晒青毛茶为原料,经潮水、渥堆、陈化及干燥等特殊工序加工而成的人工后发酵茶[2]。普洱茶渥堆过程中的微生物、温度、水分等环境条件以及发酵时间等对普洱茶品质的影响已有较多的研究[3-4]。当前主要是在传统的渥堆后发酵方法的基础上,人为接种专用优势菌种进行普洱茶的后发酵生产,以抑制杂菌和有害菌群的生长,缩短发酵时间、提高生产效率,减少环境条件等外界因素对生产过程的影响,保证产品的稳定性。人们已认识到不同的菌种对普洱茶的品质可产生不同的影响[5]。但不同的发酵微生物到底对普洱茶发酵有什么影响,对促进普洱茶特征品质成分的形成有什么样的作用还需要深入的研究。
酵母属(Saccharomycetes)酵母在自然界分布较广,一些酵母菌在酿酒业,食品加工等多个领域的应用历史悠久。研究发现,酵母菌菌体富含蛋白质、氨基酸及多种B族维生素,且具有特殊酶系统,可生产食用、药用和饲用蛋白[6]。有机物经酵母菌发酵后,其蛋白质、维生素A等物质的生物活性会大幅度提高[7]。在酵母菌所分泌的胞外酶酶促作用下,茶叶中可发生一系列复杂变化,包括茶多酚氧化,缩合蛋白质降解,碳水化合物的分解以及各产物之间的相互聚合等一系列反应[8],这一系列的化合物可赋予普洱茶独特的红褐色和特别的陈香味。但酵母菌对普洱茶品质形成的具体影响还没有较为深入和系统的研究。
本研究选用一个分离自普洱茶的酵母属酵母菌株(Saccharomycetes sp.)作为发酵菌株,以晒青毛茶为原料,对灭菌的普洱生茶进行单菌发酵。通过比较发酵前后茶叶中主要功能性化学成分的变化,分析酵母菌对普洱茶品质形成的影响,以期为普洱茶加工工艺的改进和普洱茶品质的提高以及特色普洱茶产品的开发提供相关的试验和理论依据。
1 材料、试剂与仪器
试验用茶叶:选用云南大叶种茶晒青毛茶-无叶白毫的春茶、夏茶和秋茶,由普洱市孟连行健普洱茶开发有限公司提供;试验用微生物:分离自普洱茶产区普洱茶渥堆发酵第一翻采集茶样。
菌种分离培养基:茶汤培养基(茶叶30 g,加水400 mL,煮沸 30 min,过滤定容至 1 000 mL,琼脂 20 g,pH自然);菌种活化培养基:PDA培养基。
722S可见光分光光度计:上海菁华科技仪器有限公司;754紫外分光光度计:上海第三分析仪器厂。
2 方法
2.1 发酵酵母菌种的分离与纯化
采集普洱熟茶茶样,采用稀释涂布平板法进行分离[9]。
2.2 菌株鉴定
通过菌落形态观察和细胞显微形态特征研究初步鉴定,再进一步使用天根的酵母菌基因组提取试剂盒提取酵母菌株DNA,通过PCR扩增ITS序列进行分析[10],确定酵母菌株分类地位。在NCBI网站对测得的ITS序列进行序列的BLAST分析。采用MEGA 6软件进行多序列比对及系统发育分析。
2.3 茶样中主要功能性化学成分的测定
氨基酸含量测定采用茚三酮比色法GB 5009.124-2016《食品安全国家标准食品中氨基酸的测定》;咖啡碱含量测定采用紫外分光光度法GB/T 8312-2013《茶咖啡碱测定》;茶多酚含量测定采用福林酚试剂法GB/T 8313-2008《茶叶中茶多酚和儿茶素类含量的检测方法》;茶红素、茶黄素、茶褐素含量测定采用萃取比色法[11-12]。儿茶素含量测定采用香兰素比色法[13]。黄酮含量测定采用槲皮素比色法[14-15]。
2.4 茶样的发酵
2.4.1 菌株的活化
使用PDA培养基对酵母菌菌株进行活化并培养备用。
2.4.2 菌株生长温度范围测定
将活化好的酵母菌接入茶汤培养基平板,分别置于室温(20℃左右)、28、37、45、50℃条件下培养,每天定时观察平板上菌株生长状况,使用游标卡尺测量菌落直径,连续培养7 d,以确定分离菌株的最适生长温度。重复3次。
2.4.3 茶叶的灭菌
采用间歇灭菌法对生茶样(5 g晒青毛茶预先放入250 mL三角烧瓶中,加入蒸馏水50 mL)进行灭菌。灭菌程序为95℃加热45 min,然后在28℃放置24 h,再95℃加热45 min后,28℃放置24 h,重复加热和放置3次。
无菌操作,接种酵母菌于灭菌的茶样中,随后置于恒温震荡器中,150 r/min,28℃培养 7 d~10 d。
2.5 数据分析
样本间方差齐性检验采用Levene方法。样本间差异采用单因素方差分析,并利用最小显著差数法(Least Significant Difference,LSD)比较两两样本间的差异程度。相关性分析选用Pearson指数。所有计算分析都采用SPSS16.0软件。
3 结果与讨论
3.1 菌株的鉴定
分离菌株使用PDA培养基在28℃培养3 d,分离菌株的菌落为乳白色,隆起,边缘整齐,表面光滑不透明,湿润,直径2 cm~4 cm;显微镜下观察,细胞为椭球型或卵圆形,大小为(3~5)μm×(5~9)μm,出芽生殖明显,经过促孢培养后,可观察到每个子囊产4个卵圆形的子囊孢子,具有酵母菌株典型的形态特征[16]。
测序得到分离菌株的ITS基因片段为747 bp,通过NCBI的BLAST分析和MEGA 6多序列比对分析发现,分离菌株的ITS序列与酿酒酵母(Saccharomyces cerevisiae)的序列相似性最高,为100%。因此,初步鉴定分离菌株属于酵母属(Saccharomyces)。
3.2 试验菌株生长温度范围
经过7 d培养,酵母菌菌株在2℃生长最旺盛,平板上菌落发达,生长速率为1.67 mm/d(菌落直径/天);在室温下生长较慢,生长速率为1.17 mm/d;在37℃微弱生长,平板上仅有零星菌落,生长速率为0.73 mm/d;在45℃未观察到生长现象,因此选择28℃作为发酵温度。推测该酵母菌株主要在渥堆发酵的初期发挥作用,随着堆温的升高,菌株生长受到抑制。
3.3 茶样中氨基酸含量的变化
接种酵母菌对无叶白毫的春、夏、秋茶进行单菌发酵,测定发酵前后茶汤中氨基酸的含量,结果如图1所示。
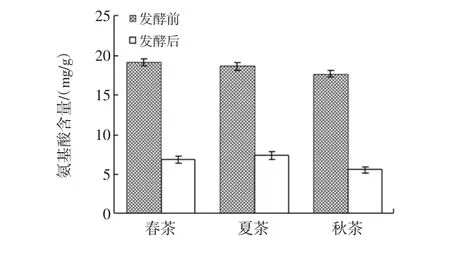
图1 茶样中氨基酸含量的变化(均值±标准差)Fig.1 Varied contents of amino acids from tea samples during fermentation process(mean±sd)
生茶茶样中,春茶、夏茶和秋茶的氨基酸平均含量分别为(19.12±0.44)、(18.63±0.51)、(17.66±0.39)mg/g(n=4),春茶>夏茶>秋茶,单因素方差分析结果表明,春茶和夏茶的氨基酸含量差异不显著,p>0.05;春茶和秋茶的氨基酸含量差异极显著,p<0.01;夏茶和秋茶的氨基酸含量差异显著,p<0.05。发酵后春茶、夏茶和秋茶的氨基酸平均含量分别为(6.81±0.45)、(7.38±0.51)、(5.52±0.43)mg/g(n=4),T 检验表明,春茶、夏茶和秋茶发酵前后的氨基酸含量均差异极显著,p<0.01。与发酵前相比,发酵后茶样中氨基酸的含量呈不同程度的减少,春茶减少了64.38%,夏茶减少了60.39%,秋茶减少了68.74%,几种茶样中氨基酸的减少幅度相近。
氨基酸与茶叶嫩度和香气的形成有密切关系,对茶汤的滋味、色泽也有较明显的影响。渥堆发酵的普洱茶,氨基酸含量也呈减少趋势[17],本研究中氨基酸的减少幅度大于渥堆发酵茶样,这一方面可能是由于酵母菌利用了部分氨基酸作为氮源,另一方面在酵母的酶系和湿热条件下,部分氨基酸发生了氧化和转化。氨基酸还可以与碳水化合物发生梅拉德反应,聚合形成大分子的不溶性黑色素,因此在发酵过程中,氨基酸总体呈减少趋势。

图2 茶样中茶多酚含量的变化(均值±标准差)Fig.2 Varied contents of tea polyphenols(TP)from tea samples during fermentation process(mean±sd)
3.4 茶样中茶多酚含量的变化
茶样中茶多酚含量的变化见图2。生茶中春茶、夏茶和秋茶的茶多酚含量分别是(171.67±1.87)、(184.12±2.63)、(172.41±2.94)mg/g(n=4),单因素方差分析结果表明,春茶和夏茶的茶多酚含量差异极显著,p<0.01;春茶和秋茶的茶多酚含量差异不显著,p>0.05;夏茶和秋茶的茶多酚含量差异极显著,p<0.01,夏茶的茶多酚含量高于春茶和秋茶。发酵后春茶、夏茶和秋茶的茶多酚含量分别是(224.10±2.94)、(238.78±2.98)、(230.09±1.38)mg/g(n=4),T 检验表明,春茶、夏茶和秋茶发酵前后茶多酚的含量均差异极显著,p<0.01。茶样中茶多酚的含量在发酵后呈不同程度的增高,春茶增加了30.54%,夏茶增加了29.62%,秋茶增加了33.57%。而对渥堆发酵茶样的研究表明,在渥堆过程中,茶叶中的茶多酚含量均显著减少[17-18]。黄振兴等研究发现,发酵40 d后,酵母菌可以有效地减少茶多酚的含量[19]。而本研究发现,酵母菌发酵7 d后,茶多酚的含量有一定增加。这可能是由于渥堆发酵时间较长,除了微生物的作用外,在湿热条件下发生的氧化作用也可使茶多酚数量减少。茶多酚因滋味苦涩且有较强的收敛性,其含量在一定范围内与茶汤的滋味、汤色成正相关[20-21]。本研究所用酵母菌菌株可使茶样中茶多酚的含量增加,而多种菌共同作用的渥堆发酵过程中茶多酚含量是减少的,因此该酵母菌菌株在纯培养状态时对普洱茶品质有明显影响。
3.5 茶样中咖啡碱含量的变化
茶样中咖啡碱含量的变化见图3。

图3 茶样中咖啡碱含量的变化(均值±标准差)Fig.3 Varied contents of caffeine from tea samples during fermentation process(mean±sd)
生茶中春茶、夏茶和秋茶的咖啡碱含量分别是(17.48±1.61)、(20.71±1.23)、(21.52±1.48)mg/g(n=4),单因素方差分析结果表明,春茶与夏茶、秋茶的咖啡碱含量差异极显著,p<0.01;夏茶和秋茶的咖啡碱含量差异不显著,p>0.05;春茶的咖啡碱含量低于夏茶和秋茶。发酵后春茶、夏茶和秋茶的咖啡碱含量分别是(13.08±2.19)、(16.84±1.80)、(16.22±1.50)mg/g(n=4),T检验表明,春茶和夏茶中的咖啡碱含量在发酵前后差异显著,p<0.05,秋茶的咖啡碱含量在发酵前后差异极显著,p<0.01。与发酵前相比,发酵后茶样中咖啡碱的含量呈不同程度的减少,春茶减少了25.17%,夏茶减少了18.69%,秋茶减少了24.63%。春茶和秋茶的减少幅度相近,但夏茶变化幅度相对较小。而已有的研究也表明,在渥堆过程中,茶叶中的咖啡碱含量逐步增加[17]。周春红等的研究则表明,在酵母的发酵初期,咖啡碱的含量是减少的[22]。咖啡碱是茶叶重要的滋味成分,其含量对茶叶品质影响较大。本研究中,咖啡碱的含量在发酵后减少,可能是在发酵中咖啡碱被分解转化,进行了一定消耗所致。
3.6 茶样中黄酮含量的变化
茶样中黄酮含量的变化见图4。

图4 茶样中黄酮含量的变化(均值±标准差)Fig.4 Varied contents of flavonid(FL)from tea samples during fermentation process(mean±sd)
生茶中春茶、夏茶和秋茶的黄酮含量分别是(12.10±1.05)、(13.00±1.51)、(12.47±1.35)mg/g(n=4),差异不显著,p>0.05,生茶各个茶样中的黄酮含量相近。发酵后春茶、夏茶和秋茶的黄酮含量分别减少为(7.83±0.69)、(8.86±0.67)、(8.48±0.55)mg/g(n=4),T 检验表明,春茶、夏茶和秋茶的黄酮含量在发酵前后差异极显著,p<0.01;春茶的黄酮含量减少了35.29%,夏茶减少了31.85%,秋茶减少了32.00%。而对渥堆发酵茶样的研究显示,经过渥堆发酵发酵后,茶叶中的黄酮含量有的减少[23];而有的则为增加,且不同产地的原料增加的幅度差别很大[24],因此普洱茶发酵中黄酮含量的变化较为复杂,这可能与黄酮类物质的组成以及发酵微生物的组成有关。本研究中,黄酮含量减少可能是由于微生物的酶和湿热作用使黄酮类物质分解所致。

图5 茶样中儿茶素含量的变化(均值±标准差)Fig.5 Varied contents of total catechins(TC)from tea samples during fermentation process(mean±sd)
3.7 茶样中儿茶素含量的变化
茶样中儿茶素含量的变化见图5。生茶春茶、夏茶和秋茶的儿茶素含量分别是(63.17±0.16)、(85.63±0.68)、(82.03±0.59)mg/g(n=4),单因素方差分析结果表明,春茶、夏茶和秋茶的儿茶素含量差异均极显著,p<0.01,夏茶中儿茶素的含量最高。发酵后春茶、夏茶和秋茶的儿茶素含量分别是(80.62±0.97)、(101.30±1.28)、(92.30±0.81)mg/g(n=4),T 检验表明,发酵前后各个茶样中的儿茶素含量差异均极显著,p<0.01。发酵后茶样中的儿茶素含量均呈不同程度的增加,春茶增加了27.62%,夏茶增加了18.30%,秋茶增加了12.56%。几种茶样的变化幅度差别较大。研究表明,酯型儿茶素包括 EGCG(Epigallocatechin gallate)、ECG(Epicatechin gallate)在渥堆过程中均剧烈的减少,至渥堆完成时已不能发现[19]。EGC在渥堆初期增加,后期剧烈减少。简单儿茶素如EC在初期呈增加趋势,后期则逐渐减少[25]。本研究所检测是总儿茶素,在发酵后含量均增加,儿茶素对茶叶的品质具有重要影响,尤其是酯型儿茶素和简单儿茶素的含量需要在适度的范围才有利于茶叶醇和口感和香味的形成[26-27],但本研究未对增加的儿茶素成分进行分析,因此酵母菌发酵后对茶叶品质的影响还需要进一步研究。
3.8 茶样中茶色素含量的变化
茶样中茶黄素含量的变化见图6。
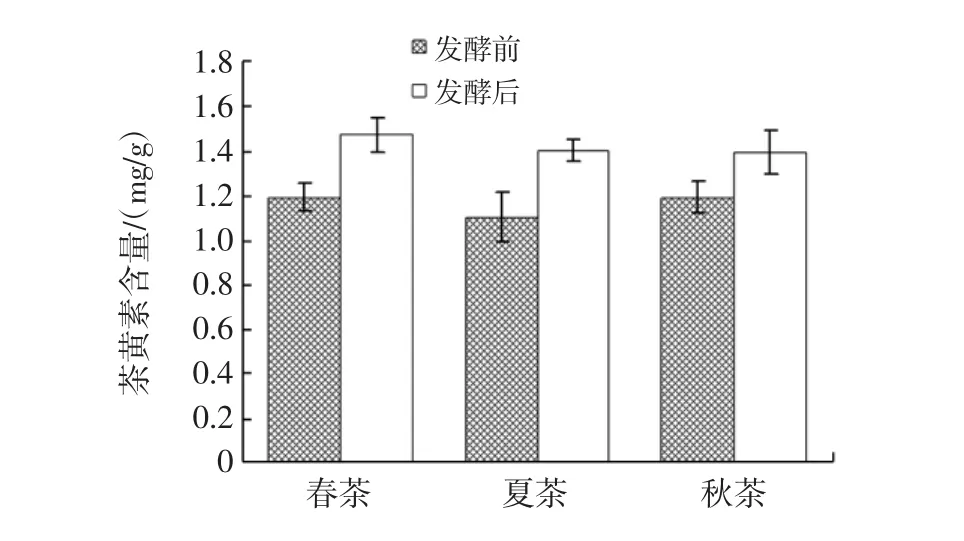
图6 茶样中茶黄素含量的变化(均值±标准差)Fig.6 Varied contents of theaflavins(TF)from tea samples during fermentation process(mean±sd)
生茶中春茶、夏茶和秋茶的茶黄素含量分别是(1.19±0.06)、(1.10±0.11)、(1.19±0.07)mg/g(n=4),单因素方差分析结果表明,春茶、夏茶和秋茶的茶黄素含量差异不显著,p>0.05,生茶各个茶样中的茶黄素含量相近。发酵后春茶、夏茶和秋茶的茶黄素含量分别是(1.47±0.08)、(1.40±0.05)、(1.39±0.10)mg/g(n=4),T检验表明,春茶和夏茶发酵前后的茶黄素含量差异极显著,p<0.01,秋茶发酵前后的茶黄素含量差异显著,p<0.05;春茶的茶黄素含量增加了23.53%,夏茶增加了27.27%,秋茶增加了16.81%。
茶样中茶红素含量的变化见图7。

图7 茶样中茶红素含量的变化(均值±标准差)Fig.7 Varied contents of thearubigins(TR)from tea samples during fermentation process(mean±sd)
生茶中春茶、夏茶和秋茶的茶红素含量分别是(84.09±1.80)、(82.80±2.37)、(67.97±4.42)mg/g(n=4),单因素方差分析结果表明,春茶和夏茶的茶红素含量差异不显著,p>0.05;秋茶和春茶、夏茶的茶红素含量差异均极显著,p<0.01;生茶组秋茶中茶红素的含量低于春茶和夏茶。发酵后春茶、夏茶和秋茶的茶红素含量分别是(50.90±1.85)、(49.82±1.10)、(41.30±1.38)mg/g(n=4),T检验表明,发酵前后3种茶样中的茶红素含量差异极显著,p<0.01,发酵后茶样中茶红素的含量呈不同程度的减少,春茶减少了39.47%,夏茶减少了39.83%,秋茶减少了39.24%。
茶样中茶褐素含量的变化见图8。
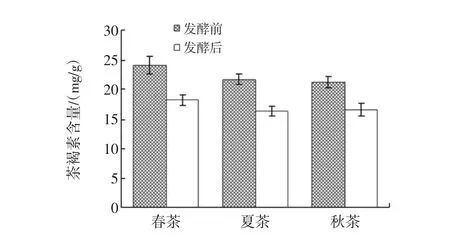
图8 发酵7 d后茶样中茶褐素含量的变化(均值±标准差)Fig.8 Varied contents of theobromine(TB)from tea samples during fermentation process(mean±sd)
生茶中春茶、夏茶和秋茶的茶褐素含量分别是(24.00±1.45)、(21.61±0.85)、(21.14±0.97)mg/g(n=4),单因素方差分析结果表明,春茶和夏茶的茶褐素含量差异显著,p<0.05春茶和秋茶的茶褐素含量差异极显著,p<0.01,夏茶和秋茶的茶褐素含量差异不显著,p>0.05。生茶组茶样中茶褐素的含量为春茶>夏茶>秋茶。发酵后春茶、夏茶和秋茶的茶褐素含量分别是(18.08±0.86)、(16.21±0.80)、(16.51±1.11)mg/g(n=4),T检验表明,3种茶样发酵前后的茶褐素含量差异均极显著,p<0.01。与发酵前相比,发酵后茶样中茶褐素的含量呈不同程度的减少,春茶减少了24.67%,夏茶减少了24.99%,秋茶减少了21.90%。
已有研究表明,渥堆发酵过程中,茶色素中茶黄素和茶褐素的含量呈增加趋势,而茶红素呈减少趋势[22]。本研究中,茶红素和茶褐素在发酵后减少,茶黄素增加。茶黄素对茶的色、香、味及品质有着重要影响,一定范围内,茶黄素含量与茶叶品质呈正相关[27]。经酵母菌发酵后,茶红素的含量减少,与渥堆发酵结果相同;而茶褐素的含量下降,与渥堆发酵结果不同。研究认为茶红素可能是由儿茶素经氧化缩合、聚合等生成[28],茶褐素是由多酚类物质氧化聚合形成[29]。微生物对茶褐素的生成具有重要影响[30]。本研究中,茶红素和茶褐素含量下降可能是由于酵母菌对茶多酚和儿茶素的转化较少,因此经酵母菌菌株发酵后,儿茶素和茶多酚含量增加,而茶红素和茶褐素含量减少。
4 结论
经过7 d发酵后,酵母菌生长基本已进入衰亡期。发酵后茶样中氨基酸、咖啡碱、黄酮、茶红素、茶褐素的含量与发酵前相比都呈不同程度的减少。而茶多酚、儿茶素、茶黄素的含量与发酵前相比都呈不同程度的增加。研究表明,普洱茶中茶多酚、氨基酸与品质得分呈正相关,表明它们的含量越高,茶叶中的品质越好[30]。儿茶素、黄酮、茶黄素、茶红素与普洱茶品质得分呈负相关[18]。本研究中,经酵母菌菌株发酵后,茶样中茶多酚含量的增加,黄酮、茶红素含量的减少可能对普洱茶的品质有一定积极影响,而儿茶素、茶黄素的增加则可能对普洱茶的品质有一定的负面作用,但普洱茶的品质还与水浸出物、多糖、寡糖、粗纤维、蛋白质等多种化学成分相关,还需结合其它指标进行判定。
普洱茶特殊的风味品质是多种微生物包括黑曲霉、青霉、酵母菌、根霉等共同作用的结果,本研究初步明确了在发酵过程中,酵母菌对普洱茶中主要功能性化学成分的影响,可为实现普洱茶可控的发酵过程以及普洱茶品质的改良和风味普洱茶的研究提供相关的理论依据。
[1]沈雪梅,沈晓进.普洱茶科学饮用与健康[J].云南农业科技,2008(5):62-64
[2]赵龙飞,周红杰,安文杰.云南普洱茶保健功效的研究[J].食品研究与开发,2005,26(2):114-118
[3]Loncar E,Djuric M,Malbasa R,et al.Influence of working conditions upon Kombucha conducted fermentation of black tea[J].Food and Bioproducts Processing,2006,84(3):186-192
[4]Thomas Muthumani,RS Senthil Kumar.Influence of fermentation time on the development of compounds responsible for quality in black tea[J].Food Chemistry,2007,101(1):98-102
[5]赵龙飞,徐亚军,周红杰.黑曲霉在普洱茶发酵过程中生长特性的研究[J].食品研究与开发,2007,28(10):1-3
[6]王定昌,赖荣婷.酵母的用途[J].粮油食品科技,2002,10(1):12-13,16
[7]王尊生,华秀英.有效微生物菌群(EM)制剂中的酵母菌的分析[J].沈阳农业大学学报,2000,31(3):304-305
[8]王平盛,梁名志.普洱茶古今漫谈[J].热带农业科技,2001,24(4):23-27
[9]陈华红,李雪玲,岩燕,等.顶头孢霉对普洱茶品质的影响[J].食品科技,2011,36(10):53-56,61
[10]李东霄,常景玲,张志宏,等.两株产人参皂苷糖苷酶酵母菌株的18S rDNA和ITS序列分析[J].河南师范大学学报(自然科学版),2010,38(6):128-131
[11]黄意欢.茶学实验技术[M].北京:中国农业出版社,1995:126-127
[12]陆松侯.茶叶审评与检验[M].北京:中国农业出版社,2000:208-209
[13]刘坤,伏圣青,高华,等.茶叶中儿茶素含量的快速测定方法研究[J].青岛大学学报(工程技术版),2010,25(4):87-90
[14]杨普香,黎小萍.桑叶茶黄酮类化合物的测定方法研究[J].食品科学,2001,22(10):81-82
[15]秦雪莲.甜茶叶中黄酮类化合物提取条件研究[J].贵州化工,2003,28(5):19-20
[16]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:107-109
[17]梁名志,夏丽飞,陈林波,等.普洱茶渥堆发酵过程中理化指标的变化研究[J].中国农学通报,2006,22(10):321-325
[18]张新富,龚加顺,周红杰,等.云南普洱茶中多酚类物质与品质的关系研究[J].食品科学,2007,28(1):230-233
[19]黄振兴,赵明星,阮文权,等.普洱茶渥堆过程中微生物对其品质形成的影响及其研究进展[J].安徽农业科学,2008,36(28):12496-12498
[20]周红杰,郭红芳,曾燕妮,等.陈香普洱茶品质特点分析[J].茶叶,2001,27(3):31-34
[21]邵宛芳,蔡新,杨树人,等.云南普洱茶品质与化学成分关系的初步研究[J].云南农业大学学报,1994,9(1):17-22
[22]周春红,黄振兴,阮文权,等.微生物对普洱茶渥堆过程中特定风味成分变化的影响[J].食品与发酵工业,2009,35(7):36-39
[23]龚加顺,周红杰,张新富,等.云南晒青绿毛茶的微生物固态发酵及成分变化研究[J].茶叶科学,2005,25(4):300-306
[24]张春花,单治国,周红杰.云南普洱茶加工中黄酮类化合物的研究[J].茶叶通讯,2008,35(1):7-9,13
[25]Zuo Yuegang,Chen Hao,Deng Yiwei.Simultaneous determination of catechins,caffeine and gallic acids in green,Oolong,black and pu-erh teas using HPLC with a photodiode array detector[J].Talanta,2002,57(2):307-316
[26]顾谦,陆锦时,叶宝存.茶叶化学[M].合肥:中国科学技术大学出版社,2002:61-62
[27]宛晓春.茶叶生物化学[M].北京:中国农业出版社,2011:191-192
[28]李大祥,王华,白蕊,等.茶红素化学及生物学活性研究进展[J].茶叶科学,2013,33(4):327-335
[29]刘忠英,潘科,沈强,等.茶褐素的组成结构与功能活性研究进展[J].食品工业科技,2017(5):396-400
[30]龚加顺,周红杰.云南普洱茶化学[M].昆明:云南科技出版社,2011:93-96,117
The Effects of A Saccharomycetes Strain on the Main Functional Ingredients of Pu-er Tea
LI Xue-ling1,CHEN Hua-hong1,*,ZHANG Jin-li1,WANG Bo1,ZHOU Hong-jie2
(1.Department of Chemistry and Life Science,Chuxiong Normal University,Chuxiong 675000,Yunnan,China;2.Longrun Pu-er Tea Academy,Yunnan Agricultural University,Kunming 650201,Yunnan,China)
A Saccharomycetes strain was isolated from a ripe Pu-er tea samples.The sterilized Pu-er raw tea was fermented with this isolate.The important flavor chemical ingredients[amino acids,tea polyphenols(TP),caffeine,flavonoid(FL),total catechins(TC)and tea pigments]from tea samples were determinated and analyzed.The results showed that the contents of tea polyphenols(TP),total catechins(TC),theaflavins(TF)from the fermented tea samples increased,but the contents of amino acids,caffeine,flavonoid(FL),thearubigins(TR),theabromine(TB)from tea samples decreased during fermentation process.These results were different from the results of piles-fermented Pu-er tea.Therefore,Saccharomycetes strain affected evidently the quality of Pu-er tea.
Saccharomycetes;fermentation;flavour chemical ingredients
10.3969/j.issn.1005-6521.2017.21.033
国家自然科学基金(31100009)
李雪玲(1965—),女(汉),副教授,学士,研究方向:真菌资源研究。
*通信作者:陈华红,教授,研究方向:微生物资源研究。
2017-06-28
