胃肠间质瘤14例及胃肠外间质瘤2例临床病理分析
2017-11-03河南省平煤神马医疗集团总医院467000张芳
河南省平煤神马医疗集团总医院(467000)张芳
胃肠道间质瘤是一种发生于消化道较少见的间叶性肿瘤,少数可发生于胃肠道外,以前曾经被诊断为平滑肌肿瘤或神经来源的肿瘤。随着免疫组化技术及分子生物学技术的不断进步,1983年,Mazur[1]等首先发现这种肿瘤既没有平滑肌分化又没有神经分化的抗原表达和超微结构,它是一种非定向分化的间叶性肿瘤而首先命名为“间质瘤”。本文通过16例间质瘤的临床病理特点及免疫组化结果分析,并复习相关文献,为以后工作总结经验,提高该肿瘤的诊断正确率。
1 材料与方法
1.1 临床资料 收集我科2014年01月~2016年10月间病理诊断最终诊断为间质瘤的16例患者的临床资料和病理资料。14例胃肠间质瘤中,男6例,女8例,年龄37岁~79岁,平均61.2岁,其中10例发生于胃,3例发生于小肠,1例发生于结肠,高度风险3例,中度风险3例,低度风险8例,梭形细胞型14例。2例胃肠外间质瘤,1例女性,发生于阴道壁,年龄50岁,高度风险;1例男性,发生于食管,年龄62岁,低度风险。2例胃肠外间质瘤均为梭形细胞型。临床表现情况:患者临床表现没有特异性,发生于胃的10例是以腹部不适,饱胀、腹痛等为主,发生于于结肠和小肠的4例患者以腹部不适,腹痛及血便为主,发生于食管的1例病人是体检中无意发现的。发生于阴道壁的1例病人有临床出血阴道突出物及阴道内血迹。
1.2 方法 所有组织均经过4%甲醛固定,系列脱水处理、石蜡包埋,4um切片及HE染色。免疫组化采用全自动免疫组化机。抗体:广谱CD34、CD117、S-100、Dog-1、SMA均购买自罗氏公司并与全自动免疫组化机匹配。
1.3 结果判断 免疫组化染色阳性细胞大于10%判断为(+),小于10%判断为(-)。CD34、Vim、SMA为胞浆内着色,CD117、Dog-1为胞浆(和)/包膜着色,S-100为胞浆和包膜着色。按照曹登峰、陈杰等[2][3][4]提出的2013年中国胃肠间质瘤病理诊断专家共识,从肿瘤大小、原发部位、核分裂象及肿瘤有无破裂等方面将该类肿瘤危险度分为极低、低、中等和高度等四个等级。高度风险性的指标包括:①肿瘤浸润周围组织。②肿瘤出现转移。③肿瘤破裂。④肿瘤最大径大于10cm或核分裂象大于10个/50HPF。⑤肿瘤最大径大于5cm,同时核分裂象大于5个/50HPF。⑥肿瘤最大径2.1cm~5.0cm,核分裂大于5个/50HPF,非胃原发。⑦肿瘤最大径5.1cm~10.0cm,核分裂象小于或等于5个/50HPF,非胃原发。中等风险性指标包括:①肿瘤最大径小于等于2.0cm,核分裂象6~10个/50HPF。②肿瘤最大径2.1cm~5.0cm,核分裂象大于5个/50HPF,胃原发。③肿瘤最大径5.1cm~10.0cm,核分裂象小于或等于5个/50HPF,胃原发。低度风险指标包括:肿瘤最大径2.1~5.0cm,核分裂象小于或等于5个/50HPF,任何部位。极低风险性指标包括:肿瘤最大径小于等于2.0cm,核分裂象小于等于5个/50HPF,任何部位。
2 结果
2.1 大体检查 肿瘤直径0.3cm~14.0cm,平均3.63cm。胃原发10例,8例位于黏膜下,2例位于肌壁间。其中2例为胃镜检查时发现并手术切除,1例为胃癌手术后偶然发现。发生于小肠3例,2例位于黏膜下,1例位于浆膜面,术后偶然发现。发生于结肠1例,发生于黏膜下。发生于食管1例。发生于阴道壁1例。极度风险8例,肿瘤均较小,与周围组织分界清楚,切面呈灰白色,质地稍韧,未见坏死。低度风险1例。中度风险3例,肿物与周围组织边界清楚,切面灰白灰红色,质地中等,编织状。高度风险4例,其中有1例阴道壁的肿瘤破裂,肿物切面灰红,质地细腻,鱼肉样,可见出血坏死,部分有囊性变。
2.2 镜下检查 根据间质瘤细胞的形态和瘤细胞在肿瘤组织中的比例,将间质瘤分为梭形细胞型、上皮样细胞型和混合细胞型。本组间质瘤细胞均为梭形细胞,细胞为长梭形,胞质丰富,嗜酸性,细胞界限不清楚,核呈梭形或杆状,细胞呈束状、编织状、旋涡状排列,部分细胞核排列成栅栏状,部分可见核的一端有空泡,要与神经鞘瘤和平滑肌瘤鉴别。
2.3 免疫组化 16例间质瘤免疫组织化学阳性表达见附表。
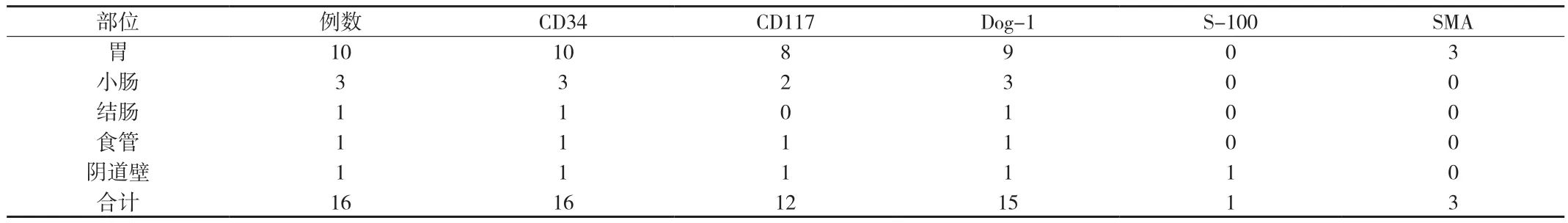
附表 16例间质瘤免疫组化阳性表达情况
3 讨论
胃肠间质瘤是消化道中最常见的间叶组织来源的肿瘤,以往曾经被认为是平滑肌肉瘤、平滑肌瘤或者神经鞘瘤等,Mazur和Clark于1983年提出间质瘤的概念,并指出间质瘤是一种特殊的肿瘤,肿瘤成分中既没有平滑肌成分又没有神经分化的抗原表达及超微结构,它是一种非定向分化的间叶性肿瘤,免疫表型上表达Kit蛋白(CD117)以及功能未知的蛋白(Dog-1),但是本组标本中发现3例灶性表达平滑肌标记,1例灶性表达神经标记,这也和肿瘤细胞起源于胃肠道间质干细胞Cajal细胞,可向多能分化符合。2013年中国专家共识中,并未把这些有平滑肌分化及神经分化作为评价肿瘤恶性风险的指标,并提出了微小间质瘤的新标准,将直径≤1cm的间质瘤定义为微小间质瘤,其中大多数为偶然发现。
随着免疫组化技术及分子生物学的发展及基因检测技术的提高,1998年Hirota等[5][6]发现了在间质瘤中存在c-kit基因的遗传学改变,即c-Kit基因频发性突变或PDGFR基因突变。本组标本中有3例CD117阴性而Dog-1阳性。
间质瘤主要发生于中老年人,临床没有特异性表现,有的微小间质瘤于手术标本中偶然发现。组织学上,肿瘤细胞主要由梭形细胞和上皮样细胞组成,根据两种成分比例不同,分为梭形细胞型、混合细胞型和上皮样细胞型。本组均为梭形细胞型,细胞为长梭形,胞质丰富,嗜酸性,细胞界限不清楚,核呈梭形或杆状,细胞呈束状、编织状、旋涡状排列,部分细胞核排列成栅栏状,部分可见核的一端有空泡,其中3例伴有灶性平滑肌分化,1例伴有灶性神经分化。间质瘤主要与平滑肌肿瘤、神经鞘瘤及其它梭形细胞肿瘤鉴别。尤其是发生于胃肠道外的间质瘤和较小的间质瘤,在日常工作中容易误诊和漏诊,应引起注意。肿瘤的恶性潜能主要根据肿瘤大小、发生部位、核分裂象、肿瘤边界、有无破裂及侵袭性等情况综合分析,尽管多数小的间质瘤或微小间质瘤在临床上呈良性或惰性经过,但确有极少数病理显示侵袭性行为[7],尤其核分裂象计数>5/50HPF或>10/50HPF者。本组有6例为微小间质瘤,其中2例为偶然发现。对于直径较小甚至微小和没有症状偶然发现的间质瘤报告很少,对于这种微小的间质瘤的性质并不是很明确[8][9][10]。
外科手术目前是该肿瘤的治疗首选方法,手术切除肿瘤时应完整切除,避免肿瘤破裂,如有肿瘤组织与周围组织粘连浸润,必要时行相邻脏器联合切除。间质瘤特征性的表达CD34、CD117、Dog-1等,结合形态学和免疫组化分析,必要时进行分子检测是间质瘤诊断正确的关键,根据肿瘤的发生部位、大小、与周围组织的关系、核分裂象及是否有破裂等综合评价其风险性。
