不同贮藏温度下马鲛鱼和秋刀鱼中生物胺含量变化
2017-11-03闵娟刘红田鑫李钰金李传勇张凌晶曹敏杰刘光明
闵娟,刘红,2,田鑫,2,李钰金,李传勇,张凌晶,2,曹敏杰,2,刘光明,2*
(1. 集美大学食品与生物工程学院, 福建 厦门 361021; 2. 厦门市海洋功能食品重点实验室, 福建 厦门 361021;3. 荣成泰祥食品股份有限公司,山东 荣成 264309; 4. 厦门市农产品质量安全检验测试中心, 福建 厦门 361009)
不同贮藏温度下马鲛鱼和秋刀鱼中生物胺含量变化
闵娟1,刘红1,2,田鑫1,2,李钰金3,李传勇4,张凌晶1,2,曹敏杰1,2,刘光明1,2*
(1. 集美大学食品与生物工程学院, 福建 厦门361021;2. 厦门市海洋功能食品重点实验室, 福建 厦门361021;3. 荣成泰祥食品股份有限公司,山东 荣成264309;4. 厦门市农产品质量安全检验测试中心, 福建 厦门361009)
建立反相高效液相色谱法快速检测鲭科鱼类(马鲛鱼和秋刀鱼)中8种生物胺(色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺)含量的方法,进而研究马鲛鱼和秋刀鱼在不同贮藏温度下(-30、4和25℃)生物胺含量的变化情况。衍生后的样品经反相色谱柱C18分离,以超纯水和甲醇为流动相梯度洗脱,254nm紫外检测生物胺含量。结果显示,8种生物胺在17min内完全分离,加标回收率为96.80%~116.29%,检出限、定量限分别为0.06~0.31mg/L和0.20~0.75mg/L。马鲛鱼和秋刀鱼中总生物胺含量与贮藏温度和贮藏时间显著相关(P<0.05),且随着温度(4、25℃)的升高而增加。-30℃条件下,在前10天秋刀鱼与马鲛鱼总生物胺含量均降低;10d后秋刀鱼中总生物胺含量升高。两种鱼在3种不同贮藏温度下,2-苯乙胺、尸胺和组胺均是贮藏过程中的主要生物胺;在-30℃贮藏条件下,马鲛鱼2-苯乙胺和尸胺含量在前10天随贮藏时间延长而降低,而秋刀鱼中两者的含量在前10天逐渐增加;在4、25℃条件下,秋刀鱼较马鲛鱼更易产生组胺;鲭科鱼中精胺含量在整个检测时间内无明显变化规律。秋刀鱼在-30、4℃贮藏条件下未检出色胺和酪胺;马鲛鱼中色胺含量较低且变化不显著;鲭科鱼中酪胺在4℃贮藏条件下显著性升高。在25℃贮藏条件下,除亚精胺和精胺外,鲭科鱼中其他生物胺均明显增加。结果表明,鲭科鱼类中生物胺含量与贮藏温度紧密相关,低温贮藏可有效抑制鱼肉中色胺、2-苯乙胺、腐胺、尸胺、组胺和酪胺的产生。本结果可为鲭科鱼类贮藏和生物胺监控提供参考依据。[中国渔业质量与标准,2017,7(5):01-10]
反相高效液相色谱;马鲛鱼;秋刀鱼;生物胺;贮藏温度
生物胺主要是由游离氨基酸经携带脱羧酶的微生物脱羧转化而成的[1],是一类含氮低分子有机化合物的总称,广泛存在于富含蛋白质的水产品及加工制品中。人体摄入适量生物胺可维持其正常生理功能,但摄入过量会出现头痛、心悸和恶心等中毒症状[2-3]。生物胺引起人们关注,主要是因其可作为评价食品品质的指标以及其潜在毒性引发的公众事件[4]。目前,生物胺的检测方法包括色谱法、比色法、毛细管电泳法、生物传感器法以及酶联免疫吸附法[5]。色谱法又可分为薄层色谱法[6]、离子色谱法[7]、气相色谱法[8]、液相色谱法和反相高效液相色谱法[9-11]。其中,反相高效液相色谱法具有高灵敏度的优点,其应用最为广泛[11]。
马鲛鱼又名鲅、竹鲛、串乌,多分布于中国的东海、黄海和渤海。秋刀鱼又名竹刀鱼,多分布于西北太平洋公海及其沿岸海域的中上层。马鲛鱼和秋刀鱼同属鲭科,为典型的青皮红肉海水鱼,因富含蛋白质、钙、铁等人体所需的多种营养成分,且肉质细嫩,而倍受消费者喜爱[12-13],但同时其因贮藏条件不当导致体内生物胺含量易超标的鱼种之一。温度是影响水产品在贮藏过程中腐败的重要因素,贮藏温度不当易导致肌肉中组氨酸脱羧产生组胺[14-15]。组胺的毒性最强,美国FDA规定组胺限量为50mg/kg,欧盟规定鲭科鱼类中组胺限量为300mg/kg、水产品及加工制品中组胺限量为100mg/kg。中国规定鲐中组胺含量限量为1000mg/kg,其他海水鱼中的限量为300mg/kg[16-17]。其余种类鱼中生物胺含量报道较少,Til等[18]表明腐胺、精胺和亚精胺摄入量分别超过2000、600和600mg/kg会导致急性中毒。
本研究建立了快速测定生物胺的柱前衍生-反相高效液相色谱法,并初步探讨马鲛鱼和秋刀鱼中生物胺含量和贮藏温度的关系,为鲭科鱼类的贮藏条件提供依据,同时为水产品中生物胺的监控提供技术支持。
1 材料与方法
1.1 实验材料与仪器设备
1.1.1 实验材料
新鲜马鲛鱼(Scomberomorusniphonius)和秋刀鱼(Cololabissairabrevoort),购自厦门市集美菜市场。样品购买后,置于-30 ℃贮藏备用。
生物胺标准品:色胺二盐酸盐(纯度≥99.0%)、2-苯乙胺(纯度≥99.5%)、腐胺二盐酸盐(纯度≥99.0%)、尸胺(纯度≥98.0%)、组胺二盐酸盐(纯度≥99.0%)、酪胺盐酸盐(纯度≥99.5%)、亚精胺三盐酸盐(纯度≥99.0%)、精胺四盐酸盐(纯度≥99.0%)标准品,全部购自于德国Dr.Ehrenstorfer公司。
实验试剂:丹磺酰氯(DNS-CL,纯度≥99.0%,Sigma公司);甲醇、丙酮(色谱纯,西陇科学股份有限公司);三氯乙酸(TCA,分析纯,西陇化工);盐酸、氨水和氢氧化钠(HCl、NH3·H2O和NaOH,分析纯,国药集团);碳酸氢钠(NaHCO3,分析纯,西陇科学股份有限公司);0.22 μm有机针式滤器和0.22 μm水相针式滤器(天津市津腾实验设备有限公司);实验室用水为Milli-Q超纯水,美国Millipore公司RIOS 8超纯水系统制得。
1.1.2 仪器设备
Agilent-1260 高效液相色谱仪(美国Agilent公司);Agilent ZORBAX Extend 反相色谱柱C18(4.6 mm I.D.×150 mm,5 μm,美国Agilent公司);1-15K 中型台式高速冷冻离心机(德国Sigma公司);5417R 小型高速离心机(德国Eppendorf公司);PT-2100 组织捣碎机(瑞士Kinematica公司);WB-14恒温水浴锅(德国Memmert公司);RIOS 8超纯水系统(美国Millipore公司);KQ5200DE 数控超声波清洗器(中国昆山超声公司);FA 2004 电子天平(上海精密科学仪器有限公司);BC/BD-829HN 冷柜(海尔公司)。
1.2 实验方法
1.2.1 生物胺标准溶液配制
称取一定量生物胺标准品,用0.1 mol/L HCl定容,制得1 000 mg/L的生物胺标准储备液;吸取1 mL生物胺单组分溶液(1 000 mg/L),用超纯水定容,制得100 mg/L生物胺标准混合溶液,逐级稀释至50、 20、 10、 5和1 mg/L,置于4 ℃避光保存。
1.2.2 样品提取
参照Mardiana等[19]及胡家伟等[20]报道方法,将-30 ℃冰鲜储存的马鲛鱼和秋刀鱼解冻,用无菌蒸馏水清洗表面。去内脏、头及尾,切成均匀大小鱼块备用。称取5.000 g鱼肉,置于25 mL离心管中,加入15 mL 5% TCA溶液,组织捣碎,混合均匀。4 ℃ 15 000 g离心15 min,上层清液移置25 mL棕色容量瓶中。沉淀中再加8 mL 5% TCA溶液重复离心1次,合并上清液,并用5% TCA定容,过0.22 μm水相针式滤器,滤液置于4 ℃下留待衍生。
1.2.3 标准品及样品衍生
参照GB/T 20768—2006[21]及田鑫等[22]的方法对其进行衍生处理。取300 μL生物胺标准混合溶液或样液于2 mL离心管中,加入90 μL饱和NaHCO3溶液及30 μL NaOH溶液(2 mol/L),再加入600 μL DNS-CL溶液(10 mg/mL),置于40 ℃恒温水浴锅中水浴45 min。反应完毕后,加入50 μL NH3·H2O,混匀,暗处静置30 min,用甲醇定容至1.5 mL,混匀后过0.22 μm有机相针式滤器,滤液置于-30 ℃保存,待测。
1.2.4 色谱条件
色谱柱Agilent ZORBAX Extend反相色谱柱C18(4.6 mm I.D.×150 mm,5 μm);柱温为35 ℃;紫外检测波长为254 nm;进样量20 μL;流速1 mL/min。流动相A为超纯水,流动相B为甲醇,梯度洗脱条件见下表1。
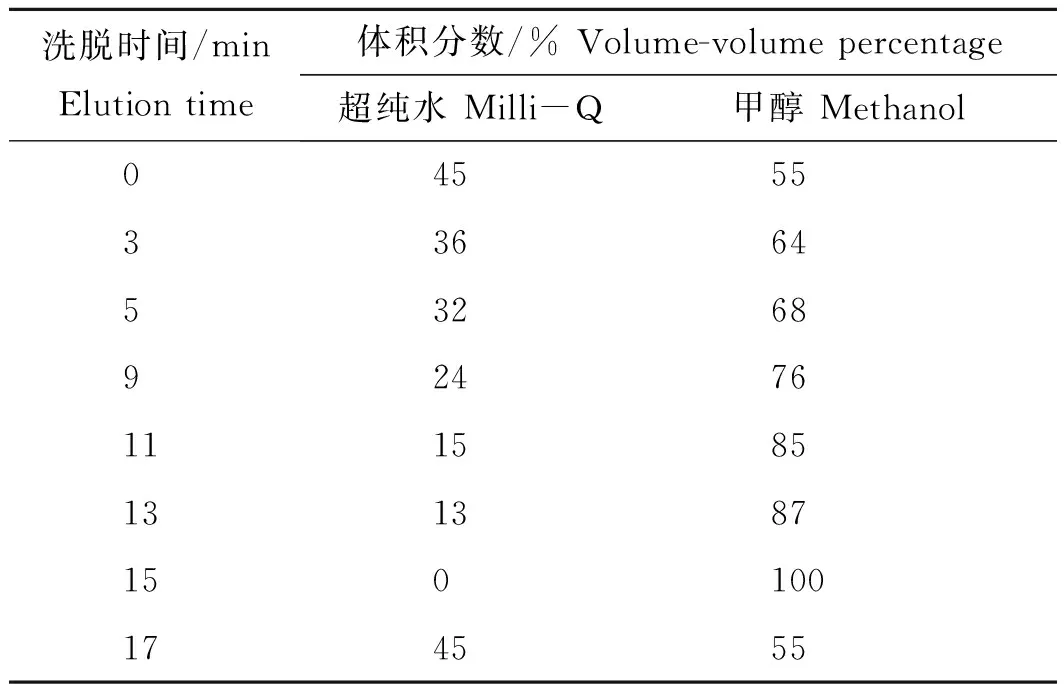
表1 梯度程序洗脱表Tab.1 The procedure of gradient elution
1.2.5 标准曲线和稳定性
将一定稀释梯度的生物胺混合标准溶液按步骤1.2.3衍生,上机测定。以各生物胺的色谱峰峰面积为纵坐标(y)与相应浓度为横坐标(x)绘制标准曲线,并拟合线性方程。将衍生的标准混合生物胺溶液置于-30 ℃保存1个月后,上机检测,分析比较生物胺的变化情况。
1.2.6 精密度
将10 mg/L生物胺混合标准溶液衍生后连续进样10次,通过计算保留时间及峰面积的相对标准偏差(RSD),确定其精密度。
1.2.7 检出限和定量限
将生物胺标准溶液稀释成不同的低浓度溶液,上机检测后,根据信噪比(S/N)确定检出限(LOD,S/N=3)以及定量限(LOQ,S/N=10)。
1.2.8 加标回收率
以马鲛鱼样品为研究对象,样液中分别添加一定量5、 10、 25 mg/L混合标准溶液,平行测定3次。同时做3组空白实验。
1.2.9 鲭科鱼类中生物胺含量随贮藏温度的变化
将马鲛鱼和秋刀鱼用蒸馏水清洗,去内脏,切成长宽高一致的鱼块或鱼片,均分装3份。马鲛鱼块用自封袋密封,分别放置在-30、 4和25 ℃温度下贮藏0、 3、 6和10 d。秋刀鱼片用自封袋密封,分别放置在:-30 ℃温度下贮藏0、 5、 10、 15和20 d;4 ℃温度下贮藏0、 2、 4、 6、 8和10 d;25 ℃温度下贮藏0、 1、 2、 3和4 d。按步骤1.2.2和1.2.3提取和衍生,留待上机测定。
1.2.10 挥发性盐基氮含量的测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[23]方法测定。
1.2.11K值测定
样品前处理方法参照SC/T 3048—2014 《鱼类鲜度指标K值的测定 高效液相色谱法》[24]。
K值采用高效液相色谱法测定,其色谱条件[25]为:色谱柱SHODEX Asahipak GS-320 HQ;流动相为205 mmol/L NaH2PO4∶205 mmol/L H3PO4=300∶7(V/V);流速 0.6 mL/min;柱温 30 ℃;检测波长 260 nm;进样量 20 μL。
1.2.12 数据分析
采用Excel 2003软件作图,运用SPSS 17.0软件的单因素方差分析对马鲛鱼和秋刀鱼中8种生物胺的含量进行统计分析,并对总生物胺与单胺进行皮尔逊(Pearson)相关性分析,以P<0.05为差异显著,P<0.01为差异极显著设定。结果以平均值±标准差表示。
2 结果与讨论
2.1 保留时间
通过对8种生物胺(色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺)进行单峰测定,确定了各生物胺出峰时间分别为9.3、 10.8、 11.3、 11.8、 13.0、 14.2、 14.5及16.5 min。图1是生物胺混合标准溶液的HPLC图(100 mg/L),17 min内达到完全分离,峰型对称,且可达到基线分离,短时高效,说明本方法可应用于8种生物胺的检测。
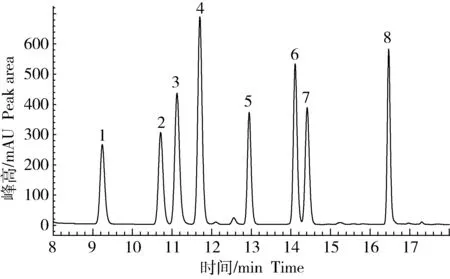
图1 混合标准品色谱图(100 mg·L-1)1:色胺;2:2-苯乙胺;3:腐胺;4:尸胺;5:组胺;6:酪胺;7:亚精胺;8:精胺。Fig.1 Mixed standard chromatogram (100 mg·L-1)1: Tryptamine; 2: 2-Phenylethylamine; 3: Putrescine;4: Cadaverine; 5: Histamine; 6: Tyramine; 7: Spermidine; 8: Spermine.
2.2 标准曲线和稳定性
按照所建立RP-HPLC测定不同浓度的生物胺混合标准品,8种生物胺的回归方程、相关系数、线性范围、检出限和定量限的结果见表2。可知,8种生物胺的相关系数均大于0.999,说明线性关系良好;8种生物胺的检出限范围为0.06 ~0.31 mg/L,定量限范围为0.20 ~0.75 mg/L,均在0.10~100.00 mg/L呈线性关系。由上,建立的RP-HPLC可应用于水产品中生物胺的检测,且效果准确可靠。
将衍生后的生物胺置于-30 ℃冰箱贮藏一个月,上机测定,除精胺和亚精胺有轻微变化外,其余6种生物胺变化不明显,说明衍生后的生物胺稳定性良好。
2.3 精密度
表3为10 mg/L生物胺混合标准品重复测定10次的结果。由表3可知,保留时间的RSD范围为0.10%~0.46%,小于1%;峰面积的RSD范围为0.15%~2.95%,小于3%。说明本实验仪器具有高精密度,可准确测定样品中生物胺含量。

表2 HPLC法测定生物胺的回归方程、相关系数、线性范围、检出限和定量限Tab.2 Regression equation, correlation coefficient, linear range, limit of detection(LOD) and limit of quantitation(LOQ)of biogenic amines by HPLC
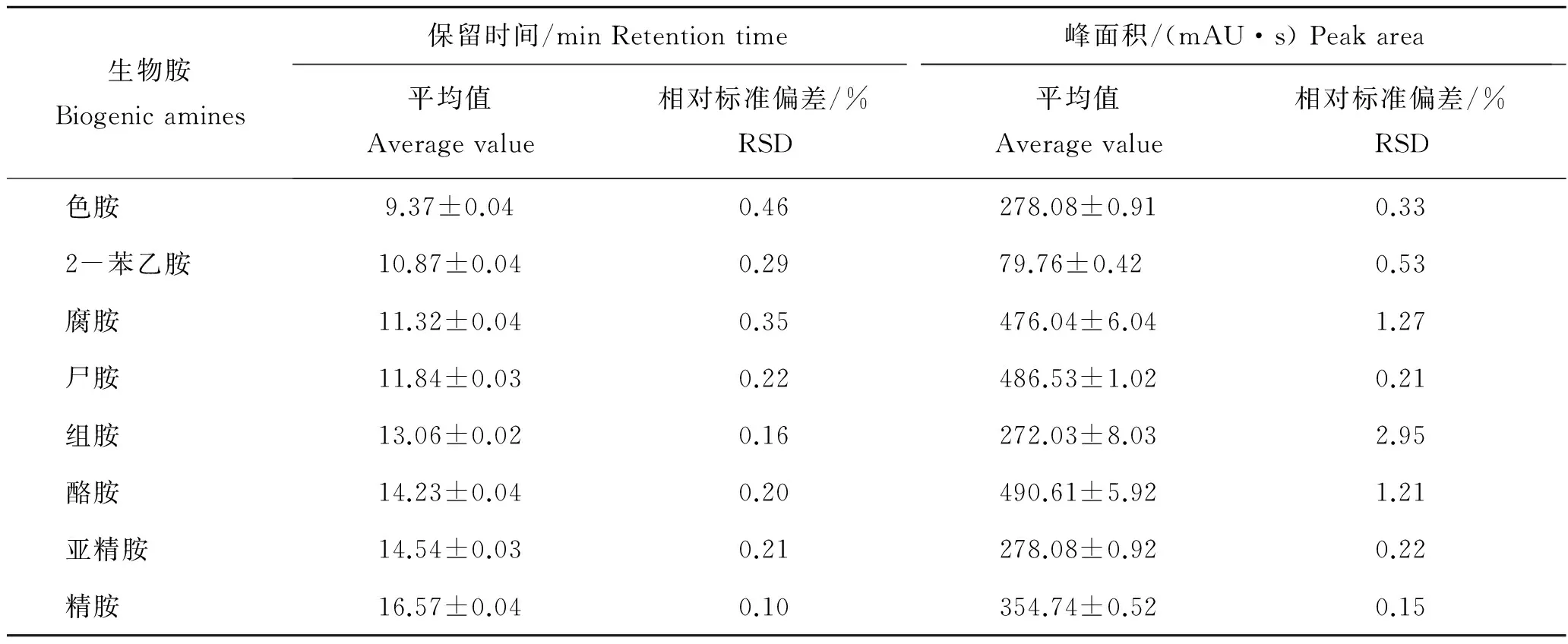
表3 生物胺标准品的精密度(10 mg·L-1)Tab.3 Precision of biogenic amine standard(10 mg·L-1) n=10
2.4 加标回收率
向马鲛鱼样品中添加不同浓度的生物胺混合标准品,平行测定3次,马鲛鱼的加标回收率结果见表4。可知,8种生物胺的RSD范围为1.28%~10.54%,平均加标回收率范围为96.20%~116.19%,说明本方法具有高稳定性,该法满足生物胺的分析检验要求,进一步证实了实验方法的准确性和可靠性。

表4 马鲛鱼中生物胺的加标回收率Tab.4 Recovery rate of biogenic amines in Scomberomorus niphonius n=3
2.5 不同贮藏温度下马鲛鱼中生物胺含量变化情况
生物胺的产生与所选用的水产品种类、贮藏环境和微生物等因素有关。部分海水鱼类在捕捞至销售过程中一定程度会受到外界因素影响,从而导致生物胺的产生。水产品中微生物生长与温度密切相关,低温贮藏可有效抑制鱼体内微生物的生长及繁殖,从而延缓其腐败变质。随着贮藏温度升高,微生物生长加速,生物胺含量递增至超标,导致鱼类腐败加快,其货架期缩短,生物胺总量可作为马鲛鱼的质量品质评价指标[26]。
本实验选用马鲛鱼为24 h内打捞,冰温条件下送至实验室,期间不超过36 h。测定马鲛鱼其初期K值为18.00%,挥发性盐基氮含量为9.33 mg/100 g,均在一级鲜度范围内。表5通过对总生物胺与8种生物胺进行皮尔逊相关性分析,以确定马鲛鱼中单胺与总生物胺的相关性。表6为-30、 4和25 ℃贮藏温度下马鲛鱼中生物胺含量情况。马鲛鱼中总生物胺含量与贮藏时间、温度相关性极显著(P<0.01),总生物胺的含量在相同温度下贮藏一段时间具有显著的组间差异(P<0.05),总生物胺含量在贮藏过程中随着温度(4、 25 ℃)的升高而递增。色胺、腐胺和组胺随着贮藏时间的延长而递增,温度越高,其增加速度越快。这一发现与史策等[27]对鲢的研究相似,即色胺和腐胺在3 ℃条件下随贮藏时间延长而增加。组胺是引起鲭科中毒主要因素,也是毒性最强的生物胺,多个国家规定了组胺的限量标准。由表5可以看出,组胺在4、 25 ℃条件下与总生物胺相关性极显著(P<0.01),-30 ℃相关性显著(P<0.05)。马鲛鱼块中组胺的含量初期为2.05 mg/kg,-30 ℃温度下马鲛鱼在第3、 6天时差异不显著(P>0.05),大体呈递增趋势;在4 ℃下贮藏3、 6和10 d,组胺含量分别为13.46、 48.18和2 378.21 mg/kg, 6 d时组胺含量低于美国FDA限量50 mg/kg,10 d时远高于中国水产品组胺限量300 mg/kg,超标。综合表明组胺是马鲛鱼中与贮藏温度和时间高度相关的一种生物胺。
马鲛鱼中酪胺和精胺在整个过程中无明显规律,Kanki等[28]也研究了其他种类水产品中精胺,但变化也无明显规律,这可能是由原材料、加工过程以及微生物等多方面因素综合导致。本研究中马鲛鱼中亚精胺含量在-30和4 ℃下逐渐降低;郭慧[29]推测,-20 ℃温度下贮藏30 d,带鱼中亚精胺含量降低甚至未检出,与氧化降解生物胺的酶、酶体系有关,或者发生生物胺的转化。2-苯乙胺和尸胺的含量在不同贮藏时间差异显著(P<0.05)。贮藏初期,马鲛鱼中2-苯乙胺和尸胺含量较高,可能与新鲜马鲛鱼所含的微生物种类有关,这与Zare等[30]的研究结果相似。-30 ℃贮藏条件下,2-苯乙胺和尸胺含量随贮藏时间延长显著降低,导致总生物胺含量大幅度下降。本研究中,2-苯乙胺出现该变化趋势,一方面是马鲛鱼在贮藏过程中体内可能产生降解2-苯乙胺的酶,另一方面可能与低温嗜冷菌作用有关[29]。从表5和表6可看出2-苯乙胺、尸胺、组胺在3种贮藏条件下与总生物胺含量高度相关,总生物胺含量与尸胺和2-苯乙胺的变化趋势一致。马鲛鱼中生物胺与温度的相关性由高至低分别为:尸胺、2-苯乙胺、组胺、腐胺、色胺、酪胺、精胺、亚精胺。

表5 马鲛鱼中总生物胺与8种生物胺的相关性Tab.5 Correlation between total biogenic amines and 8 biogenic amines in Scomberomorus niphonius
注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01);r表示相关性系数。下表同。
2.6 不同贮藏温度下秋刀鱼中生物胺含量变化情况
本部分实验以马鲛鱼研究结果为基础,延长-30 ℃的贮藏时间,并同时调整3种温度测定时间间隔。秋刀鱼初期K值为19.37%,挥发性盐基氮含量为8.83 mg/100g,均在一级鲜度范围内。表7对8种生物胺及总生物胺进行皮尔逊相关性分析,以确定秋刀鱼中总生物胺与单胺的相关性。表8为-30、 4和25 ℃贮藏温度下秋刀鱼的生物胺含量。秋刀鱼中总生物胺含量与贮藏时间、温度相关性极显著(P<0.01),总生物胺含量随着时间和温度递增大体呈增长趋势。-30 ℃贮藏温度下,秋刀鱼在0 d时总生物胺含量为29.27 mg/kg,10 d时降低至18.34 mg/kg,与马鲛鱼的研究结果一致,可能是在此温度下存在氧化降解生物胺的酶或酶体系。延长秋刀鱼在-30 ℃贮藏天数至20 d,总生物胺含量升高至35.57 mg/kg。

表6 马鲛鱼中生物胺的含量Tab.6 The contents of biogenic amines in Scomberomorus niphonius n=3
注:ND为未检出,下表同。同一温度下,表中同一列不同字母表示显著性差异(P<0.05)。
在-30和4 ℃贮藏温度下秋刀鱼中色胺和酪胺一直未检出,可能是由于秋刀鱼这两个温度下微生物没有产生相应的赖氨基酸、酪氨酸脱羧酶。在-30 ℃秋刀鱼中亚精胺和精胺从初期的含量3.03 mg/kg和4.42 mg/kg分别升至4.34 mg/kg和5.16 mg/kg,整个贮藏过程无明显规律。4和25 ℃条件下,马鲛鱼和秋刀鱼各生物胺(除色胺、酪胺)含量变化趋势大致相同。25 ℃贮藏温度下马鲛鱼贮藏10 d时组胺含量为1 691.96 mg/kg,远低于秋刀鱼贮藏4 d时的组胺含量3 329.76 mg/kg,说明秋刀鱼比马鲛鱼更易产生组胺,导致组胺中毒,也表明组胺的产生与水产品本身所含的营养成分以及微生物种类有关。以10 d为分界限,秋刀鱼中2-苯乙胺、腐胺、尸胺和组胺含量与马鲛鱼变化趋势完全一致,但是10 d之后,除腐胺含量逐渐降低外,其余几种生物胺含量均上升。秋刀鱼中各生物胺含量与温度的相关性从高到低分别为:2-苯乙胺、尸胺、组胺。
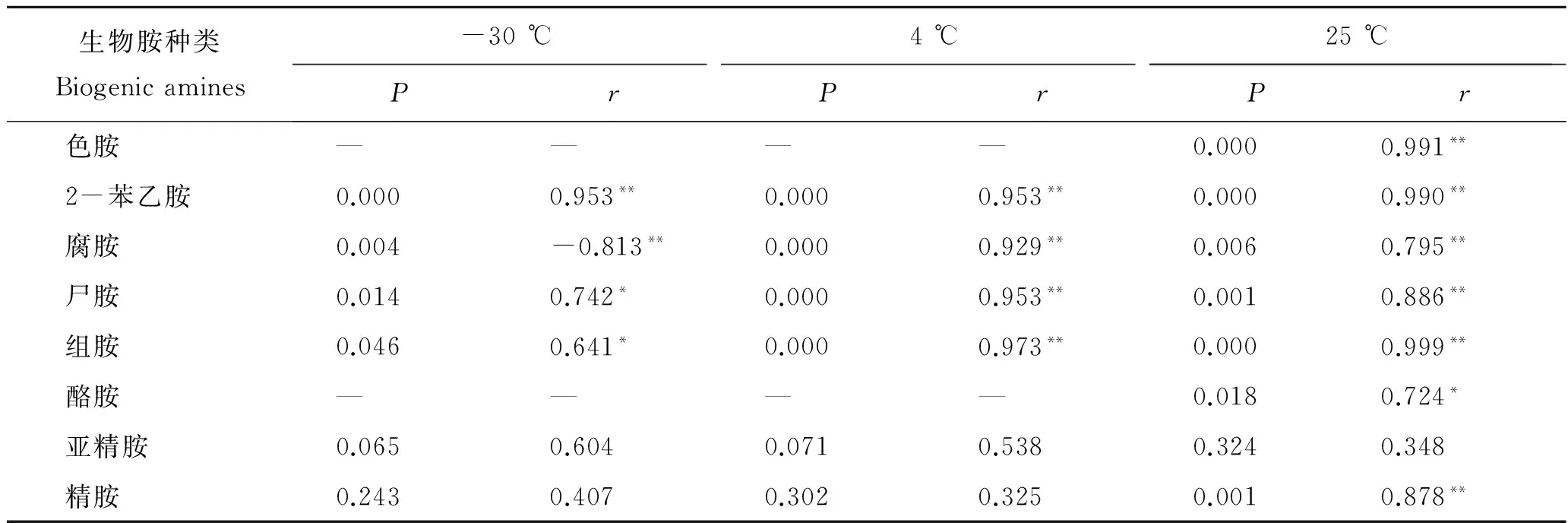
表7 秋刀鱼中总生物胺与8种生物胺的相关性Tab.7 Correlation between total biogenic amines and 8 biogenic amines in Cololabis saira Brevoort
注:—表示生物胺未检出无相关性统计。
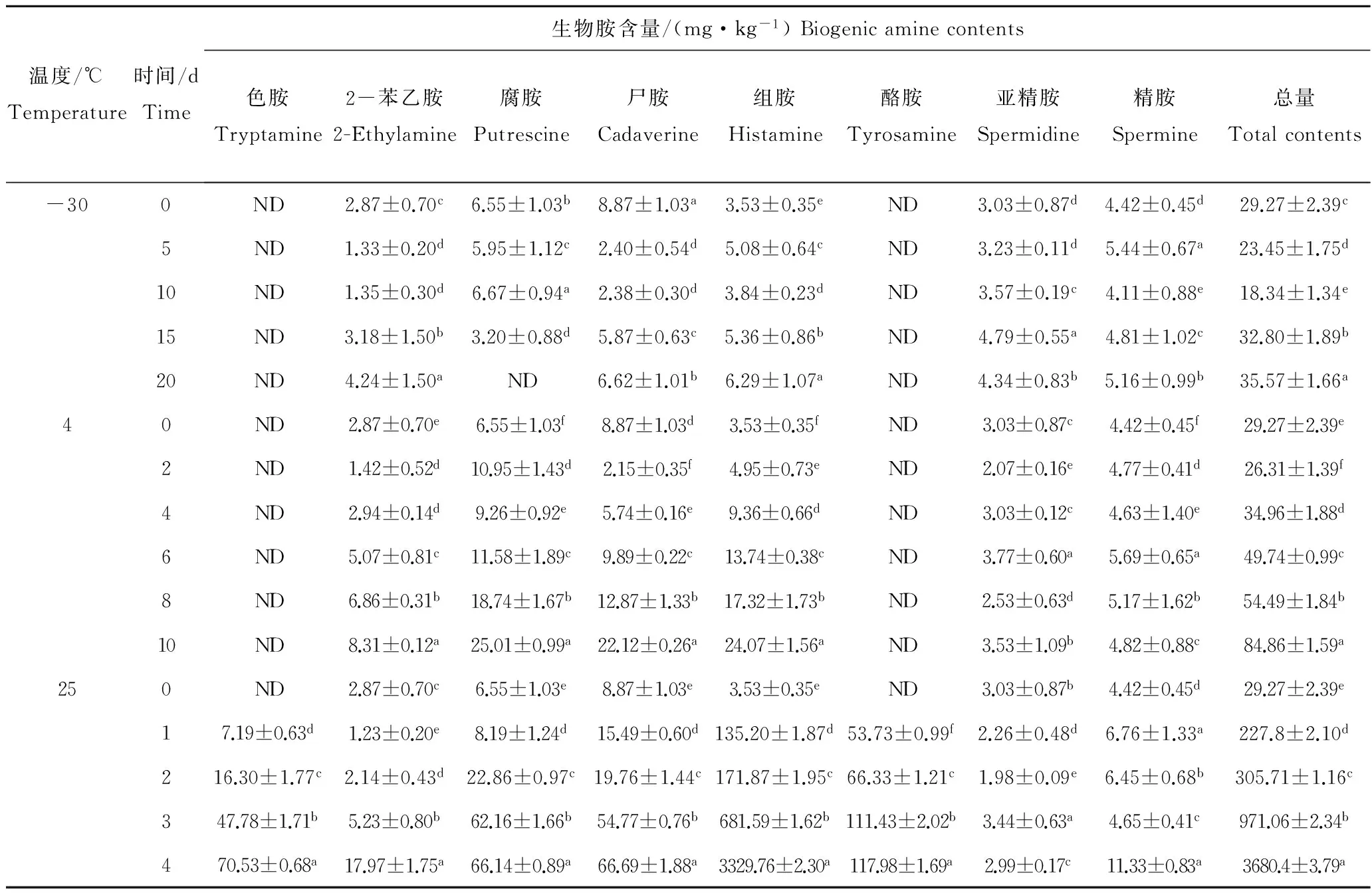
表8 秋刀鱼中生物胺的含量Tab.8 The contents of biogenic amines in Cololabis saira Brevoort n=3
3 结论
本研究建立了快速检测鲭科鱼类中生物胺含量的方法,研究了马鲛鱼和秋刀鱼中生物胺与贮藏温度的关系,得出以下结论:
1)本研究建立的方法在17 min内可完全分离8种生物胺,分离度好,色谱图峰型对称,相关系数大于0.999,在0.10~100.00 mg/L内呈线性关系,检出限、定量限范围分别为0.06~0.31 mg/L和0.20 ~0.75 mg/L,加标回收率范围为96.80%~116.29%,保留时间和峰面积RSD范围分别为0.10%~0.46%和0.15%~2.95%,方法重复性好。
2)马鲛鱼和秋刀鱼中总生物胺含量与贮藏温度存在显著性相关(P<0.01),且在不同贮藏时间内差异显著(P<0.05)。在3种贮藏温度下,2-苯乙胺、尸胺和组胺为两种鲭科鱼类的主要生物胺,在-30 ℃贮藏温度下,马鲛鱼和秋刀鱼中2-苯乙胺和尸胺含量在前10 天逐渐降低,10 d后秋刀鱼中2-苯乙胺和尸胺的含量分别升高至4.24 mg/kg和6.62 mg/kg,且与总生物胺的变化完全一致,这表明2-苯乙胺和尸胺可能是鲭科鱼发生腐败变质的主要因素;精胺含量无明显变化规律。组胺是马鲛鱼中与贮藏温度和时间高度相关的一种生物胺,但秋刀鱼比马鲛鱼在相同贮藏温度下产生组胺含量更高,这有可能会导致组胺中毒。秋刀鱼只在25 ℃贮藏条件下检出色胺和酪胺;马鲛鱼中色胺变化不明显(0至1.65 mg/kg);酪胺在4 ℃贮藏条件下变化明显(7.18至149.13 mg/kg);两种鱼中亚精胺和精胺均无明显规律。在4、 25 ℃贮藏温度下,马鲛鱼和秋刀鱼8种生物胺含量变化趋势相同,随着温度升高,总生物胺含量也逐渐增加。
结果表明,在鲭科鱼中温度与生物胺产生有密切关系,低温可有效降低生物胺的产生。
[1] Ten B B, Damink C, Joosten H M, et al. Occurrence and formation of biologically active amines in foods[J]. Int J Food Microbiol, 1990, 11(1):73-84.
[2] Ali A M, Fleet I, Paul Thomas C L. Determination of biogenic diamines with a vaporisation derivatisation approach using solid-phase microextraction gas chromatography-mass spectrometry [J]. Food Chem, 2008, 111(2):462-468.
[3] Caston J C, Eaton C L, Gheorghiu B P, et al. Tyramine induced hypertensive episodes and panic attacks in hereditary deficient monoamine oxidase patients: case reports [J]. J S C Med Assoc, 2002, 98(4):187.
[4] Aflaki F, Ghoulipour V, Saemian N, et al. A simple method for benzoyl chloride derivatization of biogenic amines for high performance liquid chromatography [J]. Anal Methods-UK, 2014, 6(6):1482-1487.
[5] 刘红, 李传勇, 曾志杰,等. 水产品中生物胺的检测与控制技术研究进展[J]. 食品安全质量检测学报, 2015, 6(11):4516-4523.
[6] Lapa-Guimarães J, Pickova J. New solvent systems for thin-layer chromatographic determination of nine biogenic amines in fish and squid [J]. J Chromatogr A, 2004, 1045(1):223-232.
[7] De Borba B M, Rohrer J S. Determination of biogenic amines in alcoholic beverages by ion chromatography with suppressed conductivity detection and integrated pulsed amperometric detection[J]. J Chromatogr A, 2007, 1155(1):22-30.
[8] 程卫, 王艳伟, 陈培云, 等. HPLC测定虾皮中不同类型的生物胺[J]. 食品工业, 2016(2):293-296.
[9] Yen G C, Hsieh C L. Simultaneous analysis of biogenic amines in canned fish by HPLC [J]. J Food Sci, 2010, 56(56):158-160.
[10] Pendem A, Pawar V M, Jayaraman S. Development of a gas chromatography method for the estimation of alkylamines in foods [J]. J Agr Food Chem 2010, 58(16):8904-8910.
[11] Onal A, Tekkeli S E, Onal C. A review of the liquid chromatographic methods for the determination of biogenic amines in foods [J]. Food Chem, 2013, 138(1):509-515.
[12] 陈涛, 陆云飞, 叶晓峰, 等. 不同贮藏条件下东海马鲛鱼鱼肉质构变化研究[J]. 食品科技, 2012(9):129-132.
[13] 黄惠莉, 童记强, 汪泳, 等. 响应面法优化酶法提取马鲛鱼油[J]. 华侨大学学报(自然版), 2016, 37(5):595-600.
[14] 刘霞, 陈旭峰, 乔莉,等. 食用马鲛鱼致急性组胺中毒28例报告[J]. 江苏预防医学, 2004, 15(4):27-28.
[15] 尤娟, 郭丹婧, 熊善柏,等. 贮藏温度和时间对鳝鱼肌肉鲜度及生物胺含量的影响[J]. 食品安全质量检测学报, 2016(9):3608-3614.
[16] Lange J, Wittmann C. Enzyme sensor array for the determination of biogenic amines in food samples[J]. Anal Bioanal Chem, 2002, 372(2): 276-283.
[17] 王光强, 俞剑燊, 胡健, 等. 食品中生物胺的研究进展[J]. 食品科学, 2016, 37(1):269-278.
[18] Til H P, Falke H E, Prinsen M K, et al. Acute and subacute toxicity of tyramine, spermidine, spermine, putrescine and cadaverine in rats[J]. Food Chem Toxicol, 1997, 35(3/4):337-348.
[19] Mardiana S, Bahruddin S, Noorhasani H, et al. Determination of biogenic amines in selected Malaysian food[J]. Food Chem, 2009, 113(4):1356-1362.
[20] 胡家伟, 高榕, 曹敏杰, 等. 水产食品中组胺的丹磺酰氯柱前衍生反相高效液相色谱测定方法的建立及应用[J]. 食品科学, 2014, 35(8):283-288.
[21] 中华人民共和国国家质量监督检验检疫总局&中国国家标准化管理委员会. GB/T 20768—2006 鱼和虾中有毒生物胺的测定 液相色谱-紫外检测法[S]. 北京:中国标准出版社, 2006.
[22] 田鑫, 刘红, 李传勇,等. 反相高效液相色谱法同时检测海产品中8种生物胺[J]. 食品安全质量监测学报, 2017, 8(4):1171-1178.
[23] 中华人民共和国卫生部. GB 5009.228—2016食品安全国家标准 食品中挥发性盐基氮的测定[S]. 北京:中国标准出版社, 2016.
[24] 中华人民共和国农业部. SC/T 3048—2014 鱼类鲜度指标K值的测定 高效液相色谱法[S]. 北京:中国标准出版社, 2014.
[25] 高海东. 龙须菜寡糖及其复配剂保鲜处理对虾和豆芽的研究[D]. 厦门: 集美大学, 2016.
[26] Naila A, Flint S, Fletcher G, et al. Control of biogenic amines in food—existing and emerging approaches [J]. J Food Sci, 2010, 75(7):139-150.
[27] 史策. 鲢鱼尸僵及贮藏过程中ATP关联物及生化特性变化规律的研究[D]. 北京: 中国农业大学, 2015.
[28] Kanki M, Yoda T, Tsukamoto T, et al. Histidine decarboxylases and their role in accumulation of histamine intunaand driedsaury[J]. App Environ Microb, 2007, 73(5):1467-1473.
[29] 郭慧. 不同贮藏温度条件下海洋鱼类生物胺变化规律研究及特征生物胺分析[D]. 杭州: 浙江大学, 2015.
[30] Zare D, Ghazali H M. Assessing the quality of sardine based on biogenic amines using a fuzzy logic model [J]. Food Chem, 2017, 221 (4):936-943.
ChangesofthecontentsofbiogenicaminesinScomberomorusniphoniusandCololabissaira(Brevoort)underthedifferenttemperatureconditions
MIN Juan1, LIU Hong1,2,TIAN Xin1,2, LI Yujin3, LI Chuanyong4, ZHANG Lingjing1,2,CAO Minjie1,2, LIU Guangming1,2*
(1. College of Food and Bioscience Engineering, Jimei University, Xiamen 361021, China; 2. Key Laboratory of MarineFunctional Food in Xiamen, Xiamen 361021, China; 3. Rong Cheng Tai Xiang Food Co., LTD, Rongcheng 264309;4. Xiamen Agriculture Product Quality and Safety Testing Center, Xiamen 361009, China)
A rapid determination method was established on 8 types of biogenic amines (tryptamine, 2-ethylamine, putrescine, cadaverine, histamine, tyramine and spermidine and spermine) in the family Scombridae——ScomberomorusniphoniusandCololabissaira(Brevoort) using the reversed-phase high performance liquid chromatography. The changes of biogenic amines contents inScomberomorusniphoniusandCololabissaira(Brevoort) were deterimined under different storage temperatures (-30 ℃, 4 ℃ and 25 ℃). The derivative samples were separated by reversed phase chromatographic column C18, and eluted with ultrapure water and methanol as mobile phase gradient elution. The contents of biogenic amines were detected at 254 nm by UV detector. 8 types of biogenic amines ofScomberomorusniphoniusandCololabissaira(Brevoort) could be completely segregated using this method within 17 min. The range of adding standard recovery was 96.80%~116.29%, LOD and LQD were 0.06 ~ 0.31 mg/L, 0.20 ~ 0.75 mg/L, respectively. The contents of total biogenic amines were significantly related with storage temperature and time inScomberomorusniphoniusandCololabissaira(Brevoort) (P<0.05), and the contents increased with the elevation of temperature (4、 25 ℃). The contents of total biogenic amines in the family Scombridae decreased before 10 days at -30 ℃. After 10 days, the contents of total biogenic amines inCololabissaira(Brevoort) increased with the extension of storage time. Under the three different temperature conditions, 2- phenylethylamine, cadaverine and histamine in the family Scombridae are the majority of biogenic amines during the process of storage. At the temperature storage of -30 ℃, the contents of 2-ethylamine and cadaverine reduced before 10 days with the extention of time inScomberomorusniphoniu; whereas both of them increased before 10 days inCololabissaira(Brevoort). The generation of histamine inCololabissaira(Brevoort) were easier than those ofScomberomorusniphoniuat 4 and 25 ℃. Additionally, the contents of spermine was not shown significant change in the family Scombridae. The tryptamine and tyramine were undetected inCololabissaira(Brevoort) at -30 and 4 ℃, while the contents of tryptamine were less and changed non-significantly inScomberomorusniphoniu. The contents of tyramine changed obviously at 4 ℃. Except spermidine and spermine, 6 types of biogenic amines increased dramatically at 25 ℃. The results showed that the contents of biogenic amines were closely related to the storage temperature. The generation of the tryptamine, 2-ethylamine, putrescine, cadaverine, histamine, tyramine could be inhibited effectively under the low temperature in the family Scombridae. The results could provide a reference implementation of the storage in the family Scombridae and the monitoring of biogenic amines.[Chinese fishery quality and standards, 2017,7(5):01-10]
high performance liquid chromatography,Scomberomorusniphoniu,Cololabissaira(Brevoort), biogenic amines, storage temperature
LIU Guangming, gmliu@jmu.edu.cn
10.3969/j.issn.2095-1833.2017.05.001
S98
A
2095-1833(2017)05-0001-10
2017-05-15;接收日期2017-08-08
国家自然科学基金重点项目(U1405214);海洋公益性行业科研专项课题(201505026-3);福建省海洋功能食品工程技术研究中心开放基金项目(C11175);福建省海洋生物资源开发利用协同创新中心产学研基金(FJMBIO1611);水产品加工过程中危害因素的识别与脱除技术研究(2015BAD17B02)
闵娟(1993-), 女, 硕士研究生, 研究方向为食品安全质量检测,371728038@qq.com
刘光明,教授,研究方向为水产品加工与安全,gmliu@jmu.edu.cn
