喹烯酮对建鲤和斑点叉尾鮰生长性能和抗缺氧能力的影响
2017-11-03刘永涛郭东方齐富刚杨红艾晓辉
刘永涛,郭东方,齐富刚,杨红,艾晓辉*
(1.中国水产科学研究院长江水产研究所,武汉430223; 2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070;3. 宜昌市农业局, 湖北 宜昌 443000; 4. 江苏农牧科技职业学院水产科技系, 江苏 泰州 225300;5.中国水产科学研究院, 农业部水产品质量安全控制重点实验室, 北京 100141)
喹烯酮对建鲤和斑点叉尾鮰生长性能和抗缺氧能力的影响
刘永涛1,2,5,郭东方3,齐富刚4,杨红1,艾晓辉1,2,5*
(1.中国水产科学研究院长江水产研究所,武汉430223;2. 淡水水产健康养殖湖北省协同创新中心, 武汉430070;3. 宜昌市农业局, 湖北 宜昌443000;4. 江苏农牧科技职业学院水产科技系, 江苏 泰州225300;5.中国水产科学研究院, 农业部水产品质量安全控制重点实验室, 北京100141)
在池塘养殖条件下,饲料中添加3个不同含量(50、75和100mg/kg)的喹烯酮来饲养建鲤(Cyprinuscarpiovar. Jian)和斑点叉尾鮰(IetalurusPunetaus),养殖周期为60d,研究喹烯酮对建鲤和斑点叉尾鮰生长性能和抗缺氧能力的影响。结果表明:与不添加喹烯酮的对照组相比,添加喹烯酮的实验组中建鲤和斑点叉尾鮰生长速度加快,死亡率降低,饲料系数下降。当饲料中添加喹烯酮的剂量为75mg/kg时,其对建鲤和斑点叉尾鮰的生长效率提高最佳(P<0.05),饲料系数最低,成活率最高。在75mg/kg的喹烯酮添加量下,建鲤和斑点叉尾鮰的抗缺氧能力、血细胞和血红蛋白量均有提高,但与对照组相比,差异均不显著(P>0.05)。饲料中添加喹烯酮对建鲤和斑点叉尾鮰生长性能的作用呈现非剂量依赖性,而且添加75mg/kg喹烯酮对其抗缺氧能力影响不显著(P>0.05)。研究表明,建鲤和斑点叉尾鮰养殖中喹烯酮的最适用量为75mg/kg。[中国渔业质量与标准,2017,7(5):11-17]
建鲤;斑点叉尾鮰;喹烯酮;生长性能;抗缺氧能力
喹烯酮(quinocetone)属喹噁啉类药物,其化学名称为3-甲基-2-苯乙烯酮基-喹噁啉-1,4-二氧化物,是中国自主研发并拥有自主知识产权的国家一类新兽药,在中国喹烯酮作为饲料添加剂己被批准用在猪的养殖业上[1]。研究表明,喹烯酮安全、无毒,无明显的蓄积毒性作用、无致突变性、无致癌作用[2-5],但近期一些学者在喹烯酮毒性研究方面有些新发现,他们认为喹烯酮对哺乳动物的细胞具有一定的毒性作用[6-12],体外Ames实验中高浓度的喹烯酮(10μg/mL)显示出一定的基因毒性[13]。喹烯酮在仔猪[14-17]、肉鸭[18]和肉鸡[19]上应用具有良好的促生长效果,也有一定的抗菌作用[20-22]。喹烯酮在水产养殖中的应用研究相对较少,张慧晶[23]报道了喹烯酮对罗非鱼(Oreochromismossambicus)生长性能的影响和耐缺氧应激反应。李金善等[24]用浸泡和投喂喹烯酮的方式对鲫(Carassiusauratus)进行处理,发现喹烯酮对鲫鱼病有一定的防治作用,可以提高其成活率。喹烯酮对彭泽鲫(Carassiusauratusvar. pengze)和南方鲇(Silurusmeridionalis)也有较好的促生长效果[25-26]。本实验研究了池塘养殖条件下添加了不同水平喹烯酮的饲料对建鲤(Cyprinuscarpiovar. Jian)和斑点叉尾鮰(IetalurusPunetaus)生长性能的影响,确定了饲料中喹烯酮的适宜添加量,揭示了喹烯酮对建鲤和斑点叉尾鮰耐低氧能力以及对红细胞数量和血红蛋白含量影响的特征,以期为喹烯酮在建鲤和斑点叉尾鮰养殖中的合理应用提供参考。
1 材料与方法
1.1 实验动物
建鲤(Cyprinuscarpiovar. Jian),平均体重为(159.09±2.37) g;斑点叉尾鮰(Ictaluruspunctatus),平均体重为(46.69±2.09) g,购自仙桃市郭河镇,将实验鱼运至实验场后进行消毒和分组称重。正式实验前,将建鲤和斑点叉尾鮰先暂养在暂养池中,分别用鲤用通威-103饲料(粗蛋白含量30%,粗脂肪含量5.8%)和斑点叉尾鮰用通威-170饲料(粗蛋白含量为33%,粗脂肪含量6.3%)预饲1周,再饥饿1 d后,选择健康无伤的鱼(各2 400尾建鲤和斑点叉尾鮰),称重进行养殖实验。养殖实验用鱼均为同一批次。
1.2 主要试剂与器材
5%喹烯酮预混剂(北京中农发药业有限公司),红细胞稀释液试剂盒(南京建成生物工程研究所),水质在线分析仪(美国赛默飞世尔科技公司),血红蛋白计(苏州市激光图像厂),血球计数板(上海市求精生化试剂仪器有限公司)。
1.3 实验地点
养殖实验在中国水产科学研究院长江水产研究所窑湾实验场开展,选用的每个实验池塘(水泥池)的面积约为400 m2,水深为1~1.3 m。
1.4 实验设计
1.4.1 喹烯酮对建鲤和斑点叉尾鮰生长性能的影响
喹烯酮对建鲤生长性能的影响实验设4个处理组,即对照组(饲喂不添加喹烯酮的饲料)、Ⅰ组(饲喂添加量为50 mg/kg喹烯酮的饲料),Ⅱ组(饲喂添加量为75 mg/kg喹烯酮的饲料),Ⅲ组(饲喂添加量为100 mg/kg喹烯酮的饲料),对照组和每个实验组(Ⅰ、Ⅱ和Ⅲ组)设3个平行,每个平行200尾实验鱼。对照组投喂不添加喹烯酮的鲤用通威-103饲料,实验组投喂在鲤用通威-103饲料的基础上添加喹烯酮的饲料。喹烯酮对斑点叉尾鮰生长性能影响的实验设对照组(饲喂不添加喹烯酮的饲料)、Ⅰ组(饲喂添加量为50 mg/kg喹烯酮的饲料),Ⅱ组(饲喂添加量为75 mg/kg喹烯酮的饲料),Ⅲ组(饲喂添加量为100 mg/kg喹烯酮的饲料),对照组和每个实验组(Ⅰ、Ⅱ和Ⅲ组)设3个平行,每个平行200尾实验鱼。对照组投喂不添加喹烯酮的斑点叉尾鮰用通威-170饲料,实验组投喂在斑点叉尾鮰用通威-170饲料的基础上添加喹烯酮的饲料。实验前对鲤用通威-103饲料和斑点叉尾鮰用通威-170饲料进行检测,未发现喹烯酮。实验期间,每日上午9点和下午4点按照鱼体重的3%对实验鱼投喂饲料,并仔细观察实验鱼的采食情况。定期对池塘水体的溶氧和氨氮含量进行监测,确保良好的水质条件,每天记录水温。实验结束后,让实验鱼饥饿1 d后,将池塘水放干,取出实验鱼测定其生长性能。
添加喹烯酮的饲料的制备方法:分别将鲤用通威-103饲料和斑点叉尾鮰用通威-170饲料粉碎后,将喹烯酮添加到其中,反复混匀后再加20%的水混匀,用绞肉机将其挤压呈条状,常温条件下避光风干后破碎成直径为2 mm的颗粒饲料。
1.4.2 喹烯酮对建鲤和斑点叉尾鮰抗缺氧能力的影响
喹烯酮对建鲤和斑点叉尾鮰抗缺氧能力的影响实验,所用实验鱼为喹烯酮对建鲤和斑点叉尾鮰生长性能影响实验中75 mg/kg剂量组和对照组的实验鱼,生长实验结束后,采用塑料袋密封法[27]进行喹烯酮对建鲤和斑点叉尾鮰抗缺氧能力的影响实验。实验选用的塑料袋的规格为80 cm×45 cm,袋内装池塘水15 L,实验组(75 mg/kg剂量组)和对照组塑料袋中各放鱼15尾,每组设3个平行,每个塑料袋的口用绳子扎紧。实验前后分别测定塑料袋水体的pH、温度和溶氧,并从实验鱼尾静脉采血后测定其血液指标(红细胞数量和血红蛋白含量)。实验过程中观察鱼的活动情况,并记录从实验开始到实验鱼开始浮头和昏迷的时间。
1.5 测定指标与计算方法[28-29]
测量鱼的初始体重和结束体重,计算其增重率和特定生长率,见式(1)和式(2)。
式(1)
式(2)
记录采食量,计算饲料系数,见式(3)。
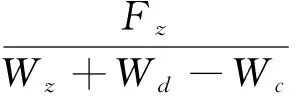
式(3)
记录鱼的数量和发病情况,计算成活率,见式(4)。
式(4)
式(1)~式(4)中:Wo为实验开始时鱼体的平均体重(g);Wt为实验结束时鱼体平均体重(g);Wz为实验鱼终末总体重(g),Wd为死亡实验鱼总体重(g),Wc为实验鱼初始总体重(g),Fz整个养殖期间投喂饲料的总量(g);St为实验结束时存活鱼的尾数,So为实验开始时放养鱼的尾数;d为养殖实验的天数。
1.6 数据分析
数据用SPSS 13.0软件进行统计分析,采用Duncan多重比较来检验实验处理均值间的差异显著性,当P<0.05时表示均值间差异显著,当P>0.05时,表示均值间差异不显著。实验结果以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 添加喹烯酮对建鲤和斑点叉尾鮰生长性能的影响
喹烯酮对建鲤和斑点叉尾鮰生长性能的影响见表1和表2。从表1可知,Ⅰ、Ⅱ和Ⅲ组建鲤的增重率和特定生长率均显著高于对照组(P<0.05),其中Ⅱ组(75 mg/kg剂量组)建鲤的增重率最大,较对照组提高11.60%,且与其他实验组相比差异显著(P<0.05);Ⅰ、Ⅱ和Ⅲ组的饲料系数显著低于对照组(P<0.05),且Ⅱ组最低。Ⅱ和Ⅲ组建鲤的成活率显著高于对照组(P<0.05),而Ⅰ组与对照组差异不显著(P>0.05)。由表2可知,Ⅱ组斑点叉尾鮰的增重率和特定生长率均显著高于对照组(P<0.05),增重率较对照组提高27.26%;饲料系数下降且与对照组差异显著(P<0.05);Ⅱ和Ⅲ组斑点叉尾鮰的成活率显著高于对照组(P<0.05),各实验组斑点叉尾鮰的成活率差异不显著(P>0.05)。各实验组增重率:Ⅱ组>Ⅲ组>Ⅰ组,各实验组饲料系数:Ⅱ组<Ⅲ组<Ⅰ组。Ⅰ组增重率与对照组相比,差异不显著(P>0.05),但饲料系数显著低于对照组(P<0.05)。
由上述结果分析可知,饲料中添加为75~100 mg/kg的喹烯酮时,可以提高建鲤和斑点叉尾鮰的增重率和成活率,降低饲料系数。饲料中添加75 mg/kg喹烯酮对建鲤和斑点叉尾鮰生长性能的作用优于其他剂量组和对照组。

表1 饲料中添加不同含量水平的喹烯酮对建鲤生长性能的影响Tab.1 Effects on growth performance of Jian carp (Cyprinus carpio var. jian) by adding different levels of quinocetone in feed n=3
注:同列肩标字母不同者表示差异显著(P<0.05),下同。

表2 饲料中添加不同含量水平的喹烯酮对斑点叉尾鮰生长性能的影响Tab.2 Effects on growth performance of Channel catfish (Ietalurus Punetaus) by adding different levels of quinocetone in feed n=3
2.2 喹烯酮对建鲤和斑点叉尾鮰抗缺氧能力的影响
2.2.1 实验前后水质指标的变化情况
实验前后对照组和实验组水体的pH、温度和溶氧的测定结果见表3。比较实验后实验组与对照组水体的温度、溶氧和pH,结果显示差异不显著(P>0.05),说明实验前后养殖水体的溶氧、pH和温度较为稳定。
2.2.2 喹烯酮对建鲤和斑点叉尾鮰缺氧耐受时间的影响
由表4可知,对照组与实验组建鲤和斑点叉尾鮰对缺氧耐受时间的差异不显著(P>0.05),说明对建鲤和斑点叉尾鮰饲喂添加了喹烯酮(75 mg/kg)的饲料不会影响其抗缺氧能力。

表3 抗缺氧能力实验中水质指标的变化情况Tab. 3 Changes of physical and chemical indicators of water quality in anti-hypoxic capability experiment n=3
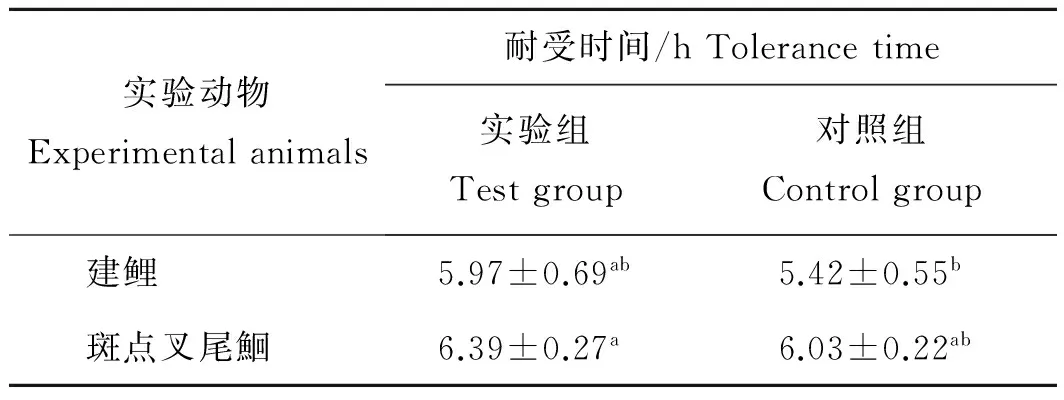
表4 喹烯酮对建鲤和斑点叉尾鮰密闭缺氧耐受时间的影响Tab. 4 Effect of Hypoxia tolerance time ofQuinocetone on Jian carp and Channel catfish
2.2.3 饲喂喹烯酮对实验鱼血液指标的影响
由表5可知,喹烯酮(75 mg/kg剂量组)能提高建鲤和斑点叉尾鮰的红细胞数和血红蛋白量,但与对照组相比差异不显著(P>0.05)。对建鲤和斑点叉尾鮰进行抗缺氧能力影响实验后,实验组(75 mg/kg剂量组)建鲤和斑点叉尾鮰血细胞数量和血红蛋白含量略高于对照组,但差异不显著(P>0.05),表明喹烯酮对建鲤和斑点叉尾鮰血液指标的变化影响较小。

表5 喹烯酮对建鲤和斑点叉尾鮰血液指标的影响Tab. 5 Effects of quinocetone on blood indicators of Jian carp(Cyrinus carpio var.Jian) and Channel catfish(Ietalurus Punetaus)
3 讨论
喹烯酮(Quinocetone) 作为喹乙醇的合理替代品,具有促生长和一定的抗菌作用。喹烯酮通过促进肠道内有益菌群的生长,同时抑制有害菌群的生长,从而提高饲料在肠道中的消化和吸收,进而起到促生长的作用,喹烯酮还可对消化道内多种病原菌的生长繁殖产生选择性的抑制作用,从而起到一定的抗菌作用[30]。
饲料中喹烯酮适宜的添加剂量对鱼体生长有一定的效果。本研究中喹烯酮添加剂量为50、 75和100 mg/kg时,对建鲤和斑点叉尾鮰的生长均具有促进作用,与赵海鹏等[26]和李建文等[31]的研究结果相似。在饲料中加入25、 50、 75、 100和125 mg/kg的喹烯酮饲喂南方鲇,结果显示,75 mg/kg剂量组南方鲇的体重增加量和增重率都达到最大[26]。对异育银鲫饲喂添加喹烯酮剂量为25、 50、 75、 100、 125和150 mg/kg的饲料,研究喹烯酮对异育银鲫生长性能的影响,结果显示,实验组异育银鲫平均增重率都明显高于对照组,且较对照组分别提高了12.73%、 7.54%、 30.07%、 25.68%、 24.79%和30.60%,饲料中的喹烯酮添加量为75和150 mg/kg时,异育银鲫的平均增重率较大,但150 mg/kg剂量组异育银鲫的成活率较低[30],说明高剂量的喹烯酮也会对鱼体造成损害。因此,在选择喹烯酮的添加剂量时,除了考虑其对鱼体的促生长效果还要考虑其毒性作用,结合本实验结果,建议饲料中喹烯酮的添加剂量为75 mg/kg。
喹烯酮可提高鱼体特定生长率(SGR),降低饲料系数。张慧晶[23]报道了125 mg/kg喹烯酮对罗非鱼幼鱼(约10 g)的SGR较对照组提高5.5%,饲料系数较对照组降低2.52%。刘翠玲等[32]研究了喹烯酮对体重为(24.39±0.30)g鲤幼鱼的生长、消化酶和免疫相关酶活性的影响,结果显示,饲料中喹烯酮的添加剂量为125 mg/kg时,实验组鲤幼鱼与对照组相比,SGR提高3.78%,增重率提高7.10%。可见相同添加剂量下喹烯酮对罗非鱼幼鱼的促生长作用要优于其对鲤幼鱼的促生长作用,这可能与鱼体品种有关。本研究中对建鲤饲喂添加了喹烯酮(50、 75和100 mg/kg)的饲料,各实验组建鲤的SGR都有所提高,较对照组分别提高7.95%、 19.32%和11.36%;实验组斑点叉尾鮰除50 mg/kg剂量组的SGR低于对照组外,另外两个剂量组(75 mg/kg和100 mg/kg)较对照组的SGR分别提高15.09%和6.604%。从SGR的数据来看,喹烯酮对建鲤的促生长作用优于斑点叉尾鮰,但由于实验中使用的鱼体规格不同,采食的饲料不同,只有养殖环境和使用喹烯酮的剂量是相同的并不能说明喹烯酮对建鲤的促生长作用优于斑点叉尾鮰。本研究中实验组建鲤和斑点叉尾鮰的饲料系数均降低与对照组相比分别减少14.72%、28.43%、 23.35%和7.21%、 20.67%、 16.83%。
喹烯酮对鱼体的成活率也有一定的影响。该研究实验组与对照组相比,建鲤和斑点叉尾鮰成活率分别增加了1.78%、 4.32%、 3.30%和0.68%、 4.48%、 1.79%。而李建文等[31]报道,在饲料中添加6个水平的喹烯酮(25、 50、 75、 100、 125和150 mg/kg)饲喂异育银鲫幼鱼(7.7 g),与对照组相比,实验组异育银鲫的成活率除了25 mg/kg剂量组成活率高于对照组外,其他剂量组的成活率均低于对照组;当喹烯酮添加剂量为150 mg/kg时,该实验组异育银鲫的成活率最低,且比对照组少8.44%,该现象可能是与异育银鲫的幼鱼(仅有7.7 g)代谢功能尚未发育完全,摄入的高剂量的喹烯酮后不能及时代谢,蓄积在体内会产生毒性作用有关。
张慧晶[23]采用水煮沸20 min排氧后放凉,将罗非鱼分别放入4个桶中,每个处理组放15尾鱼,研究罗非鱼耐缺氧应激反应,结果显示,喹烯酮(125 mg/kg剂量组)能使罗非鱼的耐缺氧能力下降,该作者推测喹烯酮对罗非鱼的促生长作用降低了罗非鱼的应激反应能力。本实验对建鲤和斑点叉尾鮰饲喂添加75 mg/kg喹烯酮的饲料60 d后,采用密封法进行抗缺氧能力影响实验,结果表明,实验组与对照组抗缺氧能力差异不显著(P>0.05)。从血液指标的测定结果来看,饲喂添加75 mg/kg喹烯酮的饲料对建鲤和斑点叉尾鮰的抗缺氧能力未见不良影响。Liu等[33]通过喹烯酮在鱼体内的药代动力学研究发现喹烯酮在鱼体内的吸收率低,而喹烯酮的血浆蛋白结合率无浓度依赖性,属高强度的蛋白结合率[34]。吸收进入鱼体血液中的低浓度的喹烯酮主要与鱼体的血浆蛋白结合,可能是喹烯酮未对鱼体的血液指标等造成影响的原因,而该实验结果与张慧晶研究结果不同,可能与使用的喹烯酮的添加剂量、采用的实验方法、鱼种等不同有关。
4 结论
池塘养殖条件下,喹烯酮在建鲤和斑点叉尾鮰饲料中添加的适宜剂量为75 mg/kg,在该剂量下,建鲤和斑点叉尾鮰的增重率最高,分别较对照组提高11.60%和27.26%,特定生长率分别提高19.32%和15.09%,饲料系数分别降低28.43%和20.67%,该剂量条件下也不会影响建鲤和斑点叉尾鮰的抗缺氧能力,且实验组建鲤和斑点叉尾鮰的血细胞数量和血红蛋白含量与对照组差异不显著。
[1] 中华人民共和国农业部.中华人民共和国农业部公告第295号.(2003-08-26)[2017-03-20].http://www.moa.gov.cn/sjzz/syj/shenpi/201006/t20100606_1535380.htm.
[2] 王玉春,严相林,赵荣材,等.新型药物饲料添加剂喹烯酮的一般毒性研究[J].中兽医医药杂志, 1992 (4):13-14.
[3] 王玉春,赵荣材,严相林,等.喹烯酮对大白鼠胚胎致畸性的研究[J].中国兽医科技, 1993,23(8):30-31.
[4] 王玉春,严相林,赵荣材,等.新型添加剂喹烯酮的一般毒性研究、亚急性毒性试验[J].中兽医医药杂志,1994(5):10-21.
[5] 王玉春,赵荣材,严相林,等.喹烯酮对小白鼠的致癌试验[J]. 中国兽医科技, 1995,25(3):24-25.
[6] Dai C,Li B,Zhou Y,et al.Curcumin attenuates quinocetone induced apoptosis and inflammation via the opposite modulation of Nrf2/HO-1 and NF-kB pathway in human hepatocyte L02cells[J].Food Chem Toxicd, 2016,95(9):52-63.
[7] Liu Q Y,Zhang J W,Luo X,et al.Further investigations into the genotoxicity of quinoxaline-di-N-Oxides and their primary metabolites[J].Food Chem Toxicol, 2016,93:145-157.
[8] Wang X,Bai Y,Chneg G Y,et al.Genomic and proteomic analysis of the inhibition of synthesis and secretion of aldosterone hormone induced by quinocetone in NCI-H295R cells[J].Toxicology, 2016,350(3):1-14.
[9] Wang X,Wan D,Ihsan A,et al.Mechanism of adrenocortical toxicity induced by quinocetone and its bidesoxy-quinocetone metabolite in porcine adrenocortical cells invitro[J].Food Chem Toxicol, 2015,84(10):115-124.
[10] Yu M,Wang D,Xu M,et al.Quinocetone-induced Nrf2/HO-1 pathway suppression aggravates hepatocyte damage of Sprague-Dawley rats[J].Food Chem Toxicol, 2014,69(7):210-219.
[11] 班曼曼,张可煜,江善祥,等.喹烯酮和喹乙醇对人源肝细胞的毒性作用[J].中国兽医学报, 2010,30(1):1517-1521.
[12] Yu M,Xu M,Liu Y,et al.Nrf2/ARE is the potential pathway to protect Sprague-Dawley rats against oxidative stress induced by quinocetone[J].Regul Toxicol Pharm,2013,66(3):279-285.
[13] Ihsan A,Wang X,Zhang W,et al.Genotoxicity of quinocetone, cyadox and olaquindoxinvitroandinvivo[J].Food Chem Toxicol, 2013,59(8):207-214.
[14] 徐忠赞,李金善,赵荣才,等.饲料添加新药喹烯酮对仔猪的增重试验[J].中国兽医科技, 1995,25(6):37-39.
[15] 徐忠赞,李金善,赵荣才,等.喹烯酮对猪增重作用的初步观察[J].江西畜牧兽医杂志, 2004,22(5):7-8.
[16] 李娟,刘东升,许东宝,等.喹烯酮对仔猪生产性能影响的研究[J].中国饲料, 2004,23(12): 27-27.
[17] 孙鎏国,朱柳燕,蔡祥生,等.喹烯酮对断奶仔猪生产性能的影响[J].畜牧与饲料科学, 2005,26(3): 8-9.
[18] 陈权军,邓岳松,杜景德,等.喹烯酮、牛至油和喹乙醇对肉鸭生长的影响[J].饲料工业, 2004,25(3):41-42.
[19] 王玉春,赵荣材,严相林,等.喹烯酮促进肉鸡生长的效果观察[J].中国兽医科技, 1995,25(7):36-38.
[20] Cara A, Corona P, Loriga M. Quinoxaline 1, 4-Dioxide: A versatile scaffold endowed with Manifold Activities[J].Curr Med Chem, 2005, 12(19): 2259-2272.
[21] Chen Q, Tang S S, Jin X, et al.Investigation of the genotoxicity of quinocetone, carbadox and olaquindoxinvitrousing vero cells[J].Food Chem Toxicol, 2009, 47(2): 328-334.
[22] Wang D, Luo X, Zhong Y, et al.Pu-erh black tea extract supplementation attenuates the oxidative DNA damage and oxidative stress in Sprague-Dawley rats with renal dysfunction induced by subchronic 3-methyl-2-quinoxalin benzenevinylketo-1,4-dioxide exposure[J].Food Chem Toxicol, 2012, 50(2): 147-154.
[23] 张慧晶.三种促生长剂对罗非鱼商品品质的影响及体内残留测定[D].无锡:江南大学, 2009:8-19.
[24] 李金善,赵荣才,王玉春,等.饲料添加新药喹烯酮预防鱼病效果的观察[J].中兽医医药杂志, 1999,36(3):11-12.
[25] 熊六凤,刘晓兰,伍海拔.喹烯酮对彭泽鲫生长性能的影响[J].水利渔业, 2007,27(5):55-56.
[26] 赵海鹏,蒲德永,余必先,等.喹烯酮对南方鲇生长性能的影响[J].安徽农学通报, 2009,15(3):153-154.
[27] 齐富刚,艾晓辉,袁科平,等.黄霉素对建鲤和斑点叉尾鮰抗缺氧能力的影响[J].江苏农业科学, 2010,38(5):332-333.
[28] 戚常乐,林黑着,黄忠,等.亚麻酸对卵形鲳幼鱼生长性能、消化酶活性及抗氧化能力的影响[J].南方水产科学, 2016,12(6):59-67.
[29] 黄忠,林黑着,李卓佳,等.复方中草药投喂策略对凡纳滨对虾生长、消化及非特异性免疫功能的影响[J].南方水产科学, 2013,9(5):37-43.
[30] 陈黎龙,肖世平,刘万平.新型饲料药物添加剂喹烯酮的研究进展[J].广东饲料, 2008,17(7):33-36.
[31] 李建文,黄峰,周艳萍,等.喹烯酮对异育银鲫生长的影响及其在体内的代谢[J].粮食与饲料工业, 2010,32(5):45-48.
[32] 刘翠玲,张家国,张长峰,等.3种添加剂对鲤幼鱼生长、消化酶和免疫相关酶活性的影响[J].上海海洋大学学报, 2016,25(5):710-718.
[33] Liu Y T, Ai X H, Wang F H, et al. Comparative pharmacokinetics and tissue distribution of quinocetone in crucian carp (Carassiusauratus), common carp (CyprinuscarpioL.), and grass carp (Ctenopharyngodonidella) following the same experimental conditions [J]. J Vet Pharmacol Therap, 2015, 38(4): 383-391.
[34] 赵凤,刘永涛,胥宁,等. 喹烯酮在草鱼血浆中蛋白结合率的测定 [J]. 淡水渔业, 2014, 44(2): 71-76.
Effectsofquinocetoneongrowthperformanceandanti-hypoxiccapacityofJiancarp(Cyprinuscarpiovar.Jian)andChannelcatfish(IetalurusPunetaus)
LIU Yongtao1,2, GUO Dongfang3, QI Fugang4, YANG Hong1, AI Xiaohui1, 2,5*
(1.Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223,China; 2. Hubei FreshwaterAquaculture Collaborative Innovation Center, Wuhan 430223, China; 3. Yichang Agriculture Bureau, Yichang 443000, Hubei,China; 4. Fisheries Science and Technology Department, Jiangsu Agri-Animal Husbandry Vocational College, Taizhou 225300 Jiangsu, China; 5. Chinese Academy of Fishery Science, Key Laboratory of Control of Quality and Safetyfor Aquatic Products , Ministry of Agriculture, Beijing 100141, China)
The growth performance and the anti-hypoxic capacity of Jian carp (Cyprinuscarpiovar.Jian) and Channel catfish (IetalurusPunetaus) fed with feedstuff in different doses (50 mg/kg、75 mg/kg and 100 mg/kg) of quinocetone for 60 d were investigated under the condition of pond culture. The results showd that the growth rate was increased, and mortality rate and feed coefficient was decreased when compared with the control group. The growth performance at the dose of 75 mg/kg group is better than the other dose groups (50 mg/kg and 100 mg/kg). Growth rates of Jian carp and Channel catfish of quinocetone groups were significantly higher than that of the control group (P<0.05), and the feed coefficient of quinocetone groups was significantly lower than that of the control group (P<0.05). Jian carp and Channel catfish of quinocetone groups were higher survival rates than those of the control group (P<0.05). However, anti-hypoxic capacity and the level of blood cells and hemoglobin of Jian carp (Cyprinuscarpiovar.Jian) and channel catfish (IetalurusPunetaus) had no significant differences between 75 mg/kg dosage group and control group (P>0.05). Therefore, the growth rate was shown non-dose-dependently when they were feeded with quinocetone; in addition, anti-hypoxic capacity had no significant effect with or without 75 mg/kg quinocetone. Thus, 75 mg/kg quinocetone was recommended for aquaculture.[Chinese Fishery Quality and Stardars, 2017,7(5):11-17]
Jian carp; Channel catfish; quinocetone; growth performance; anti-hypoxic capacity
AI Xiaohui,aixh@yfi.ac.cn
10.3969/j.issn.2095-1833.2017.05.002
S948
A
2095-1833(2017)05-0011-07
2017-04-17;接收日期2017-05-11
现代农业技术体系专项资金(CARS-49);中国水产科学研究院基本科研业务费资助(2016JBF0104)
刘永涛(1979-),男,博士,副研究员,研究方向为水产动物药理和水产品质量安全,thincat2005@sina.com
艾晓辉,研究员,研究方向为水产动物药理及残留控制技术,aixh@yfi.ac.cn
