双酶分步酶解谷朊粉制备短肽的研究
2017-11-03盛晓静石爱民刘红芝
盛晓静 王 强 刘 丽 石爱民 胡 晖 杨 颖 刘红芝
(农业部农产品加工与质量控制重点开放实验室;中国农业科学院农产品加工研究所,北京 100193)
双酶分步酶解谷朊粉制备短肽的研究
盛晓静 王 强 刘 丽 石爱民 胡 晖 杨 颖 刘红芝
(农业部农产品加工与质量控制重点开放实验室;中国农业科学院农产品加工研究所,北京 100193)
本文通过比较酶种类、加酶量、底物浓度、酶解温度、酶解时间对短肽得率和水解度的影响,采用二次回归正交旋转组合设计优化分步酶解制备谷朊粉短肽的最佳工艺。在复合蛋白酶(Protamex)水解谷朊粉91.50 min后加入中性蛋白酶(Neutrase)继续酶解121.50 min,Protamex添加量为 665.00 U/g底物,Neutrase添加量为5 290.00 U/g底物,水解温度 50℃,质量浓度 12%,在此条件下,短肽得率为 69.88%,水解度25.74%。经高效液相色谱测定,分子质量小于1 000 Da的水解产物占100%。采用Protamex与Neutrase分步酶解谷朊粉制备谷朊粉短肽,与现有制备谷朊粉短肽方法相比,避免了后续脱盐步骤,简化工艺,且具有制备条件温和,TCA-NSI和DH高,纯度高,分子量集中分布于 1 000 Da以下等特点。
谷朊粉短肽 复合蛋白酶 中性蛋白酶 分步酶解
谷朊粉又名小麦面筋蛋白,谷朊粉中蛋白质质量分数在80%[1]以上,其氨基酸组成较齐全,是营养丰富、物美价廉的植物蛋白;我国谷朊粉年产量高达10万吨[2],加工产物附加值低,为提高谷朊粉资源利用率与企业经济效益,有必要对其开发利用进行更深入的研究。
研究发现植物蛋白酶解物及其生物活性肽类物质,不仅能作为氨基酸供体,在体内具有优良的消化吸收性能,是一类生理调节剂,在体内参与机体免疫调节、降血压、促进矿物质吸收、抗血栓等[3-5],谷朊粉短肽也具抗炎、降血压、治疗腹泻等生理功能[6-8]。
已报道的酶法制备谷朊粉短肽研究中,李清丽等[9]采用胰蛋白酶与复合蛋白酶复合酶解,双酶复合酶解耗时12 h,水解度为23.26%;刘树兴等[10]采用超声辅助碱性蛋白酶酶解谷朊粉制备ACE抑制短肽,水解度为14.64%,但采用碱性蛋白酶酶解需通过分离纯化技术提高谷朊粉短肽纯度,该方法后续处理多且对环境造成一定程度的污染。目前选用蛋白酶(胰蛋白酶、胃蛋白酶、复合蛋白酶、中性蛋白酶、木瓜蛋白酶[11-12]等)作为工具酶,耗时长,水解效果较差,短肽含量低,为获得高纯度、低分子量的短肽,保证产品功能特性,使谷朊粉短肽制备成本增加。因此如何简化工艺的同时获得高水解度、高得率、低分子质量的谷朊粉短肽成为生产工艺中需要解决的技术难题。
本研究以谷朊粉为原料,通过一系列单一酶和复合酶的效果对比,选出最佳效果酶;通过考察酶用量、底物浓度、酶解温度、时间对水解度和短肽得率的影响,采用二次回归正交旋转组合设计优化分步酶解制备谷朊粉短肽最佳工艺,以期获得高水解度、高短肽得率、低分子质量谷朊粉短肽,同时避免后续脱盐步骤,简化工艺,为谷朊粉短肽的工业化生产提供理论依据和技术支持。
1 材料与方法
1.1 主要材料与试剂
谷朊粉:郑州食全食美商贸有限公司;木瓜蛋白酶(Papain):南宁厐博生物工程有限公司;水解蛋白酶(Alcalase)、风味蛋白酶(Flavorzyme)、复合蛋白酶(Protamex)、中性蛋白酶(Neutrase):丹麦诺维信公司;福林-酚试剂、标准分子量蛋白(MW):Sigma公司;三氟乙酸(TFA,色谱纯):Fluka公司;乙腈(色谱纯),德国Merk公司;其他试剂均为国产分析纯。
1.2 主要设备
UV-1201紫外分光光度计:北京瑞利分析仪器公司;KIELETEC ANALYSISER全自动凯氏定氮仪:瑞典 Foss 公司;Mini Spray Dryer B-290 喷雾干燥器:瑞士步琦Buchi公司;Waters 600高效液相色谱仪:Waters 公司;TSKgel2000 SWXL色谱柱:Tosho公司。
1.3 试验方法
1.3.1 谷朊粉理化指标测定
水分测定:GB/T 5009.3-2010;蛋白质测定:GB/T 5009.5-2010;
脂肪测定:GB/T 5009.6-2003;灰分测定:GB/T 5009.4-2010。
1.3.2 可溶性氮的测定
Folin-酚法[13]
1.3.3 短肽得率测定
三氯乙酸(TCA)可溶性氮法[14],短肽得率按下式计算:
(1)
式中:TCA-NSI 为三氯乙酸可溶性氮得率(%);N1为在 15%TCA 中的可溶性氮(mg);N2为原料中的总氮(mg)。
1.3.4 水解度(DH)的测定
pH-Stat[15]法

(2)
式中:DH 为水解度/%;B 为碱液体积/mL;Nb为碱液当量浓度/mol/L;α为α-氨基的解离度;MP 为底物中蛋白质总量/g;htot为底物中蛋白质中肽键总数/mmol/g蛋白,对谷朊粉而言,htot=8.38(根据谷朊粉的氨基组成计算得到)。
1.3.5 短肽分子量分布测定
采用高效液相色谱(HPLC)测定酶解物的分子量分布,检测条件为:
色谱柱:TSKgel2000 SWXL(300 mm×7.8 mm);
流动相∶乙腈∶水∶三氟乙酸=45∶55∶0.1;
流速:0.5 mL/min;
检测波长:220 nm;
柱温:30 ℃;
标准分子量分别为细胞色素C(MW 12 500)、抑肽酶(MW 6 511)、杆菌肽(MW 1 422)、乙氨酰胺-乙氨酰胺-精氨酸(MW 451)、谷胱甘肽(MW 189)。
1.3.6 蛋白酶活力的测定
改进的Folin-酚法[16]
蛋白酶活力:酪蛋白底物在特定条件下经酶水解,每分钟产生1μg酪氨酸为1个活力单位,以U表示。
本试验采用木瓜蛋白酶(Papain,5.00×105U/g)、风味蛋白酶(Flavorzyme,2.00×104U/g)、复合蛋白酶(Protamex,1.20×105U/g)、中性蛋白酶(Neutrase,6.00×104U/g)、水解蛋白酶(Alcalase,3.1752×105U/g)为工具酶。
1.3.7 蛋白酶的筛选
分别对复合蛋白酶(Protamex)、中性蛋白酶(Neutrase)、风味蛋白酶(Flavorzyme)、木瓜蛋白酶(Papain)、碱性蛋白酶(Alcalase)在其推荐最适条件下进行单一酶解,除碱性蛋白酶外的4种酶两两复合酶解,分别测定酶解物的 TCA-NSI 和DH。
1.3.8 谷朊粉功能短肽的制备
将谷朊粉过100目筛后,配制一定浓度的谷朊粉溶液(边搅拌边加入一定量的水中,形成悬浮液),在80 ℃预热10 min,降至酶推荐最适温度后,用1 mol/L NaOH调节pH值,并加入蛋白酶,一定温度下反应。反应过程中不断搅拌并加入1 mol/L NaOH以保证体系pH值恒定。酶解完成后,90 ℃水浴中加热15 min灭酶,冷却到室温4 200 r/min离心10 min,上清液即为谷朊粉功能短肽溶液[17]。
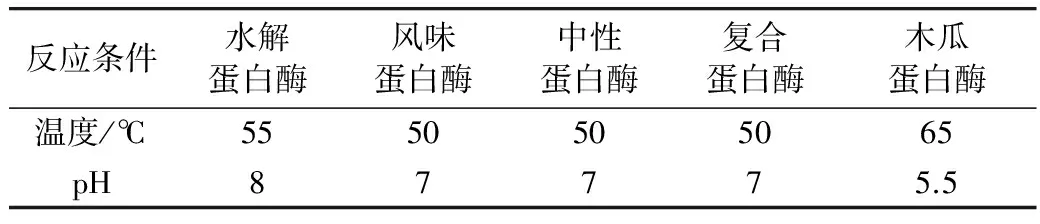
表1 各种酶反应温度和pH
1.3.9 双酶单因素酶解试验
固定谷朊粉溶液浓度为 8%,其他因子基本条件为Protamex用量250 U/g底物,反应温度50 ℃,Protamex加入时间为Neutrase反应 120 min 后,加入Protamex继续反应。反应结束后,90 ℃水浴 15 min 灭酶,离心,取上清液1ml稀释定容至100 mL,测TCA-NSI 和DH。改变其中 1 个条件,固定其他条件以考察酶用量、反应温度、酶解时间对TCA-NSI和DH的影响。各因子水平见表 2。
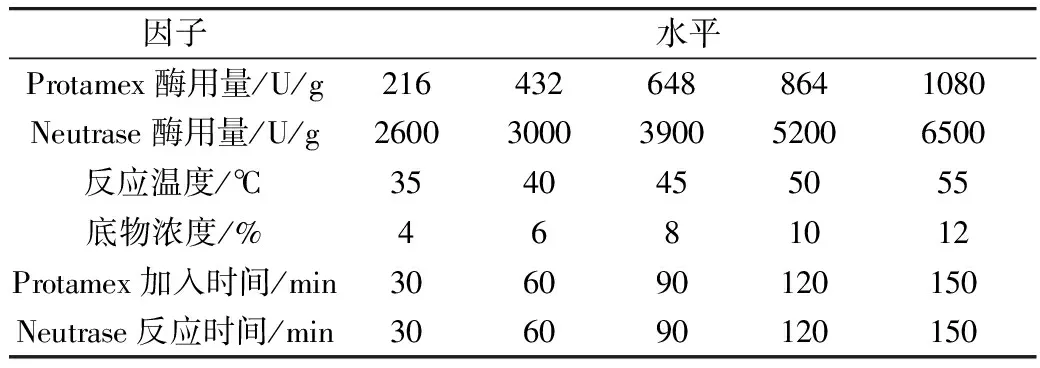
表2 双酶单因素试验各因子水平
1.3.10 双酶多因素酶解试验
根据单因子试验结果,设定复合蛋白酶和中性蛋白酶分步水解。选取Protamex加酶量(A)、Neutrase加酶量(B)、Protamex酶解时间(C)、Neutrase酶解时间(D)为影响因子,以短肽得率TCA-NSI(Y1)、水解度DH(Y2)为响应值,设计二次回归正交旋转组合试验(表3)。

表3 二次回归正交旋转组合试验因素水平表
1.3.11 谷朊粉双酶酶解工艺路线
谷朊粉加水→80 ℃前处理(10 min)→冷却至50 ℃→加入Protamex→恒温(50 ℃)酶解(90 min)→加入Neutrase→恒温(50 ℃)酶解(120 min)→90 ℃灭酶(10 min)→离心(4 200 r/min,10 min)→上清液喷雾干燥→谷朊粉短肽。
1.4 数据处理
试验均重复3次,平行3次;试验数据采用 t 检验方法,P≤0.05 认为结果差异显著,P≤0.01 认为结果差异极显著,数据处理采用design expert软件。
2 结果与讨论
2.1 酶的筛选
通过17种蛋白酶的对比,可以看出,Alcalase是酶解效果最好的酶,但Alcalase是碱性蛋白酶,制成的短肽需要脱盐,从经济效益上讲,该酶不适宜工业生产,则它不是最佳效果酶;那么Protamex和Neutrase的复合酶解,使TCA-NSI和DH两者皆有一定程度的提高;同时,对比相同单一酶加入顺序不同对酶解效果的影响,通过试验结果可以看出复合酶加入顺序与水解结果关系较大。筛选出最佳复合酶为:Protamex和Neutrase的组合,TCA-NSI和DH分别为67.89%和24.14%。

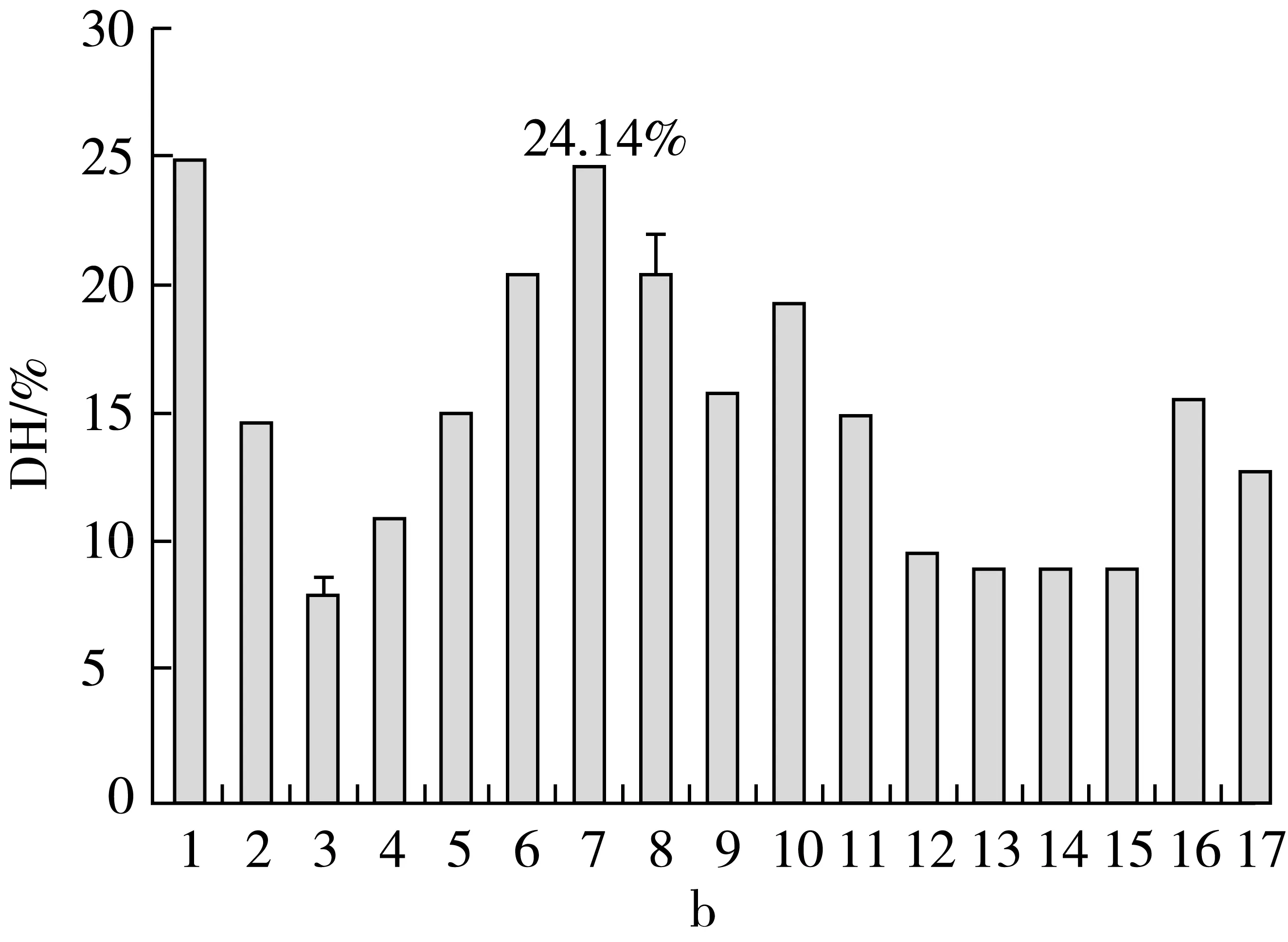
注:1 Al(碱性蛋白酶),2 Ne(中性蛋白酶),3 Fl(风味蛋白酶),4 Pr(复合蛋白酶),5 Pa(木瓜蛋白酶),6 Ne-Pr,7 Pr-Ne,8 Ne-Fl,9 Fl-Ne,10 Ne-pa,11 Pr-Pa,12 Fl-Pa,13 Pa-Ne,14 Pa-Pr,15 Pa-Fl,16 Pr-Fl,17 Fl-Pr。图1 不同蛋白酶酶解谷朊粉对其TCA-NSI和DH的影响
2.2 单因素试验
2.2.1 酶解时间对TCA-NSI和DH的影响
2.2.1.1 分步酶解Protamex所需最佳酶解时间
试验考察了0~180 min内Protamex不同酶解时间对体系TCA-NSI和DH的影响如图2:
如图可知:30~60 min时,TCA-NS和DH呈明显上升趋势。60~180 min酶解过程中,TCA-NS和DH缓慢上升,这是因为随着酶解时间的延长,大分子蛋白在蛋白酶的作用下分解为小分子肽,酶切位点逐渐减少,蛋白酶活力也逐渐下降,致使 DH 和 TCA-NSI 的增长趋势平缓;又考虑经济效益,单酶酶解时间不宜过长。因此Protamex的最佳酶解时间为90 min。
2.2.1.2 分步酶解Neutrase所需最佳酶解时间
试验考察了0~150 min内Neutrase不同酶解时间对体系TCA-NSI和DH的影响如图2:
如图所示:30~120 min内TCA-NSI和DH随时间的延长不断升高,且在120 min后趋于稳定。在酶解120 min时,TCA-NSI和DH分别达到65.94%和18.86%。这是因为随着时间的延长,酶与物料的更加充分,酶切效应更加明显,使得TCA-NSI和DH增高;时间继续延长,作用位点已充分反应,蛋白酶活力下降;则Neutrase的最佳酶解时间为120 min。
2.2.2 底物浓度对TCA-NSI和DH的影响
在底物浓度分别为4%、6%、8%、10%、12%、14%的酶解条件下,探究底物浓度对TCA-NSI和DH的影响如图2:
如图所示:在4%~12%范围内随底物浓度的增加而增加;在12% ~14%内增加幅度较小基本趋于平缓;这是由于随着底物浓度的增加,谷朊粉与溶剂接触面的浓度差增大、酶切位点接触较多,使得反应速度加快,从而短肽得率上升、水解度增大;虽然低浓度时溶质流动性好,但蛋白酶和作用底物的碰撞次数减少,酶解反应受到抑制;而体系底物浓度过大会造成体系中有效水分浓度过低,因此底物和蛋白酶的扩散和运动速度减慢,从而对酶解产生抑制作用,且底物浓度过大,生产成本增加,不利于经济效益。故选择12%为最佳底物浓度。
2.2.3 酶解温度对TCA-NSI和DH的影响
在酶解温度为30、35、40、45、50 ℃条件下,探究温度对TCA-NSI和DH的影响如图2:
如图所示:在35~50 ℃间,随着温度的升高TCA-NSI和DH也随之增大,且均在50 ℃时达到最高,并在50 ℃后有所下降。这是由于反应温度过低时,降低了体系内分子运动的激烈程度,从而降低了蛋白酶与底物的碰撞机率;而当温度过高时,会引起蛋白酶次级键的解离,使蛋白酶丧失或部分丧失催化活性,使得得率和水解度降低。因此,最佳酶解温度为45 ℃。
2.2.4 加酶量对TCA-NSI和DH的影响
2.2.4.1 Protamex的量对TCA-NSI和DH的影响
Protamex加酶量分别为236、432、648、864、1 080 U/g时,对TCA-NSI和DH的影响如图2所示。
随着加酶量的增大,TCA-NSI和DH也随之增大,在236~432 U/g范围内增加速度相对缓慢,在432~648 U/g之间酶解液的TCA-NSI和DH急剧增加,增高速率变快;在648 U/g后趋于平稳无明显上升趋势,且在实际产业化中,加酶量过大,成本增大,不利于经济效益;故选择Protamex为648 U/g的底物。
2.2.4.2 Neutrase的量对TCA-NSI和DH的影响
Neutrase加酶量分别为2 600、3 000、3 900、5 200、6 500 U/g时,对TCA-NSI和DH的影响如图2所示。
基于Protamex的加酶量上,改变Neutrase的量,以期确定该复合酶的最适加酶量;可以看出在2 600~5 200 U/g范围内,随着加酶量增大,酶的水解作用加强,反应后TCA-NSI和DH上升,且在5 200 U/g处达到最高点;但在5 200 U/g后当加酶量继续增加,酶的抑制作用导致水解度和短肽得率均不同程度下降;故选择Neutrase为5 200 U/g的底物。
2.3 双酶多因子酶解试验结果
二次回归正交旋转组合设计试验结果及回归分析见表4和表 5。
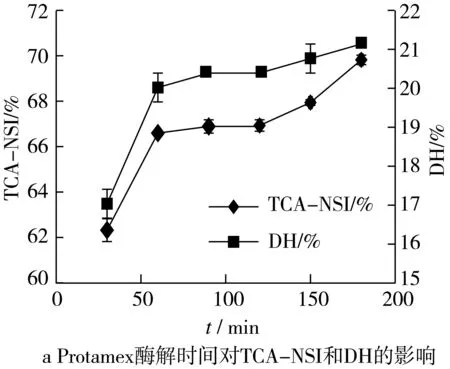
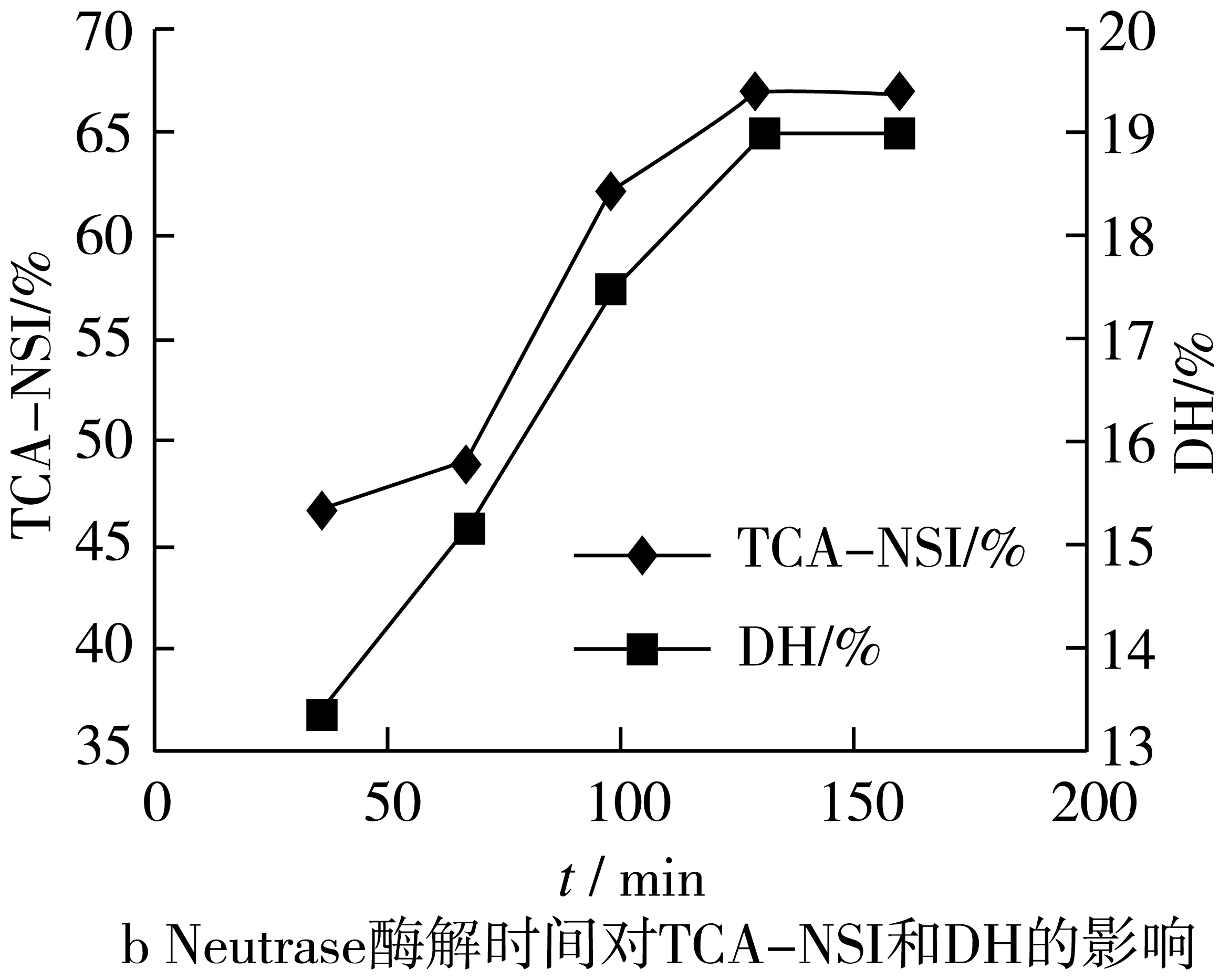
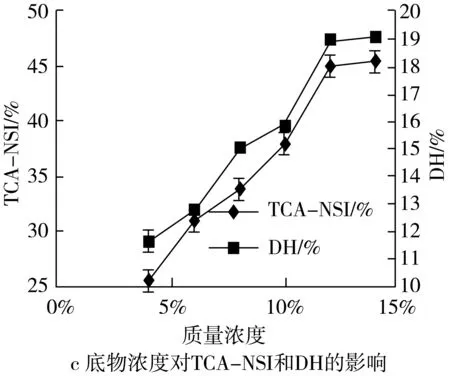
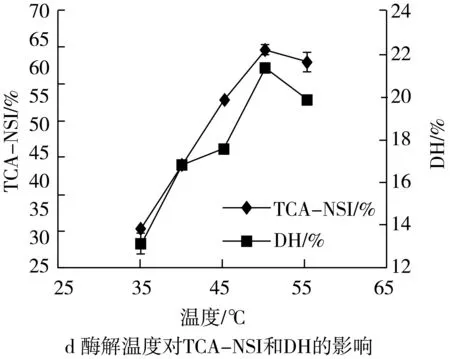
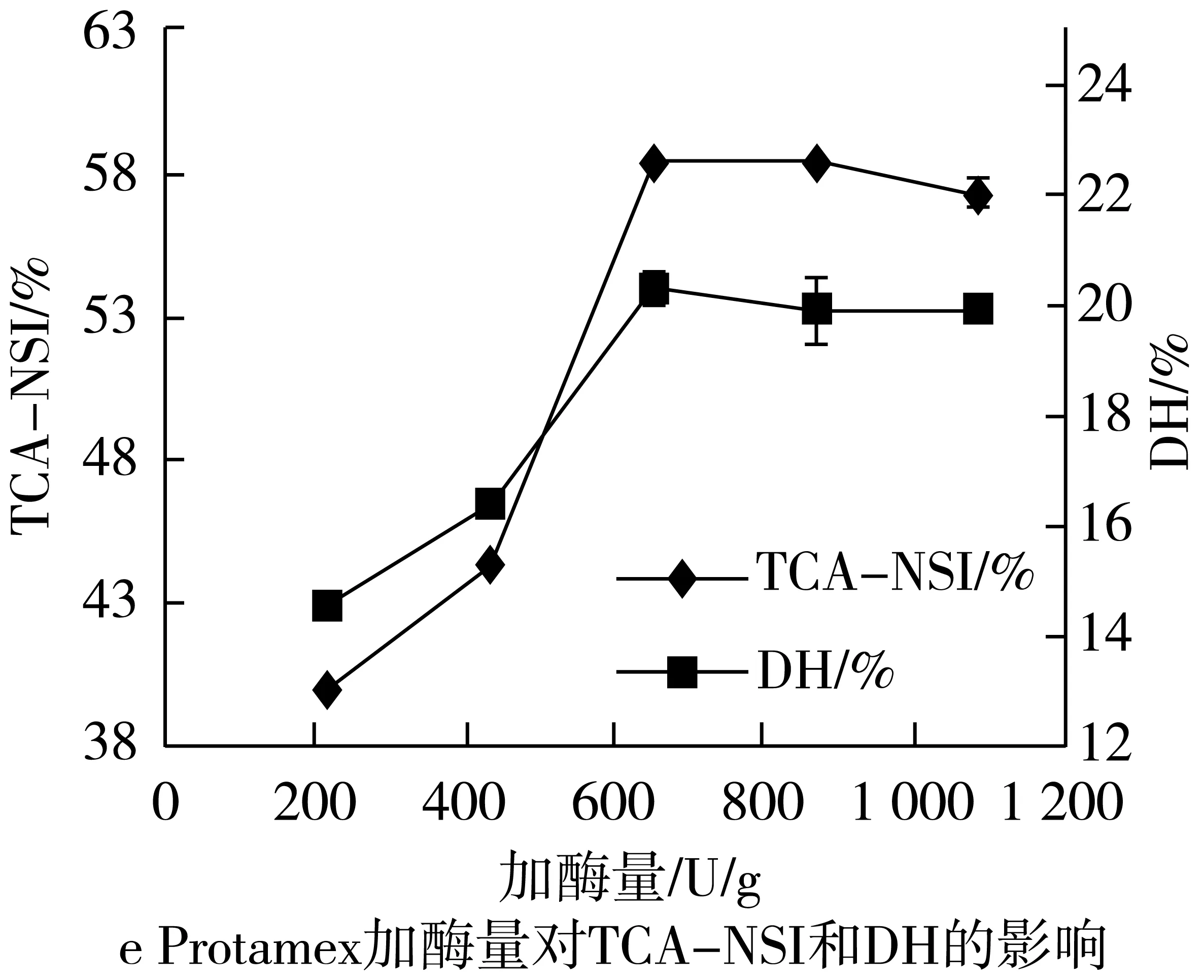
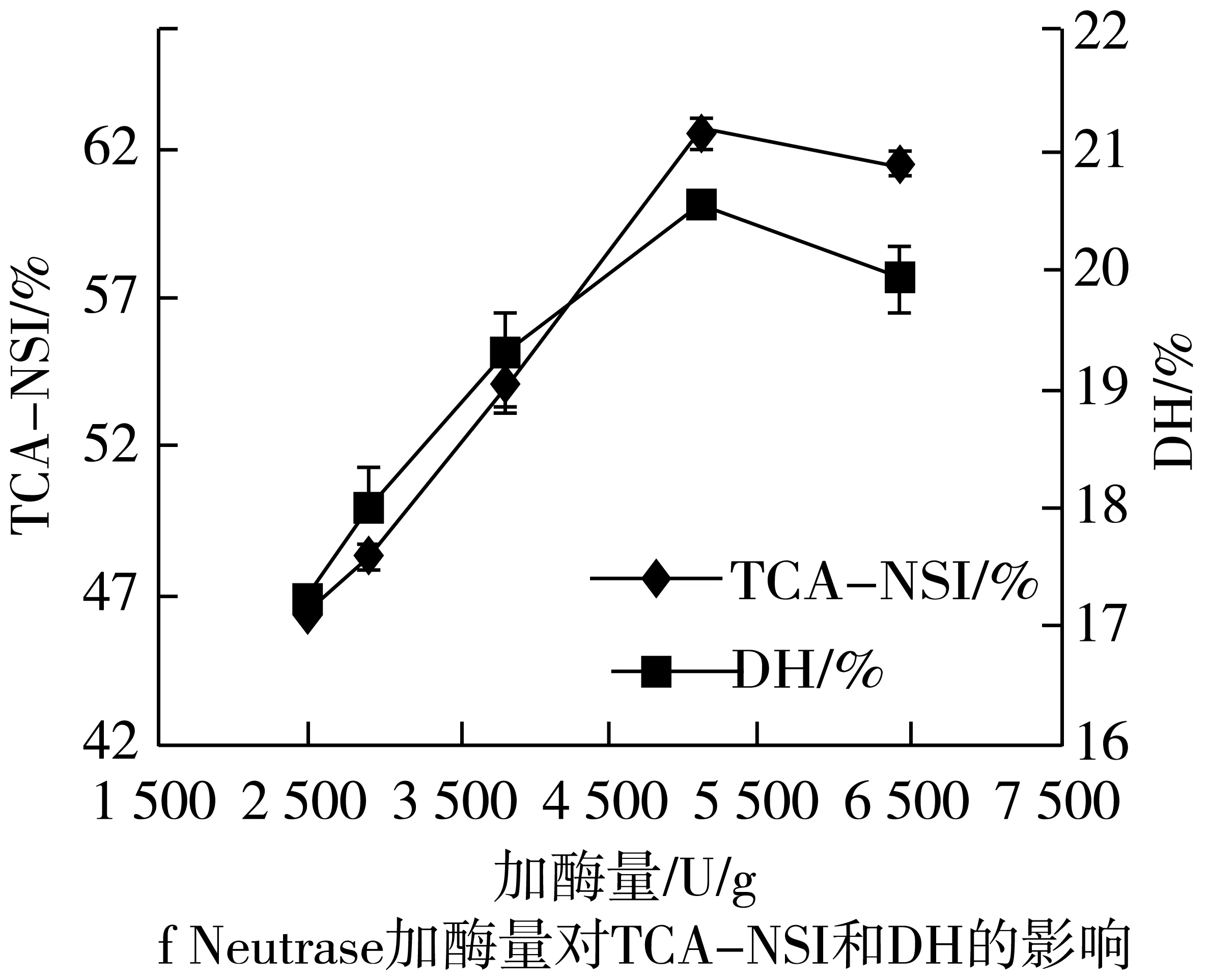
图2 不同处理对蛋白质TCA-NSI和DH的影响
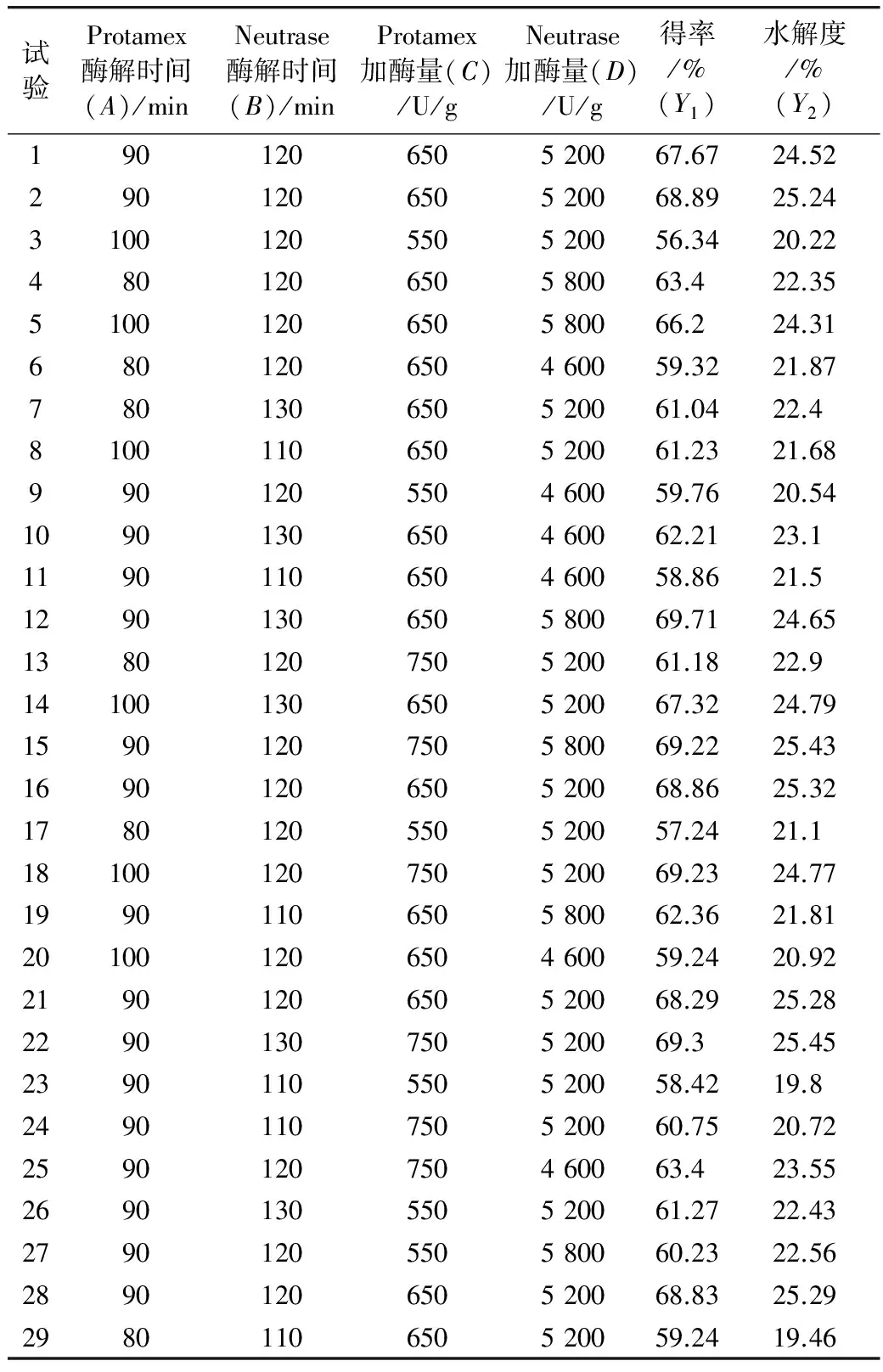
表4 二次回归正交旋转设计试验及结果
为考察各因子对水解度和短肽得率的影响,分别以水解度、短肽得率为指标,对表4 试验结果进行分析,可分别得到3 因子与短肽得率(TCA-NSI)、水解度(DH)之间的回归方程为:
TCA-NSI=68.51+1.51A+2.50B+3.32C+2.36D+1.07AB+2.24AC+0.72AD+1.42BC+1.00BD+1.34CD-3.98A2-2.64B2-3.31C2-2.37D2(3)
DH=25.13+0.55A+1.49B+1.35C+0.80D+0.042AB+0.69AC+0.73AD+0.53BC+0.31BD-0.035CD-1.65A2-1.52B2-1.31C2-0.92D2
(4)
对方程(3)进行方差分析,结果见表 5。从表 5可以看出,回归模型 Model(P<0.0001)达到极显著水平,失拟性检验即P=0.051 5>0.05,误差不显著,说明试验所选回归模型可行。由方程(3)可知,酶解时间与加酶量对TCA-NSI有正影响。从表5中可得各因子对TCA-NSI影响大小依次为Protamex加酶量(C)、Neutrase酶解时间(B)、Neutrase加酶量(D)、Protamex酶解时间(A),且Protamex酶解时间(A)与Protamex加酶量(C)、Neutrase酶解时间(B)与Neutrase加酶量(D)、Protamex加酶量(C)与Neutrase加酶量(D)间存在交互作用。剔除不显著项后,建立得率对试验各因子的回归方程为:
TCA-NSI=68.51+1.51A+2.50B+3.32C+2.36D+2.24AC+1.42BC+1.34CD-3.98A2-2.64B2-3.31C2-2.37D2
(5)
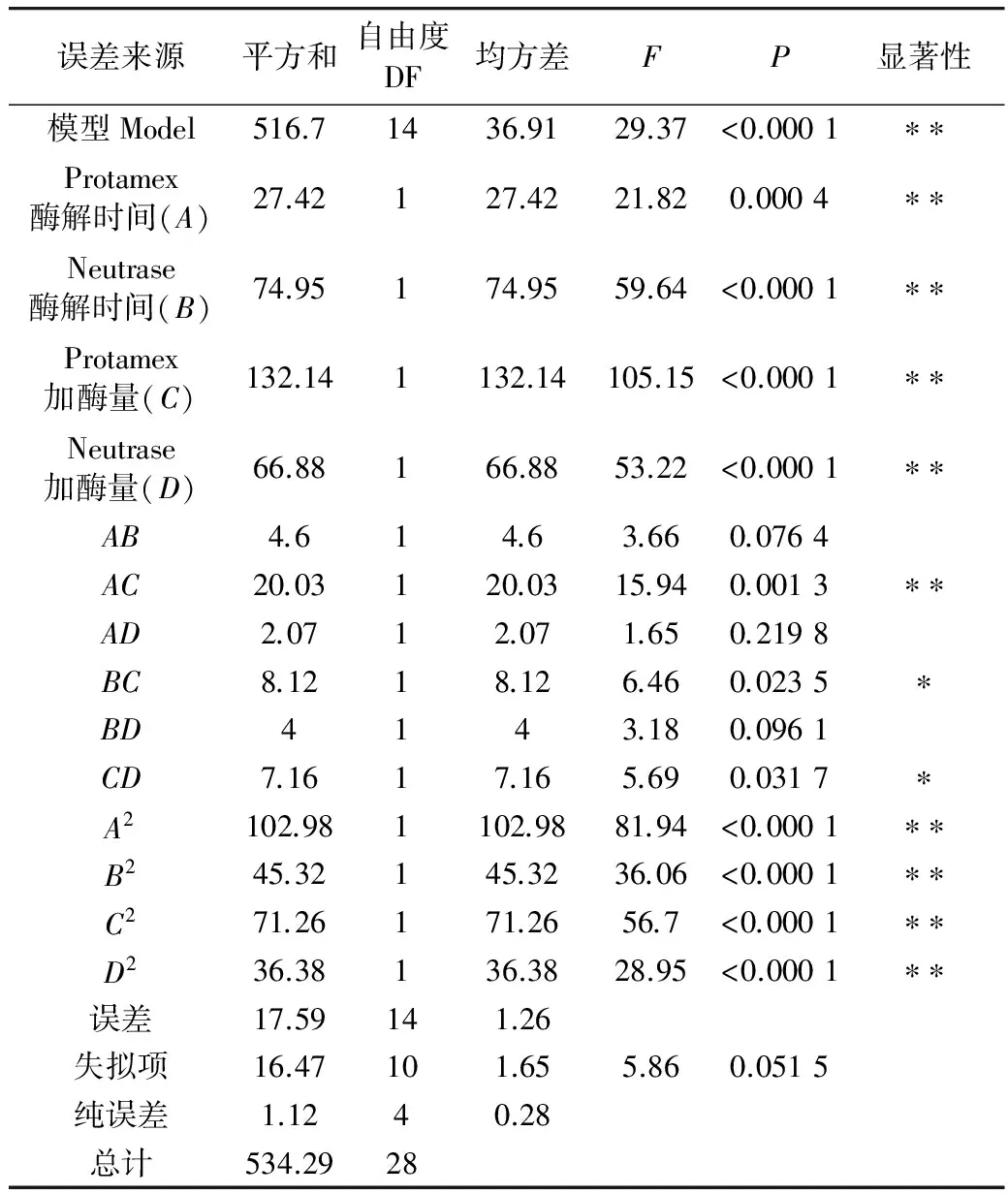
表5 TCA-NSI方差分析表
注:*表示在α=0.05 水平上显著;**表示在α=0.01 水平上显著。
对方程(4)进行方差分析,结果见表 6。从表 6可以看出,回归模型 Model(P<0.0001)达到极显著水平,失拟性检验P=0.081 3>0.05,误差不显著,说明试验所选回归模型可行。由方程(3)可知,酶解时间和加酶量对DH有正影响。从表6中可得各因子对DH影响大小依次为Neutrase酶解时间(B)、Protamex加酶量(C)、Neutrase加酶量(D)、Protamex酶解时间(A),而且Protamex酶解时间(A)与Protamex加酶量(C)、Neutrase加酶量(D)间有显著的交互作用。剔除不显著项后,建立水解度对试验各因子的回归方程为
DH=25.13+0.55A+1.49B+1.35C+0.80D+0.69AC+0.73AD-1.65A2-1.52B2-1.31C2-0.92D2
(6)
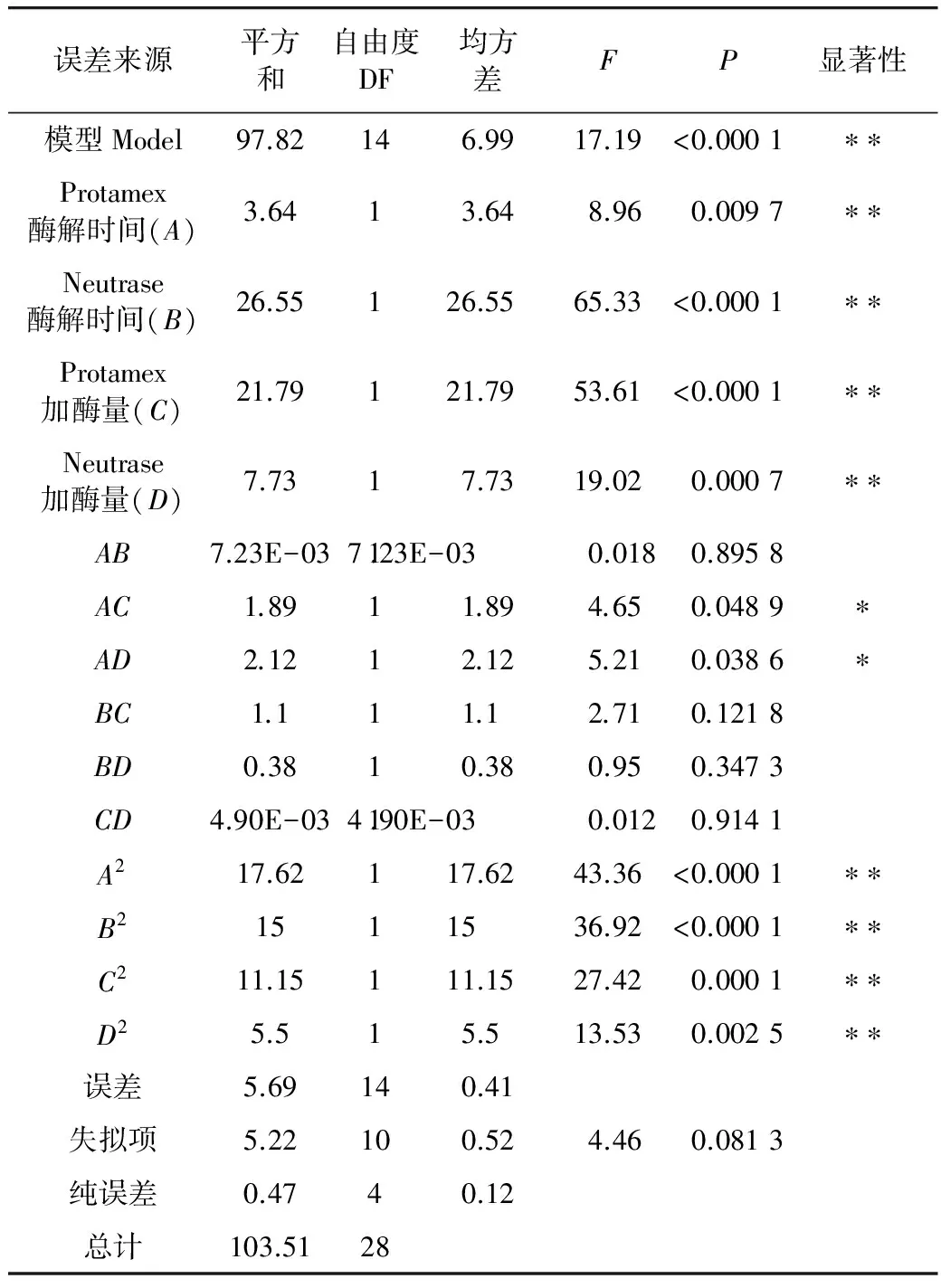
表6 DH方差分析表
注:*表示在α=0.05 水平上显著;**表示在α=0.01 水平上显著。
由上可知,在适当范围内调整酶解时间和加酶量之间的关系,可使酶解反应的短肽得率和水解度达到较理想的水平。最佳条件为加入复合蛋白酶(Protamex),加酶量为665.00 U/g,酶解时间91.50 min后加入中性蛋白酶(Neutrase),加酶量为5 290.00 U/g,酶解时间为121.50 min。通过在TCA-NSI的最佳条件下进行检验,其TCA-NSI为69.88%,其理论值为69.86%,两者相对误差为0.02%,在此条件下反应体系的DH为25.74%。上述结果证明试验优化得到的水解条件是可行的。对比上述最优工艺条件下实际水解度和短肽得率,经综合考虑确定最优工艺为:在Protamex水解谷朊粉91.50 min后加入Neutrase继续酶解121.50 min,Protamex添加量为665.00 U/g底物,Neutrase添加量为5 290.00 U/g底物,水解温度 50 ℃,质量浓度 12%,在此条件下,短肽得率为69.88%,水解度25.74%。
2.4 谷朊粉短肽的分子质量分布
采用HPLC对谷朊粉短肽分子质量分布进行分析,标准分子质量出峰时间分别:细胞色素C(MW 12 500):13.73 min、抑肽酶(MW 6 511):15.73 min、杆菌肽(MW 1 422):17.88 min、乙氨酰胺-乙氨酰胺-精氨酸(MW 451):21.12 min、谷胱甘肽(MW 189):23.81 min。各标样相对分子质量对数与各自的洗脱时间呈很好的相关性,由此可以准确地推断出谷朊粉短肽的分子质量分布。图3是谷朊粉短肽分子质量分布HPLC图谱。谷朊粉在2种酶的作用下水解程度较好,大分子蛋白被水解为分子质量较小的片段,分子质量小于1ku占100%。目前研究报道中蛋白质经水解后所得的短肽以完整的形式被人体吸收而进入血液循环系统[18],对机体的功能具有积极作用,具有更好的营养特性,近年来引起了食品学界的广泛重视[19]。因此在本试验中酶解制备得到的谷朊粉短肽可能具有特殊的生理功能,为谷朊粉短肽的产业化打下了良好的基础。
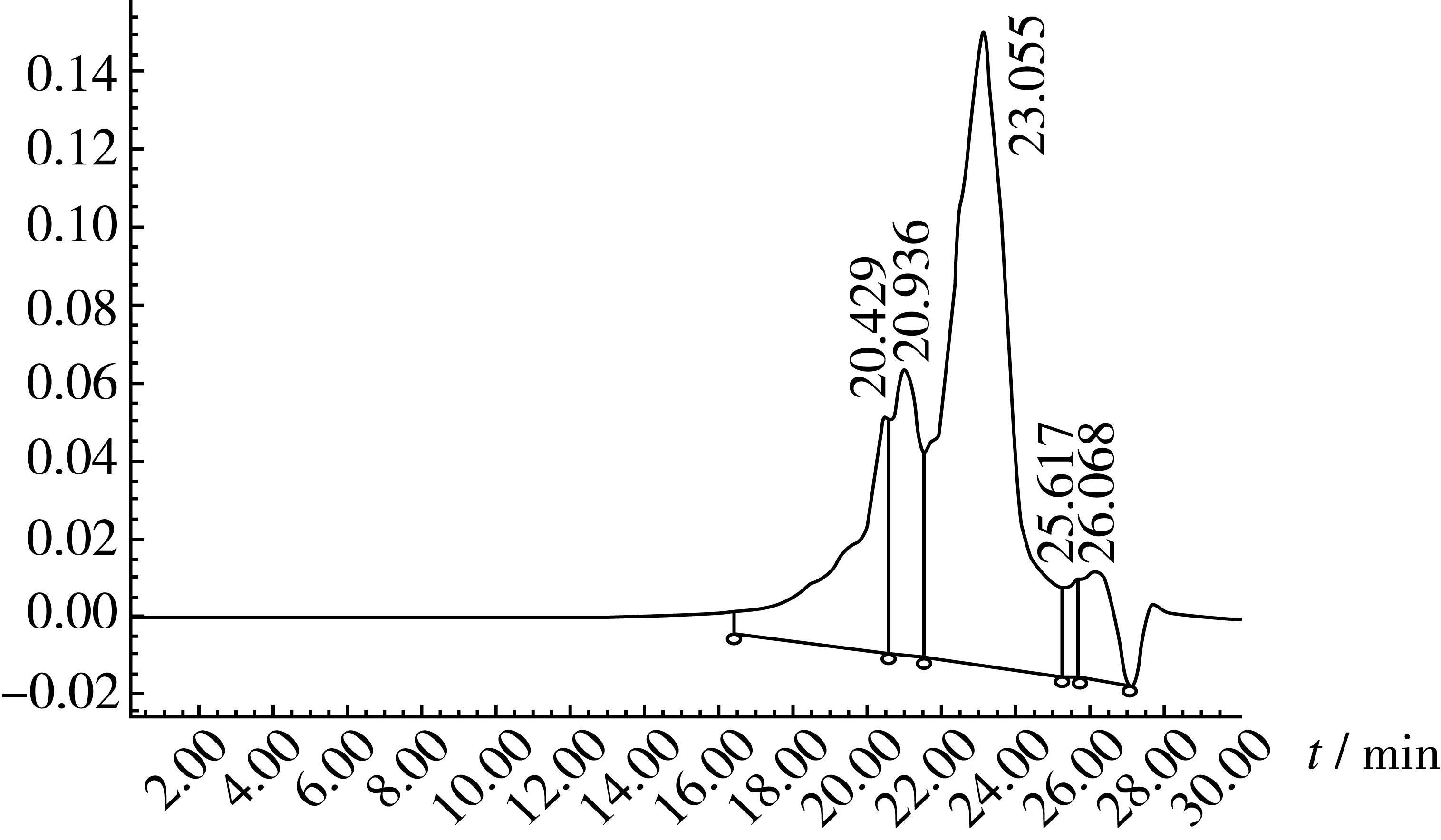
图3 短肽分子质量分布的HPLC图谱
3 结论
通过单因素试验确定双酶酶解谷朊粉的工艺条件为:在Protamex水解谷朊粉 1.50 h 后加入Neutrase继续酶解 2.0 h,Protamex添加量为 648 U/g底物,Neutrase添加量为5 200 U/g底物,水解温度50 ℃,底物浓度 12%;通过考察双酶不同加酶量与酶解时间的影响,采用二次旋转回归Box-Benkeman的方法进行优化,确定双酶分步酶解谷朊粉制备谷朊粉短肽的最佳工艺参数为:在Protamex水解谷朊粉91.50 min后加入Neutrase继续酶解121.50 min,Protamex添加量为 665.00 U/g底物,Neutrase添加量为5 290.00 U/g底物,水解温度 50 ℃,质量浓度 12%,在此条件下,短肽得率为69.88%,水解度25.74%。
[1]王章存,原媛,王许东.谷朊粉酶解条件优化及其抗氧化活性[J].中国粮油学报,2014,29(11):7-13
Wang zhangcun, Yuan yuan, Wang Xudong. Optimization of Enzymatic Hydrolysis of Wheat Gluten and Antioxidant Activities of Its Hydrolysates[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(11):7-13
[2]张强,丁伟,刘有根.从谷朊粉中制备抗氧化肽的研究[J]. 粮油加工, 2010 (5): 80-84
Zhang Qiang, Ding Wei, Liu Yougen. From the study of the preparation of antioxidant peptides of the gluten[J]. Cereals and Oils Processing, 2010 (5): 80-84
[3]Tsou M J, Lin W T, Lu H C, et al. The effect of limited hydrolysis with Neutrase and ultrafiltration on the anti-adipogenic activity of soy protein[J]. Process Biochemistry, 2010, 45(2): 217-222
[4]Moure A, Domínguez H, Parajó J C. Antioxidant properties of ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates[J]. Process Biochemistry, 2006, 41(2): 447-456
[5]黄薇, 宋永康, 余华. 酶法制备玉米抗氧化肽[J]. 中国食品学报, 2014 (8): 69-76
Wang Wei, Song Yongkang, Yu hua. Enzymatic Preparation of Corn Anti-oxidation Peptide[J]. Journal of Chinese Institute of Food Science and Technology, 2014 (8): 69-76
[6]吴爽, 朱科学, 周惠明. 酶解谷朊粉的研究进展[J]. 粮食与食品工业, 2012, 19(2): 39-41
Wu Shuang, Zhu Kexue, Zhou Huiming. Research progress on the hydrolysis of wheat gluten[J]. Cereal & Food Industry, 2012, 19(2): 39-41
[7]Morón B, Cebolla, Manyani H, et al. Sensitive detection of cereal fractions that are toxic to celiac disease patients by using monoclonal antibodies to a main immunogenic wheat peptide[J]. The American journal of clinical nutrition, 2008, 87(2): 405-414
[8]Dørum S, Arntzen M Ø, Qiao S W, et al. The preferred substrates for transglutaminase 2 in a complex wheat gluten digest are peptide fragments harboring celiac disease T-cell epitopes[J]. PLoS One, 2010, 5(11): e14056
[9]李清丽, 王卫国. 双酶复合水解谷朊粉制备小肽的工艺条件研究[J]. 饲料工业, 2007, 28(11): 17-18
Li Qingli, Wang Weiguo. Double enzyme compound preparation of small peptides hydrolyzed wheat gluten process conditions[J]. China Feed Industry, 2007, 28(11): 17-18
[10]刘树兴, 石凯. 超声辅助酶解谷朊粉制备 ACE 抑制肽工艺优化[J]. 陕西科技大学学报: 自然科学版, 2014, 32(6): 110-114
Liu Shuxing, Shi Kai. Wheat gluten of ACE inhibitory peptides preparation technology research[J]. Journal of Shaanxi University of Science & Technology, 2014, 32(6): 110-114
[11]Wang J, Zhao M, Zhao Q, et al. Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J]. Food Chemistry, 2007, 101(4): 1658-1663
[12]Ney K H. Hydrolysis of deliberated proteins[J]. Journal of Food Science, 2002,24(3):87-89
[13]Owueu-ApentenRK. Food Protein Analysis. New York: Marcel Dekker, Inc, 2002
[14]Jang A, Lee M. Purification and identification of angiotens in converting enzyme inhibitory peptides from beef hydroly sates[J]. Meat Science, 2005, 69: 653-661
[15]袁斌, 吕桂善, 刘小玲. 蛋白质水解度的简易测定方法[J]. 广西农业生物科学, 2002, 21(2): 113-115
Yuan Bin, Lu Guishan, Liu Xiaoling. The simple method of determining for the degree of hydrolysis of proteins[J]. Journal of Guangxi Agric. and Biol. Science, 2002, 21(2): 113-115
[16]Kamarudlin M S, Jones D A, Vay L L. Ontogenetic change in digestive enzyme activity during larval development of Macrobrachiumrosenberii. Aquaculture. 1994, 123: 320-324
[17]李宁, 刘红芝, 王强. 中性蛋白酶分步酶解花生分离蛋白制备花生短肽的研究[J]. 中国农业科学, 2013, 46(24): 5237-5247
Li Ning, Liu Hongzhi, Wang Qiang. Preparation of Peanut Oligopeptides from Peanut Protein Isolated by Neutral Proteinase Stepping Hydrolysis[J]. Scientia Agricultura Sinica, 2013, 46(24): 5237-5247
[18]李昊剑, 杨良嵘, 魏雪团. 功能性短肽的分类及其酶解制备方法[J]. 食品工业科技, 2012, 33(17): 373-377
Li Haojian, Yang Liangrong, Weixuetuan. Classification of functional oligopeptides and preparation of enzymatic hydrolysis[J]. Science and Technology of Food Industry, 2012, 33(17): 373-377
[19]张宇昊, 王强. 功能性短肽的研究进展.中国油脂, 2007, 32(2): 69-73
ZhangYuhao, Wang Qiang. Research progress of functional oligopeptides[J]. China Oils and Fats, 2007, 32(2):69-73.
Analysis on Preparation of Wheat gluten Oligopeptides by Double Proteinase Stepping Hydrolysis
Sheng Xiaojing Wang Qiang Liu Li Shi Aimin Hu Hui Yang Ying Liu Hongzhi
(Key Laboratory of Agro-Products Processing, Ministry of Agriculture Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193)
The influence of enzyme kind, substrate concentration, enzymolysis temperature, enzymatic hydrolysis time on DH and TCA-NSI were compared and the best preparation technology was determined by quadratic regression orthogonal rotational combing design. The optimum process parameters for the preparation of wheat gluten oligopeptides from wheat gluten by neutral proteinase stepping hydrolysis was that neutrase hydrolyzed continually for 121.50 min after Protamex hydrolyzed wheat gluten 91.50 min, the volume of addition of Protamex was 665.00 U/g substrate and the volume of addition of neutrase was 5 290.00 U/g substrate, the enzymolysis temperature was 50 ℃, the substrate concentration was 12%. Under these conditions, the TCA-NSI was 69.88%, the DH was 25.74%. Hydrolysis products with the relative molecular mass less than 1 000 Da accounted for 100% by HPLC. Compared with other processes, the preparation of gluten oligopeptides by Protamex and Neutrase stepping hydrolysis had the characteristics of simplifying process, avoiding subsequent desalting, preparation moderate conditions, high TCA-NSI, DH and the molecular weight of peptides being mainly concentrated below 1 000 Da.
wheat gluten, oligopeptides, protamex, neutrase, stepping hydrolysis
TS201.2
A
1003-0174(2017)09-0139-08
公益性行业(农业)科研专项(201303071-04),中国农业科学院科技创新工程(CAAS-ASTIP-201X-IAPPST)
2016-06-12
盛晓静,女,1991年出生,硕士,粮油副产物综合利用
刘红芝,女,1980年出生,研究员,粮油副产物综合利用
