不同粒色青稞酚类化合物含量与抗氧化活性的差异及评价
2017-11-03杨希娟樊明涛
杨希娟 党 斌 徐 菲 樊明涛
(西北农林科技大学食品科学与工程学院1,杨凌 712100)(青海省青藏高原农产品加工重点实验室;青海省农林科学院2,西宁 810016)(省部共建三江源生态与高原农牧业国家重点实验室;青海大学3,西宁 810016)
不同粒色青稞酚类化合物含量与抗氧化活性的差异及评价
杨希娟1,2,3党 斌2,3徐 菲2樊明涛1
(西北农林科技大学食品科学与工程学院1,杨凌 712100)(青海省青藏高原农产品加工重点实验室;青海省农林科学院2,西宁 810016)(省部共建三江源生态与高原农牧业国家重点实验室;青海大学3,西宁 810016)
为了比较不同粒色青稞中游离态及结合态酚类化合物的含量及其抗氧化活性的差异。选用52份不同粒色青稞种质资源, 采用化学法分析其青稞全籽粒中游离态及结合态总酚、总黄酮含量,通过DPPH、 ABTS+·自由基清除能力及FRAP铁离子还原能力评价其体外抗氧化能力差异,利用主成分分析法客观评价其酚类化合物含量及抗氧化活性的品种排名。结果表明:结合酚是有色青稞酚酸的主要存在形式,游离黄酮是青稞中黄酮类物质的主要存在形式,组间含量差异显著,黑色组青稞的总酚类化合物含量较高;不同形态酚类物质对自由基清除能力的强弱具有选择性,游离态酚类化合物含量在一定程度上决定DPPH和ABTS自由基清除能力大小,FRAP铁离子还原能力受青稞中游离态及结合态酚类化合物含量的共同影响;不同粒色组青稞的酚类化合物含量及抗氧化活性存在品种间差异,主成分分析筛选出紫色、蓝色、黑色、黄色组青稞中酚类物质含量及抗氧化活性最高的品种分别为云青2号、循化亮蓝、947和短白青稞。
青稞 粒色 酚类化合物 抗氧化活性 主成分分析
青稞(HordeumvulgareL. var. nudum Hook. f.)是大麦的一种,又称裸大麦,属禾本科大麦属,在植物学上属于栽培大麦的变种,因其籽粒内外稃与颖果分离,籽粒裸露,故称裸大麦[1]。生长在海拔约1400米到4700多米的青藏高原,是我国藏区第一大作物和藏区农牧民赖以生存的主要口粮,是青藏高原最具特色的农作物[2]。近年研究证明青稞含有丰富的β-葡聚糖、膳食纤维及酚类物质而具有开发功能食品的潜力[3],备受人们关注,相关研究已成为功能型青稞育种和开发青稞食品或保健品的重要课题。而现有青稞功能成分的研究主要集中于β-葡聚糖,关于其酚类物质的相关研究较少。
我国青稞品种资源丰富,不同颜色、不同形状的品种多达上千种[4]。有色青稞是一类珍贵的青稞种质资源,主要包括黑青稞、紫青稞、蓝青稞等[5-7]。现有研究表明有色大麦营养保健成分普遍高于普通大麦,因此对于有色大麦作为功能食品的开发越来越受到重视[8]。目前国内外相关学者已证实大麦中酚类物质种类、含量及活性受到籽粒颜色和基因型的影响[9-11]。但前人的文献报道均是以皮大麦群体为研究对象,涉及的裸大麦品种较少,且籽粒颜色比较单一,难以揭示不同粒色裸大麦及品种的差异性,更鲜见以青藏高原种植的不同粒色青稞酚类物质含量及抗氧化活性相关报道。另外谷物中的酚类物质主要有游离态及结合态,但是现有的研究往往只注重游离态多酚含量及活性,忽略了结合态多酚致使测定结果低估。因此有必要从不同粒色及品种差异性的角度,全面比较和评价青稞中酚类物质含量、种类及抗氧化活性的影响。
本研究收集和选择了不同粒色青稞种质资源52 份, 比较不同粒色青稞游离态和结合态酚类物质含量及其抗氧化活性差异,分析它们之间的相关关系,综合评价和筛选出酚类物质含量较高且抗氧化活性强的优异青稞种质资源,为有色青稞的育种和开发利用提供参考。
1 材料与方法
1.1 试验材料
青稞:由青海省农林科学院作物育种栽培研究所青稞研究室提供(表1),所有材料于2014年3~8月在青海省农林科学院试验田(西宁)种植。样品收获后脱粒,室温晾干,去除颗粒石子。用万能粉碎机将青稞种子粉碎,时间约30 s,过60目筛得青稞全粉。
DPPH、TPTZ、Trolox(水溶性维生素E)、ABTS:Sigma公司,没食子酸、芦丁标准品(纯度≥98.0):上海源叶生物科技有限公司;福林酚(优级纯):北京索莱宝科技有限公司。

表1 52个青稞品种
1.2 主要仪器设备
TGL-20M高速台式冷冻离心机:湖南长沙湘仪离心机仪器有限公司; Retavapor R-215旋转蒸发仪:瑞士布奇有限公司; N4S紫外可见分光光度计:上海仪电分析仪器有限公司; 雷磁PHS-3C型pH计:上海雷磁仪器厂;FW-100高速万能粉碎机:天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 青稞游离态酚类化合物提取
参考Zhao等[12]的方法并稍作改进。准确称量1.0g青稞全粉,按照料液比1∶25的比例分别加入体积分数80%丙酮,室温条件下超声提取20 min,4 000 r/min冷冻离心10min,收集上清液,残渣用同样方法重复提取2次,合并3次上清液,45℃减压旋转蒸干,甲醇定容至10 mL,得游离态酚类物质提取液,分装后于-20℃避光储存,称样和提取均重复3 次。
1.3.2 青稞结合态酚类化合物提取
参考苏东晓[13]的方法,向提取游离酚后的残渣中加入20 mL正己烷,振荡后离心(3 000 r/min,5 min)弃去上清液,向沉淀物中加入17 mL体积分数为11.00%的硫酸,75 ℃水浴1 h,加入20 mL乙酸乙酯萃取5次,离心(3 000 r/min,5 min),合并乙酸乙酯萃取相,在45 ℃条件下旋转蒸发至干,残余物用甲醇定容至10 mL,0.45 μm有机膜过滤,得青稞结合酚提取液,分装后于-20 ℃避光保存。
1.3.3 青稞提取物中酚含量的测定
测定采用Folin-Ciocalteu测定法。参考Adom等[14]方法并稍作改进。吸取样品提取液125 μL于试管中,再加入500 μL蒸馏水和125 μL福林酚,摇匀,反应6min后加入1.25mL 7% Na2CO3溶液,再加入1mL蒸馏水,室温下避光放置1.5 h后,以甲醇代替样品提取液为空白调零,在波长765 nm下测定吸光度,重复3次。以没食子酸浓度为横坐标,A765值为纵坐标绘制标准曲线,回归方程为Y=0.004 2X+0.012 4(0~300 μg /mL,R2=0.999 6)。总酚含量以每100 g提取物( 干基) 中所含相当于没食子酸的质量mg表示,计算公式为:
酚含量(mg /100g DW)= [(Y×V)/(1 000×m)]× 100
式中:Y为测定的总酚质量浓度 /μg /mL;V为提取液的总体积/mL;m为样品除去水分的质量/g。
1.3.4 青稞提取物中黄酮含量的测定
参考Adom等[14]方法并稍作改进,吸取100 μL样品提取液于试管中,加入试剂5% NaNO2溶液200 μL,摇匀,6 min后加入试剂10% AL(NO3)3溶液200 μL,摇匀,6 min后再加入4% NaOH溶液2 mL,室温避光放置15 min后,以甲醇代替样品提取液为空白调零,在波长510nm下测定吸光度,重复3次。绘制吸光度与芦丁浓度的标准曲线,回归方程为Y=0.005 5X-0.004 7(0~80 μg/mL,R2=0.994 7)
式中:Y为吸光值,X为芦丁质量浓度/μg/mL。
总黄酮含量以每100g提取物(干基)中所含相当于芦丁的质量mg表示,计算公式为:
黄酮含量(mg /100g DW)= [(Y×V)/(1 000×m)]× 100
式中:Y为测定的黄酮质量浓度/g·mL-1;V为提取液的总体积/mL;m为样品除去水分的质量/g。
1.3.5 清除DPPH抗氧化能力测定
参考Abu 等[15]的方法并稍作改进。吸取样品提取液1 mL于试管中,再加入4.5 mL 0.1 mmol/L DPPH甲醇溶液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长517 nm下测吸光度,重复3次。以Trolox浓度为横坐标,A517值为纵坐标绘制标准曲线,回归方程为Y=-0.004 2X+0.916 3(0~140 μmol/L,R2=0.992 8)。根据标准曲线计算DPPH·自由基清除能力,以每100 g提取物(干基)中所含相当于水溶性维生素E的量(μmol Trolox Eq/100g DW)表示。
计算公式为:DPPH·自由基清除能力(μmol Trolox Eq /100g DW)=[(Y×V)/(1 000×m)]×100。
式中:Y为测定的DPPH·自由基清除能力(μmol/L);V为提取液的总体积(mL);m为样品干质量/g。
1.3.6 FRAP 抗氧化能力测定
参考Benzie等[16]的方法并略加修改。FRAP工作液的配制为:300 mmol/L pH 3.6的醋酸钠缓冲液(3.076 2 g C2H3NaO2·加20 mL C2H4O2,用蒸馏水定容至 250 mL)、10 mmol/L TPTZ溶液(0.1562 g TPTZ 用40 mmol·L-1盐酸定容至100 m L)和 20 mmol·L-1FeCl3溶液,按照体积比为 10∶1∶1 的比例混合,于37 ℃水浴锅中预热备用。
测定方法:吸取样品提取液50 μL于试管中,再加入4.5 mL FRAP工作液,充分摇匀后避光反应30min,以甲醇代替样品提取液为空白调零,在波长593 nm下测定吸光度,重复3次。以Trolox作为标准品绘制标准曲线,得回归方程:Y=0.007 2X-0.001 2(0~300 μmol/L,R2=0.999 2),其中Y为吸光值,X为Trolox浓度(μmol /L)。根据标准曲线计算出样品提取液铁还原能力,以μmol Trolox Eq/100g DW表示。计算公式为:FRAP铁还原能力(μmol Trolox Eq /100g DW)=[(Y×V)/(1 000×m)]×100
式中:Y为测定的FRAP铁还原能力/μmol/L;V为提取液的总体积/mL;m为样品干质量/g。
1.3.7 清除 ABTS+·自由基能力测定
参考Re 等[17]方法并稍改进。将5 mL 7 mmol/L ABTS+·溶液和88 μL 140 mmol/L过硫酸钾溶液混合,室温避光条件下静置12~16 h,得ABTS+·储备液。将此储备液按适当比例[1∶100(v/v)]与无水甲醇混合,要求其在734 nm下的吸光值达到0.7±0.02,得到ABTS+·工作液,备用。
测定方法:吸取样品提取液200 μL于试管中,再加入4 mL ABTS+·工作液,充分摇匀后避光反应30 min,以甲醇代替样品提取液为空白调零,在波长734 nm下测定吸光度,重复3次。以Trolox浓度为横坐标,波长734nm下测定的吸光度为纵坐标绘制标准曲线,回归方程为Y=-0.001X+0.624 2(0~300 μmol/L,R2=0.990 7)。根据标准曲线计算出样品提取液清除ABTS+·自由基能力,以μmolTE/100 g DW表示。
计算公式为:ABTS+·自由基清除能力(μmol Trolox Eq /100g DW)=[(Y×V)/(1 000×m)]×100。
1.3.8 数理统计
利用Excel和SPSS 21.0 软件进行数据统计分析及作图,数据以均值±标准差(Means±SD)表示,青稞多酚含量比较采用单因素方差分析,不同品种间比较采用 LSD 法,显著性水平为 0.05。主成分分析采用SPSS 21.0数据处理软件。
2 结果分析与讨论
2.1 不同粒色青稞酚类化合物含量差异分析
由表2可知,不同粒色青稞中酚酸含量是黄酮含量的10倍,说明酚酸是青稞中的主要酚类物质。除黄色组外,紫色、黑色组青稞结合酚平均含量分别为221.91、241.62 mg/100 g DW,显著高于其对应游离酚含量,蓝色组青稞结合酚(207.59 mg/100 g DW)高于游离酚(207.11 mg/100 g DW)含量,但差异不显著。结合酚是有色青稞多酚的主要存在形式,与前人研究结果类似[18-21]。4种粒色青稞中游离酚平均含量的顺序依次为黑色>黄色>紫色>蓝色,结合酚的顺序依次为黑色>紫色>蓝色>黄色,黑色组青稞的游离酚与结合酚平均含量在组间最高,分别为(225.34±25.97)、(241.62±23.45) mg/100 g DW,其中黑色[(225.34±25.97)mg/100 g DW]与黄色[(223.61±34.17 mg/100 g DW]游离酚平均含量差异不显著,但显著高于紫色、蓝色组青稞,不同粒色青稞的结合酚平均含量差异显著,组内变异均较小。
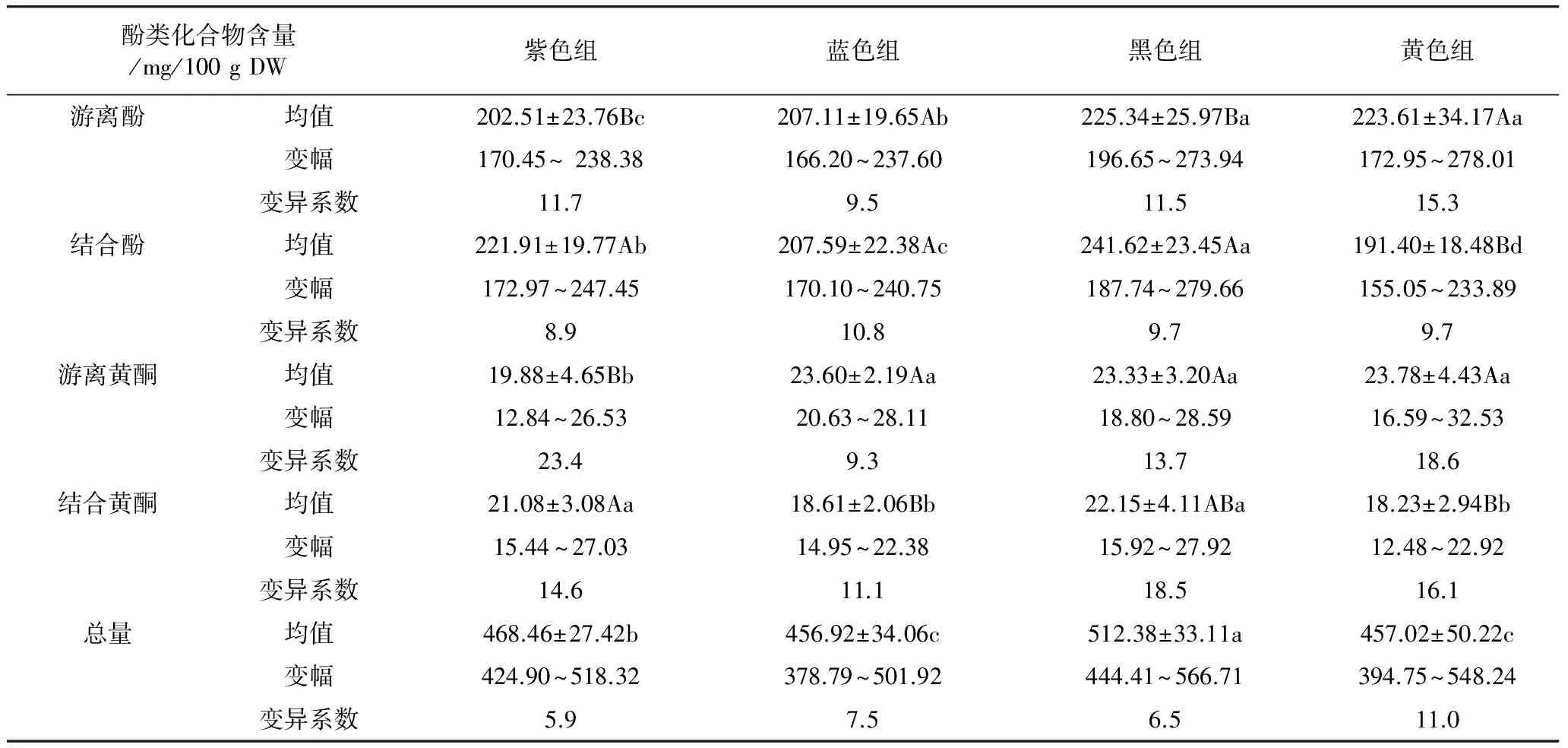
表2 不同粒色青稞酚类含量分析
注:表中数据为 3 次重复的平均值,小写字母表示不同组间差异显著(P<0. 05) ,大写字母表示同一组间游离态与结合态物质的显著差异(P<0.05)。
4种粒色组青稞中除紫色组青稞的结合黄酮含量显著高于游离黄酮含量,蓝色、黑色、黄色组青稞游离黄酮含量分别为(23.60±2.19)、(23.33±3.20)、(23.78±4.43) mg/100 g DW,显著高于其对应的游离黄酮含量,表明青稞中黄酮类物质主要以游离态形式存在。游离黄酮平均含量的顺序依次为黄色>蓝色>黑色>紫色,紫色组青稞[(19.88±4.65) mg/100 g DW]的游离黄酮平均含量显著低于其他粒色组青稞,蓝色[(23.60±2.19) mg/100 g DW]、黑色(23.33±3.20 mg/100 g DW)、黄色组[(23.78±4.43) mg/100 g DW]青稞游离黄酮平均含量组间无显著差异,不同粒色结合黄酮平均含量的高低排序与结合酚一致,黑色显著高于蓝色与黄色组,与紫色组青稞含量无显著差异,组间变异较大。
不同粒色组间总酚类化合物含量的高低顺序依次为黑色>紫色>黄色>蓝色,其中黄色与蓝色组间差异不显著,黑色显著高于其他粒色组,不同粒色青稞组内变异较小。结果表明籽粒颜色对青稞中酚类化合物的含量及种类影响较大,黑色青稞中含有更为丰富的酚类化合物。这与Kim和Abdel等[9,11]人研究证实的黑色、蓝色、黄色大麦的游离酚、结合酚含量有显著差异,籽粒颜色和基因型是导致多酚含量差异的主要因素的结果比较一致。因此将青稞作为功能性食品加工原料时要综合考虑其籽粒颜色和青稞品种的相互影响。
2.2 不同粒色青稞提取物抗氧化活性分析
由图1可见,在3种抗氧化体系中,不同粒色组青稞酚类提取物均具有清除 DPPH·和 ABTS+·的能力及较强的FRAP铁离子还原能力。4种颜色组青稞游离态提取物的ABTS+·清除能力及FRAP铁离子还原能力远远强于结合态提取物,但结合态提取物的DPPH·清除能力显著高于游离态提取物,这是由于大麦中游离态和结合态酚类化合物中单体多酚的组成及含量不同,而不同单体酚对不同自由基的清除具有选择性而造成活性的差异[11,22]。此外青稞不同颜色组间在DPPH·和 ABTS+·清除能力及FRAP铁离子还原能力方面均有显著的差异(P<0.05),本研究中黑色组青稞的游离态及结合态酚类物质清除 DPPH·和 ABTS+·的能力及FRAP还原能力均较强,其含量也高于其他颜色组。这种差异可能与不同颜色青稞中不同形态的酚类物质组成及含量有关[22]。


注:图中不同小写字母表示不同组间差异显著( P<0.05)。图1 不同粒色青稞抗氧化能力分析
2.3青稞酚类化合物含量与抗氧化活性的相关分析
为进一步明确青稞中不同形态酚类物质含量和其抗氧化活性的关系,进行相关性分析,结果见表3。游离酚、结合酚分别与游离黄酮、结合黄酮含量呈极显著正相关,说明青稞的多酚含量越高,其所含黄酮含量就越高。游离酚、游离黄酮与本研究中3个抗氧化活性呈极显著或显著正相关,结合酚、结合黄酮只与FRAP铁离子还原能力极显著或显著正相关,与DPPH及ABTS+·自由基清除力不显著相关。说明游离态酚类化合物含量在一定程度上决定着DPPH和ABTS+·自由基清除能力大小,在图1a中发现结合态提取物清除DPPH自由基的能力显著高于游离态提取物,这种结果与游离态及结合态提取物中酚酸及黄酮的组成及含量差异所导致[22],说明青稞结合态提取物中含有较强清除DPPH自由基的多酚种类。FRAP铁离子还原能力受到青稞中游离态及结合态酚类化合物含量的共同影响。

表3 青稞酚类物质含量与抗氧化的相关性分析
2.4不同粒色青稞酚类化合物功能品质的综合评价
2.4.1 主成分分析
主成分分析是将多指标简化为少量综合指标的一种统计分析方法,用少数变量尽可能多的反映原来变量的信息,保证原信息损失小且变量数目尽可能少,且得到的综合指标(主成分)之间彼此独立,减少信息的交叉,使得分析评价结果具有客观性和准确性[23]。通过主成分分析得到的方差贡献分析表和经过方差极大正交旋转后的主成分荷载矩阵,分别如表4、表5所示。由表4可知,前3个主成分累计贡献率为80.716%,基本反映了原指标的信息。由初始的7项评价指标降为3个彼此不相关的主成分,达到了降维的目的。 因此提取前用3个主成分代替原7个指标评价不同粒色青稞的功能活性。
由表5可知,第一主成分P1主要综合了结合酚、结合黄酮的信息,称为结合型多酚因子,P2主要综合了游离酚和游离黄酮的信息,称为游离型多酚因子。P3主要综合了DPPH、ABTS、FRAP的信息, 称为抗氧化功能因子。
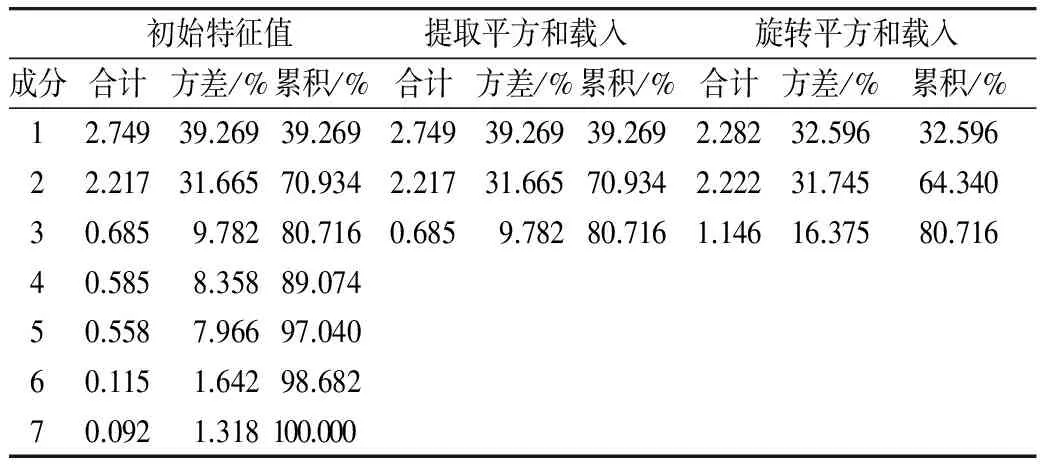
表4 方差贡献分析表

表5 主成分分析旋转后的成分载荷矩阵
注: 旋转法:具有 Kaiser 标准化的正交旋转法。a.旋转在6次迭代后收敛。
2.4.2 不同粒色青稞的综合评价
通过主成分荷载矩阵(表5), 得到以每个载荷量来表示主成分与对应变量的相关关系,可以构建前 3 个主成分分值( P) 与青稞功能指标( X) 的线性方程式:P1=-0.020X1-0.058X2+0.913X3+0.836X4+0.311X5+0.795X6+0.128X7;P2=0.971X1+0.832X2+0.007X3-0.025X4-0.048X5+0.057X6+0.762X7;P3=-0.035X1-0.238X2+0.256X3+0.010X4+0.871X5+0.356X6+0.371X7;利用公式P=32.596P1+31.745P2+16.375P3计算出 52种青稞功能活性的主成分得分,即各品种青稞功能活性的综合得分,按主成分大小依次排序,可权衡每个性状在每个品种中所处的位置与分量(表6),能较直观地判断某一品种的优劣。
由表6可以看出,52个不同粒色的青稞品种中,Z536的结合型多酚因子得分最高,昆仑14号最低,短白青稞的游离型多酚因子得分最高,14-Z505的得分最低,13YN-5的抗氧化功能因子得分因子最高,北青6号的得分最低。按照主成分综合得分的排列顺序,947、Z530、Z536、949、950、短白青稞、Z528、云青2号、长黑青稞、Z533分别居综合主成分得分的前10名,其中黑色组青稞品种占60%,说明黑色组青稞的多酚含量及抗氧化活性普遍较高,因此可将黑色籽粒青稞品种的选育作为开发富含多酚的抗氧化功能食品的主要原料;康青6号、门农1号、Z560、北青6号、柴青1号、阿青5号、昆仑14号、藏青25、肚里黄、阿青6号分别居综合主成分得分的最后 10名,其中黄色组青稞占80%,说明黄色组青稞的多酚含量及抗氧化活性相对其他颜色较低,一般不宜作为富含多酚的功能性青稞品种选育的材料和加工原料。
不同粒色青稞的综合主成分得分排序在组间差异很大,说明青稞品种的遗传性对多酚含量及抗氧化活性的影响较大,因此在富含多酚的青稞优异种质资源的挖掘及利用过程中应充分考虑品种的因素。本试验中紫色、蓝色、黑色、黄色组青稞的综合主成分得分最高的分别为云青2号、循化亮蓝、947和短白青稞,均可作为富含多酚的不同粒色青稞品种选育的优异种质或抗氧化功能产品生产的原料。

表6 青稞功能品质主成分得分及排名

续表6
3 结论
3.1 不同粒色青稞中酚类化合物主要以酚酸形式存在,其中结合酚是有色青稞酚酸的主要存在形式,游离黄酮是青稞中黄酮类物质的主要存在形式。不同粒色青稞的酚类化合物含量受籽粒颜色的影响较大,黑色青稞具有较高的酚类化合物含量,可作为潜在的生产青稞功能产品的原料。
3.2 青稞抗氧化活性与酚类物质含量呈正相关,不同形态酚类物质对自由基清除能力的强弱具有选择性。游离态酚类化合物含量在一定程度上决定着DPPH和ABTS自由基清除能力大小,FRAP铁离子还原能力受青稞中游离态及结合态酚类化合物含量的共同影响。
3.3 不同粒色组青稞的酚类化合物含量及抗氧化活性存在品种间的差异,受品种遗传性的影响。主成分分析筛选出紫色、蓝色、黑色、黄色组青稞的酚类物质含量及抗氧化活性最高的品种分别为云青2号、循化亮蓝、947和短白青稞,可为青稞抗氧化品质育种及功能性产品开发提供材料。
[1]徐廷文.中国栽培大麦的分类和变种鉴定[J].中国农业科学, 1982(6): 39-46
Xu T W. Classification and identification of varieties of chinese cultivated barley[J]. Scientia Agricultura Sinica,1982(6): 39-46
[2]吴昆仑.青稞功能元素与食品加工利用简述[J].作物杂志,2008(2) :15-17
Wu K L. Brief introduction of functional element sand food machining processing of hulless barley[J]. Crops,2008(2):15-17
[3]Gray D,Abdel-Aal E S.M,Seetharaman K, et al.Difference in carbohydrate and digestion in vitro of selected barley cultivars as influenced by pearling and cooking.Cereal Chemistry,2009,86:669-678
[4]强小林, 迟德钊,冯继林.青藏高原区域青稞生产与发展现状[J].西藏科技, 2008(3): 11-17
Qiang X L, Chi D Z, Feng J L. Production and development of hulless barley in Tibetan plateau[J]. Tibet science and technology, 2008(3): 11-17
[5]华为,朱靖环,尚毅,等.有色大麦研究进展[J].植物遗传资源学报, 2013,14(6):1020-1024
Hua W,Zhu J H,Shang Y,et al.Research advances in colored barley[J]. Journal of Plant Genetic Resources, 2013,14(6):1020-1024
[6]Bothmer R V,Sato K,Komatsuda T,et al. Diversity in Barley (Hordeum vulgare):The domestication of culticated barley[M].Amsterdam,Netherlands:Elsevier Science B.V.,2003
[7]Sparks G A,Malcolm J P. Barley identification by grain characters in New Zealand[J]. New Zealand Journal of Crop and Horticulture Science,1978,6:1-10
[8]Zhang M W, Zhang R F, Zhang F X, et al.Phenolic Profiles and Antioxidant Activity of Black Rice Bran of Different Commercially Available Varieties[J].Journalof Agricultural and Food Chemistry,2010,58(13):7580-7587
[9]Kim, M. J., Hyun, J N., Kim, J A , et al. Relationship between phenolic compounds, anthocyanins content and antioxidant activity in colored barley germplasm[J]. Journal of Agricultural and Food Chemistry, 2007,55(12):4802-4809
[10]Bellido, G. G., Beta, T., et al. Anthocyanin composition and oxygen radical scavenging capacity (ORAC) of milled and pearled purple, black, and common barley. Journal of Agricultural and Food Chemistry, 2009,57(3):1022-1028
[11]Abdel-Aal, E M, ChooT M, DhillonS,et al.Free and bound phenolic acids and total phenolics in black, blue, and yellow barley and their contribution to free radical scavenging capacity[J]. Cereal Chemistry, 2012, 89( 4):198-204
[12]Zhao H F, Dong J J, Lu J,et al.Effects of Extraction Solvent Mixtures on Antioxidant Activity Evaluation and Their Extraction Capacity and Selectivity for Free Phenolic Compounds in Barley (Hordeum vulgare L.) [J]. Journal of Agricultural and Food Chemistry, 2006, 54, 7277-7286
[13]苏东晓.荔枝果肉的分离鉴定既起到调节脂质代谢作用机制[D].武汉:华中农业大学,2014
Su D X.Preparation and structure identification of litchi pulp polyphenols and research on the mechanism of their hypolipidemic effect[D]. Wuhan: Huazhong Agricutural University,2014
[14]Adom K K, Sorrells M E,Liu R H. Phytochemical profiles and antioxidant activity of wheat varieties.Journal of Agricultural and Food Chemistry, 2003, 51(26):7825-7834
[15]Abu Bakar M F, Mohamed M, Rahmat A, Fry J. Phytochemicals and antioxidant activity of different parts of bambangan (Mangifera pajang) and tarap (Artocarpus odoratissimus). FoodChemistry, 2009,113: 479-483
[16]Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “Antioxidant Power”: The FRAP Assay. Analytical Biochemistry, 1996, 239: 70-76
[17]Re R, Pellegrini N, Proteggente A,et al.Antioxidant activity applyingan improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, 1999, 26(9):1231-1237
[18]李青,张名位,张瑞芬,等. 5种籼稻品种谷壳中游离态和结合态酚类物质含量及抗氧化活性比较[J].中国农业科学,2012,45 (6):1150-1158
Li Q, Zhang M L, Zhang R F,et al.Free and bound phenolic contents and antioxidant activity of five varieties of indica rice husk[J]. Scientia Agricultura Sinica, 2012,45 (6):1150-1158
[19]Adom K K, Liu R H. Antioxidant activity of grains. Journal of Agricultural and Food Chemistry,2002,50: 6182-6187
[20]Dykes L, Rooney L W. Phenolic compounds in cereal grains and their health benefits[J]. Cereal Foods World, 2007, 52(3): 105-111
[21]Vaher M, Matso K, Levandi T, et al. Phenolic compounds and the antioxidant activity of the bran, flour and whole grain of different wheat varieties[J]. Procedia Chemistry, 2010, 2(1): 76-82
[22]Zhao H, Dong J, Lu J, Chen J, Li Y, Shan L, Lin Y,Fan W, Gu G. Effects of Extraction Solvent Mixtures on Antioxidant Activity Evaluation and Their Extraction Capacity and Selectivity for Free Phenolic Compounds in Barley (Hordeum vulgare L.) .Journal of Agricultural and Food Chemistry ,2006, 54, 7277-7286
[23]卢纹岱.SPSS统计分析(第4版)[M]. 北京:电子工业出版社,2010:472-473
Difference and Evaluation of Phenolics Contents and Antioxidant Activity of Colored Hulless Barley
Yang Xijuan1,2,3Dang Bin3Xu Fei2Fan Mingtao1
(College of Food Science and Engineering, Northwest A&F University1, Yangling 712100)(Qinghai Tibetan Plateau key Laboratory of Agric-Product Processing, Qinghai Academy of Agriculture and Forestr2, Xining 810016)(State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University3, Xining 810016)
The contents of free and bound phenolics and antioxidant activity of colored varieties of hulless barley were compared. The contents of free and bound phenolics and flavonoids of hulless barley of 52 different varieties were determined. The antioxidant activity was analyzed using DPPH, ABTS+·radical cation scavenging activity assays and the ferric reducing ability of plasma (FRAP). The contents of phenolics compound and antioxidant activity were evaluated objectively by principal component analysis, obtaining the overall scores and rankings of varieties. The results showed that combined phenol was the major form of coloured hulless barley; free flavone was the mian form of flavonoid in the hulless barley; contents was significantly difference between groups; and black hulless barley groups have high content of phenolic compounds. Different form phenolics have selectivity to radical scavenging ability; DPPH and ABTS+·radical scavenging rate were influenced by content of free phenolics, and the ferric reducing ability of plasma was combined impact by content of free and bound phenolics. Significant differences of colored varieties were observed in contents of phenolics and antioxidant activity. The results of comprehensive scores from hulless barley of purple, blue, black and yellow groups were Yunqing 2, Xunhualianglan, 947 and Duanbai hulless barley.
hulless barley, grain color, phenolics compound, antioxidant activity, principal components analysis
TQ210
A
1003-0174(2017)09-0034-09
青海省科技厅应用基础项目(2016-ZJ-711),国家重点实验室开放课题(2014-04),青海省“135”高层次人才培养计划(201612)
2016-06-04
杨希娟,女,1980年出生,副研究员,食品功能化学与营养
樊明涛,男,1963年出生,教授,食品功能化学与营养
