[BM im][HSO4]/H2SO4二元体系的黏度及其表面张力
2017-11-01唐盛伟
胡 静,张 涛,张 帅,周 飞,张 圆,唐盛伟
(四川大学 化学工程学院,四川 成都 610065)
[BM im][HSO4]/H2SO4二元体系的黏度及其表面张力
胡 静,张 涛,张 帅,周 飞,张 圆,唐盛伟
(四川大学 化学工程学院,四川 成都 610065)
测定了1-丁基-3-甲基咪唑硫酸氢盐([BM im][HSO4])/H2SO4二元体系在293.2~313.2 K的黏度和表面张力。采用Jouyban-Acree(JAM)模型与Li-Wang (LWW)模型拟合了该体系的黏度与表面张力,并利用Redlich-Kister(R-K)方程和Myers-Scott(MS)公式拟合了体系的超额黏度与超额表面张力。实验结果表明,[BM im][HSO4]/H2SO4二元体系的黏度随温度的升高而下降;随[BM im][HSO4]的摩尔含量(xIL)的增加而增大;体系的超额黏度为负值,当xIL≈0.75时,超额黏度最低。二元体系的表面张力随温度的升高而略有降低,随xIL的增加而降低;超额表面张力均不大于0,xIL≈0.1时,超额表面张力最小。JAM模型和LWW模型可用于拟合二元体系的黏度与表面张力,平均相对误差低于8.74%和0.16%。R-K方程和MS公式可用于拟合二元体系的超额黏度与超额表面张力,拟合回归相关系数R2不低于0.99和0.97。
离子液体;硫酸;黏度;表面张力
近年来,离子液体作为一种新型绿色溶剂被广泛应用于催化[1]、分离[2]、合成[3]等领域。研究发现,利用离子液体独特的物性将其与相关介质耦合可以进行特殊应用,将少量离子液体与传统无机酸耦合形成的复合催化剂具有良好的协同催化效应[4]。Wasserscheid 等[5]将 2.2%(x)咪唑离子液体与H2SO4耦合,改善了苯与1-癸烯Friedel-Crafts烷基化反应的催化效果。Tang等[6]采用少量咪唑离子液体与传统无机酸耦合催化C4基化反应,产物选择性获得了提高。Cui等[7-9]研究发现,离子液体与传统无机酸耦合可以提高目标产物的收率,同时延长了催化剂的使用寿命。
根据复合催化剂的特点,离子液体的加入有利于改善催化剂相的流动特性、分散特性以及与反应相的混合特性和传质特性。但目前仍缺乏具体的研究工作提供相应的基础数据。本课题组研究了异丁烷在离子液体中的溶解度[10]。实验结果表明,在特定的离子液体中异丁烷的溶解度高于它在硫酸中的溶解度,利于烃酸两相的反应。不同离子液体/无机酸复合体系的酸强度[11-12]和密度[13]的测定结果表明,离子液体的加入不仅可有效调节酸强度,优化酸催化体系酸度,还可降低酸催化剂密度,从而减小烃酸两相的密度差,有利于改善烃酸两相的混合特性。本课题组还成功地将酸性离子液体负载到固体酸上以改善对反应物的吸附比例,实现了反应区域反应物配比的调节[14-16]。黏度是描述流体黏滞性的基本物性参数,对流体的流动特性、传热特性等有着重要的影响。表面张力是作用于液体表面单位长度上使表面收缩的力,是影响液液两相分散特性、界面特性等相关性质的重要物性参数。黏度和表面张力均是进行工艺设计和生产操作的重要参数。
本工作在常压下测定了293.2~313.2 K范围内1-丁基-3-甲基咪唑硫酸氢盐([BM im][HSO4])/H2SO4二元体系的黏度和表面张力,分别采用Jouyban-Acree(JAM)模型与Li-Wang(LWW)模型拟合了二元体系的黏度与表面张力,并利用Redlich-Kister(R-K) 方 程 和Myers-Scott(MS)公式拟合了体系的超额黏度与超额表面张力。
1 实验部分
1.1 主要试剂
硫酸(纯度95%~98%(w))、片状氢氧化钠(纯度99%(w))、邻苯二甲酸氢钾(纯度99.8%(w)):成都科龙试剂公司;发烟硫酸:20%(w),AR,上海振泓化工有限公司;[BM im][HSO4]:纯度98%(w),中国科学院兰州化学物理研究所。
1.2 混合体系的制备
100%(w)硫酸由95%~98%(w)硫酸与20%(w)发烟硫酸按文献[11]报道的方法混合而得,其浓度由0.5 mol/L标准NaOH溶液进行滴定,滴定3次,取平均值。配置而成的100%(w)硫酸实际质量分数在99.6%~100.4%之间。离子液体在使用前先进行真空干燥预处理。在80 ℃的真空条件下(约10-2Pa)干燥24 h,去除易挥发性组分。用卡尔费休仪(ZSD-2型,上海市安亭电子仪器厂)测定含水量,测得[BM im][HSO4]的含水量约为0.23%(w)。
[BM im][HSO4]/H2SO4通过充分混合制备,分别精确称量[BM im][HSO4]和H2SO4,然后充分混合,密封真空保存。因[BM im][HSO4]/H2SO4二元混合体系有较强的吸水性,故实验所处环境均保持干燥,实验前后分别用卡尔费休仪测定含水量。测试[BM im][HSO4]/H2SO4二元体系浓度时,分别测定3个新鲜试样的值,取平均值。
1.3 黏度和表面张力的测定
[BM im][HSO4]/H2SO4二元体系黏度的测定采用全自动落球式微量黏度计(Anton Paar Lovis 2000M型,奥地利安东帕(中国)有限公司),黏度测量的不确定度为5×10-5mPa·s,控温精度为0.1 K。利用表面张力仪(JK99C型,上海中晨数字技术设备有限公司)采用白金板法测定体系的表面张力。
测定去离子水的黏度与表面张力,并与文献值对比,以验证测量方法的可靠性与精密度,结果见表1。

表1 水的黏度和表面张力的实验值与文献值Table 1 The experimental and literature data of viscosity(η) and surface tensions(γ) of water
从表1可知,水的黏度测定值与文献值的相对偏差低于0.16%,表面张力测定值与文献值的相对偏差低于 0.21%。对于[BM im][HSO4]/H2SO4二元体系,黏度多次平均测量结果的偏差低于±5×10-2mPa·s;表面张力多次平均测量结果的偏差低于±0.30 mN/m。说明本工作所用仪器与测量方法具有较高的可重复性和准确性。
2 结果与讨论
2.1 [BM im][HSO4]/H2SO4二元体系的黏度
[BM im][HSO4]/H2SO4二元体系的黏度见图1。由图1可知,[BM im][HSO4]比H2SO4的黏度高1~2个数量级,[BM im][HSO4]/H2SO4二元体系的黏度随温度的升高而单调降低。当温度由293.2 K升至313.2 K时,[BMim][HSO4]的黏度由2 087.00 mPa·s降至519.20 mPa·s,降幅为75.12%;H2SO4的黏度由31.81 mPa·s降至16.68 mPa·s,降幅为47.57%。离子液体[BM im][HSO4]与H2SO4的黏度相差较大。当温度为293.2 K时,[BM im][HSO4]的黏度是H2SO4的65倍左右,因此,离子液体的加入对体系黏度有很大的影响。随[BM im][HSO4]的摩尔分数(xIL)的不断增大,[BM im][HSO4]/H2SO4二元体系的黏度不断增加,特别是xIL在0.6~1.0范围内时,黏度增加非常迅速;而在xIL=0~0.2区域,黏度变化较小,在相同温度下,当xIL从0增至0.2时,体系黏度的最大增幅度仅为8.66%。实验结果表明,在H2SO4中添加少量离子液体时,体系黏度变化不大,对流动性的影响较小。值得注意的是,当二元体系的xIL= 0.1时,体系黏度最低,这可能是因为部分离子液体与硫酸产生了某种特殊的耦合效应,降低了体系黏度,有待进一步研究。
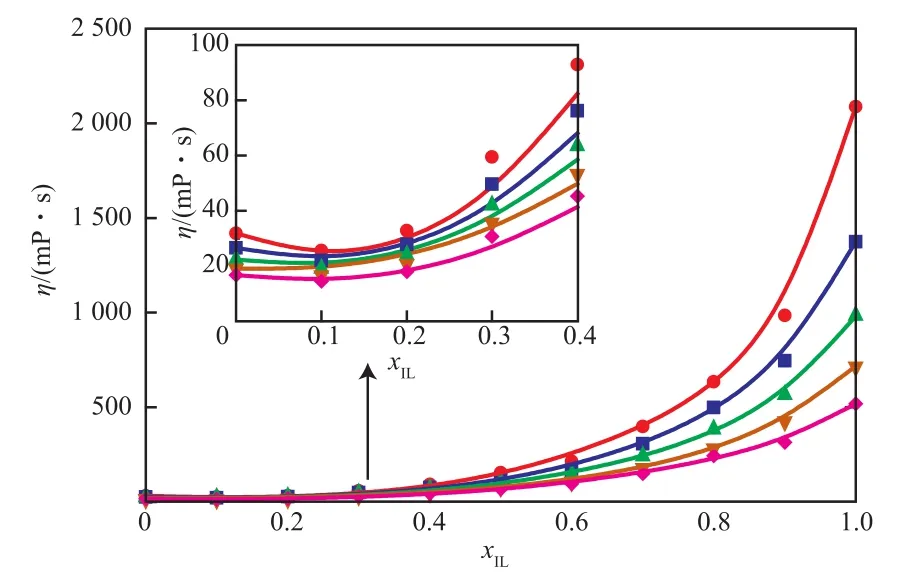
图1 [BM im][HSO4]/H2SO4 二元体系黏度随x IL的变化Fig.1 Effects of ion liquid molar fraction(x IL) on the η of[BM im][HSO4]/H2SO4 system.
为了描述[BM im][HSO4]/H2SO4二元体系黏度的变化规律,同时提供离子液体/硫酸二元体系黏度的预测计算方法,采用JAM模型(见式(1))[19]对实验数据进行关联。

式中,Ai为JAM模型i次方的系数,i = 0,1,2;xAcid为硫酸的摩尔分率;ηIL为[BMim][HSO4]的黏度,mPa·s;ηAcid为 H2SO4的黏度,mPa·s;η为[BMim][HSO4]/H2SO4二元体系的黏度,mPa·s。
不同组成下JAM模型的拟合参数见表2。从表2可看出,基于JAM模型计算的[BM im][HSO4]/H2SO4二元体系的黏度与实验值的平均相对误差不超过8.74%,从图1也可看出,JAM模型对[BMim][HSO4]/H2SO4二元体系黏度有较好的关联预测效果。
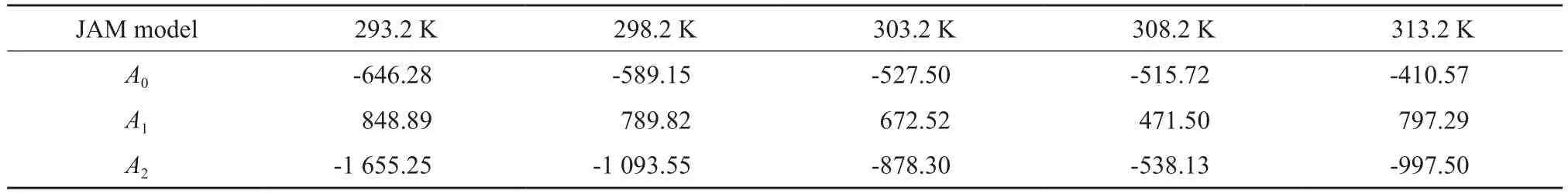
表2 [BM im][HSO4]/H2SO4二元体系的JAM模型拟合参数Table 2 Fitting parameters(A i) for[BM im][HSO4]/H2SO4 system by JAM model.
超额性质反映了真实溶液性质与理想溶液性质间的差异性。为了解离子液体[BM im][HSO4]与H2SO4分子间的相互作用,按式(2)计算了[BMim][HSO4]/H2SO4二元体系的超额黏度(ηE)。

[BM im][HSO4]/H2SO4二元体系的超额黏度随xIL的变化见图2。由图2可看出,在实验条件范围内,二元体系的超额黏度均为负值。在xIL≈0.75时超额黏度达到极值,说明此时混合溶液的实际溶液性质与理想溶液性质的差异达到最大。溶液黏度在本质上是一种流动传递性质,是分子层之间单位面积上的黏滞力[20],亦是分子间作用力在宏观上的体现。[BM im][HSO4]与H2SO4混合后,分子间自由体积增大,致使混合溶液总体积膨胀[13]。该结果与[BM im][HSO4]/H2SO4二元体系超额黏度为负值这一结果相符,表明H2SO4与[BM im][HSO4]混合有助于增大体系黏度与理想溶液的差异,改善体系流动性。
温度对[BM im][HSO4]/H2SO4二元体系超额黏度同样具有较大影响。从图2可看出,温度越高,超额黏度的绝对值越小,即温度升高降低了混合导致的超额黏度的绝对值。这主要是因为,随温度的升高,离子液体和硫酸的黏度均降低,同时也缩小了二者之间黏度的差异。
采用三级R-K[21]经验方程(见式(3))对[BM im][HSO4]/H2SO4二元体系超额黏度进行拟合,拟合所得参数列于表3,拟合结果见图2。

式中,αj为拟合参数,j = 0,1,2,3。

图2 [BM im][HSO4]/H2SO4二元体系超额黏度随x IL的变化Fig.2 Effects of x IL on the excess viscosities(ηE) of[BM im][HSO4]/H2SO4 system.
从表3可看出,拟合回归相关系数R2为0.99,同时从图2可看出R-K方程能很好地关 联[BM im][HSO4]/H2SO4二 元 体 系 的 超 额黏度。

表3 [BM im][HSO4]/H2SO4二元体系超额黏度的R-K方程拟合参数Table 3 Fitting parameters(αj) for excess viscosities of[BM im][HSO4]/H2SO4 system by R-K equation
2.2 [BM im][HSO4]/H2SO4二元体系的表面张力
表面张力的测定需知道体系的密度,结合前期工作[13],[BM im][HSO4]/H2SO4二元体系的密度可由比重瓶法测定。比重瓶法测定体系密度的多次平均测量结果偏差低于±0.002 0 g/cm3。[BM im][HSO4]/H2SO4二元体系在不同温度下的表面张力见图3。由图3可知,随温度的升高,H2SO4,[BM im][HSO4]和[BM im][HSO4]/H2SO4二元体系的表面张力均单调降低。当温度由293.2 K升至313.2 K时,H2SO4的表面张力由52.62 mN/m降至 51.87 mN/m,[BM im][HSO4]的表面张力由50.60 mN/m降至49.54 mN/m,降幅分别为1.42%,2.09%,[BM im][HSO4]/H2SO4二元体系表面张力的降幅介于二者之间。说明在实验温度范围内,温度对体系表面张力的影响相对较小。
从图3还可看出,在相同温度下,[BMim][HSO4]与H2SO4的表面张力差异不大。随xIL的增大,表面张力呈单调下降趋势,其中,当xIL在0~0.1区间,体系表面张力迅速下降,而当xIL由0.1增至1.0时,表面张力变化不明显。相同温度下,表面张力在xIL= 0~0.1范围内的降幅占xIL= 0~1.0范围内降幅的73.76%左右。说明在H2SO4中添加少量离子液体即可降低体系表面张力,这有利于利用微量离子液体改善[BM im][HSO4]/H2SO4二元体系液相的分散特性,及其与反应相关的混合特性和传质特性。
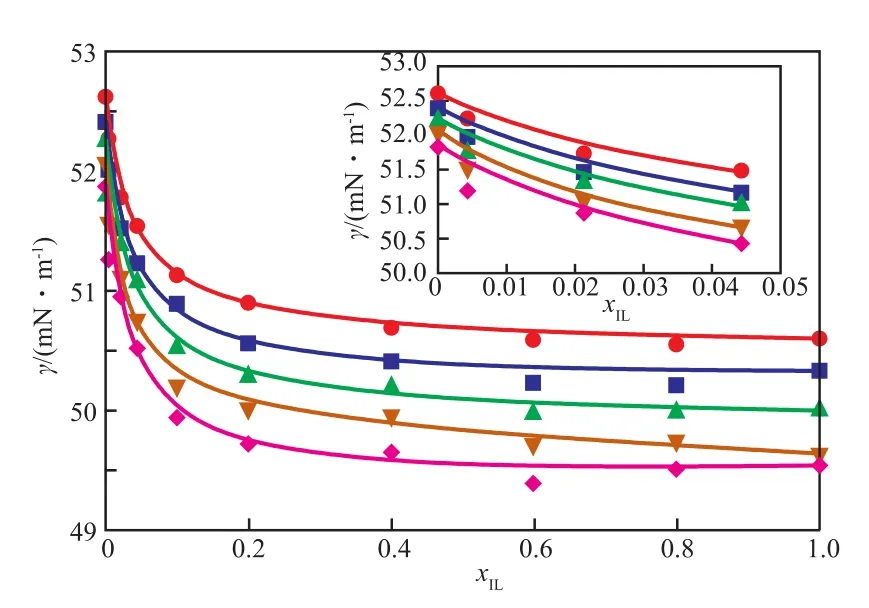
图3 [BM im][HSO4]/H2SO4二元体系在不同温度下的表面张力Fig.3 γ of[BM im][HSO4]/H2SO4 system at different temperature.
为了描述[BM im][HSO4]/H2SO4二元体系表面张力的变化规律,同时提供二元体系表面张力的预测计算方法,采用LWW模型[22](见式(4))对实验数据进行关联。

式中,∂Λ21/∂A与Λ21在相同体系温度下为常数,可视为拟合常数;R为理想气体常数,R = 8.314 Pa·m3/(mol·K);T为温度,K;γIL为[BM im][HSO4]的表面张力,mN/m;γAcid为H2SO4的表面张力,mN/m;γ为[BM im][HSO4]/H2SO4二元体系的表面张力,mN/m。
[BM im][HSO4]/H2SO4二元体系表面张力的LWW模型拟合参数见表4,基于LWW模型计算的表面张力见图3。由图3可知,LWW模型计算所得表面张力与实验值的平均相对误差不超过0.16%,说明 LWW模型对[BM im][HSO4]/H2SO4二元体系表面张力有很好的拟合效果。

表4 [BM im][HSO4]/H2SO4体系表面张力的LWW模型拟合参数Table 4 Fitting parameters for surface tensions of[BM im][HSO4]/H2SO4 m ixtures by LWW model.
为研究体系溶液表面张力实际性质与理想性质的差异,按式(5)计算了体系的超额表面张力(γE)。

[BM im][HSO4]/H2SO4二元体系超额表面张力随xIL的变化见图4。从图4可看出,随着温度的升高,超额表面张力的绝对值增大,表面张力实际性质与理想性质的差异也越大。但总体而言,温度对体系超额表面张力的影响较小。
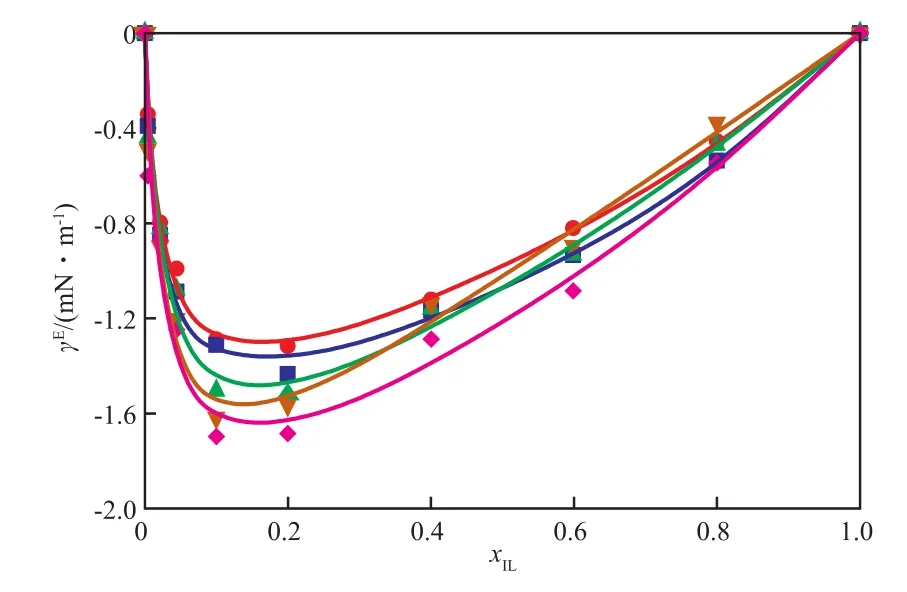
图 4 [BM im][HSO4]/H2SO4 二元体系超额表面张力随x IL的变化Fig.4 Effects of x IL on the excess surface tensions(γE) of[BM im][HSO4]/H2SO4 system.
超额表面张力反映了混合液中各组分在溶液表面界面区域和溶液主体区域间的不均匀分布特性。[BM im][HSO4]/H2SO4二元体系的超额表面张力均不大于0,在xIL≈0.1时最低。在二元混合溶液中,表面张力较低的组分具有正吸附效应[23],该效应使表面张力较低的组分富集于溶液表面界面区域[21,24]。在[BM im][HSO4]/H2SO4二元体系中,表面张力较低的[BM im][HSO4]分子会富集于溶液表面界面区域。实验结果表明[BM im][HSO4]与H2SO4虽然互溶,但在相界面处与液相主体存在浓度分布差异。在相界面富集更多的离子液体,有利于增大反应物在催化剂相界面处的溶解度,从而提供更大的反应物在液相的浓度梯度。
采用MS[25]公式(见式(6))对[BMim][HSO4]/H2SO4二元体系的超额表面张力拟合,拟合结果见图4,拟合所得相关参数见表5。
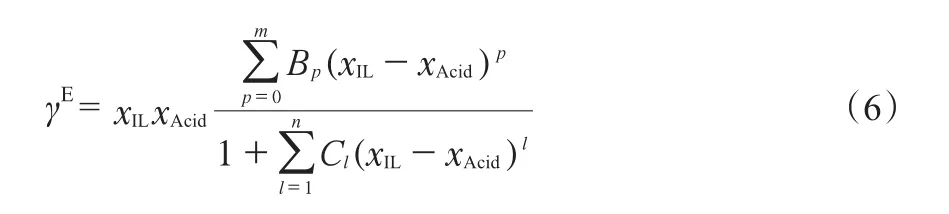
式中,Bp与Cl均为拟合参数;m与n为展开系数,m = 0,n = 1,2。
从表5可见,MS公式拟合的回归相关系数R2不低于0.97。同时从图4可见,该模型能很好拟合[BM im][HSO4]/H2SO4二元体系的超额表面张力随离子液体组成的变化情况。
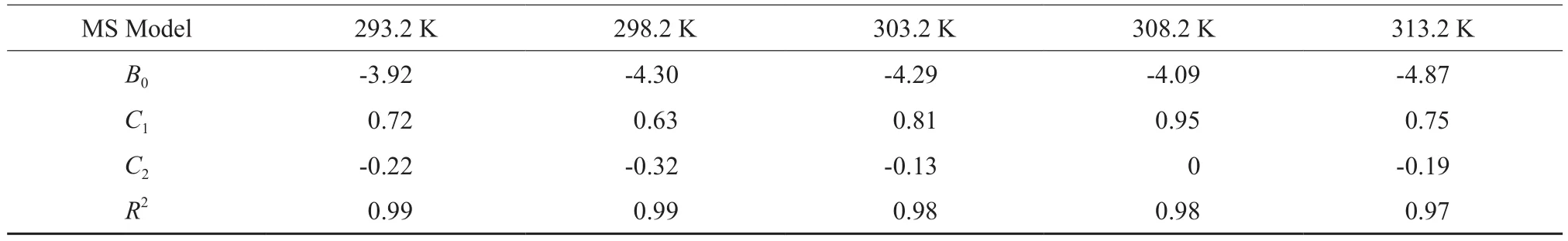
表5 [BM im][HSO4]/H2SO4二元体系超额表面张力的MS公式拟合参数Table 5 Fitting parameters for excess surface tensions of[BM im][HSO4]/H2SO4 m ixtures by MS equation
3 结论
1)在293.2~313.2 K范围内,[BM im][HSO4]/H2SO4二元体系的黏度随温度的升高而下降;随xIL的增加而增大。其中,在xIL= 0.6~1.0范围内,黏度随xIL的增大而显著增加。
2)[BM im][HSO4]/H2SO4二元体系的超额黏度为负值,其中,xIL≈0.75时,超额黏度达到最低。表明 H2SO4与[BM im][HSO4]混合有助于增大体系黏度与理想溶液的差异,改善体系流动性。
3)在293.2~313.2 K范围内,[BM im][HSO4]/H2SO4二元体系的表面张力随温度的升高而略有降低;随xIL的增加而降低,在xIL= 0~0.1区域,表面张力变化相对显著。
4)[BM im][HSO4]/H2SO4二元体系的超额表面张力均不大于0,其中,当xIL≈0.1时,超额表面张力达到最小值,说明[BM im][HSO4]与H2SO4虽然互溶,但在相界面处与液相主体存在浓度分布差异。
5)JAM模型和LWW模型可以分别用于拟合[BM im][HSO4]/H2SO4二元体系的黏度与表面张力,平均相对误差分别低于8.74%和0.16%。R-K方程和MS公式可分别用于拟合二元体系的超额黏度与超额表面张力,R2不低于0.99和0.97。
[1] Hallett J P,Welton T. Room-temperature ionic liquids:Solvents for synthesis and catalysis. 2[J].Chem Rev,2011,111(5):3508-3576.
[2] Mahurin S M,Lee J S,Baker G A,et al. Performance of nitrile-containing anions in task-specific ionic liquids for improved CO2/N2separation[J].J Membr Sci,2010,353(1/2):177-183.
[3] Howarth J,James P,Ryan R. Sodium borohydride reduction of aldehydes and ketones in the recyclable ionic liquid[Bmim][PF6][J].Synth Commun,2001,31(19):2935-2938.
[4] Gan Panxue,Tang Shengwei. Research progress in ionic liquids catalyzed isobutane/butene alkylation[J].Chin J Chem Eng,2016,24(11):1497-1504.
[5] Wasserscheid P,Sesing M,Korth W. Hydrogensulfate and tetrakis(hydrogensulfato)borate ionic liquids:Synthesis and catalytic application in highly Brönsted-acidic systems for Friedel-Crafts alkylation[J].Green Chem,2002,4(2):134-138.
[6] Tang Shengw ei,Scurto A M,Subramaniam B. Improved 1-butene/isobutane alkylation with acidic ionic liquids and tunable acid/ionic liquid m ixtures[J].J Catal,2009,268(2):243-250.
[7] Cui Peng,Zhao Guoying,Ren Hailing,et al. Ionic liquid enhanced alkylation of iso-butane and 1-butene[J].Catal Today,2013,200:30-35.
[8] Xing Xueqi,Zhao Guoying,Cui Jianzhong,et al. Isobutane alkylation using acidic ionic liquid catalysts[J].Catal Commun,2012,26:68-71.
[9] Huang Qian,Zhao Guoying,Zhang Suojiang,et al. Improved catalytic lifetime of H2SO4for isobutane alkylation with trace amount of ionic liquids buff er[J].Ind Eng Chem Res,2015,54(5):1464-1469.
[10] Zhang Yuan,Zhang Tao,Gan Panxue,et al. Solubility of isobutane in ionic liquids[BM Im][PF6],[BM Im][BF4],and[BM Im][Tf2N][J].J Chem Eng Data,2015,60(6):1706-1714.
[11] Zhang Shuai,Zhang Tao,Tang Shengwei. Determ ination of the hammett acidity functions of trifl ic acid/ionic liquid binary m ixtures by the13C NMR-probe method[J].J Chem Eng Data,2016,61(6):2088-2097.
[12] 周飞,张圆,唐盛伟. 离子液体/硫酸混合物的Hammett值测定方法[J].天然气化工:化学与化工,2013,38(6):87-92.
[13] 张帅,张涛,唐盛伟. [BM im][HSO4]-H2SO4二组分物系密度的测定及相关热力学性质的研究[J].石油化工,2016,45(8):957-965.
[14] Jin Keting,Zhang Tao,Ji Junyi,et al. Functionalization of MCM-22 by dual acidic ionic liquid and its paraffin absorption modulation properties[J].Ind Eng Chem Res,2015,54(1):164-170.
[15] Li Hongxia,Zhang Tao,Yuan Shaojun,et al. MCM-36 zeolites tailored with acidic ionic liquid to regulate adsorption properties of isobutane and 1-butene[J].Chin J Chem Eng,2016,24(12):1703-1711.
[16] 李红霞,张涛,唐盛伟. 负载离子液体调节MCM-36上异丁烷和1-丁烯的相对吸附量[J].华东理工大学学报:自然科学版,2016,42(6):743-749.
[17] Yoshizawa M,Xu Wu,Angell C A. Ionic liquids by proton transfer:Vapor pressure,conductivity,and the relevance of ΔpKafrom aqueous solutions[J].J Am Chem Soc,2003,125(50):15411-15419.
[18] Pátek J,Součková M,K lom far J. Generation of recommendable values for the surface tension of water using a nonparametric regression[J].J Chem Eng Data,2016,61(2):928-935.
[19] Ghani N A,Sairi N A,Aroua M K,et al. Density,surface tension,and viscosity of ionic liquids(1-ethyl-3-methylim idazolium diethylphosphate and 1,3-dimethylim idazolium dimethylphosphate) aqueous ternary m ixtures with MDEA[J].J Chem Eng Data,2014,59(6):1737-1746.
[20] 孙义,马沛生. 巴豆酸乙酯与乙醇混合液密度和粘度的测定及关联[J].高校化学工程学报,2007,21(3):510-515.
[21] Tsierkezos N G,Filippou A C. Thermodynam ic investigation of N,N-dimethylformam ide/toluene binary m ixtures in the temperature range from 278. 15 to 293. 15 K[J].J Chem Thermodyn,2006,38(8):952-961.
[22] Rafati A A,Bagheri A,Najafi M. Experimental data and correlation of surface tensions of the binary and ternary systems of water+acetonitrile+2-propanol at 298. 15 K and atmospheric pressure[J].J Chem Eng Data,2010,55(9):4039-4043.
[23] Tariq M,Freire M G,Saramago B,et al. Surface tension of ionic liquids and ionic liquid solutions[J].Chem Soc Rev,2012,41(2):829-868.
[24] Yue Hongya,Liu Zhigang. Surface tension of binary m ixtures of 2,2,4-trimethylpentane+1-alkanols from 298. 15 to 323. 15 K[J].J Chem Eng Data,2016,61(3):1270-1279.
[25] Bagheri A,Abolhasani A,Moghadasi A R,et al. Study of surface tension and surface properties of binary systems of DMSO with long chain alcohols at various temperatures[J].J Chem Thermodyn,2013,63:108-115.
Viscosity and surface tensions of[BM im][HSO4]/H2SO4binary system
Hu Jing,Zhang Tao,Zhang Shuai,Zhou Fei,Zhang Yuan,Tang Shengwei
(College of Chem ical Engineering,Sichuan University,Chengdu Sichuan 610065,China)
A t the range of 293.2-313.2 K,the viscosities and surface tensions of 1-buty l-3-methylim idazolium hydrogen sulfate([BM im][HSO4])/H2SO4binary system were measured and calculated by Jouyban-Acree(JAM) and Li-Wang(LWW) equation respectively. The excess viscosities and excess surface tensions of the binary system were fitted by Redlich-Kister(R-K) and M yers-Scott(MS) equation separately. The results show that the viscosities of[BM im][HSO4]/H2SO4decreased with the increasing temperature and increased with the increasing molar fraction of[BM im][HSO4](xIL). The excess viscosities of the binary system are negative and reach m inimum at xIL≈ 0.75. The surface tensions of the binary system decrease slightly with increasing temperature and xIL. The surface tensions of the binary system are negative and reach minimum at xIL≈0.1. The viscosities and surface tensions of the binary system are fitted well by JAM and LWW equation. The relative standard deviations are no more than 8.74% and 0.16%,respectively. R-K and MS equation describes the excess viscosities and excess surface tensions of the binary system well,both of their correlation coeffi cient R2are not less than 0.99 and 0.97 separately.
ionic liquid;sulfuric acid;viscosity;surface tension
1000-8144(2017)09-1161-07
TQ 019
A
2017-02-22;[修改稿日期]2017-06-19。
胡静(1990—),男,四川省眉山市人,硕士生,电邮 1558463069@qq.com。联系人:唐盛伟,电话028-85405201,电邮tangdynasty@scu.edu.cn。
国家自然科学基金项目(21576168;21276163)。
10.3969/j.issn.1000-8144.2017.09.011
(编辑 邓晓音)
