超氧化物歧化酶重组酵母的构建及其发酵条件的优化
2017-11-01张海玲孙金钰郑屹峰刘树滔饶平凡
张海玲, 刘 超, 程 欲, 孙金钰, 郑屹峰,傅 婷, 赵 丹, 刘树滔*, 饶平凡
(1.福州大学 生物工程研究所,福建 福州 350002;2.中国科学院 上海生命科学研究院-浙江工商大学食品营养科学联合研究中心,浙江 杭州 310035)
超氧化物歧化酶重组酵母的构建及其发酵条件的优化
张海玲1, 刘 超1, 程 欲1, 孙金钰1, 郑屹峰1,傅 婷1, 赵 丹1, 刘树滔*1, 饶平凡2
(1.福州大学 生物工程研究所,福建 福州 350002;2.中国科学院 上海生命科学研究院-浙江工商大学食品营养科学联合研究中心,浙江 杭州 310035)
超氧化物歧化酶(SOD)由于具有高效清除氧自由基的作用而广泛用于食品、日化和医药领域。作者研究了提高SOD产量的基因工程新方法。利用密码子优化后人源铜锌超氧化物歧化酶基因,构建亚克隆及表达载体,最终转化进巴斯德毕赤酵母进行表达。通过正交试验,分析工程菌的最适摇瓶表达条件。摇瓶正交试验确定最优表达条件为:28℃,诱导剂体积分数1.0%,接种体积分数1.0%,最优表达水平为2 339.4 U/mL,与现有的一些研究相比,其表达量提高了近3倍。这些结果表明:对人源铜锌SOD经过适当的密码子优化和发酵条件优化,使酵母表达量显著提高,有助于解决SOD原料来源的局限。
人源铜锌超氧化物歧化酶;基因工程;巴斯德毕赤酵母;表达;优化
自由基是含有一个或以上不成对电子的原子或原子团,极易夺取其他分子的电子而形成稳定的物质,当损伤性自由基的产生能力超过机体抗氧化防御系统的处理能力时,就称为氧化应激[1]。人体中90%以上的自由基都是氧自由基,SOD可以将超氧阴离子自由基歧化为H2O2和O2,降低对机体的损害。
人体补充SOD可以预防或治疗肌萎缩性侧索硬化症等自由基综合症[2]。SOD也可以作为保健食品的功能因子或食品营养强化剂,如添加了SOD的蛋黄酱、牛奶、啤酒和果汁饮料等;制成SOD食品或复合食品,如SOD胶囊、片剂和口服液等;以富含SOD的原料加工制成保健食品,如大蒜饮料、刺梨SOD汁等[3]。
国内外对SOD均有较大需求,目前SOD制备的研究主要有两个方向,一是从动植物中提取,但往往会面临原料来源和免疫原性两个局限[4];二是使用基因工程技术通过微生物表达人源SOD蛋白[5]。
作者尝试将优化后的人源 Cu,Zn-SOD(hSOD1)基因转化进巴斯德毕赤酵母中,获取hSOD1的高表达工程菌和优化发酵条件,解决SOD的来源问题。
1 材料与方法
1.1 材料与仪器
PCR和电穿孔仪:美国BIO-RAD公司;蛋白质电泳仪:日本ATTO公司;核酸电泳和转膜电泳槽:北京六一仪器厂;pMD18-T simple:宝生物公司;pPICZαA表达质粒:Invitrogen公司。
1.2 试验方法
1.2.1 酵母最适密码子的优化 由于密码子的简并性,hSOD1的某些密码子在酵母中成为稀有密码子,影响蛋白合成的效率。从NCBI数据库查得hSOD1基因后,参照毕赤酵母密码子使用偏好性对密码子进行替换,并兼顾GC含量在40%~60%之间,合成优化后的基因。
1.2.2 目的基因扩增 根据目的基因设计PCR引物,上游引物5'CTCGAGAAAAGAGCTACTAAGG CTG TTT 3',下游引物5'TCTAGATTATTGGGCG ATACCGATAA 3',其中下划线部分分别为XhoⅠ和XbaⅠ酶切位点、碱性氨基酸密码子、终止密码子。上游添加Lys和Arg两个碱性氨基酸,利于蛋白质分泌表达时酵母细胞膜上的Kex2酶将前导肽和目的蛋白质切开。
PCR反应条件为:94℃预变性10 min;94℃30 s,55 ℃ 30 s,72 ℃ 40 s,扩增 25 个循环;循环结束后72℃ 延伸10 min,4℃保存。
1.2.3 真核表达载体pPICZαA-SOD的构建 将胶回收的目的基因与pMD18-T simple连接,构建亚克隆载体后转入大肠杆菌JM109,挑取阳性克隆子,经PCR和双酶切初步验证后测序。确认无突变后将亚克隆载体和pPICZαA表达质粒经XhoⅠ和XbaⅠ双酶切,分别回收hSOD1片段和pPICZαA载体片段,使用T4连接酶4℃过夜连接构建表达载体pPICZαA-SOD。将表达载体转入大肠杆菌JM109中,涂布于氨苄抗性平板,挑取抗性菌进行培养,提取质粒双酶切验证后电转化进毕赤酵母GS115,使用Zeocin抗性平板筛选重组菌,选取工程菌命名为GS115/pPICZαA-SOD。
1.2.4 目的蛋白质的诱导表达 挑取平板上的工程菌接种于5 mL YPD液体培养基中,30℃培养过夜后,接种体积分数1%至25 mL的YPD培养基。30℃摇瓶培养40 h,添加体积分数1.0%甲醇诱导,每隔24小时取样并添加诱导剂,诱导4 d后收集发酵液,离心取上清液进行SDS-PAGE电泳和蛋白免疫印迹。
1.2.5 目的蛋白质表达条件的正交分析 设计3因素3水平的正交试验,分析温度、诱导剂和接种体积分数对最终蛋白质表达水平的影响[6],以酶活为实验指标,使用盐酸羟胺法测定酶活。
2 结果与讨论
2.1 目的基因PCR扩增结果
以密码子优化后的基因为模板,使用设计的引物进行PCR扩增,获得的目的基因片段长度为480 bp,电泳结果见图1。
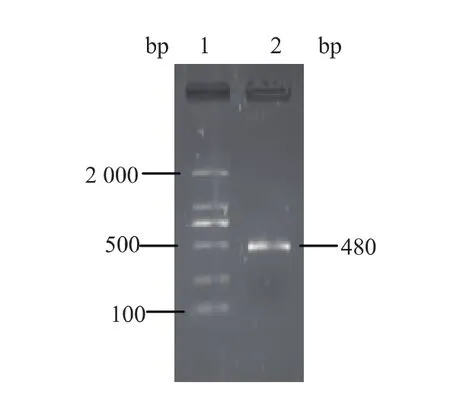
图1 目的基因PCR扩增后电泳图Fig.1 Electrophoresis spectrums of SOD gene expanded by PCR
2.2 鉴定真核表达载体pPICZαA-SOD
使用两种限制性内切酶对pPICZαA-SOD载体进行双酶切,电泳图谱可见3.6 kb的载体片段和480 bp的目的片段,见图2。
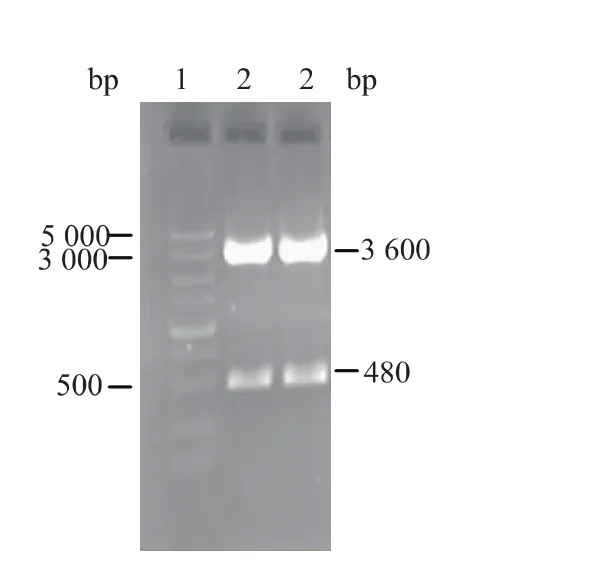
图2 pPICZαA-SOD载体双酶切验证结果Fig.2 Restricion map of pPICZαA-SOD
2.3 目的蛋白质的诱导表达
摇瓶培养40 h以后开始诱导,图3电泳结果表明,随着诱导时间的增加,22 000附近的电泳条带从无到有逐渐变深。纯化后的样品进行蛋白免疫印迹,也可在目标蛋白质处见特异条带。
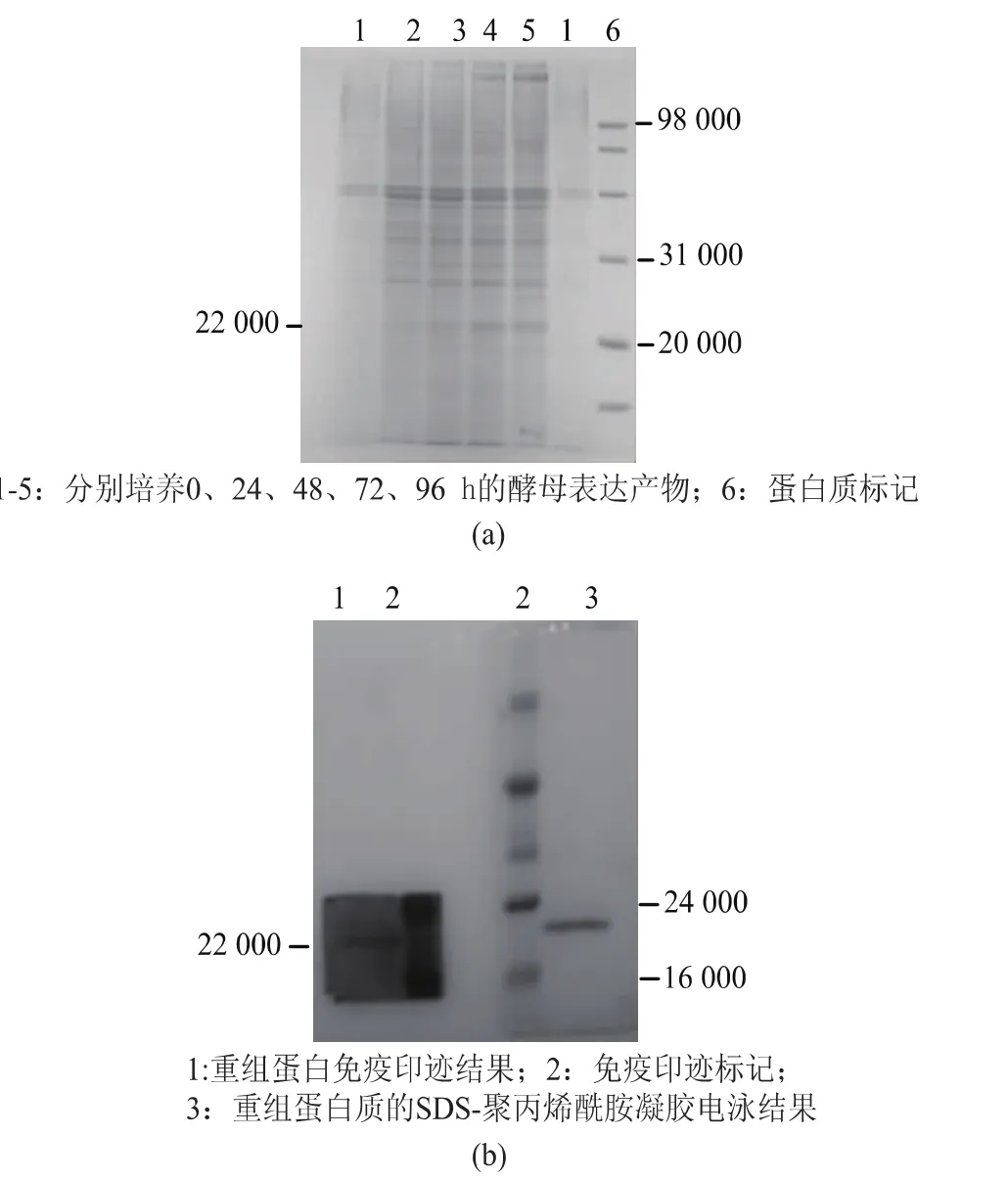
图3 目的蛋白质诱导表达产物的SDS-PAGE和WB结果Fig.3 SDS-PAGE andWesternblottingresultof expression pruduct
2.4 表达条件的正交分析
设计正交试验[7],分析不同温度、诱导剂量和接种体积分数对最终表达产物的影响,正交分析结果见表1。显示1号试验组酶活最高,可达2 339.4 U/mL,条件为温度28℃、诱导剂体积分数1.0%、接种体积分数1.0%。

表1 SOD摇瓶表达条件的正交试验分析Table 1 Orthogonal experiment of SOD’s expression condition in shaking culture
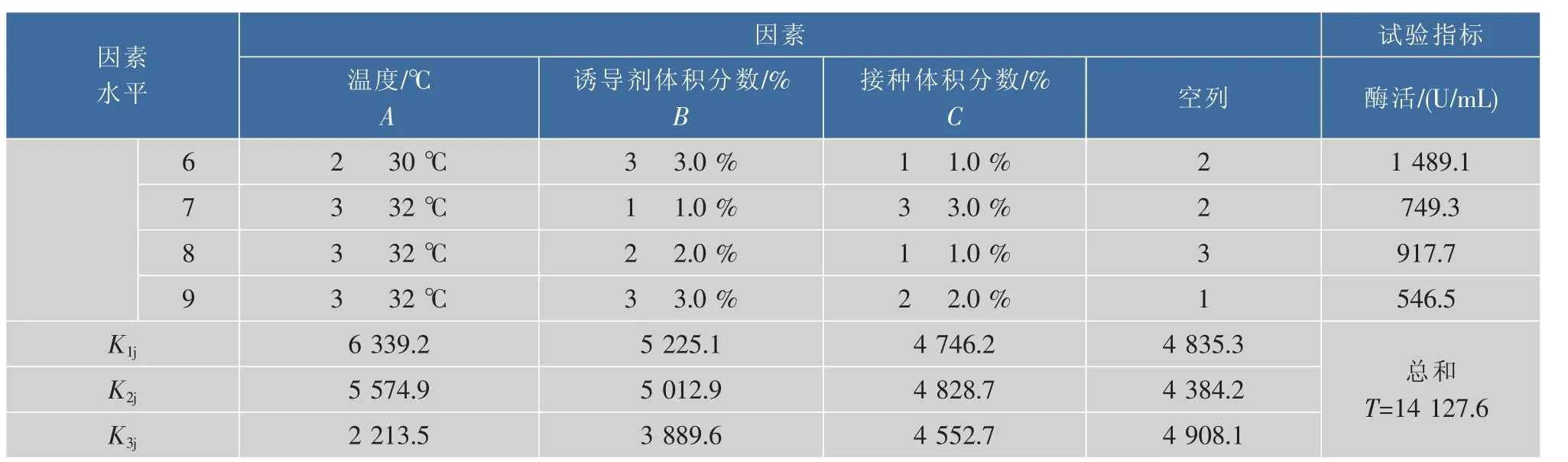
续表1
对试验结果进行F检验,从表2的检验p值可以看出,温度因素的检验p值为0.000 416,小于α=0.01,对试验结果的影响极显著,诱导量因素的检验p值为0.026 707,小于α=0.05,对试验结果有显著性影响,接种体积分数对试验影响不显著。
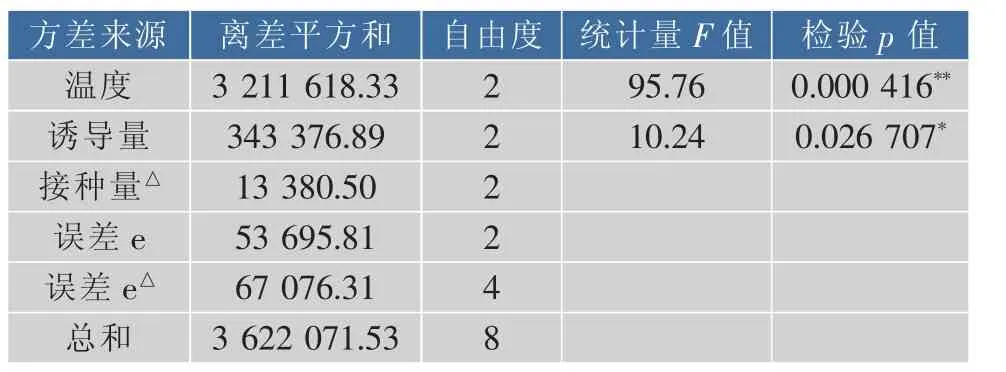
表2 正交试验结果的F检验Table 2 F-test results of orthogonal experiment
3 结 语
巴斯德毕赤酵母表达系统因具有可分泌表达、背景蛋白质少、易于高密度发酵等优点,越来越广泛地运用到科研和生产方面[8]。作者旨在构建出能高效分泌表达人源Cu,Zn-SOD的巴斯德毕赤酵母工程菌,利用毕赤酵母密码子的偏好性来优化表达以提高产量。通过引物设计去掉前导肽和组氨酸标签获取天然构象蛋白质。
人源Cu,Zn-SOD已经在酵母系统中得到表达,但是表达水平往往不高,作者希望能通过上述技术提高酵母表达人源铜锌SOD的产量。从正交试验可以看出,本实验构建的菌株在温度28℃、诱导剂体积分数1.0%、接种体积分数1.0%的摇瓶条件下,表达的酶活可高达2 339.4 U/mL,远远高于国内现已发表文献的表达水平,例如迟春萍等研究获得的最高酶活性仅达到611 U/mL[9-10],因此,本研究达到了实验的预期。
[1]HEATH D S,KATIE C,SALLY H W,et al.A review of free radicals and antioxidants for critical care nurses[J].Intensive and Critical Care Nursing,2005,21:24-28.
[2]QIU Chuanghua,ZHOU Yongjun,HIU Gan,et a1.Cu,Zn-superoxide dismutase associated with amyotrophic lateral sclerosis[J].Chinese Journal of Biochemistry and Molecular Biology,2008,24(2):107-112.(in Chinese)
[3]YU Ping.Research progress of superoxide dismutase[J].Bulletin of Biology,2006,41(4):4-6.(in Chinese)
[4]何晓红.茶花粉超氧化物歧化酶的分离提纯、表征及功能基团研究[D].长春:吉林大学,2007.
[5]迟春萍.人铜锌超氧化物歧化酶在毕赤酵母中高表达及其中试工艺研究[D].长春:吉林农业大学,2011.
[6]ZHANG Wenhui,Mehmet Inan,Michael M Meagher.Fermentation strategies for recombinant protein expression in the methylotorphic yeast Pichia pastoris[J].Chemical and Biomolecular Engineering Research and Publications,2000,5:257-287.
[7]梁飞豹.应用统计方法[M].北京:北京大学出版社,2010:176-190.
[8]LOU Runjuan,LUO Lilong,ZHANG Xia,et a1.Research progress and prospects on Pichia pastoris[J].Journal of Biology,2010,27(5):73-76.(in Chinese)
[9]CHI Chunping,SUI Hong,LI Yutong,et a1.Expression of human Cu-Zn gene in Pichia pastoris and stability of expressed product[J].Chin J Biologicals,2008,21(5):374-377.(in Chinese)
[10]CHI Chunping,SHI Chengbo,CAO Yufeng,et al.Construction and high expression of Pichia pastoris transformants carrying human Cu/Zn superoxide dismutase gene[J].Food Science,2012,33(5):218-223.(in Chinese)
Construction and Expression of Recombinant Superoxide Dismutase in Pichia pastoris
ZHANG Hailing1, LIU Chao1, CHENG Yu1, SUN Jinyu1, ZHENG Yifeng1,FU Ting1, ZHAO Dan1, LIU Shutao*1, RAO Pingfan2
(1.Institute of Biotechnology,Fuzhou University,Fuzhou 350002,China;2.CAS.SIBS-Zhejiang Gongshang University Joint Centre for Food and Nutrition Research,Hangzhou 310035,China)
Superoxide dismutase (SOD) can be widely used in the field of food,cosmetic and medicine for its high capacity to scavenge free radicals.This paper reported a method of gene engineering attempting to solve the issue of SOD production.The gene of Cu,Zn-SOD with the yeast bias codon was firstly chemically synthesized and integrated into the genome of Pichia pastoris and the expression condition was optimized through orthogonal experiment.It was found that the maximum expression level of SOD was nearly three times greater than some reserach reported and the optimal temperature,methanol concentration and inoculation were 28 ℃ ,1.0%and 1.0%respectively.These results suggest that the problem of SOD production can be solved by improvingthe expression level of P.pastoris through the optimization of gene codon and fermentation conditions.
superoxide dimutase,gene engineering,Pichia pastoris,expression;optimization
Q 78
A
1673—1689(2017)09—0918—04
2015-04-17
国家自然科学基金项目(31071497,31271859);国家973计划项目(2010CB530605);国家重点研发项目(2016YFD0400200)。
*通信作者:刘树滔(1970—),男,福建周宁人,农学博士,教授,硕士研究生导师,生物化学与分子生物学专业。Email:stliu@fzu.edu.cn
张海玲,刘超,程欲,等.超氧化物歧化酶重组酵母的构建及其发酵条件的优化[J].食品与生物技术学报,2017,36(09):918-921.
