不同水热条件下TiO2/电气石复合材料的光催化机制
2017-11-01亓淑艳王德朋胥焕岩
亓淑艳 吴 超 王德朋 胥焕岩
不同水热条件下TiO2/电气石复合材料的光催化机制
亓淑艳*吴 超 王德朋 胥焕岩
(哈尔滨理工大学材料科学与工程学院,哈尔滨 150080)
为了解决TiO2纳米光催化剂易团聚、禁带宽度大的缺点,本文采用水热法制备了TiO2/电气石(3%)复合材料,研究了水热时间(2~10 h)和水热温度(120~200℃)对TiO2/电气石(3%)的光催化性能的影响。发现光催化降解罗丹明B的降解率由单独TiO2的60%提高到加入电气石后的99.4%。电气石具备自发极化电场效应,降低了TiO2的禁带宽度和光生电子和空穴的复合率。在水热温度160℃、水热时间4 h条件下制备的TiO2/电气石(3%)表现出最高的光催化降解罗丹明B的性能。说明TiO2与这种有自发极化的材料复合能够有效提高其光催化性能。
水热法;TiO2/电气石;罗丹明B;光催化;第一性原理
0 引 言
环境质量的下降以及生态的失调,对人类的生产和生活都产生了极为不利的影响。而对环境产生不利影响的因素有很多,其中有机污染物是不可忽视的污染源之一。由于有机污染物具有残留时间不确定性、半挥发性、微毒性以及高破坏性,所以处理不同有机污染物时所采用的方法亦不尽相同[1-5]。光催化法是一种利用太阳光可以在短时间内将有机污染物氧化成二氧化碳和水的方法,且降解率可以达到95%以上,绿色环保且不引起二次污染,具有相当大的发展前景[6-9]。
在1972年,Fujishma等[10]研究发现水能够在紫外光的激发照射下被锐钛矿纳米TiO2分解为氢气和氧气,此后,TiO2等半导体性能的研究引起了人们的广泛关注。纳米TiO2光催化材料具有化学性质不活泼、催化性能高、成本低、无二次污染等优点,在环境污染物的催化治理方面得到广泛的利用和开发。其主要面临的问题是锐钛矿型TiO2的能隙较宽,只能吸收太阳光中的紫外光,因此对太阳光的利用率较低。另外光激发产生的电子-空穴会在小于10-9s内复合,降低其光催化效率[11]。因而,对TiO2材料进行设计和改善成为了近些年国内外研究的热点[12-19]。
选择适当的俘获剂将电子导出或俘获的方法能有效地降低电子-空穴的复合效率,从而提高光催化性能。电气石是由Al、Na、Ca、Mg和Fe等元素组成的天然环状硅酸盐矿物,化学成分复杂,通式可写为 XY3Z6Si6O18(BO3)3W4(式中 X=Na、Ca、K;Y=Mn、Fe、Mg、Al;Z=Al、Fe、Cr、Mg;W=OH、F、O)。电气石在受到外界条件的影响下(温度、压力等),内部结构中的正负电荷中心沿3次轴方向上发生不同的位移,从而导致电气石晶体中的电矩增大,晶体表面的电性增强。电气石的这种自发极化电场效应是永久的,表现为电气石微粒周围存在静电场[20-22]。这种静电场的正负极可以分别吸引电子和空穴,从而降低电子和空穴的复合效率。Liu等[23]就曾利用TiO2与电气石的复合体系做了降解苯酚的一系列研究,实验结果表明电气石的引入有效提高了TiO2降解苯酚的能力,从原来的26%提高到96.29%。
所以本文利用天然电气石的这种自发极化电场,研究不同水热温度和时间对电气石含量为3%的TiO2/电气石复合材料降解水中有机污染物罗丹明B的光催化性能的影响。
1 实验部分
1.1 TiO2/电气石复合材料的制备
在冰水浴和不断搅拌的条件下,配制浓度为0.1 mol·L-1的TiCl4溶液。再向其中逐滴加入浓氨水,搅拌,至溶液的pH=7,得到白色沉淀。抽滤,分别用去离子水和无水乙醇清洗,去除Cl-离子和NH4+离子,得到无定型的TiO2白色固体。将上述TiO2白色固体加入到350 mL去离子水中,搅拌1 h。向其中逐滴加入22 mL、30%的H2O2溶液,并不断搅拌直至悬浊液变为清亮的橘黄色溶液。按比例3%加入电气石,在100℃水浴中加热,并不断搅拌1~2 h,放入反应釜(反应釜体积50 mL,放入溶液40 mL)中,在不同的水热温度(120~200℃)和水热时间(2~10 h)下进行反应,经过离心分离,洗涤,烘干,得到最终样品。
1.2 表征手段
晶相分析采用日本理学D/max-3B型X射线衍射仪,Cu Kα 为辐射源(λ=0.154 18 nm),工作电压为40 kV,工作电流为 30 mA,扫描范围为 10°~80°,扫描速度为 4°·min-1。
采用FEISirion 200扫描电子显微镜(工作电压设定为20 kV)和JEOL JEM-2010透射电子显微镜(电子加速电压为200 kV),对光催化剂的表面微观形貌进行观察。扫描电子显微镜中的所有实验样品都经过喷金处理。
PL光谱采用日本Shimadzu公司的RF-5301PC荧光分光光度计进行测试,将实验样品粉末装入粉末样品池中,使用固体样品架固定样品,用波长为550 nm的可见光对其进行激发。
1.3 吸附及光催化实验方法
10 mg的TiO2/电气石复合材料加入到体积为100 mL,浓度为20 mg·L-1的罗丹明B溶液中,在避光条件下搅拌,每隔30 min取出3~5 mL,测定其吸光度,计算复合材料的吸附性能,直至达到吸附饱和。光催化测试是在模拟太阳光光源500 W的gx2500型氙灯光源下进行的。将吸附饱和的悬浮液转移到氙灯下照射,不断搅拌。在整个实验过程中每隔相等的时间取1次样进行测量,测量时,经过15 min的离心分离,拾取上清液,加入到石英比色皿中。测量时,各次取样的最大吸收波长相同,都选用554 nm,且吸光度数值都在同一条件下记录。利用722型分光光度计测定样品的吸光度后,通过下式计算染料的脱色率:

式中C0为染料的初始浓度,Ct为实验过程中染料在特定时间点的浓度。
2 结果与讨论
2.1 XRD分析
图1a和b为在不同水热温度和不同水热时间下制备得到TiO2/电气石的XRD衍射图。由图可知,所有TiO2/电气石特征衍射峰与锐钛矿型TiO2(PDF No.1-562)基本一致。由于电气石的含量较少,在TiO2/电气石的XRD图中未检测到电气石的衍射峰。图1c为水热温度为160℃,水热时间为4 h条件下的TiO2/电气石复合样品的EDS能谱,分析TiO2/电气石复合光催化剂的物相元素成分,发现样品中主要含有 Si、Ca、Al、C、O、Ti等元素, 含量分别为 0.12%、0.20%、0.44%、14.22%、37.55%、47.47%。证明样品表面TiO2的含量较多,从图中可以看到Al、Si、Ca等元素,从而确定样品的组成成分含有电气石。
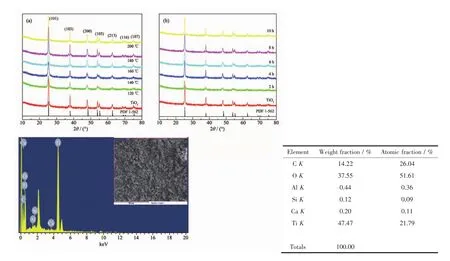
图1 (a)不同水热温度和(b)不同水热时间制备的TiO2/电气石的XRD图;(c)TiO2/schorl(3%)的能谱图Fig.1 XRD patterns of the TiO2/schorl prepared at different hydrothermal temperatures(a)and different hydrothermal time(b);EDSpatterns and elements analysis of the TiO2/schorl(3%)(c)
从图1a和b中可以看出,随着水热温度的升高和水热时间的增加,样品的衍射峰逐渐变得尖锐,峰强增强,表明TiO2结晶度随着温度的升高和时间的增加而提高。另外,根据Scherrer公式D=Kλ/(βcosθ),计算出在 120、140、160、180、200 ℃的反应温度下制备的TiO2/电气石复合材料中TiO2的平均晶粒尺寸分别为 11.2、12.3、15.8、18.6、19.2 nm。 可知,复合材料中TiO2的晶粒尺寸随着水热温度的升高而增大。 同样也可得到在 2、4、6、8、10 h 制备的TiO2/电气石复合材料TiO2的平均晶粒尺寸约为13.2、17.8、18.2、18.9、19.8 nm。从以上数据可以看出TiO2晶粒尺寸随着水热时间的延长而增大,这是因为温度提高、时间延长促进了晶体的生长[17,24]。
2.2 SEM分析
图2为在不同水热温度和水热时间下制备得到TiO2/电气石的SEM图。从图2(a~e)(不同水热温度)和图2(f~j)(不同水热时间)可以观察到,复合材料中TiO2颗粒均匀、致密地分散于电气石的表面,大量TiO2颗粒将电气石包裹在内部。除此以外,从图中还可观察到材料的空隙率有增加的趋势,这主要是由于小颗粒溶解所致。图2k为在160℃时相同水热条件制备的纯TiO2的SEM图,可以发现纯的TiO2纳米粒子团聚形成无规则的块状的团聚体。当TiO2与电气石复合后,由于电气石的大孔结构和表面极性的存在,导致对TiO2颗粒强烈的吸附和舒展作用,阻止了TiO2团聚成更大的团聚体[25]。
2.3 TEM分析
图3为在水热温度为120℃,4 h和160℃,4 h条件下制备的TiO2/电气石的TEM图。从左图中可以观察到TiO2/电气石粒径为5~10μm。右图为边缘处放大图,可以看出,TiO2为橄榄形的小颗粒,尺寸为50 nm左右,均匀地分散于电气石的表面上。

图 2 不同条件下 TiO2/电气石(3%)的 SEM 图:(a~e)水热温度为 120、140、160、180、200 ℃;(f~j)水热时间 2、4、10 h;(k)纯 TiO2;(l)纯电气石;(m)形成机理Fig.2 SEM pictures of TiO2/schorl(3%)prepared at different conditions(a~e)hydrothermal temperature at 120,140,160,180,200 ℃;(f~j)hydrothermal time at 2,4,10 h;(k)pure TiO2;(l)pure schorl;(m)the formation mechanism

图3 TiO2/电气石(3%)的TEM图:(a,b)120℃,4 h;(c,d)160℃,4 hFig.3 TEM images of the TiO2/schorl(3%):(a,b)120℃,4 h;(c,d)160℃,4 h
2.4 光催化性能分析
图4为不同水热温度和水热时间下制备得到TiO2/电气石吸附和光催化性能的曲线图。图5为TiO2/电气石复合材料光催化罗丹明B的原理图。从图4a中可以观察到,在水热温度为120、140、160、180、200℃的条件下制备得到的TiO2/电气石复合材料对罗丹明B的降解率分别为92%、91.7%、97%、89%、86.1%,而纯TiO2对罗丹明B的降解率仅仅为61.4%。从图4b中可以观察到,水热时间为2、4、6、8、10 h 的条件下制备得到的 TiO2/电气石对罗丹明B的降解率为91.36%、99.4%、89.8%、53%、61.3%。由上可知,采用水热法制备TiO2/电气石复合材料的最佳水热温度为160℃,水热时间为4 h。
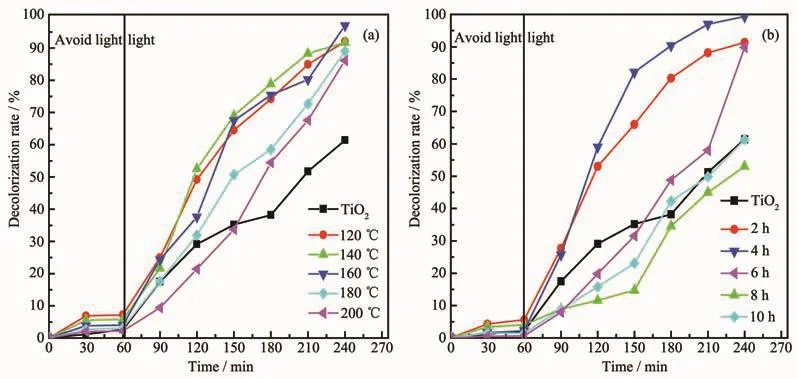
图4 TiO2/电气石(3%)光催化效率图:(a)不同水热温度;(b)不同水热时间Fig.4 Photocatalytic activity of the TiO2/schorl(3%):(a)Different hydrothermal temperatures;(b)Different hydrothermal time
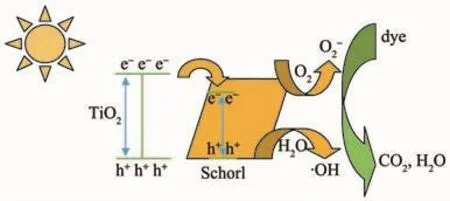
图5 TiO2/电气石(3%)光催化机理图Fig.5 Photocatalytic schematic of the obtained TiO2/schorl(3%)
TiO2/电气石复合材料对罗丹明B的降解率总体上呈现先升高后下降的趋势,这可能是因为:(1)由于电气石具有永久性电极,表面场强达到107V·cm-3,在光照射下,电气石可以和包覆在其表面的TiO2发生光电催化反应,迅速有效的将光生电子转移到电气石表面,这就减少了光生电子和空穴的重新复合,提高了光生空穴的利用率,从而提高光催化活性[26];(2)电气石辐射的远红外线能够活化水分子,降低水分子缔合度[27],有利于光催化反应进行。但随着热处理的温度和时间的增加,TiO2晶体缺陷逐渐减少,结晶更加完整,将促进光生电子与空穴的复合,降低了电子-空穴的利用率,所以又使光催化活性减弱了。
3 电气石增强TiO2光催化活性的微观机制
3.1 UV-Vis DRS分析
图6为纯TiO2和水热温度为160℃,水热时间为4 h的TiO2/电气石复合催化剂样品的UV-Vis DRS图,从图6a中可以看出样品的吸收边范围在400~450 nm,属于可见光区域,说明2个样品都能可见光响应。通过计算得出hν与[F(R)·hν]0.5的关系得出关系曲线,如图6b所示,从图中可以看出纯TiO2禁带宽度Eg=2.93 eV与普通的锐钛矿型TiO2禁带宽度Eg=3.23 eV相比要小有利于电子跃迁,有利于光催化,这也同样说明实验制得的TiO2光催化性能更好。而掺杂电气石后的样品禁带宽度降低到2.62 eV,则表明了电气石的存在改变了TiO2的禁带宽度。
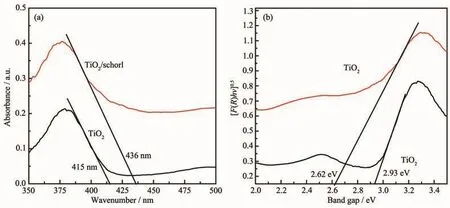
图6 (a)TiO2/电气石和TiO2紫外漫反射图;(b)TiO2/电气石和TiO2的禁带宽度图Fig.6 (a)UV-Vis DRSspectra of TiO2/schorl(3%)and TiO2;(b)Relationship between hν and[F(R)hν]0.5)
3.2 PL分析
图7为在不同水热温度和水热时间下制备得到TiO2/电气石的PL谱图。从图中可以观察到,不同水热温度和水热时间没有引起新的发光现象,只影响了PL光谱的响应强度,TiO2/电气石的荧光强度明显弱于纯TiO2荧光强度,这主要归结于电气石对TiO2所激发出的电子与空穴复合率的抑制作用所致。另外,从图中可以观察到,随着水热温度的降低和水热时间的减少,TiO2/电气石的荧光强度逐渐减弱,出现这种现象的原因可能是温度较低时所制备的复合物中的TiO2晶体缺陷较多,阻止了光生电子与空穴的复合[28]。
3.3 第一性原理分析
锐钛矿相TiO2(下文简称TiO2)晶体结构属于四方晶系,其空间群为I41/amd。在该晶体结构中,1个Ti4+和6个相邻的O2-构成八面体,其中Ti4+位于该八面体的中心,每个O2-与3个Ti4+相邻。根据无机晶体数据库(ICSD)查询可知,TiO2晶格参数为a=b=0.374 4 nm,c=0.951 4 nm。TiO2中Ti原子的分数坐标为a=b=c=0,O原子的分数坐标为a=b=0,c=0.207 8。
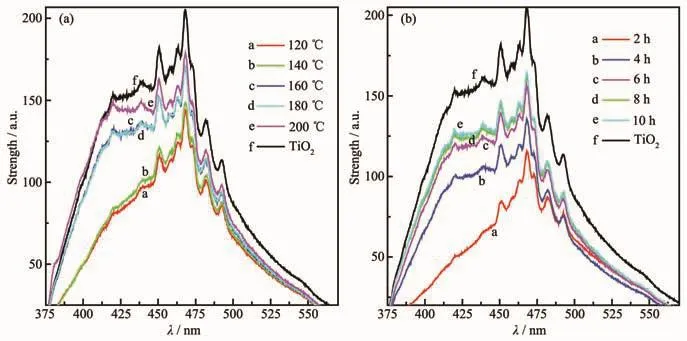
图7 TiO2/电气石(3%)的光致发光光谱图:(a)不同水热温度;(b)不同水热时间Fig.7 Photoluminescence Spectroscopy of the TiO2/schorl(3%):(a)different hydrothermal temperatures;(b)different hydrothermal time
根据以上数据,采用Accelrys公司开发的软件Materials studio 7.0版本建立TiO2正格矢晶包模型,如图8所示。图8所建立的TiO2晶胞中含有4个Ti原子,8个O原子。另外,在TiO2中存在着2种不同的Ti-O键,其键的长短不同,其中键长较长的用dap表示,键长较短的用deq表示。
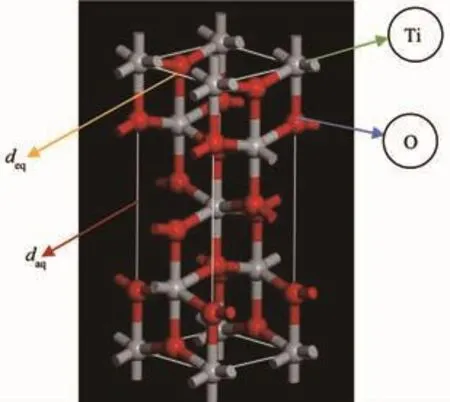
图8 锐钛矿型TiO2晶胞图Fig.8 Primitive unite cell of anatase TiO2
通过对锐钛矿相TiO2结构的优化处理,采用计算方法为GGA-PW91及平面波截止能为380 eV,固定K点为3×7×3对TiO2及TiO2/电气石的能带结构进行计算。
图9为锐钛矿相TiO2及复合材料TiO2/电气石的能带结构图。通过计算得到TiO2禁带宽度约为2.252 eV,远远小于实验值2.93 eV,这是因为在求解Kohn-Sham方程时忽略了体系的激发态,导致价带及基态以上的能级普遍比实验值偏低,而价带以下的能级与实验值相一致[29-31]。通常情况下,理论计算得到的锐钛矿相TiO2禁带宽度比实验值要小30%~50%,虽然与实验值相差较大,但是计算结果的相对值较为准确,对于分析材料的能带结构具有较高的可信度。另外,计算得到在电气石电场作用下TiO2禁带宽度减小到2.188 eV。TiO2禁带宽度的减小,有利于增大TiO2的光响应范围,提升TiO2光催化降解有机污染物的能力。该计算结果与TiO2/电气石复合材料光催化降解有机污染物实验结果相一致,从理论上解释了TiO2/电气石复合材料光催化能力提升的原因。

图9 (a)锐钛矿型TiO2能带结构;(b)TiO2/电气石(3%)能带结构Fig.9 (a)Band structure of anatase TiO2;(b)Band structure of TiO2/schorl(3%)
4结 论
本文采用水热法在不同水热温度和水热时间下制备了TiO2/电气石复合材料。采用了XRD、SEM、TEM、荧光光谱、UV-Vis DRS、第一性原理及光催化等多种测试方法对所制备的样品进行表征分析,发现由于电气石表面极性的存在,对TiO2纳米颗粒起到了强烈的吸附和舒展作用,不仅阻止了TiO2纳米颗粒的团聚,同时也抑制了TiO2所激发出的电子与空穴复合,降低了TiO2的禁带宽度,在很大程度上提高了TiO2对罗丹明B的降解率。在水热温度为160℃,水热时间为4 h的条件下,对罗丹明B的降解率达到了99.4%。
[1]Piril M,Saouabe M,Ojala S,et al.Top.Catal.,2015,58(14/15/16/17):1085-1099
[2]Zhou G,Li W,Wang Z,et al.Int.J.Environ.Sci.Technol.,2015,12(12):3735-3744
[3]Rubio-Clemente A,Chica E,Peuela G A.Water Air Soil Pollut.,2015,226(3):62
[4]Zhang J,Chen S,Wang X.Water Air Soil Pollut.,2015,226(9):315
[5]Wei Z,Spinney R,Ke R,et al.Environ.Chem.Lett.,2016,14(2):163-182
[6]Yu J,Low J,Xiao W,et al.J.Am.Chem.Soc.,2014,136(25):8839-8842
[7]Rashid J,Barakat M A,Ruzmanova Y,et al.Environ.Sci.Pollut.Res.,2015,22(4):3149-3157.
[8]Wang F,Cao K,Wu Y,et al.J.Mol.Model.,2015,21(3):48
[9]Gunasekar V,Ponnusami V.J.Sol-Gel Sci.Technol.,2015,74(1):84-93
[10]Fujishima A,Honda K.Nature,1972,238(5358):37-38
[11]SONGHai-Yan(宋海燕).Thesisfor the Doctorateof University of Science and Technology of China(中国科技大学博士论文).2006.
[12]Ozawa M,Matsui H,Suzuki S.Powder Metall.Met.Ceram.,2016,54(11/12):746-749
[13]Xia H Y,He G Q,Min Y L,et al.J.Mater.Sci.-Mater.Electron.,2015,26(5):3357-3363
[14]Okuno T,Kawamura G,Muto H,et al.J.Sol-Gel Sci.Technol.,2015,74(3):748-755
[15]Mert B D.Acta Metall.Sinica.(Engl.Lett.),2015,28(7):858-865
[16]Shet A,Shetty V.Environ.Sci.Pollut.Res.,2016,23(20):20055-20064
[17]Antonopoulou M,Konstantinou I.Environ.Sci.Pollut.Res.,2015,22(12):9438-944
[18]CHEN Gang(陈刚),MI Can-Gen(米灿根),LÜ Hong(吕洪),et al.Chem.J Chinese Universities(高等学校化学学报),2016,37(1):126-133
[19]ZHU Jie-Lian(朱洁莲),XIA Xiao-Feng(夏晓峰),ZHU Shan-Shan(朱珊珊),et al.Chem.J Chinese Universities(高等学校化学学报),2016,37(10):1833-1839
[20]WU Rui-Hua(吴瑞华),TANG Yun-Hui(汤晓晖),ZHANG Xiao-Hui(张晓晖).Acta Petrologica Et Mineralogica(岩石矿物学杂志),2001,20(4):474-476
[21]Li N,Zhang J,Wang C,et al.J.Mater.Sci.,2017,52(12):6937-6949
[22]Bian X,Ji R.Desalin.Water Treat.,2016,57(41):19292-19300
[23]Liu L B,He D L,Zhao D M.Adv.Mater.,2012,399:1337-1341
[24]Meng J,Liang J,Ding Y,et al.J.Rare Earths,2004,22(s3):101-105
[25]WANG Yu-Jie(王玉洁),XU Shuang-Ying(许双英),ZHAO Yi-Xing(赵以辛),et al.Journal of Jilin University:Earth Science Edition(吉林大学学报:地球科学版),2012,42(2):514-518
[26]WAN Xin(万鑫),TANGChao(唐潮),FANGMing-Hao(房明浩),et al.Bull.Chin.Ceram.Soc.(硅酸盐通报),2014,33(8):1880-1884
[27]LIANG Jin-Sheng(梁金生),LIANG Guang-Chuan(梁广川),QI Hong-Fei(祁洪飞),et al.J.Mater.Sci.Technol.(中国稀土学报),2003,21(2):241-243
[28]YAO Chao(姚超),YANG Guang(杨光),LIN Xi-Ping(林 西平),et al.Chinese J.Inorg.Chem.(无机化学学报),2005,21(12):1821-1826
[29]López R,Gómez R.J.Sol-Gel Sci.Technol.,2012,61(1):1-7[30]Choudhury B,Bayan S,Choudhury A,et al.J.Colloid Interface Sci.,2016,465:1-10
[31]Tosoni S,Lamiel-Garcia O,Hevia D F,et al.J.Phys.Chem.C,2012,116(23):12738-12746
Photocatalytic Mechanism of TiO2/schorl Composite by Different Hydrothermal Conditions
The TiO2/schorl(3%)were prepared by a hydrothermal method in order to solve the defects easy agglomeration and wide band gap of TiO2.The influences of the hydrothermal time (2~10 h)and the hydrothermal temperature(120~200 ℃)on photocatalytic activity of TiO2/schorl(3%)were studied.It was found that the degradation efficiency to rhodamine Bimproved from 60%(TiO2)to 99.4%by composited with schorl.The schorl shows spontaneous polarization electric field,which can effectively reduce the recombination rate of photogenerated electrons and holes of TiO2.The sample TiO2/schorl(3%)synthesized at 160℃for 4 h shows the highest photocatalytic performance.These results indicate that the material with spontaneous polarization can effectively improve the photocatalytic properties of TiO2.
hydrothermal method;TiO2/schorl;Rhodamine B;photocatalytic;First-principles
P578.953
A
1001-4861(2017)10-1789-08
10.11862/CJIC.2017.219
QI Shu-Yan*WU Chao WANG De-Peng XU Huan-Yan
(College of Materials Science&Engineering,Harbin Polytechnic University,Harbin 150080)
2017-05-24。收修改稿日期:2017-08-25。国家自然科学青年基金项目(No.51404083)资助项目。*
。 E-mail:qishuyan10@163.com
