罕见性反转综合征三例微阵列基因组杂交检测结果分析
2017-11-01欧明林龚蔚蔚荆环云张若菡陈洁晶眭维国
欧明林,曾 君,龚蔚蔚,薛 雯,荆环云,张若菡,陈洁晶,甘 晴,戴 勇,眭维国
·临床研究·
罕见性反转综合征三例微阵列基因组杂交检测结果分析
欧明林,曾 君,龚蔚蔚,薛 雯,荆环云,张若菡,陈洁晶,甘 晴,戴 勇,眭维国
目的探讨微阵列基因组杂交检测在性反转综合征诊断中的价值及临床意义。方法收集2010—2015年来我院中心实验室进行遗传咨询患者的临床资料与外周血标本,采用G显带技术分析患者染色体核型,并对确诊为性反转综合征的患者进行微阵列基因组杂交检测,分析患者基因组拷贝数变异(copy number variations, CNVs)变化特点。结果同期在本实验室行遗传咨询者共9946例,其中3例(0.03%)诊断为性反转综合征。其中G显带染色体核型分析确诊46,XX男性性反转综合征2例,46,XY女性性反转综合征1例。微阵列基因组杂交检测发现3例均存在亚显微CNVs异常变化,其中1例46,XX男性性反转综合征患者性染色体Yp11.31存在扩增(SRY阳性);另2例均未检测到SRY基因(SRY阴性)。结论桂林地区遗传咨询人群中性反转综合征患者相对罕见,微阵列基因组杂交技术为CNVs检测提供了一种高效的方法,为性反转综合征病因学筛查及分类提供了新的途径。
性逆转,性腺;细胞遗传学分析;核型分析;基因拷贝数变异
目前,人类性别决定的关键因素尚未完全阐明,现有研究报道普遍认为Y染色体,特别是Y染色体中的睾丸决定因子(testis deter- mining factor, TDF)可以引导性腺原基发育成熟为睾丸,在人类性别决定中扮演着关键的角色[1]。性反转综合征是一类染色体核型与性腺不一致的罕见疾病,可以细分为46,XX男性性反转综合征和46,XY女性性反转综合征[2]。性反转综合征临床以男性假两性畸形和女性假两性畸形两种表现较为常见,患者体内一般只有1种生殖腺[3]。根据Y染色体SRY基因特异性序列的存在与否,在分子水平上此病又分为SRY阳性和阴性两类[4]。国外流行病学研究显示,46,XX男性和46,XY女性性反转综合征的发病率分别约为1/20 000和1/100 000,而我国尚缺乏本病的流行病学相关报道[5]。本研究统计近5年来我院进行遗传咨询的性反转综合征患者,并应用微阵列芯片技术对患者进行基因组拷贝数变异(copy number variations, CNVs)分析,以期为本病的分类、诊断和发病机制研究提供新的信息。
1 资料与方法
1.1一般资料 收集2010—2015年来我院中心实验室行遗传咨询患者资料和外周血标本9946例,其中发现性反转综合征3例,发病率0.03%。
1.2遗传学检测及分析
1.2.1G显带核型分析:取经肝素抗凝处理的患者外周血标本,利用细胞培养基(广州拜迪生物医药有限公司生产)增殖培养淋巴细胞70 h,加入适量秋水仙素终止细胞分裂,于第72小时收获细胞,常规制片及烘干后利用2%胰酶消化,Giemsa染色显带,最后应用光学显微镜和Imager.Z2蔡司染色体自动扫描仪及分析系统进行核型分析。其中每例标本计数细胞分裂象30个,详细分析染色体核型3~5个,存在核型异常标本适当增加染色体计数及核型分析量。
1.2.2微阵列基因组杂交:选取G显带染色体核型性别与社会性别不一致的患者临床资料及外周血标本,应用QIAamp DNA Blood Mini Kit(美国Qiagen公司生产)提取患者基因组DNA并稀释至50 ng/μl;每例标本取DNA 250 ng,应用Affymetrix CytoScan 750K Array和Affymetrix GCS 3000D V.2微阵列基因芯片分析系统(美国Affymetrix公司生产)进行分析,实验步骤主要参考试剂盒说明书进行,并根据实际情况进行适当改进。实验主要过程包括:片段化DNA样本,全基因组扩增,产物纯化及质量检测,杂交,洗脱,染色和扫描。芯片扫描仪分析所得数据由Chromosome Analysis Suite 3.1系统(美国Affymetrix公司生产)进行分析,并利用国际公共良性CNVs数据库(DGVs)和国际公共病理性CNVs数据库(DECIPHER)对结果进行过滤,获得潜在的病理性CNVs。
2 结果
2.1临床特征 经G显带染色体核型分析发现46,XX男性性反转综合征2例,46,XY女性性反转综合征1例。3例主要临床表现及性激素水平见表1、表2。

表1 3例性反转综合征临床表现
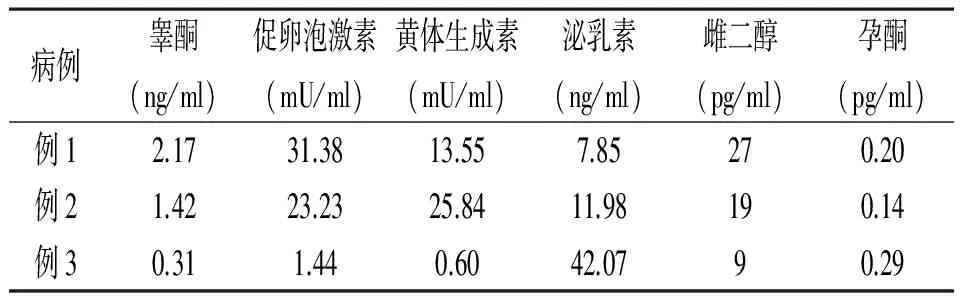
表2 3例性反转综合征性激素水平
2.2微阵列基因组杂交结果 1例46,XX男性性反转综合征患者为SRY基因阳性,另1例46,XX男性和1例46,XY女性性反转综合征患者均为SRY基因阴性。3例患者在不同的染色体区带均存在相对较大片段(Marker Count>50)的潜在病理性CNVs,见表3和图1。
3 讨论
性反转综合征是一类罕见的性腺发育异常相关的染色体病,目前人们对此病的了解仍十分有限。性反转综合征中以46,XY女性患者较为罕见,国际上共发现46,XX男性患者仅数百例[6-7]。在近5年的遗传咨询以及染色体核型分析工作中,我们累计发现本病患者仅3例,发病率与国外文献报道相近。在临床表现方面,由于大多数患者在出生时具有正常表型,仅15%的患者会出现尿道下裂、隐睾和严重的生殖器畸形病征,因此大多数患者是在青春期后由于性腺发育不全、男性乳房异常发育和不育,进行遗传咨询筛查从而确诊[8]。国外一些研究认为性反转综合征发病率(1/20 000~1/25 000)可能被严重低估,导致一部分患者可能在不孕不育病因筛查中被漏诊[9]。本组1例表现为相对正常男性表型,因不育进行核型分析从而确诊;另2例因为生殖器异常和生长发育异常进行核型分析从而确诊。因此,根据相关诊疗指南针对严重无精子症、少弱精子症和生长发育异常患者,进行染色体核型分析在本病诊断中具有重要的临床意义[10]。
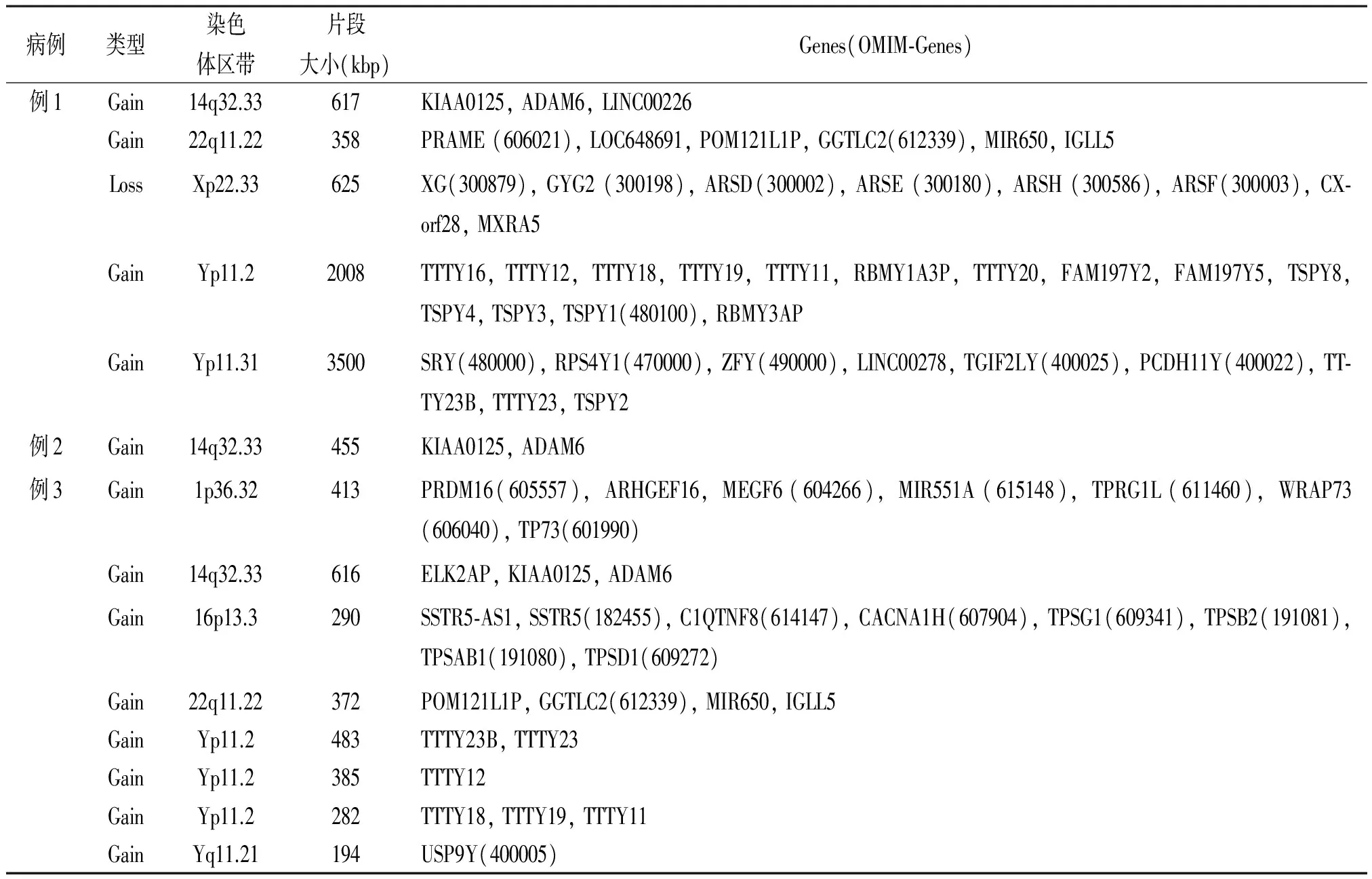
表3 3例性反转综合征染色体相对较大片段的基因组拷贝数变化情况
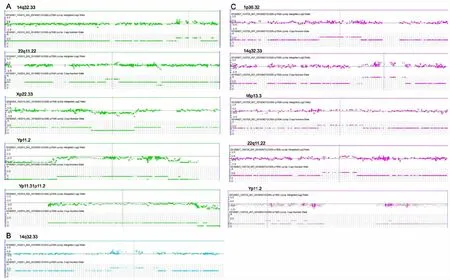

图1 3例性反转综合征微阵列基因组杂交图
性反转综合征的发病机制目前尚未完全阐明,现普遍认为本病与Y染色体缺失,特别是Y染色体特定区带缺失存在密切的关系[9]。一些研究表明,Xp-Yp易位导致的染色体异常是本病发病的最主要原因,因为在其父系生殖细胞减数分裂异常而产生的包含SRY基因的X型精子,与正常母系卵子结合很可能会导致子代异常受精卵产生[11]。在本研究中,G显带核型分析并未发现这些患者的X染色体长臂存在明显的异常,也未发现与Y染色体可能相关的标记染色体,该结果可能与染色体显带的分辨率较低,以及易位片段大小有关;为了进一步明确这些患者是否存在Y染色体DNA序列,我们利用微阵列基因组杂交技术对患者基因组DNA序列的拷贝数进行了分析,结果发现例1和例3存在部分Y染色体DNA序列,例2不存在,结果表明存在Y染色体DNA序列的性反转综合征患者与其父系生殖细胞Xp-Yp易位相关可能性较大,而不存在Y染色体DNA序列的患者致病原因则可能与Xp-Yp易位无关。SRY基因为雄性的性别决定关键基因,该基因只有一个外显子,无内含子,46,XX男性性反转综合征患者SRY阳性和46,XY女性性反转综合征患者SRY阴性较为常见[12]。本研究中,两例未检测到Y染色体者为SRY阴性,余1例检测到Yp11.31存在扩增,为SRY阳性患者,基因组杂交分析进一步确定了G显带核型分析难以明确的疾病亚型;SRY基因缺失可能在例2和例3患者的性发育异常过程中起关键作用。
一些研究发现,性染色体遗传物质DNA的突变、重复或缺失在性反转综合征患者基因组内比较常见[13-15],其临床表现较高的异质性以及病因的不确定性可能与染色体异常有关。本研究微阵列基因组杂交分析发现了一些G显带核型分析无法发现的性染色体亚显微CNVs。例1性染色体Xp22.33存在缺失涉及8个基因,其中6个基因存在于孟德尔遗传数据库中,可能与生物过程蛋白质的合成以及基因表达调控存在密切的关系。此外,该患者Yp11.2与Yp11.31存在多个片段的重复,涉及SRY和ZFY等与性别决定密切相关的基因。与例1类似,例3性染色体Yq11.21-2染色体存在多个片段重复,尽管片段相对较小(<500 kbp),但涉及7个基因,其中6个基因为睾丸特异转录蛋白,有趣的是它们很可能是1976年Tieplolo等发现的无精子因子(azoospermia factor, AZF)成员,AZF缺失一直被认为是无精子症致病的关键原因之一,然而AZF重复是否与无精子症有关仍未明确[16]。潜在具有病理性作用的亚显微CNVs不但存在于性反转综合征患者X和Y性染色体上,而且也见于常染色体上,并且其片段大小不一,涉及多个基因。对相关基因进行功能分析发现,不少基因与各种已知孟德尔遗传病存在一些联系,该结果表明性反转综合征可能仅代表一大类疾病,其进一步分类仍有待根据分子细胞遗传检测结果确定。但是,人类基因组中存在的CNVs多为非病理性,本研究中发现CNVs的临床意义尚有待更多研究证实。此外,微阵列基因组杂交技术也存在一些明显的不足,比如该技术只能针对包括重复和缺失的CNVs进行检测,而无法对性反转综合征致病相关基因的突变、平衡易位、倒位等因素进行检测。
综上所述,性反转综合征是一类相对罕见的性发育异常疾病,此病临床表现较高的异质性以及发病机制的多样性给临床诊疗带来了挑战,针对严重少精子症、无精子症和外生殖器畸形患者进行染色体核型分析,有利于本病的确诊。尽管不少亚显微CNVs的致病机制尚未被明确,在传统核型分析的基础上进行微阵列基因组杂交分析可以获得更详细的患者核型重复与缺失异常信息,这些信息可能在明确疾病分类、指导临床合理治疗、促进患者第二性征发育及避免性腺恶变相关疾病的发生等方面具有重要的应用前景。
[1] 蔡志明.Y染色体及其微缺失与男性不育:过去,现在与将来[J].中华男科学杂志,2010(5):387-394.
[2] 贺静,唐新华,朱宝生,等.46,XX男性综合征的遗传学诊断和临床分析[J].中华男科学杂志,2011,17(1):68-72.
[3] Vorona E, Zitzmann M, Gromoll J,etal. Clinical, endocrinological, and epigenetic features of the 46,XX male syndrome, compared with 47,XXY Klinefelter patients[J].J Clin Endocrinol Metab, 2007,92(9):3458-3465.
[4] Boucekkine C, Toublanc J E, Abbas N,etal. Clinical and anatomical spectrum in XX sex reversed patients. Relationship to the presence of Y specific DNA-sequences[J].Clin Endocrinol (Oxf), 1994,40(6):733-742.
[5] Majzoub A, Arafa M, Starks C,etal. 46 XX karyotype during male fertility evaluation; case series and literature review[J].Asian J Androl, 2017,19(2):168-172.
[6] Akinsal E C, Baydilli N, Demirtas A,etal. Ten cases with 46,XX testicular disorder of sex development: single center experience[J].Int Braz J Urol, 2017,6:43.
[7] Majzoub A, Arafa M, Starks C,etal. 46 XX karyotype during male fertility evaluation; case series and literature review[J].Asian J Androl, 2017,19(2):168-172.
[8] Gao X, Chen G, Huang J,etal. Clinical, cytogenetic, and molecular analysis with 46,XX male sex reversal syndrome: case reports[J].J Assist Reprod Genet, 2013,30(3):431-435.
[9] Ryan N A, Akbar S. A case report of an incidental finding of a 46,XX, SRY-negative male with masculine phenotype during standard fertility workup with review of the literature and proposed immediate and long-term management guidance[J].Fertil Steril, 2013,99(5):1273-1276.
[10] Gameiro S, Boivin J, Peronace L,etal. Why do patients discontinue fertility treatment? A systematic review of reasons and predictors of discontinuation in fertility treatment[J].Hum Reprod Update, 2012,18(6):652-669.
[11] Magenis R E, Webb M J, McKean R S,etal. Translocation(X;Y)(p22.33;p11.2) in XX males: etiology of male phenotype[J].Hum Genet, 1982,62(3):271-276.
[12] 滕奔琦,王青青,章钧,等.性发育异常患者的细胞分子遗传学分析[J].中国病理生理杂志,2012,28(10):1851-1855.
[13] Queralt R, Madrigal I, Vallecillos M A,etal. Atypical XX male with the SRY gene located at the long arm of chromosome 1 and a 1qter microdeletion[J].Am J Med Genet A, 2008,146A(10):1335-1340.
[14] 武桂芳,金瑞林,贾和平,等.46XY女性性反转综合征一例sry基因的错义突变分析[J].解放军医药杂志,2011,23(1):4-6,后插一.
[15] Harrison S M, Granberg C F, Keays M,etal. DNA copy number variations in patients with 46,XY disorders of sex development[J].J Urol, 2014,192(6):1801-1806.
[16] Vogt P H. Human chromosome deletions in Yq11, AZF candidate genes and male infertility: history and update[J].Mol Hum Reprod, 1998,4(8):739-744.
ResultsAnalysisofDetectionofMicroarrayGenomicHybridizationfor3PatientswithRareSexReversalSyndromes
OU Ming-lin1, ZENG Jun2, GONG Wei-wei1, XUE Wen1, JING Huan-yun1, ZHANG Ruo-han1, CHEN Jie-jing1, GAN Qing1, DAI Yong2, SUI Wei-guo1
(1. Central laboratory Guangxi Key laboratory of Metabolic Diseases Research, 181 Hospital of PLA, Guilin, Guangxi Zhuang Nationality Autonomous Region 541002, China; 2. Clinical Medical Research Center, Shenzhen People's Hospital, Shenzhen, Guangdong 518020, China)
ObjectiveTo analyze values and clinical significances of detection of microarray genomic hybridization in diagnosis of sex reversal syndromes.MethodsClinical data and peripheral blood samples of patients with genetic counseling from 2010 to 2015 were collected. G-banding technique was used to analyze the chromosomal karyotypes. Detection of microarray genomic hybridization was performed for patients confirmed sex reversal syndromes, and characteristics changes in patients were analyzed.ResultsThere were 9946 patients with genetic counseling at the same period, and 3 patients (0.03%) were confirmed as having sex reversal syndromes. G band karyotype analysis showed that there were 2 male patients with 46, XX female sex reversal syndrome and 1patient with 46, XY sex reversal syndrome. Detection of microarray genomic hybridization showed that 3 patients had micro sub CNVs abnormal changes, which included that sex chromosome Yp11.31 of 1 patient with 46, XX male sex reversal syndrome had amplification (SRY-positive), while other 2 patients did not find SRY gene (SRY-negative).ConclusionThe sex reversal syndrome in genetic counseling population in Guilin is relatively rare. Microarray genomic hybridization provides an effective method for CNVs detection. It is a new way for the etiological diagnosis and classification of sex reversal syndromes.
Sexual reversal, gonad; Cytogenetic analysis; Karyotype analysis; Gene copy number variations
广西科技计划项目(桂科攻1598012-25)
541002 广西壮族自治区 桂林,解放军181医院中心实验室 广西代谢性疾病研究重点实验室(欧明林、龚蔚蔚、薛雯、荆环云、张若菡、陈洁晶、甘晴、眭维国);518020 广东 深圳,深圳市人民医院临床医学研究中心(曾君、戴勇)
眭维国,E-mail:suiwg@163.com
R698.2
A
1002-3429(2017)10-0076-05
10.3969/j.issn.1002-3429.2017.10.026
2017-06-26 修回时间:2017-07-23)
