连续反应釜中 γ-十一内酯合成宏观动力学研究
2017-11-01宋云飞许保云翟金国
宋云飞,许保云,翟金国,艾 波
上海化工研究院精细化工研究所,上海 200062
连续反应釜中γ-十一内酯合成宏观动力学研究
宋云飞,许保云,翟金国,艾 波
上海化工研究院精细化工研究所,上海 200062

先加入25 mL正辛醇,预热到反应温度后同时开启进料和出料。进料混合液的物质的量比为正辛醇:丙烯酸:DTBP为2:1:0.1。实验时釜内温度波动控制为±1 ℃;采用Agilent 7890B型气相色谱仪检测出料口反应物系,面积归一法进行含量计算。反应动力学实验装置见图1。
2 反应动力学方程
自由基加成法合成γ-十一内酯兼具自由基反应和酯化反应的特点,反应速度较快,主反应过程含有酯化反应的可逆步骤。将反应过程进行合理简化,主反应式和副反应式如下所示:
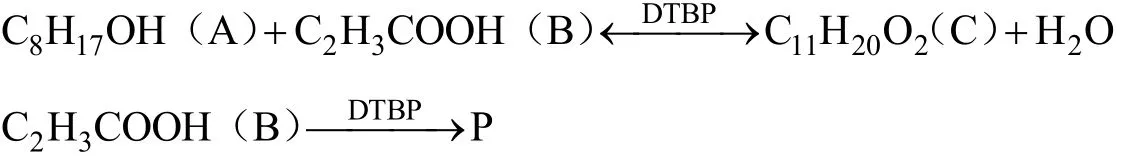
反应过程中正辛醇大大过量,反应器中正辛醇浓度近似为常数,反应速率对正辛醇可近似为零级[9];产物水与其它液体不互溶。因此建立幂函数型主反应[10]和副反应[8,11]动力学模型如下:
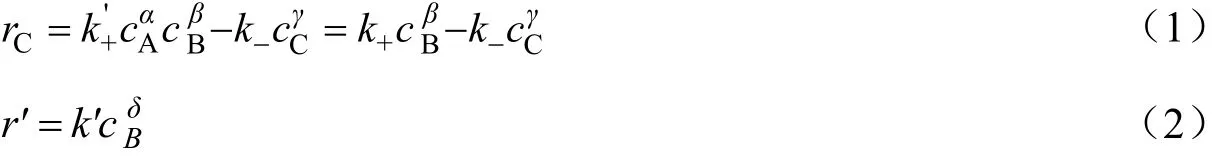
3 结果与讨论
3.1 不同反应条件下γ-十一内合成反应实验考察
不同反应温度下通过调节进料流量控制不同反应时间,测定反应釜出口流股的组成,结果见图2。从图2可见,同一反应温度,产物γ-十一内酯浓度随丙烯酸进料流量的减小而增大,说明降低反应物浓度有利于提高产物收率,提高反应选择性;相同反应物进料流量,γ-十一内酯浓度随温度升高而增大,说明提高反应温度有利于提高产物收率,提高反应选择性。

图2 不同温度下进料流量对丙烯酸和γ-十一内酯浓度的影响Fig.2 The acrylic-acid and γ-undecalactone concentrations under different feed rates and different temperatures
3.2 动力学参数确定
采用非线性最小二乘法用反应动力学方程对所得的实验数据进行参数拟合,得到了各组分的反应级数为:β=0.9,γ=0.6,δ=2。即:

结果所示副反应对丙烯酸的反应级数为2,表明在该反应过程中,副反应对反应物的浓度更敏感,反应物浓度提高不利于主反应的生成。不同温度下的反应速率常数见表1。

表1 不同反应温度下的速率常数Table 1 Rate constants at different temperatures
用Arrhenius方程的对数形式对表1速率常数进行拟合,结果见图3。可得到三个速率常数的指前因子和活化能分别为:k+,0=7.166×108min-1,E1= 90.623 kJ/mol;k-,0=2.842×106mol0.4/(L0.4·min),E-= 86.964 kJ/mol;k0’=1.400×109mol-1/(L-1·min),E’= 71.592 kJ/mol。一定温度下活化能E越大,反应速率随温度的变化越显著,即提高相同的温度,生成γ-十一内酯的反应速率增加最大,所以提高反应温度有利于主反应的进行。

图3 反应速率常数随温度的变化关系Fig.3 Relationship between reaction rate constant and temperature
3.3 动力学模型检验
为了检验动力学模型的适用性,对模型进行统计检验,结果见表2。

表2 动力学模型的统计检验Table 2 Statistical tests of the kinetic models
表2中下标M代表主反应,下标S代表副反应。其中n为实验次数,m为参数个数,ρ2为决定性指标,F为回归均方与模型残差均方和之比[12]:
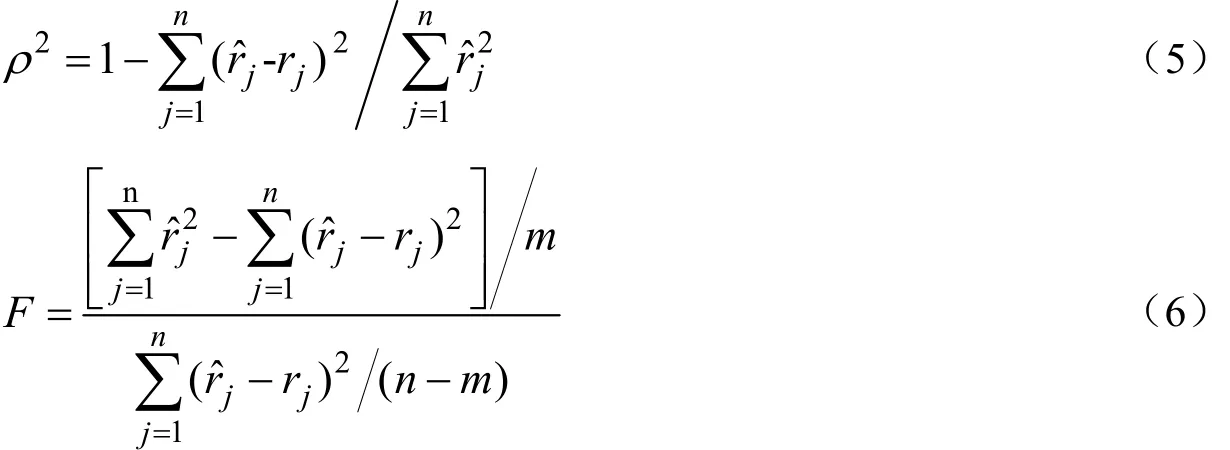
F(0.05)为显著水平α为0.05的相应自由度下的F表值。对非线性方程进行F检验时,需给予安全系数,一般取10,即:F> 10Fα,则认为模型是显著的[11]。表2中对主反应和副反应动力学模型的统计检验结果显示,两个方程:ρ2>0.9,F> 10Fα,因此可认为得到的动力学参数可靠。
用残差标准差(δ*)对实验值和拟合值进行残差检验[13],结果见图 4。根据残差分析,残差随独立变量随机分布,实验点的标准化残差对称分布在零坐标附近,且落在(-2, 2)内的概率大于等于0.95,说明模型的拟合效果较好。

图4 反应实验值与拟合值的残差Fig.4 Residual plots of real values and fitted values
4 结 论
基于为满足工业反应器设计需要的前提下,考察了正辛醇大大过量的情况下,正辛醇和丙烯酸反应合成γ-十一内酯的反应过程。建立了丙烯酸转化为γ-十一内酯的可逆反应动力学,以及同时并存的丙烯酸转化成其他副产物的动力学。
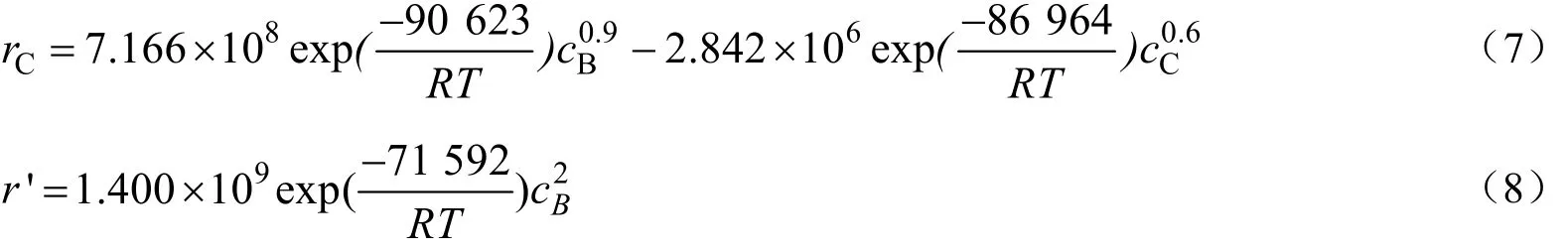
研究结果表明,升高反应温度,降低丙烯酸浓度有利于增加γ-十一内酯收率。由于γ-十一内酯是热敏性物质,生产中应控制反应温度在175 ℃左右,低于γ-十一内酯的分解温度;而降低丙烯酸浓度会影响反应速率,因此实际生产中需综合考虑成本和效益问题。
[1]刘 伟.γ-十一内酯合成工艺改进 [J]. 精细石油化工, 1998, 1(1):22-24.Liu Wei. The advanced technical study on synthesis of Undecan-4-olide [J]. Speciality Petrochemicals, 1998, 1(1):22-24.
[2]冯佳佳.γ-十一内酯的合成与提纯研究 [D]. 天津: 天津大学, 2007.
[3]周作良, 俞忠华.γ-十一内酯的合成研究 [J]. 江西科学, 2015, 33(4):475-479.Zhou Zuoliang. Study on Synthesis of γ-Undecalactone [J]. Jiangxi Science, 2015, 33(4):475-479.
[4]丁宝维. 桃醛合成工艺优化及其动力学研究 [D]. 天津: 天津大学, 2009.
[5]秦 榛.γ-十一内酯合成过程特征及反应动力学研究 [D]. 上海: 华东理工大学, 2014.
[6]张富捐, 王经亚, 张翔宇.γ-十一内酯的合成研究 [J]. 许昌学院学报, 2005, 24 (2):121-123.Zhang Fujuan, WangYajing, Zhang Xiangyu. Study on synthesis ofγ-undecalactone [J]. Journal of Xuchang University, 2005, 24 (2):121-123.
[7]刘朝明. 1800吨/年桃醛生产工艺中分离工段的改进与优化设 [D]. 安徽: 合肥工业大学, 2014.
[8]Cutie S S, Smith P B, Henton D E, et al. Acrylic acid polymerization kinetics [J]. J Polym Sci: Part B: Poly Phys, 1997, 35:2029-2047.
[9]郭汉贤. 应用化工动力学 [M]. 北京: 化学工业出版社, 2003:35-36.
[10]Xu B Y, Zheng X M, Zhang W J, et al. Kinetics of esterification of 2-keto-L-gulonic acid with methanol catalyzed by cation exchange resin [J]. Transactions of Tianjin University, 2008, 14(1):37-42.
[11]Qiu L, Wang K, Zhu S, et al. Kinetics study of acrylic acid polymerization with a microreactor platform [J]. Chem Eng J, 2016, 284:233-239.
[12]任海伦, 蔡旺锋, 张向京, 等. NO2氧化二甲基硫醚动力学研究 [J]. 化学反应工程与工艺, 2005, 21(5):451-455.Ren Hailun, Cai Wangfeng, Zhang Xiaojing, et al. Kinetics of oxidation of dimethyl sulfide with nitrogen dioxide [J]. Chemical Reaction Engineering and Technology, 2005, 21(5):451-455.
[13]唐启义. DPS数据处理系统第一卷 [M]. 北京: 科学出版社, 2013:25-29.
Study on Macrokinetics ofγ-Undecalactone Synthesis in a Continuous Reactor
Song Yunfei, Xu Baoyun, Zhai Jinguo, Ai Bo
Shanghai Research Institute of Chemical Industy, Shanghai 200062, China
Macrokinetics of reversible main reaction and acrylic polymerization side reaction were studied and the model was established to provide the kinetic basis for improving the reaction selectivity.Experiments were carried out in a continuously operated kettle reactor and the reaction rates were measured at different temperatures and different feed rates. The parameters of the model were fitted with experimental data to obtain the main reaction and the side reaction kinetics parameters. Statistical tests and residual analysis showed that the established kinetic model was reliable and can be used to describe the reaction macroscopically. The results showed that increasing the reaction temperature and decreasing the concentration of acrylic acid were beneficial to improve the selectivity of the main reaction and improve the yield ofγ-undecalactone.
γ-undecalactone; acrylic-acid; reversible reaction; feed flow rate; macrokinetics
1001—7631 ( 2017 ) 03—0279—05
10.11730/j.issn.1001-7631.2017.03.0279.05
