小鼠小肠类器官体外培养体系的建立与应用
2017-11-01万光升张新艳
万光升,张新艳
(1. 复旦大学附属妇产科医院研究所,上海 200011; 2. 上海中医药大学附属普陀医院,上海 200062)
研究报告
小鼠小肠类器官体外培养体系的建立与应用
万光升2,张新艳1*
(1. 复旦大学附属妇产科医院研究所,上海 200011; 2. 上海中医药大学附属普陀医院,上海 200062)
目的建立一种研究肠上皮细胞的体外模型—小肠类器官培养体系,探索其相关病理检测技术方法,为肠道相关疾病的体外研究提供便利平台。方法将小鼠肠上皮隐窝分离并培养成小肠类器官,体外模拟肠上皮的生长发育过程。通过制作石蜡切片,探索应用免疫组化技术以及基于基质胶中类器官三维水平免疫荧光技术对相应的增殖与分化信号进行检测。结果探索并建立了小肠类器官体外培养体系,应用石蜡切片免疫组化技术与三维水平免疫荧光技术能够准确检测小肠上皮结构的生长发育状态。结论小肠类器官体外培养体系的建立与免疫检测技术的应用,将逐渐使其成为人们研究肠道相关疾病最为有利的技术手段。
小肠类器官;石蜡切片;免疫组化;免疫荧光;小鼠
肠上皮形成了一种天然屏障,将肠的腔体与免疫系统分隔开来[1]。上皮层向固有层内陷形成无数隐窝,隐窝中存在着干细胞群维持着上皮细胞的更新[2,3]。干细胞能够增殖分化为行使不同功能的小肠终末分化细胞:肠吸收细胞、杯状细胞、内分泌细胞以及潘氏细胞等[4],这些细胞不仅是维持小肠稳态和小肠上皮的损伤修复所必需的,而且对于肠炎的发病机理也十分重要[5]。鉴于体内研究肠道疾病的空间局限性,2009年Hans Clever实验室建立了一种新型的肠上皮细胞培养方法—小肠类器官培养[6],体外模拟肠上皮的增殖分化过程。这一方法的建立既实现了肠上皮长期体外培养又可以维持肠上皮细胞原始分化能力,该技术已经逐渐被应用于干细胞、疾病模型以及再生药物等相关研究[7]。然而,国内极少数实验室能够熟练掌握小肠类器官体外培养技术,其应用及推广更是止步不前。本研究旨在建立稳定的小鼠小肠类器官培养体系的基础上,探索小肠类器官切片的制作及免疫染色检测方法,为肠道相关疾病的基础研究提供便利的体外研究平台。
1 材料与方法
1.1实验动物
6~8周龄SPF级C57BL/6的小鼠6只,体重约25 g左右,雌雄不限,由华东师范大学SPF级实验动物中心提供【SCXK(沪)2016-0004】,并饲养于华东师范大学SPF级实验动物中心【SYXK(沪)2015-0011】,动物实验符合华东师范大学动物伦理委员会的规定并被授权(审批号:AR2013/12011)。
1.2实验试剂
1.2.1 小肠类器官的分离与培养
加有青霉素和链霉素双抗P/S的磷酸盐缓冲液(PBS,Sigma公司)、小肠隐窝消化液:5 mM乙二胺四乙酸(EDTA,Gibco公司)、基质胶(Matrigel,BD 公司)、类器官培养基:1× N2 Supplement(Life-Invitrogen-Gibco)、1% glutamax(Life-Invitrogen-Gibco)、1 μmol/LN-acetylcysteine(Sigma)、1× B27 serum-free supplement(Life-Invitrogen-Gibco)、0.1% penicillin/streptomycin(Roche)、0.1 μg/μL EGF(Life-Invitrogen-GIBCO)、1 μg/μL Human R-spondin 1(PeproTech)、0.1 μg/μL Murine Noggin(PeproTech)、基础培养基为DMEM/F12(Life-Invitrogen-GIBCO)。
1.2.2 小肠类器官石蜡切片的制作及阿幸兰、免疫组织化学染色
4%多聚甲醛(PFA,上海润捷化学有限公司)、各浓度梯度乙醇(上海凌峰化学试剂有限公司)、二甲苯(上海润捷化学有限公司)、液体蜡(上海润捷化学有限公司)、双氧水(H2O2,上海润捷化学有限公司)、苏木精染液(Selleck中国)、阿幸兰-核快红染液(鼎国生物)、磷酸盐缓冲液(PBS,Sigma公司)、PBST(PBS 加0.2% Triton X-100,上海生工生物有限公司)、柠檬酸抗原修复液(上海生工生物有限公司)、抗体稀释液(北京诺博莱德科技有限公司)、中性树脂胶(鼎国生物)、免疫组化试剂盒(包含封闭液、二抗、显色液、信号放大素HRP,Vector Labs)、增殖标记蛋白Brdu抗体(1∶500,Sigma公司)、增殖标记蛋白Ki67抗体(1∶3000,NeoMarker公司)、杯状细胞标记蛋白Muc2抗体(1∶50,Immunostar公司)、潘氏细胞特异标记蛋白Lysozyme抗体(1∶1500,Dako公司)。
1.2.3 小肠类器官三维水平免疫荧光技术
磷酸盐缓冲液(PBS,Sigma公司)、4%多聚甲醛(PFA,上海润捷化学有限公司)、PBST(PBS 加0.2% Triton X-100,上海生工生物有限公司)、封闭液(Vector Labs)、一抗(Ki67、Muc2、Lysozyme抗体同上)、荧光二抗(Cell Signal Technology公司)、DAPI(Roche公司)。
1.3实验方法
1.3.1 小肠类器官的分离与培养
将6~8周龄的小鼠安乐死,在75%乙醇中浸泡30 min,转移至超净工作台中,取其十二指肠、空肠、回肠各约5 cm,纵向剖开后用预冷的加有双抗P/S的PBS清洗数次。将洗净的小肠剪成5 mm左右的片段,转移至50 mL离心管,冰浴静置至肠片段沉底,小心弃掉上清,加入30 mL 5 mmol/L预冷的EDTA,冰上静置消化30 min,消化期间每隔5 min上下颠倒离心管数次,便于消化彻底。将上清换成预冷的PBS,用移液枪轻柔吹打沉淀混合液,并及时镜检,弃去含有大量绒毛片段的上清,直至视野中出现大量小肠隐窝开始收集上清。将带有小肠隐窝的上清用100 μmol/L细胞过滤器过滤到15 mL离心管,用70 μmol/L细胞过滤器再次过滤,4℃ 1200 r/min离心5 min后收集沉淀。用预冷的DMEM/F12基础培养基重悬沉淀,再用600 r/min离心收集,反复3~4次直至洗净多余的绒毛碎片;如果单细胞过多,可200 r/min离心2 min收集上清以去除单细胞。计数,以每微升基质胶(Matrigel)约10个隐窝的密度计算重悬隐窝的体积,用基质胶重悬隐窝,混合均匀后接种到预热的培养孔中央。将接种好的培养皿放置37℃培养箱中静置10 min,待基质胶凝固后添加预先配制好的类器官培养基。
1.3.2 小肠类器官石蜡切片的制作
将小肠类器官培养数天后,连同基质胶和培养基一起转移到1.5 mL离心管内,在4℃ 离心机中1600 r/min 离心3 min收集沉淀。用4%多聚甲醛(PFA)在4℃冰箱中固定样品6 h,将样品按乙醇浓度逐渐升高的顺序(50%、75%、85%、95%、100%、1∶1 乙醇/二甲苯、二甲苯Ⅰ、二甲苯Ⅱ)在室温下逐级脱水,每一浓度乙醇或二甲苯浸润组织20 min,最后65℃浸蜡过夜。石蜡包埋后,将样品切成约0.5 μm厚度的切片,烘片机上60℃烘烤2 h,收片常温保存。
1.3.3 阿幸兰(Alcian blue)染色
将小肠类器官石蜡切片置于二甲苯-乙醇-水梯度浓度中进行脱蜡:二甲苯Ⅰ(10 min)、二甲苯Ⅱ(10 min)、乙醇与二甲苯1∶1(10 min)、100%乙醇(5 min)、95%乙醇(3 min)、85%乙醇(3 min)、75%乙醇(3 min)、50%乙醇(3 min)。将蒸馏水浸润过的组织切片放入阿幸兰染液中染色20 min,自来水冲洗玻片数次,洗去多余的阿幸兰染液。将切片置于核快红染液中染色5 min,自来水冲去多余的染液,在蒸馏水中浸润5 min。组织切片经乙醇-二甲苯梯度脱水(与脱蜡步骤相反),最后中性树脂封片。
1.3.4 免疫组织化学染色
将小肠类器官石蜡切片置于二甲苯-乙醇-水梯度浓度中进行脱蜡(步骤同上),将200 mL抗原修复液倒入修复盒中,将玻片置于盒中,盖紧盖子放入100℃水浴箱中进行抗原修复20 min后,组织切片置于修复液中自然冷却。 将切片置于1%~3%的H2O2中避光反应10 min,用蒸馏水润洗2~3次,用PBS润洗3 min,用PBST润洗2次(5 分/次)。滴加封闭液覆盖组织,在湿盒内静置反应10 min, 后用50 μL一抗覆盖组织在湿盒内平放至4℃冰箱中进行一抗孵育10 h。PBST清洗玻片3次(5 分/次);滴加二抗,室温反应10 min,去掉二抗,用PBST清洗3次(5 分/次);滴加信号放大素(HRP)覆盖组织,在避光条件下反应10 min,用PBST清洗3次(5 分/次),加入显色液(每个玻片约50 μL)覆盖组织,显色时间视抗体灵敏度而定,用自来水清洗玻片3次。苏木精染色5 min,自来水清洗玻片3次,置于盐酸乙醇中去色5 s,蒸馏水清洗2次,在自来水中浸泡返蓝20 min,脱水封片。
1.3.5 三维水平免疫荧光技术
小肠类器官培养数天后弃去培养基,用常温的PBS在培养皿中润洗3~4次。用4%多聚甲醛(PFA)将样品在室温下固定30 min,PBS润洗3次(5 分/次),PBST常温处理2 h,弃去PBST,加入封闭液封闭样品30 min。吸掉封闭液,加入一抗室温反应2 h。PBST洗3次(10 分/次),室温条件下加入荧光二抗反应2 h。用PBST洗净二抗,DAPI染细胞核5 min,洗净DAPI后,在PBS浸润条件下,用倒置显微镜采集图片。
2 结果
2.1小肠类器官体外培养体系的建立
这种分离出的小肠隐窝在EGF、R-spondin 1、Noggin等基本生长因子存在的条件下可以持续生长。在接种后的24 h内,成活的隐窝首先变为囊状的圆球体(图1A)。圆球体逐渐增大,内部渐呈现类似肠腔的中空结构,充斥着各种细胞(图1B黑色箭头所示)。培养1.5 d左右,在圆球体外侧会有芽状的上皮结构突起,在突起的顶端可以观察到小肠终末分化细胞如潘氏细胞(图1C,黑色箭头指向潘氏细胞)。随着培养时间的增加,出芽数逐渐增多(图1D)。最后,一个成熟的芽可以逐渐从母体上脱落下来(图1E黑色箭头所示),形成一个新的类器官单位(图1F黑色箭头所示)。
2.2免疫染色技术在小肠类器官研究中的应用
将生长数天的小肠类器官制作成石蜡切片后,通过免疫组化技术可以清晰地检测到小肠类器官的增殖标记物Brdu和Ki67(图2A-B),说明代表着肠上皮结构的小肠类器官具有强烈的增殖能力,这种增殖能力在出芽的顶端尤其明显(图2B黑色箭头所示)。通过阿辛兰-核快红染色技术(Alcian blue)可以检测到肠上皮杯状细胞所在位置(图2C黑色箭头所示)。而通过免疫组化技术,溶菌酶(lysozyme)抗体标记了肠上皮另一种终末分化细胞,也是具有重要功能的潘氏细胞的存在(图2D黑色箭头所示)。增殖与分化细胞的检测说明体外培养的小肠类器官确实可以模拟肠上皮细胞的生长状态。
2.3免疫荧光技术在小肠类器官研究中的应用
基于小肠类器官在基质胶中的三维水平的生长,探索了应用于三维水平的免疫荧光技术。研究发现在类器官出芽的同时,各种终末分化细胞如杯状细胞(Muc2)、潘氏细胞(Paneth cell)也开始形成(图3A~B中红色荧光信号所示),并且在芽的顶端可以检测到强烈的增殖信号(Ki67)(图3C中红色荧光信号所示)。这种3D水平的信号检测能够在保持样品立体结构的基础上,比较便捷且全面地呈现出类器官的增殖分化等情况,利于掌握小肠类器官连续生长的动态过程。

注:A.培养24 h的小肠类器官;B.黑色箭头指向小肠类器官内容物;C.黑色箭头指向潘氏细胞;D.小肠类器官出芽数增多;E.黑色箭头指向即将从母体上脱落的芽;F.黑色箭头指向脱落的芽形成一个新的类器官。图1 小肠类器官形成过程Note. A. A small intestinal organoid cultured for 24 hours; B. Black arrow points to the contents of the small intestinal organoid; C. Black arrow points to a Paneth cell; D. A small intestinal organoid has more buds; E. Black arrow points to the bud falling off form the matrix; F. Black arrow points to a new organoid fallen off from the matrix.Fig.1 The formation process of small intestinal organoid

注:A.黑色箭头指向BrdU标记的增殖细胞;B.黑色箭头指向Ki67标记的增殖细胞;C.黑色箭头指向阿辛兰染液标记的杯状细胞;D. 黑色箭头指向Lysozyme标记的潘氏细胞。图2 免疫染色技术检测小肠类器官的增殖与分化Note. A. Black arrow points to a BrdU-labeled proliferating cell; B. Black arrow points to a Ki67-labeled proliferating cell; C. Black arrow points to an Alcian blue-labeled goblet cell; D. Black arrow points to lysozyme-labeled Paneth cells.Fig.2 Detection of the proliferation and differentiation of small intestinal organoids by immunohistochemical staining
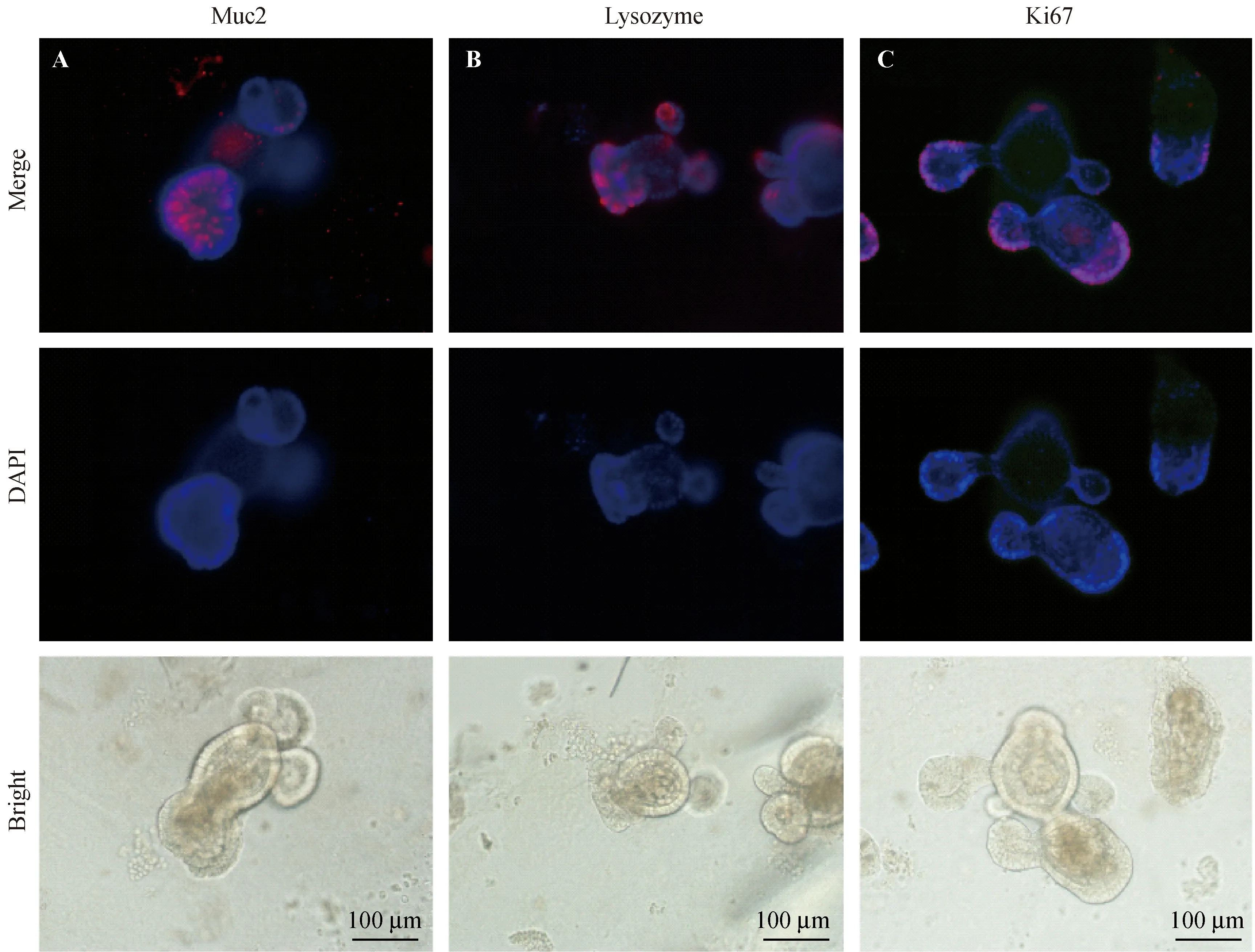
注:A.红色荧光信号表示Muc2标记的杯状细胞;B. 红色荧光信号表示Lysozyme标记的潘氏细胞;C. 红色荧光信号表示Ki67标记的增殖细胞。图3 免疫荧光技术检测三维水平的小肠类器官的增殖与分化Note. A. Red fluorescent signal represents Muc2-labeled goblet cells; B. Red fluorescent signal represents lysozyme-labeled Paneth cells; C. Red fluorescent signal represents Ki67-labeled proliferating cells.Fig.3 Detection of the proliferation and differentiation of three-dimensional small intestinal organoids by immunofluorescence-staining
3 讨论
肠上皮在维持肠稳态中发挥着十分重要的作用—包括形成小肠微环境、识别有益或者有害细菌、分泌影响微生物的复合物以及调节免疫反应等[8]。肠上皮通过快速的自我更新来维持自身的稳态,而这种快速增殖的自我更新能力来源于位于隐窝基底部的肠干细胞[9]。2007年,Barker等[10]运用Lgr5-EGFP-ires-CreERT2/Rosa26RlacZ工具鼠,通过世系追踪(lineage tracing)的方法证明了Lgr5是肠干细胞标志物。小肠类器官体外培养体系为研究小肠干细胞提供了更为直接的证据。2009年,Hans Clever团队用小肠类器官体外培养方法证明了小肠单个Lgr5干细胞能够在体外增殖并分化出肠上皮各种功能细胞[6]。这种体外培养的小肠类器官不仅能够进行移植,修复DSS诱导造成的肠上皮的损伤[11],甚至实现了用CRISPR-Cas9技术对人类肠类器官进行基因编辑,模拟结肠癌模型[12]。科学家们已经着手于将该技术应用于临床疾病治疗,这种类器官培养体系能够对治疗肠道相关疾病的药物进行筛选,或应用于一些细胞因子对肠道损伤修复的作用研究[13],应用前景广泛。
然而,如此便利的体外研究肠道的技术平台在国内并没有得到很好的掌握与推广。虽然Hans Clever实验室公开发表了小鼠小肠类器官体外培养的方法步骤[14],但是我们在实际模拟操作中还是会因为细节处理不当导致培养体系的失败。在不断地探索与改进中,我们优化了实验步骤,建立了稳定的小鼠小肠类器官体外培养体系,较好地模拟了肠上皮的增殖分化过程,该结构不但具有“肠腔”,还具有小肠的各种功能细胞。其较为单一的微环境为体外研究肠上皮的功能提供了一个便利的平台。小肠类器官相关病理检测技术方法目前在国内外并没有详细的报道,本研究中这一检测方法的建立能够清晰呈现出类器官结构增殖分化动态,进一步推动了小肠类器官体外培养体系的应用,将促进该技术成为人们探索肠的生长发育及肠炎肠癌最为有力的研究模型。
[1] Sturm A, Dignass AU. Epithelial restitution and wound healing in inflammatory bowel disease [J]. World J Gastroenterol, 2008, 14(3): 348-353.
[2] Medema JP, Vermeulen L. Microenvironmental regulation of stem cells in intestinal homeostasis and cancer [J]. Nature, 2011, 474(7351): 318-326.
[3] Barker N, Bartfeld S, Clevers H. Tissue-resident adult stem cell populations of rapidly self-renewing organs [J]. Cell Stem Cell, 2010, 7(6): 656-670.
[4] Simons BD, Clevers H. Stem cell self-renewal in intestinal crypt [J]. Exp Cell Res, 2011, 317(19): 2719-2724.
[5] Wright NA. Epithelial stem cell repertoire in the gut: clues to the origin of cell lineages, proliferative units and cancer [J]. Int J Exp Pathol, 2000, 81(2): 117-143.
[6] Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche [J]. Nature, 2009, 459(7244): 262-265.
[7] Sato T, Clevers H. Growing self-organizing mini-guts from a single intestinal stem cell: mechanism and applications [J]. Science, 2013, 340(6137): 1190-1194.
[8] Artis D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut [J]. Nat Rev Immunol, 2008, 8(6): 411-420.
[9] Barker N, Clevers H. Tissue-resident adult stem cell populations of rapidly self-renewing organs [J]. Cell Stem Cell, 2010, 7(6): 656-670.
[10] Barker N, vaan Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5 [J]. Nature, 2007, 449(7165): 1003-1007.
[11] Yui S, Nakamura T, Sato T, et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell [J]. Nat Med, 2012, 18(4): 618-623.
[12] Matano M. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids [J]. Nat Med, 2015, 21(3): 256-262.
[13] Lindemans CA, Calafiore M, Mertelsmann AM, et al. Interleukin-22 promotes intestinal-stem-cell-mediated epithelial regeneration [J]. Nature, 2015, 528(7583): 560-564.
[14] Sato T, Clevers H. Primary mouse small intestinal epithelial cell cultures [J]. Methods Molec Biol, 2013, 945: 319-328.
Establishmentandapplicationofaninvitromouseintestinalorganoidculturesystem
WAN Guang-sheng2, ZHANG Xin-yan1*
(1. Hospital and Institute of Obstetrics and Gynecology Affiliated to Fudan University,Shanghai 200011, China; 2. Putuo Hospital Affiliated to Shanghai University of Traditional Chinese Medicine,Shanghai 200062)
ObjectiveTo establish a small intestinal organoid culture system as aninvitrostudy model of intestinal epithelial cells, and to explore the relevant pathological detection techniques and provide a convenient platform forinvitrostudy of various intestinal diseases.MethodsThe mouse intestinal epithelium was isolated and cultured into organoids to simulate the growth and development of intestinal epitheliuminvitro. The proliferation and differentiation signals were detected by immunohistochemistry and three-dimensional immunofluorescence technique.ResultsThe culture system of the mouse small intestine epithelium was established. Immunohistochemical staining and three-dimensional immunofluorescence technique were successfully used to detect the growth and development of small intestinal organoids.ConclusionsThe successfully established mouse small intestinal organoid culture system and application of immunoassay technology will gradually become a most favorable technical means for studies of various intestinal diseases.
Small intestinal organoids; Pathology; Immunohistochemistry; Immunofluorescence; Mouse
ZHANG Xin-yan. E-mail: 1989117xyz@sina.com
Q95-33
A
1005-4847(2017) 05-0513-06
10.3969/j.issn.1005-4847.2017.05.008
2017-04-19
国家自然科学基金项目 (No.31371455 2014-2017)。
万光升(1984-),男,硕士,主治医师,研究方向:中西医结合治疗消化道肿瘤。E-mail: great_sunny@163.com
张新艳(1989-),女,硕士,初级技师,研究方向:肠干细胞。E-mail: 1989117xyz@sina.com
