miR-5572转基因小鼠构建病态窦房结综合征疾病模型的繁殖与鉴定
2017-11-01张进李颖范洁
张进,李颖,范洁
(云南省第一人民医院 昆明理工大学附属医院心内科,昆明 650000)
研究报告
miR-5572转基因小鼠构建病态窦房结综合征疾病模型的繁殖与鉴定
张进,李颖,范洁*
(云南省第一人民医院 昆明理工大学附属医院心内科,昆明 650000)
目的探讨miR-5572转基因小鼠构建病态窦房结综合征疾病模型的可行性。方法繁殖与鉴定了 miR-5572 F1及F2代野生型纯合子及杂合子小鼠,并通过形态学、心电图记录及窦房结组织Cav1.2、Cav1.3 mRNA和蛋白表达水平测定来观察疾病模型。结果F2代miR-5572纯合子敲入小鼠在形态上较野生型小鼠生长缓慢,体型较小。相较于杂合子和野生型小鼠,纯合小鼠的平均心率明显偏低(P<0.05),差异有显著性。miR-5572纯合子小鼠窦房结组织Cav1.2、Cav1.3 mRNA和蛋白表达水平低于野生型(P<0.05),差异有显著性。结论过表达miR-5572转基因小鼠可以构建病态窦房结综合征疾病模型。
病态窦房结综合征;转基因小鼠;繁殖与鉴定;微小RNA-5572
病态窦房结综合征 (sick sinus syndrome, SSS)是由于窦房结及其周围组织的器质性改变导致心脏窦房结起搏功能障碍, 从而引起缓慢心律失常的综合征。近几年研究表明,SSS的发病与离子通道如Cav1.3、Cav1.2、Nav1.5、Cav3.1和Cav3.2异常表达有关[1-6]。
MicroRNAs是长度为20-25 nt的短链非编码RNAs,其发挥生物功能的主要方式是:与mRNAs互补或者非互补方式结合,从而阻断蛋白翻译过程,使靶基因表达下调[7]。通过课题组前期的人血浆及动物心肌组织表达谱芯片以及荧光定量PCR技术,我们最终筛选出人血浆及动物心肌组织中差异表达比较明显的miR-5572。并且通过目前权威的MicroRNA靶基因预测软件miRanda,miRBase,TargetScan[8,9]预测miR-5572的靶基因为Cav1.2、Cav1.3,而Cav1.2、Cav1.3与SSS的发病密切相关[1-6]。因此,我们从赛业生物科技有限公司购入了12只F1代miR-5572过表达转基因小鼠,进行了如下实验,以期验证miR-5572转基因小鼠构建病态窦房结综合征疾病模型的可行性。
1 材料与方法
1.1实验动物
1.1.1 实验动物
2月龄C57BL/6 miR-5572阳性 F1代小鼠12只,购自赛业生物科技有限公司【SCXK (滇) K 2015-0005】。其中:雄性7只,平均体重(25.0±1.2)g,雌性5只,平均体重(24.2±1.0)g。小鼠在昆明医科大学实验动物中心SPF级动物房内进行繁殖【SYXK(滇) K2015-0002】。本实验所有操作均符合中华人民共和国《实验动物管理条例》。
1.1.2 实验动物分组
C57BL/6 miR-5572 F1代杂合子小鼠同胞之间相互杂交获得后续实验所需的F2代野生型,纯合子及杂合子小鼠(繁殖示意图见:图2A, B),每种小鼠获得6只后分为三组进行心电图的记录,野生型(6只),杂合子(6只),纯合子(6只)。
1.2主要试剂及仪器
心电图仪(EickECG-220X),异氟烷麻醉剂,DNA提取试剂盒:TaKaRa MiniBEST Universal Genomic DNA Extraction kit (Ver.5.0_Code No.9765),引物由生工生物工程股份有限公司合成,琼脂糖 (BIOWEST)。
1.3实验方法
1.3.1 DNA提取及鉴定
对小鼠尾和脚趾使用TaKaRa MiniBEST Universal Genomic DNA Extraction kit (Ver.5.0_Code No.9765)试剂盒进行DNA的提取,将得到的DNA进行PCR扩增,扩增产物在琼脂糖凝胶上进行电泳,使用Thermo Scientific GeneRuler 100 bp DNA Ladder,进行小鼠的基因型鉴定。
1.3.2 转基因小鼠心电图记录
对已成年的野生型,纯合子,杂合子小鼠采用异氟烷麻醉剂进行吸入式麻醉,并采用肢体导联的方法进行心电图的记录。电极位置参照人的相应部位,心电图机走纸速度 25 mm/s。(见图1)

图1 转基因小鼠平均心率的记录Fig.1 The recording device of the average heart rate of the miR-5572 transgenic mice
1.3.3 qRT-PCR检测
用Qiagen试剂盒提取纯合子、杂合子及野生型小鼠窦房结组织总RNA。采用SYBR法在Real-time-PCR 7900仪上行定量 PCR扩增,反应体系:cDNA 1 μL、上游引物0.5 μL、下游引物0.5 μL,SYBR 5 μL、水3 μL,反应条件:95℃ 1 min→ 95℃ 15 s→ 60℃ 60 s→ 95℃ 15 s→ 60℃ 15 s→ 95℃ 15 min。第2~4步35~40个循环,以 GAPDH 为内参,利 用TaKara-PrimeScriptTMII 1st strand cDNA Synthesis Kit 试剂盒反转录出cDNA,-20℃保存备用,利用 2-ΔΔCt方法统计结果。
1.3.4 Western blot实验
取纯合子、杂合子及野生型小鼠窦房结组织,提取总蛋白,BCA法测蛋白浓度。取相同量总蛋白行SDS-PAGE电泳,80 V电压20~30 min,120 V电压约90 min。300 mA湿转印120 min,将蛋白转印到PVDF膜,用5%脱脂奶粉室温封闭1 h,根据需要加入一抗(Cav1.2及Cav1.3,购于Abcam公司)。4℃孵育过夜,次日TBST洗膜3次,根据一抗加入相应的二抗,TBST洗膜3次,ECL发光液在ChemiDocTMXRS+ System (Bio-Rad)显影,用Image 软件曝光加灰度值分析。
1.4交配原则
其一:通过TALEN技术[10 ]将目的基因随机整合到基因组,因此首代转基因小鼠(F0)的每一只的整合位点都可能会不同,后代的基因型也可能不一样。因此,每一只F0代小鼠都需要作为一个单独的谱系,与不同的F0代小鼠分开进行繁殖。其二:由于外源基因一般只在二倍体动物的一条染色体上进行整合,且F0之间不能相互交配。因此,F0代要与背景相同的野生型小鼠进行交配,筛选出基因型一致的F1代,以保证其遗传背景的纯合性。
1.5交配流程
F0代小鼠性成熟后(8周)与野生型小鼠进行交配繁殖,获得F1代小鼠。将来自同一只F0的阳性F1代小鼠同胞交配,可获得F2代小鼠。
1.6选种原则及注意事项
选择发育良好、体形正常、体毛光滑、体格健壮、食欲旺盛、反应敏捷、眼睛明亮有神、尾不弯曲、均匀、无异常、无皮肤病、生殖器正常的小鼠用于繁殖的动物留种。一般选择阳性后代中雌性小鼠作为留种对象,雄性可以作为扩大繁殖用。主要采用1∶2或1∶3的长期同居法进行交配。并详细记录小鼠的繁育情况,以便于对小鼠的繁育情况进行数据统计与整理,为每只小鼠建立终身的笼卡和个体系谱作为资料长期保存。对于新出生小鼠应避免挪动,而幼鼠一般在3周左右进行断乳,若出现发育缓慢的小鼠,断乳时间可延长至30 d左右。
1.7小鼠的标记方法
实验本着不对动物生理或实验结果产生影响,以及耐久适用的原则进行标记。在幼鼠出生7 d左右,可以采用断趾方法,对幼鼠进行独立编号,同时,采用剪尾方法获取组织进行鉴定。小鼠的剪尾长度约3 mm,剪下后放入EP管中,写明脚趾编号和性别。幼鼠在21~28 d进行分笼,雌雄分开放到不同笼盒中且每个笼盒不超过5只小鼠。
1.8统计学方法
2 结果
2.1F2代转基因小鼠的获得
通过同窝F1 代杂合子小鼠的互交获得后续实验需要的F2代小鼠(图2A, B),F2代小鼠中纯合子,杂合子及野生型小鼠比例符合孟德尔遗传规律(图3,3A,3B),提示miR-5572转基因小鼠传代过程中未发生突变。

注:A: F0代杂合小鼠和同类型野生型小鼠交配获得F1代小鼠;B:F1代杂合子小鼠互交获得后续实验需要的F2代转基因小鼠。图2 获得F2代转基因小鼠示意图Note. A: Diagram of the harvested F1 miR-5572 heterozygous mice; B: Diagram of the harvested F2 miR-5572 homozygous mice. Tg:Trangenic; +:Wild type.Fig.2 Diagram of harvested F2 miR-5572 transgenic mice
2.2miR-5572纯合小鼠和野生小鼠发育情况对比
6月龄时,将miR-5572纯合小鼠和野生型、杂合小鼠进行发育情况比较,大体形态观察发现,miR-5572纯合小鼠体型较短,发育相对迟缓(见图4)。6月龄时,纯合小鼠平均体重为:(25.2±2.8)g,杂合子小鼠平均体重为:(31.7±2.1)g,野生型小鼠平均体重为:(32.4±3.7)g。结果发现:纯合小鼠平均体重与杂合子小鼠及野生型小鼠平均体重差异有显著性(P<0.05)。杂合子小鼠及野生型小鼠平均体重差异无显著性。
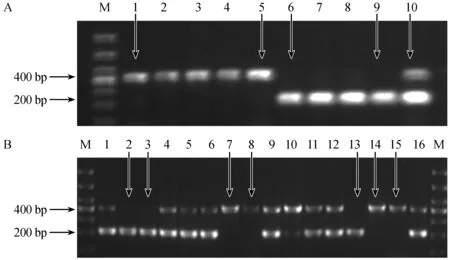
注:A: 1~5号为野生型小鼠;6~9号为纯合小鼠;10号为杂合子小鼠。B: 2、3、13号,表示基因纯和小鼠;1、4~6、9~12、16号,表示杂合小鼠;7、8、14、15号表示野生型小鼠。M表示DNA marker。图3 F2代转基因小鼠的电泳图Note. A: 1-5 represent wild-type mice; 6-9 represent homozygous mice; 10 represent heterozygous mice.B: 2,3,13 represent homozygous mice; 7, 8, 14, 15 represent wild-type mice;1,4-6,9-12,16 represent heterozygote mice.Fig.3 Identification of the F2 miR-5572 transgenic mice by PCR.

图4 纯合子、杂合子和野生型小鼠6月龄时的生长情况Fig.4 Development of the homozygous, heterozygous and wild type mice at 6 months of age
2.3纯合小鼠、杂合小鼠和野生型小鼠6个月时的心电图差异
6月龄时,在异氟烷吸入麻醉下记录小鼠肢体导联心电图,纯合小鼠、杂合小鼠和野生型小鼠各6只,取平均值,结果提示:纯合小鼠、杂合小鼠和野生型小鼠的平均心率分别为260,375和428次/分。纯合子小鼠的平均心率较杂合子及野生型小鼠平均心率显著下降,且差异有显著性,其他心电学指标:PR间期,QTc间期,QRS间期未见差异显著性。见图5,表1。
2.4纯合小鼠,杂合小鼠和野生型小鼠6个月时窦房结组织Cav1.2、Cav1.3mRNA和蛋白表达水平测定
我们取纯合小鼠,杂合小鼠和野生型小鼠窦房结组织进行Cav1.2、Cav1.3 mRNA和蛋白表达水平测定,qRT-PCR显示:纯合小鼠及杂合子小鼠窦房结组织Cav1.2、Cav1.3 mRNA表达明显低于野生型小鼠P<0.05,n=6)。免疫印迹结果显示相似的结果(图6)。
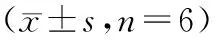
表1 纯合小鼠,杂合小鼠和野生型小鼠平均心率、PR间期,QTc间期,QRS间期的比较Tab.1 Comparison of average heart rate, PR interval, QTc interval, QRS interval in the wild type, heterozygous and homozygous mice
注:*表示纯合子小鼠组与野生型小鼠组比较P<0.05,△表示纯合子组与杂合子组比较P<0.05。
Note.*indicates the comparison between homozygous and the wild type mice,P<0.05;△indicates the comparison between homozygous and heterozygous mice,P<0.05.
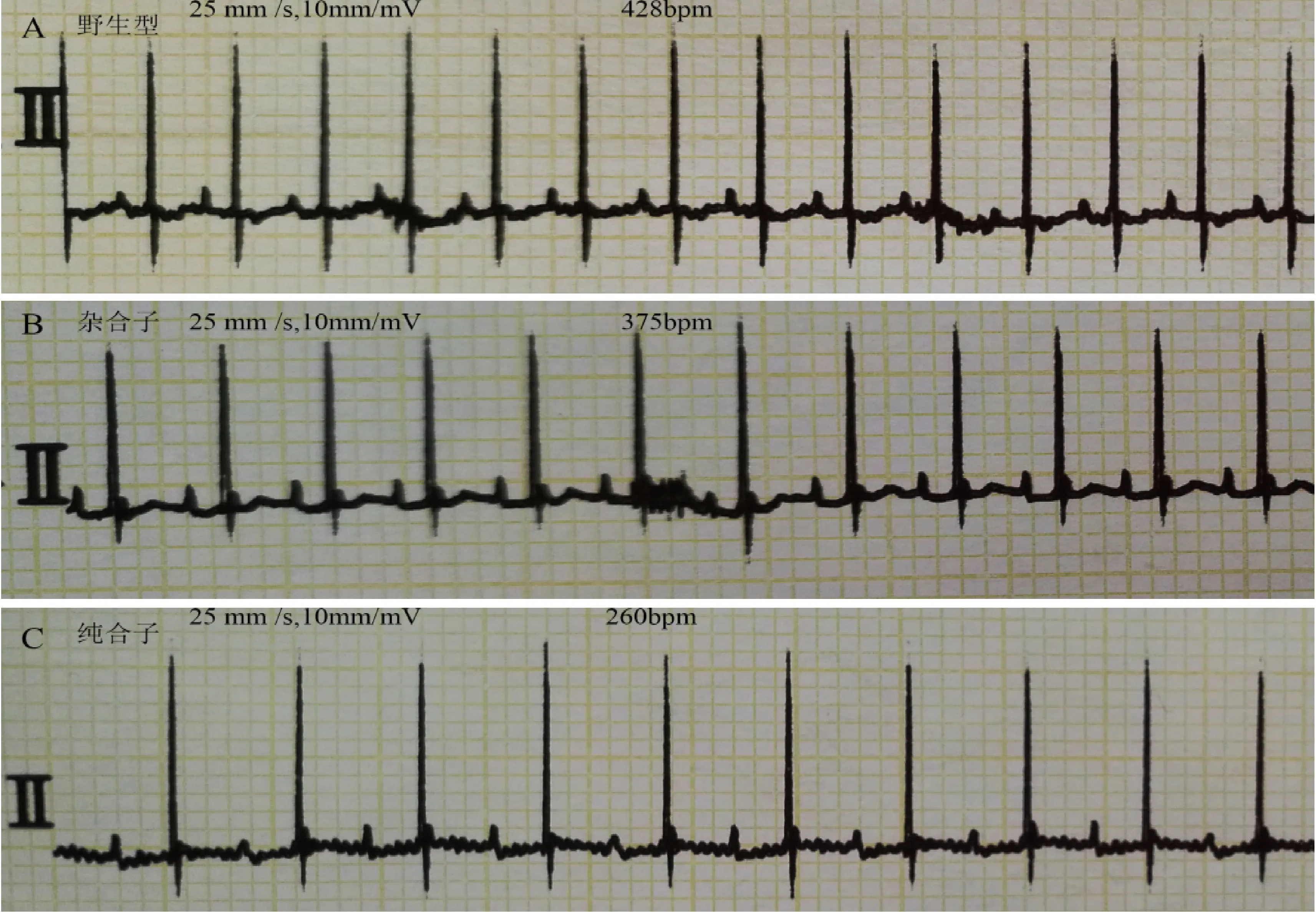
注:野生型、杂合子及纯合子小鼠的平均心率分别为428、375和260 次/分。图5 miR-5572野生型小鼠(A)、杂合子小鼠(B)及纯合子小鼠(C)心电图Note. The average heart rate was 428 beat per minute (bpm) (A), 375 bpm (B), 260 bpm (C) in the wild type, heterozygote and homozygous mice, respectively.Fig.5 Electrocardiograms (ECG) of the wild type (A), heterozygous (B) and homozygous (C) mice

图6 纯合小鼠、杂合小鼠和野生型小鼠窦房结组织Cav1.2、Cav1.3 mRNA和蛋白表达水平测定Fig.6 The Cav1.2 and Cav1.3 expression at mRNA and protein levels in sinoatrial node tissue of the homozygous (HO), heterozygous (HE) and wild type mice (WT)
3 讨论
随着老龄化社会的到来及心血管疾病的逐年增多,SSS病人数量逐年增加,针对这一疾病的主要诊断方法是心电图,而多数病人确诊后安装人工心脏起搏器仍是主要的治疗方法,但是人工心脏起搏器治疗存在一些先天的缺陷和不足,如起搏器昂贵的价格、电池寿命有限、心内电极植入存在风险等[11]。因此,建立SSS动物疾病动物模型对探索其发病机制及改善治疗具有重要意义。目前国内外尚未见较好的SSS动物疾病模型,国内报道用甲醛或者氢氧化钠涂抹窦房结致兔窦房结损伤建立SSS疾病动物模型[12,13],但该方法需开胸属于有创性方法,动物损伤程度较大,损伤程度难以把握,动物容易死亡,且该方法不能模拟窦房结组织的自然老化及病变过程。因此迫切需要建议一种损伤小,能够模拟自然状态下SSS发生、发展的动物模型。
近年来,逐渐阐述了L型Ca2+通道功能的丧失或减弱可能是SSS的发病机制。例如,Cav1.3介导的L型Ca2 +(ICa,L)电流中的功能丧失可导致窦房结功能障碍[1,2]。此外,有数据表明,慢性铁过载通过Cav1.3介导的L 型钙电流的减少诱导获得性SSS[3]。在小鼠中,Cav1.3通道可在窦房结,心房和房室结中表达,而缺乏Cav1.3通道的小鼠的心率出现了心动过缓等一系列SSS症状[4,5]。Jones研究表明, 豚鼠窦房结中心Cav1.2缺失面积随着年龄的增加而增加,这种缺失可能有助于解释随着年龄的增加出现的固有心率下降和窦房结传导减慢[6]。以上这些研究得出了重要结论:即Cav1.3及Cav1.2的缺失或者减少可能是SSS发病的重要离子通道机制。但Cav1.3及Cav1.2的缺失或者减少的转录机制目前还不清楚。近几年来发现高等真核细胞中广泛存在一种内源性的、非编码的、长约22个核苷酸的单链RNA,并命名为MicroRNA(简写为miRNA)。miRNA通过与靶基因mRNA 的3′ 非翻译区(3′-UTR) 不同程度的互补结合导致靶基因的降解或抑制,从而在转录水平负向调节靶基因的表达。每种miRNA可调控多种靶基因mRNA,一种靶基因mRNA可能受不同miRNA的调控[7]。miRNA的这种多靶标性使其作为重要的调节分子广泛参与了几乎所有的生理和病理过程。因此,在各种病理因素下,表达异常的miRNA有可能多靶点、负向调控起搏相关基因Cav1.3及Cav1.2并导致不利的窦房结离子通道重塑,从而导致SSS发生、发展。
本实验通过前期的表达谱芯片以及荧光定量PCR技术,从中挑选出一个差异表达比较明显的miR-5572进行验证。miRNA靶基因预测软件miRanda,miRBase,TargetScan[8,9]预测miR-5572的靶基因为Cav1.2、Cav1.3,而Cav1.2、Cav1.3编码的离子通道蛋白与SSS的发病密切相关[1-6],提示miR-5572转基因小鼠构建病态窦房结综合征疾病模型的可行性。我们通过赛业公司构建了miR-5572转基因小鼠,通过繁殖和鉴定了F0、F1、F2代小鼠。通过对比6个月时纯合子,杂合子和野生型小鼠的生长情况,以及心电图的比较,我们可以发现,miR-5572纯合子敲入小鼠在形态上较野生型小鼠生长缓慢,且体形较小。在平均心率方面,纯合小鼠,杂合小鼠和野生型小鼠的平均心率分别为260、375和428分/次,相较于杂合子和野生型小鼠,纯合小鼠的心率明显偏低。这些表型提示:过表达的miR-5572有可能下调靶基因Cav1.2,Cav1.3的转录与表达,从而导致窦房结功能减退,最终引起动物发育迟缓及平均心率降低,我们进一步研究结果同时提示:miR-5572纯合小鼠窦房结组织Cav1.2、Cav1.3 mRNA及蛋白表达明显低于杂合子小鼠及野生型小鼠,过表达miR-5572可以负向调小鼠窦房结组织Cav1.2、Cav1.3 mRNA及蛋白表达,从而调控起搏电流的产生及平均心率的减慢,提示动物过表达miR-5572可以构建病态窦房结综合征疾病模型,这为进一步研究病态窦房结综合征的发病机制及可能的治疗靶点打下了良好的基础。
[1] Mesirca P, Bidaud, Mangoni ME. Rescuing cardiac automaticity in L-type Cav1.3 channelopathies and beyond [J]. J Physiol. 2016, 594(20): 5869-5879.
[2] Mesirca P, Bidaud I, Briec F, et al. G protein-gated IKACh channels as therapeutic targets for treatment of sick sinus syndrome and heart block [J]. Proc Natl Acad Sci U S A,2016,113(7):E932-941.
[3] Rose RA, Sellan M, Simpson JA, et al. Iron overload decreases CaV1.3-dependent L-type Ca2+currents leading to bradycardia, altered electrical conduction, and atrial fibrillation[J]. Circ Arrhythm Electrophysiol, 2011, 4(5):733-742.
[4] Platzer J, Engel J, Schrottfischer A, et al. Congenital deafness and sinoatrial node dysfunction in mice lacking class D L-type Ca2+channels [J]. Cell, 2000, 102(1): 89-97.
[5] Zhang Z, He Y, Tuteja D, et al. Functional roles of Cav1.3 (alpha1D) calcium channels in atria: Insights gained from gene-targeted null mutant mice [J]. Circulation, 2005, 112(13): 1936-1944.
[6] Jones SA, Boyett MR, Lancaster MK, et al. Declining into failure the age-dependent loss of the L-type calcium channel within the sinoatrial node [J]. Circulation, 2007, 115: 1183-1190.
[7] Barrel DP. MicroRNAs: genomics,biogenesis,mechanism,and function [J].Cell,2004,116:281-297.
[8] Elia L, Contu R, Quintavalle M, et al. Reciprocal regulation of microRNA-1 and IGF-1 signal transduction cascade in cardiac and skeletal muscle in physiological and pathological conditions [J].Circulation, 2009, 120(23): 2377-2385
[9] Thum T, Carina G, Jan F, et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts [J]. Nature, 2008, 456: 980-986.
[10] Sanders P, Lau DH, Kalman JM. Sinus node abnormalities [M]. In: Zipes DP, Jalife J (Eds.): Cardiac Electrophysiology: From Cell to Bedside (6thedition). Elsevier Saunders, Philadelphia, 2014, pp 691-696.
[11] Hauser RG, Hayes DL, Kallinen LM, et al. Clinical experience with pacemaker pulse generators and transvenous leads: An 8-year prospective multicenter study [J]. Heart Rhythm, 2007, 4(2): 154-160.
[12] 刘学武,王小青,赵丞,等. 甲醛致兔窦房结损伤模型的建立 [J]. 中国比较医学杂志, 2015, 25(11): 21-27.
[13] Geng N, Jiang N, Peng C, et al. Sodium hydroxide pinpoint pressing permeation method for the animal modeling of sick sinus syndrome [J]. Int Heart J. 2015, 56(4): 439-443.
BreedingandgenotypingofamiR-5572transgenicmousemodelofsicksinussyndrome
ZHANG Jin, LI Ying, FAN Jie*
(The First People’s Hospital of Yunnan Province,The Affiliated Hospital of Kunming University of Science and Technology,Department of Cardiology, Kunming 650000, Yunnan, China)
ObjectiveThis study aimed to explore the possibility of establishing a model of sick sinus syndrome by using miR-5572 transgenic mice.MethodsF1 and F2 miR-5572 transgenic mice were bred and genotyped, and then observed the phenotype levels of miR-5572 transgenic mice by morphology, electrocardiogram record (ECG) and the Cav1.2 and Cav1.3 expressions levels of mRNA and protein in sinoatrial node tissue of homozygous, heterozygote and wild type mice.ResultsCompared with the wild type and heterozygous mice,the miR-5572 homozygous mice showed a development delay and smaller body shape,and had slower average heart rate.The mRNA and protein levels of Cav1.2 and Cav1.3 in the sinoatrial node tissues were significantly lower.ConclusionsThe results of this study indicate that miR-5572 homozygous mice may be an efficient approach to establish the model of sick sinus syndrome
Sick sinus syndrome; Transgenic mice; Breeding and genotyping; miR-5572
FAN Jie. Email: fanj913@sina.com
Q95-33
A
1005-4847(2017) 05-0467-06
10.3969/j.issn.1005-4847.2017.05.001
国家自然科学基金项目(81360039,81260038);云南省心律失常诊治研究中心基金(No.2014NS260, 2014NS259)。
张进(1976-),男,副主任医师,研究方向为心肌细胞及电生理。Email: zhaqngjinxy@sina.com
范洁(1964-),女,主任医师,主要从事心律失常及心电生理研究。Email: fanj913@sina.com
