新型序贯应激法致焦虑样胃高敏感性大鼠功能性消化不良模型的建立
2017-11-01景富春张军冯诚年媛媛杨宝德胡浩孙晓明郑建云
景富春,张军,冯诚,年媛媛,杨宝德,胡浩,,孙晓明,郑建云
(1. 西安交通大学第二附属医院消化内科, 西安 710004; 2. 延安大学附属宝鸡市人民医院消化内科, 陕西 宝鸡 721000; 3. 西安交通大学医学部药理学系, 西安 710068; 4. 西安交通大学医学部基础医学实验教学中心, 西安 710068; 5. 西安医学院第一附属医院病理科, 西安 710077)
研究报告
新型序贯应激法致焦虑样胃高敏感性大鼠功能性消化不良模型的建立
景富春1,2,张军1,冯诚1,年媛媛1,杨宝德3,胡浩3,4,孙晓明4,郑建云5
(1. 西安交通大学第二附属医院消化内科, 西安 710004; 2. 延安大学附属宝鸡市人民医院消化内科, 陕西 宝鸡 721000; 3. 西安交通大学医学部药理学系, 西安 710068; 4. 西安交通大学医学部基础医学实验教学中心, 西安 710068; 5. 西安医学院第一附属医院病理科, 西安 710077)
目的应用新型序贯应激法建立焦虑样胃高敏感性大鼠模型。方法将新生大鼠幼仔随机分为对照组与模型组,每组13只。出生后第2天起序贯采用胃刺激法、母婴分离法和束缚应激法制作焦虑样胃高敏感性模型。于第8周开始采用高架十字迷宫试验(EPM)、旷场试验(OF)、腹肌回缩试验(AWR)、肌电图试验(EMG)和胃排空试验(GET)等评价模型成功与否。结果EPM和OF实验提示模型组大鼠较对照组表现出明显的焦虑样行为,AWR和EMG实验显示模型组大鼠对胃扩张刺激的敏感性亦显著升高(P<0.05,P<0.01),但两组在体重变化和胃黏膜炎症反应方面差异无显著性,符合胃敏感性增高为主功能性消化不良的临床特点。结论应用新型序贯应激法可成功建立焦虑样胃高敏感性大鼠模型。
序贯应激法;焦虑;胃高敏感性;功能性消化不良;大鼠;模型
胃高敏感性(gastric hypersensitivity, GHS)是功能性消化不良(functional dyspepsia, FD)的特征性发病机制之一[1-4],也是FD的重要病理生理改变。它不仅与FD的主要症状餐后上腹痛密切相关,也参与了上腹饱胀、恶心、呕吐等其他FD症状的发生[5-7],是FD治疗效果差且易于复发的重要原因。临床研究表明,35%~65%的FD患者存在不同程度的胃敏感性增高[5],其中10%~25%的个体患有GHS相关的餐后上腹痛[8,9]。由此可见,阐明GHS的发生机制对FD患者的临床诊治和药物开发至关重要。
焦虑是临床常见的精神心理应激状态,也是FD患者常见的伴随症状[10],发生率高达40%~90%[11],是诱发或加重FD的重要因素[12-14]。但是,焦虑等精神心理因素如何影响FD的发生和发展,其与FD尤其是GHS形成的关系是什么,目前尚不十分清楚。究其原因主要是临床上缺乏相应的病人和正常人活体组织标本,而基础研究中则缺乏适宜的动物模型供研究使用[15]。因此,建立伴焦虑症状的GHS动物模型是探讨FD的病因和发病机制、开发FD防治药物的重要手段之一。既往已有研究人员分别运用新生幼仔胃刺激法(AGI)、母婴分离法 (NMS)或束缚应激法(RS)建立了GHS大鼠模型和FD大鼠模型[16,17],但伴焦虑症状的GHS大鼠模型则尚未见报道。
本研究拟将上述两种方法与精神心理实验方法结合,建立一种新型焦虑样胃高敏感性大鼠模型,以为探讨FD及GHS的发生机制、开发相关治疗药物提供可供选择的手段和工具。
1 材料与方法
1.1动物及分组
SPF级雄性1日龄SD大鼠32只,体重3~5 g,购自第四军医大学实验动物中心【SCXK(陕)2014-002】。随机分为对照组与模型组,每组16只,其中8只造模成功后用于进行全部行为学及肌电图等实验,8只用于胃黏膜炎症评价实验。母婴同笼饲养、造模实验及无菌手术均于西安交通大学医学部实验动物中心进行【SYXK(陕)2012-005】,室温(22±2)℃,相对湿度(50±20)%,按12/12 h明暗循环,母鼠自由进食和饮水。本实验所有操作均符合中华人民共和国《实验动物管理条例》。
1.2试剂
碘乙酰胺(iodoacetamide,IA)购自上海麦克林公司,蔗糖购自国药集团,戊巴比妥钠购自德国Merck公司。甲醛及其他试剂均为国产分析纯,水为蒸馏水。
1.3仪器
PMT-100型大鼠高架十字迷宫由成都泰盟科技公司生产,由表面用无光泽黑色丙烯酸涂装的中密度纤维板制作,包括两个开放臂和两个闭合臂,均长50 cm、宽10 cm,闭合臂的侧壁高30 cm,同一类型的臂对接后呈十字形,十字中央区长宽为10 cm × 10 cm。四个臂置于距地面50 cm高的支架上。正上方安装视频摄像追踪系统。旷场实验装置为自制,箱高30 cm,底边长100 cm,底面平均分为5个20 cm × 20 cm小方格。生物机能实验系统由成都泰盟公司生产的BL-420S及其配套软件TM-WAVE组成。PE-240充气导管为江西洪达医疗用品公司生产。大鼠束缚应激装置为自制的长15 cm、直径6 cm之塑料圆筒,两端自由通气。
1.4造模方法
1.4.1 母婴分离法 (NMS)[18]
模型组乳鼠自出生后第2天起,每天与母鼠分离3 h,时间为上午9:00-12:00,至满3周时结束。对照组母婴常规同笼饲养。所有幼鼠自出生后第22天断奶,与母鼠完全分离,单笼饲养至生后第8周进入束缚应激试验。
1.4.2 束缚应激法(RS)[19]
经母婴分离等实验后发育而成的雄性SD大鼠,于生后第8周接受束缚应激试验。每只大鼠每天被置于通风良好的束缚应激装置内,持续90 min后放回原笼,连续1周。
1.4.3 新生幼仔胃刺激法(AGI)[16]
模型组乳鼠于出生后第10天起,每天采用含0.1%碘乙酰胺的2%蔗糖溶液灌胃0.2 mL,对照组仅用等容积2%蔗糖溶液灌胃,连续6 d。
1.5模型评价方法
1.5.1 体重测定
于灌胃后第2~6天、第18天及第56天分别将两组大鼠称重,观察其体重变化。
1.5.2 高架十字迷宫试验(elevated plus maze, EPM)[20]
将每只大鼠以同样方式置于高架十字迷宫中央区、面向实验者对侧的开放臂,同时立即开启视频摄像追踪系统并同步计时5 min,记录大鼠进入开放臂及闭合臂的次数、在开放臂及闭合臂内的停留时间(注意大鼠的四爪全部到达一个臂内方可计算为一次进入)。每只大鼠实验结束后将实验仪器四臂用10%乙醇清洁并用纸巾擦干以消除不同动物气味的干扰。
1.5.3 旷场(open field, OF)试验[21]
将大鼠置于反应箱底部中心格内并立即开始计时,记录5 min内大鼠在中央格的停留时间(从大鼠放入中心格计时开始至4爪均离开此格的时间);穿行格数(大鼠4爪均进入中心格以外方格的总数);直立次数(前2爪离地1 cm以上的站立次数,攀附墙壁亦计算在内);修饰行为。每只大鼠检测完毕后均用10%乙醇清洁反应箱内壁及底面并用纸巾擦干,以排除上次动物的大小便、气味等余留信息对下次检测的影响。
1.5.4 气囊和电极植入术[22]
大鼠术前夜禁食但不禁饮水。将大鼠用戊巴比妥钠溶液(50 mg/kg,腹腔注射)麻醉,整个手术过程均在严格消毒下进行。事先将用乳胶手套制作的2.5 cm长的气囊连接固定于PE240导管上。术中在大鼠侧腹部切开一条长约3~4 cm的切口,暴露胃,将气囊从胃底部切口插入胃内,适当固定并检查在不充气情况下,幽门不出现梗阻且不影响胃排空。然后将胃底的切口紧密结扎以防止胃液漏入腹腔。将连接胃气囊的聚乙烯导管经皮下放置到颈背部并露出皮肤。气囊植入完成后,腹腔及腹部切口予以缝合。
电极植入:将消毒过的不锈钢电极线植入到肩斜方肌(颈部表浅肌肉)上,缝合切口。
1.5.5 腹肌回缩试验
腹肌回缩试验(abdominal withdrawal reflex,AWR)于胃气囊植入术后第6天进行,主要用于测定大鼠对胃气囊扩张时的行为学反应。胃气囊充气压力梯度为20、40、60、80、100 mmHg,每个压力持续20 s,间隔2 min[15]。其评分标准如文献[16]所述:0,对胃扩张无行为反应;1,简单头部运动;2,腹肌收缩;3,腹部抬高;4,躯体弓形,骨盆抬高或身体扭伸。
1.5.6 肌电图试验[22]
肌电图(electromyography,EMG)是用于量化记录大鼠对胃扩张反应产生肌电活动的一种方法,与AWR同步进行。实验时先采集基线肌电图数据,然后分别记录前述不同胃气囊充气压力梯度下的EMG。所获原始数据通过计算曲线下面积加以量化,胃对胃扩张的反应以不同胃气囊充气压力梯度下曲线下面积增加的百分比表示。
1.5.7 胃排空试验[23]
两组动物各另取若干只进行胃排空试验。先将大鼠禁食一夜,实验开始后允许自由进食和饮水3 h,然后撤去饮食,继续观察3 h后处死,取胃称重后将胃内食物全部倒出并称重。胃排空率(%)=100 — (胃内容物重量/摄食量) × 100。
1.5.8 胃黏膜炎症反应评价
(1)组织学评价
另取两组大鼠在接受IA或蔗糖灌胃后第6天和第8周被迅速处死后,取胃底组织1块,置入10%甲醛溶液中固定48~72 h,蜡块包埋切片,进行HE染色,显微镜下观察胃黏膜炎症情况。
(2)MPO试验[24]
组织学评价同时,取同一胃组织按MPO试剂盒说明书进行试验,ELISA法检测,结果以每单位MPO活性/组织干重表示。
1.6统计学分析
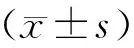
2 结果
2.1体重变化
模型组和对照组大鼠在含0.1%碘乙酰胺的2%蔗糖溶液或2%蔗糖溶液灌胃及母婴分离法处理同时,自出生后第2~6天、第18天和第56天分别称重,结果显示模型组大鼠体重增加百分比在上述各时间点均低于对照组,对照组体重增长率呈现高于模型组的趋势,但两组间的体重变化差异无显著性(P>0.05)。结果见图1。
2.2胃黏膜炎症反应
在含0.1%碘乙酰胺的2%蔗糖溶液或2%蔗糖溶液灌胃后第6天,胃黏膜HE染色发现黏膜表面炎症反应以模型组大鼠较明显,但MPO试验结果提示其与对照组间炎症未见明显差异。第56天序贯应激结束后,模型组和对照组胃黏膜炎症反应的HE染色和MPO试验均未见明显异常。见图2。
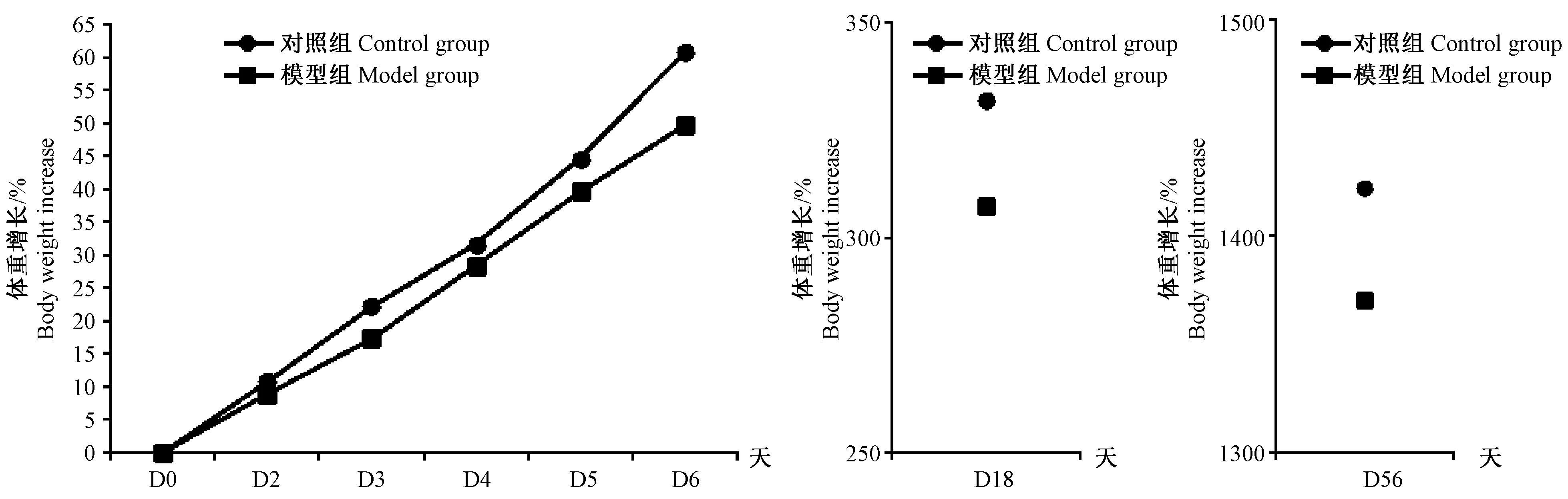
图1 两组大鼠的体重变化Fig.1 Body changes in the two groups

图2 模型组和对照组大鼠幼年和成年胃组织学(A 和 C)和MPO活性(B和 D)试验Fig.2 Changes of gastric histological (A and C) and MPO activity (B and D) in neonatal and adult rats of the control and model groups
2.3焦虑样行为试验
2.3.1 EPM
与对照组比较,模型组大鼠进入开放臂次数/进入开放臂和闭合臂总次数、在开放臂停留时间/在开放臂和闭合臂停留总时间的比值均降低,组间比较差异有显著性(P<0.05)。见表1。

表1 两组大鼠高架十字迷宫实验结果比较Tab.1 Comparison of the results of elevated plus maze test between the two groups
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.
2.3.2 OF试验
与对照组比较,模型组大鼠在中央格停留时间明显缩短(P<0.05)、穿行格数和直立次数明显减少(P<0.01),但在修饰行为方面差异无显著性(P>0.05)。见表2。
2.4胃敏感性变化
胃敏感性改变主要通过AWR和EMG实验加以验证。
2.4.1 AWR实验
经碘乙酰胺灌胃和序贯应激处理后,模型组大鼠对胃扩张的敏感性明显增加,扩张压达到40 mmHg以上时AWR得分明显高于对照组(P<0.05)。见表3。
2.4.2 肌电图试验 (EMG) 试验
与AWR实验结果相似,模型组大鼠在扩张压达到40 mm Hg以上时肩斜方肌EMG曲线下面积较对照组明显增加,两组相比差异有显著性(P<0.01)。见图3、表4。
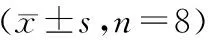
表2 两组大鼠旷场实验结果比较Tab.2 Comparison of the results of open field test between the two groups
注:与对照组比较*P<0.05,ΔP<0.01。
Note. Compared with the control group,*P<0.05,ΔP<0.01.

表3 两组大鼠AWR实验结果比较Tab.3 Comparison of the results of AWR test between the two groups
注:与对照组比较*P<0.05,ΔP<0.01。
Note. Compared with the control group,*P<0.05,ΔP<0.01.

表4 两组大鼠EMG实验结果比较Tab.4 Comparison of the results of EMG test between the two groups
注:与对照组比较ΔP<0.01。
Note. Compared with the control group,ΔP<0.01.
2.5胃排空实验
禁食18 h后,模型组大鼠3 h的摄食量与对照组比较无明显差别(P>0.05),但停止摄食3小时后对已摄取食物的胃排空率组间比较差异有显著性(P<0.05),模型组明显低于对照组。见表5。
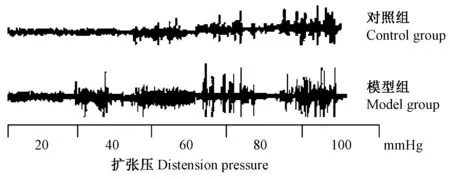
图3 模型组和对照组的代表性EMGFig.3 Representative EMG response in the two groups
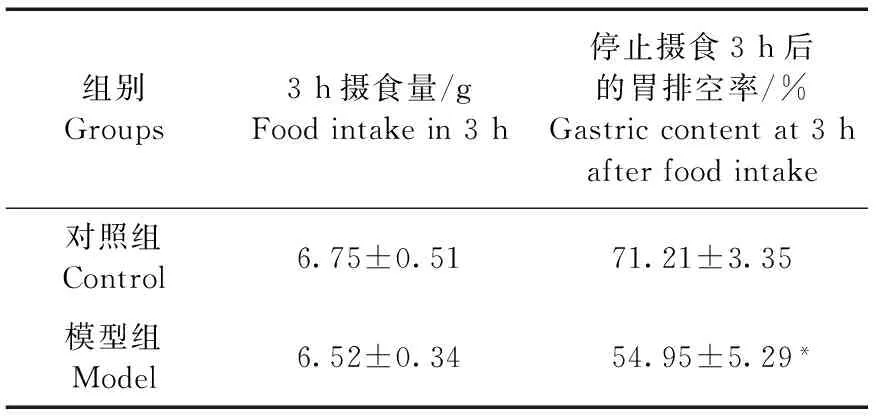
组别Groups3h摄食量/gFoodintakein3h停止摄食3h后的胃排空率/%Gastriccontentat3hafterfoodintake对照组Control6.75±0.5171.21±3.35模型组Model6.52±0.3454.95±5.29*
注:与对照组比较*P<0.05。
Note. Compared with the control group,*P<0.05.
3 讨论
焦虑等精神心理异常在FD患者中的发生率高达40%~90%[11],是FD的常见症状,也是其难治的主要原因之一,与胃功能紊乱本身所致症状高度重叠,互为因果、相互影响,促进了FD的发生和发展[12,25]。但焦虑对FD及GHS的影响机制尚不十分明确,其主要原因除与临床标本缺乏有关外,更重要的是迄今为止尚无较为成熟的焦虑样GHS动物模型。
研究表明,幼年的不良生理或心理体验及成年的急性应激状态均参与了FD症状的形成[26,27],而幼年时出现急性轻度胃炎,也可能是成年后慢性胃敏感性增高和胃功能紊乱的诱因之一[16]。母婴分离作为幼年的不良刺激可造成大鼠成年后出现焦虑样行为[28,29],对中枢的5HT、GABA、去甲肾上腺素等神经递质和胃肠道的5HT、乙酰胆碱等神经递质有重要影响[30-34],同时亦能影响下丘脑-垂体-肾上腺轴的双向调节作用,诱导大鼠出现焦虑样心理应激反应[35]。成年大鼠的急性应激状态除同样影响下丘脑-垂体-肾上腺轴外,尚可影响血清ghrelin的分泌,后者对胃动力、胃敏感性和胃容受性舒张等具有一定调节作用[19,36]。而大鼠幼年时的急性轻度胃黏膜炎症,可通过内脏传入神经,最终影响成年后的胃敏感性、摄食量和胃容受性舒张功能[16]。
然而,尽管已有大量研究分别采用母婴分离、急性应激和新生大鼠胃刺激法制作FD样GHS模型,但却鲜有研究关注上述方法对实验动物带来的焦虑等精神心理应激反应及其与GHS间的相互影响和发生机制。
本研究显示,应用新型序贯应激法制作的焦虑样GHS模型,大鼠在实验初期表现出体重增长减缓和胃黏膜轻度炎症,但体重增长在短期内即已恢复且在第8周时胃黏膜组织学和MPO试验完全正常,符合FD患者的临床特点。同时,与对照组相比,模型组大鼠的摄食量未明显减少、但胃排空率明显下降。
已有的临床研究提示,35%~65%的FD患者存在不同程度GHS,且后者与餐后上腹痛密切相关,也与恶心、早饱、上腹胀等非腹痛性症状有关[4,5,37]。本研究显示,模型组大鼠胃敏感性明显增高,对照组变化不大,与前述临床研究结果具有一致性,表明本模型成功复制了FD样GHS模型。
与此同时,与对照组相比,模型组大鼠在EPM上向开放臂探索的次数和在开放臂的停留时间均明显减少,而后腿直立次数和头部下探次数均明显增高,提示存在焦虑样行为特征。旷场试验进一步观察到模型组大鼠在中央格停留时间缩短、穿行格数明显减少,与EPM实验结果具有相似性。提示本模型较好地模拟了焦虑样症状,具备了焦虑样大鼠模型的特点。
综上所述,本研究探索建立了一种新型焦虑样GHS大鼠FD模型,其行为学特征符合焦虑和GHS表现,提示模型制作成功。同时本模型也为伴焦虑样症状、以胃敏感性增高为主要病理生理改变的FD患者的发病机制研究和新药开发等提供了一种新的手段。
[1] Tack J, Talley NJ,Camilleri M, et al. Functional gastroduodenal disorders[J]. Gastroenterology, 2006,130: 1466-1479.
[2] Van Oudenhove L, Vandenberghe J,Geeraerts B, et al. Determinants of symptoms in functional dyspepsia: gastric sensorimotor function, psychosocial factors or somatisation? [J]. Gut, 2008, 57: 1666-1673.
[3] Mertz H, Fullerton S, Naliboff B, et al. Symptoms and visceral perception in severe functional and organic dyspepsia [J]. Gut, 1998, 42: 814-822.
[4] Tack J, Caenepeel P, Fischler B, et al. Symptoms associated with hypersensitivity to gastric distention in functional dyspepsia [J]. Gastroenterology, 2001, 121: 526-535.
[5] Vandenberghe J, Vos R, Persoons P, et al. Dyspeptic patients with visceral hypersensitivity: sensitisation of pain specific or multimodal pathways? [J]. Gut, 2005, 54: 914-919.
[6] Keohane J, Quigley EM. Functional dyspepsia: the role of visceral hypersensitivity in its pathogenesis [J]. World J Gastroenterol, 2006, 12: 2672-2676.
[7] Miwa H, Watari J, Fukui H, et al. Current understanding of pathogenesis of functional dyspepsia [J]. J Gastroenterol Hepatol, 2011, 26 (Suppl 3): 53-60.
[8] Tack J, Masaoka T, Janssen P. Functional dyspepsia [J]. Curr Opinion Gastroenterol, 2011, 27: 549-557.
[9] Chang L. Review article: epidemiology and quality of life in functional gastrointestinal disorders [J]. Aliment Pharmacol Ther, 2004, 20 (Suppl 7): 31-39.
[10] Aro P,Talley NJ, Ronkainen J, et al. Anxiety is associated with uninvestigated and functional dyspepsia (Rome III criteria) in a Swedish population-based study [J]. Gastroenterology, 2009, 137(1): 94-100.
[11] Jing FH, Zhang J. Metabolic Kinetics of 5-hydroxytryptamine and the research targets of functional gastrointestinal disorders [J]. Dig Dis Sci, 2014; 59: 2642-2648.
[12] Mayer EA. The neurobiology of stress and gastrointestinal disease [J]. Gut, 2000, 47: 861-869.
[13] Chrousos GP, Gold PW. The concepts of stress and stress system disorders [J]. Overview of physical and behavioral homeostasis [J]. JAMA, 1992, 267: 1244-1252.
[14] Haug TT, Svebak S, Hausken T, et al. Low vagal activity as mediating mechanism for the relationship between personality factors and gastric symptoms in functional dyspepsia [J]. Psychosom Med, 1994, 56: 181-186.
[15] Winston JH, Sarna SK. Developmental origins of functional dyspepsia-like gastric hypersensitivity in rats [J]. Gastroenterology, 2013, 144(3): 570-579.
[16] Liu LS, Winston JH, Shenoy MM, et al. A rat model of chronic gastric sensorimotor dysfunction resulting from transient neonatal gastric irritation [J]. Gastroenterology, 2008, 134: 2070-2079.
[17] Abdel-Aziz H, Wadie W, Zaki HF, et al. Novel sequential stress model for functional dyspepsia: Efficacy of the herbal preparation STW5 [J]. Phytomedicine, 2015, 22: 588-595.
[18] Coutinho SV, Plotsky PM, Sablad M, et al. Neonatal maternal separation alters stress-induced responses to viscerosomatic nociceptive stimuli in rat [J]. Am J Physiol Gastrointest Liver Physiol, 2002, 282: G307-G316.
[19] Zhang H, Han T, Sun LN, et al. Regulative effects of essential oil fromAtractylodeslanceaon delayed gastric emptying in stress-induced rats [J]. Phytomedicine, 2008, 15: 602-611.
[20] Walf AA, Frye CA. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents [J]. Nat Protoc, 2007, 2(2): 322-328.
[21] Winocur G. The hippocampus and thalamus: their roles in short- and long-term memory and the effects of interference [J]. Behav Brain Res, 1985, 16: 135-152.
[22] Ozaki N, Bielefeldt K, Sengupta JN, et al. Models of gastric hyperalgesia in the rat [J]. Am J Physiol Gastrointest Liver Physiol, 2002, 283: G666-G676.
[23] Martinez V, Barquist E, Rivier J, et al. Central CRF inhibits gastric emptying of a nutrient solid meal in rats: the role of CRF2 receptors [J]. Am J Physiol, 1998, 274: G965-G970.
[24] Krawisz JE, Sharon P, Stenson WF. Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity [J]. Gastroenterology, 1984, 87: 1344-1350.
[25] O’Mahony SM, Hyland NP, Dinan TG, et al. Maternal separation as a model of brain-gut axis dysfunction [J]. Psychopharmacology, 2011, 214: 71-88.
[26] Van Oudenhove L, Vandenberghe J, Vos R, et al. Abuse history, depression, and somatization are associated with gastric sensitivity and gastric emptying in functional dyspepsia [J]. Psychosom Med, 2011, 73: 648-655.
[27] Kim HI, Jung SA, Choi JY, et al. Impact of shiftwork on irritable bowel syndrome and functional dyspepsia [J]. J Korean Med Sci, 2013, 28: 431-437.
[28] Caldji C, Diorio J, Meaney MJ. Variations in maternal care in infancy regulate the development of stress reactivity [J]. Biol Psychiatry, 2000a, 48:1164-1174.
[29] Huot RL, Thrivikraman KV, Meaney MJ, et al. Development of adult ethanol preference and anxiety as a consequence of neonatal maternal separation in Long Evans rats and reversal with antidepressant treatment [J]. Psychopharmacology, 2001, 158: 366-373.
[30] Matthews K, Dalley JW, Matthews C, et al. Periodic maternal separation of neonatal rats produces region- and gender-specific effects on biogenic amine content in postmortem adult brain [J]. Synapse, 2001, 40: 1-10.
[31] Lovinger DM, Partridge JG, Tang KC. Plastic control of striatal glutamatergic transmission by ensemble actions of several neurotransmitters and targets for drugs of abuse [J]. Ann NY Acad Sci, 2003, 1003: 226-240.
[32] Manabe N, Tanaka T, Hata J, et al. Pathophysiology underlying irritable bowel syndrome—from the viewpoint of dysfunction of autonomic nervous system activity [J]. J Smooth Muscle Res, 2009, 45: 15-23.
[33] Gareau MG, Jury J, MacQueen G, et al. Probiotic treatment of rat pups normalises corticosterone release and ameliorates colonic dysfunction induced by maternal separation [J]. Gut, 2007a, 56: 1522-1528.
[34] Ren TH, Wu J, Yew D, et al. Effects of neonatal maternal separation on neurochemical and sensory response to colonic distension in a rat model of irritable bowel syndrome [J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292: G849-G856.
[35] Litvin Y, Tovote P, Pentkowski NS, et al. Maternal separation modulates short-term behavioral and physiological indices of the stress response [J]. Horm Behav, 2010, 58: 241-249.
[36] Taniguchi H, Ariga H, Zheng J, et al. Endogenous ghrelin and 5-HT regulate interdigestive gastrointestinal contractions in conscious rats [J]. Am J Physiol Gastrointest Liver Physiol, 2008, 295: G403-411.
[37] Mertz H, Fullerton S, Naliboff B, et al. Symptoms and visceral perception in severe functional and organic dyspepsia [J]. Gut, 1998, 42: 814-822.
Establishmentofananxiety-likegastrichypersensitivityratmodeloffunctionaldyspepsiainducedbyanewmethodofsequentialstress
JING Fu-chun1,2, ZHANG Jun1, FENG Cheng1, NIAN Yuan-yuan1, YANG Bao-de3, HU Hao3, SUN Xiao-ming4, ZHENG Jian-yun5
(1. Department of Gastroenterology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004, China; 2. Department of Digestive Diseases, Baoji People’s Hospital Affiliated to Yan’an University, Baoji 721000; 3. Department of Pharmacology, Health Science Center, Xi’an Jiaotong University, Xi’an 710061; 4. Basic Medical Experiment Teaching Center, Health Science Center, Xi’an Jiaotong University, Xi’an 710061; 5. Department of Pathology, the First Affiliated Hospital of Xi’an Medical University, Xi’an 710004)
ObjectiveTo establish an anxiety-like gastric hypersensitivity (GHS) rat model of functional dyspepsia induced by new sequential stress.MethodsTwenty-six male 1-day-old Sprague-Dawley rat pups were randomly divided into control and model groups (n=13 in each group). The model rats
sequential stress from postnatal day 2: neonatal maternal separation (NMS), acute gastric irritation (AGI) and restraint stress (RS). The control rats were reared freely with their mothers without undergoing the sequential stress. From postnatal 8thweek all rats started to receive elevated plus maze (EPM), open field test (OF), abdominal withdrawal reflex (AWR) and electromyographic test (EMG).ResultsEPM and OF experiments depicted that the model rats showed obvious anxiety-like behavior (P<0.05 orP<0.01). AWR and EMG tests exhibited that the model rats had elevated gastric hypersensitivity to gastric distention (P<0.05 orP<0.01).ConclusionsAn anxiety-like GHS rat model of functional dyspepsia can be successfully established with our new method of sequential stress.
Sequential stress; Anxiety; Gastric hypersensitivity; Functional dyspepsia; Rat model
ZHANG Jun. Email: jun3z@163.com.
Q95-33
A
1005-4847(2017) 05-0551-07
10.3969/j.issn.1005-4847.2017.05.015
2016-10-15
景富春(1969-),男,在读博士,副主任医师。研究方向:功能性消化不良。Email: fleming7798@163.com
张军(1959-),女,医学博士,教授。研究方向:消化系疾病诊治。Email: jun3z@163.com
