急性痛风性关节炎大鼠模型的建立及模型维持时间观察
2017-11-01蔡唐彦王旭何浈郑乃熙詹正烜张英杰张艺强苏友新
蔡唐彦,王旭,何浈,郑乃熙,詹正烜,张英杰,张艺强,苏友新,2*
(1. 福建中医药大学,福州 350122; 2. 福建卫生职业技术学院,福州 350101)
研究报告
急性痛风性关节炎大鼠模型的建立及模型维持时间观察
蔡唐彦1,王旭1,何浈1,郑乃熙1,詹正烜1,张英杰1,张艺强1,苏友新1,2*
(1. 福建中医药大学,福州 350122; 2. 福建卫生职业技术学院,福州 350101)
目的建立急性痛风性关节炎(acute gouty arthritis,AGA)大鼠模型并观察其维持时间。方法采用25 mg/mL尿酸钠(monosodium urate,MSU)晶体混悬液踝关节腔注射复制大鼠AGA模型,多个时间点动态观察8 d,以大鼠受试踝关节局部皮温、肿胀度、步态、关节液炎性细胞及其滑膜组织病理形态学改变等指标判断是否成模及其维持时间。结果造模后3 h,生理盐水组和模型组均可见踝关节肿胀,皮温升高,步态异常,关节液炎性细胞数增多,滑膜组织增生、毛细血管充血、滑膜细胞排列紊乱等炎症表现,两组以上指标与空白组比较差异均有显著性(P<0.01);造模后4 h,生理盐水组以上炎症表现明显减轻,较3 h时差异有显著性(P<0.01),而模型组较3 h时加重(P<0.01),并且与生理盐水组比较差异有显著性(P<0.01);造模后24 h,生理盐水组各项指标恢复正常,而模型组炎症继续加重;造模后48~72 h,模型组肿胀、皮温、步态异常等局部炎症达到高峰;造模后96~168 h,模型组踝关节局部炎症逐渐减轻,但各项指标与空白组比较差异仍有显著性(P<0.01);造模后192 h,模型组肿胀、皮温、步态异常等外在炎症表现恢复正常,而炎性细胞数及滑膜病理变化与空白组比较差异仍均有显著性(P<0.01)。结论采用MSU晶体混悬液踝关节腔注射可在造模后4 h成功制备并鉴定出AGA大鼠模型,且至少能维持到造模后168 h。
急性痛风性关节炎;大鼠模型;尿酸钠;维持时间
急性痛风性关节炎(acute gouty arthritis)是临床常见病,发作时严重影响患者的日常生活[1]。建立AGA动物模型是研究本病的前提,目前建立AGA动物模型的方法较多,其中采用尿酸盐关节腔注射复制AGA模型具有易操作、成功率高等优点,应用最为广泛[2-4]。然而大多数研究缺乏动物成模判断标准,所用的指标特异性不高、也不一致,对模型维持时间的研究也尚未深入[5]。为此,本实验在参考AGA模型相关文献[6,7]及前期预实验的基础上,选择踝关节局部注射MSU晶体混悬液的方法复制AGA大鼠模型,并采用多个时间点动态观察与AGA密切相关的踝关节皮温、肿胀、步态、关节液炎性细胞、关节滑膜组织病理形态学等,以探讨该模型成模的判断指标及其维持时间。
1 材料与方法
1.1动物及分组
3月龄SPF级雄性SD大鼠180只,体重200±20 g,由上海斯莱克实验动物有限责任公司提供【SCXK(沪)2012-0002】,委托福建中医药大学实验动物中心饲养【SYXK(闽)2014-0001】。福利伦理审查号:福中医【2016】伦理审字第(017)号。采用随机数字表法将大鼠分为空白组、生理盐水组和模型组,每组各60只。
1.2主要的试剂及仪器
MSU晶体(美国Sigma公司,批号101498836);吐温80(上海古朵生物科技有限公司,批号304A054);ZH-YLS-7B足趾容积测量仪(安徽正华生物仪器有限公司);DT-810非接触红外线额温计(深圳华盛昌机械实业有限公司);RM2235切片机(德国Leica公司);RH-B-1-S25加热磁力搅拌器(德国IKA公司);DM4000B-LED显微镜(德国Leica公司)。
1.3方法
1.3.1 MSU晶体混悬液制备[8]
取500 mg MSU晶体,加2 mL吐温80,再加无菌生理盐水用磁力搅拌器加热搅拌,直至晶体完全溶解,定容至20 mL,制成25 mg/mLMSU晶体混悬液,高压灭菌后,于4℃保存,用前摇匀。
1.3.2 模型造模方法
SD大鼠适应性喂养1周,参照Coderre造模方法[9],乙醚麻醉后以大鼠右后肢背侧正中踝关节与胫腓骨之间的关节腔为进针点,将踝关节摆放成直角,充分暴露踝关节与胫腓骨的间隙,注射针头与胫骨成45°夹角插入关节腔,模型组注射0.2 mL 25 mg/mL MSU晶体混悬液,生理盐水组以同样方法注射0.2 mL无菌生理盐水,空白组不予任何处理。
1.3.3 指标及其检测
前期预实验结果提示造模后1~2 h模型组仅受试踝关节轻微肿胀,其他AGA外在表现不明显,故本研究从造模后3 h开始观察并记录。
(1)皮温
用非接触红外线额温计测量造模后3、4、24、48、72、96、120、144、168、192 h大鼠右踝关节进针点为中心同一部位的局部皮温值。
(2)肿胀度
参照上述时间点,采用足趾容积测量仪测量右踝关节同一部位的容积值,以造模前后容积的差值作为肿胀度。
(3)步态分级
参照上述时间点观察步态变化,根据文献分级标准改良[10,11]:0级:正常行走;I级:轻微跛行,受试下肢略有弯曲;II级:中度跛行,受试下肢刚触及地面;III级:重度跛行,受试下肢离开地面,3足着地行走。
(4)踝关节液炎性细胞含量及关节滑膜组织病理形态学变化
于上述时间点每组各取6只大鼠,以300 mg/kg 10%水合氯醛腹腔麻醉,备皮,碘伏消毒,切开右踝关节囊,用1 mL生理盐水冲洗关节腔,收集冲洗液,于载玻片上涂片,4%多聚甲醛溶液固定,再进行HE染色,光镜下取 5个随机视野进行炎性细胞计数,取均值。将冲洗完关节液的大鼠切取踝关节及其周围软组织(关节近侧及远侧各保留约0.5 cm),去皮,4%多聚甲醛溶液固定,常规脱水、透明,石蜡包埋、切片和HE染色,光镜下观察滑膜组织形态学变化,并根据滑膜组织形态学评分标准[12]进行评分。
1.4统计方法
2 结果
2.1一般状态的观察与比较
实验过程中,空白组大鼠精神、饮食正常,皮毛光泽,活泼好动。与空白组比较,生理盐水组在造模后24 h内精神、饮食尚可,皮毛欠光泽,活动减少;模型组在造模后1周内精神、饮食欠佳,皮毛无光泽,懒动,右踝关节肿胀,皮色变红,皮温升高,行走迟缓,甚至出现跛行、右足蜷缩等(见图1)。

图1 造模后4 h各组大鼠右侧踝关节皮色、肿胀对比Fig.1 Comparison of the right ankle skin color and swelling in the rats of blank (A), saline (B) and model (C) groups at 4 h after modeling
2.2不同时间点皮温比较
造模后3~4 h,生理盐水组和模型组踝关节局部皮温较空白组均升高(P<0.01);造模后24 h,模型组皮温持续上升,而生理盐水组恢复正常;造模后48~72 h,模型组皮温达到高峰,随后逐渐下降,至造模后192 h时恢复正常。(见表1)
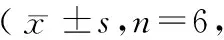
表1 不同时间点皮温比较℃)Tab.1 Comparison of the skin temperature in the rats at different time points
注:与空白组比较,1)P<0.01;与生理盐水组比较,2)P<0.01;与本组造模后3 h比较,3)P<0.01。
Note. 1) Compared with the blank group,P<0.01. 2) Compared with the saline group,P<0.01.3) Compared with the same group at 3 h after modeling,P<0.01.
2.3不同时间点肿胀度比较
造模后3~4 h,生理盐水组和模型组踝关节轻微肿胀,与空白组比较差异有显著性(P<0.01);造模后24 h,模型组踝关节肿胀明显,而生理盐水组恢复至正常;造模后48~72 h,模型组肿胀达到高峰,随后逐渐消退,至造模后192 h时恢复正常。(见表2)。
2.4不同时间点步态比较
造模前,每只大鼠均为正常行走步态。造模后3~4 h,生理盐水组和模型组右后肢略有弯曲,轻微跛行,与空白组比较差异均有显著性(P<0.01);造模后24 h,模型组步态异常更为明显,而生理盐水组步态恢复正常;造模后48~72 h,模型组右后肢弯曲最为明显,重度跛行;造模后96~168 h,模型组步态异常逐渐改善;造模后192 h,模型组步态恢复正常。(见表3)。
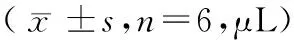
表2 不同时间点肿胀度比较Tab.2 Comparison of the degrees of joint swelling in the rats at different time points
注:与空白组比较,1)P<0.01;与生理盐水组比较,2)P<0.01;与本组造模后3 h比较,3)P<0.01。
Note. 1) Compared with the blank group,P<0.01. 2)Compared with the saline group,P<0.01. 3) Compared with the same group at 3 h after building,P<0.01.

表3 不同时间点步态变化比较(n=6,只)Tab.3 Comparison of the changes of gait in the rats at different time points
2.5不同时间点关节液炎性细胞含量比较
造模后3~4 h,生理盐水组和模型组关节液中炎性细胞数较空白组均有增加(P<0.01);造模后24 h,模型组炎性细胞数持续增多,而生理盐水组恢复至正常。造模后48~72 h,模型组炎性细胞数达到高峰,随后逐渐下降,到造模后192 h时与空白组比较差异仍有显著性(P<0.01)。(见表4,图2)。
2.6不同时间点关节滑膜组织病理形态学比较
造模后3~4 h,生理盐水组和模型组病理切片可见滑膜组织增生,滑膜细胞排列紊乱,毛细血管扩张、充血并伴有炎性细胞浸润等,与空白组比较差异均有显著性(P<0.01);造模后24 h,模型组滑膜组织炎症持续加重,而生理盐水组恢复至正常;造模后48~72 h,模型组滑膜组织炎症达到高峰,随后逐渐减轻,到造模后192 h时与空白组比较差异仍有显著性(P<0.01)。(见表5,图3)。
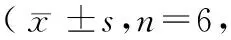
表4 不同时间点关节液炎性细胞含量比较个)Tab.4 Comparison of the amount of inflammatory cells in synovial fluid in the rats at different time points
注:与空白组比较,1)P<0.01;与生理盐水组比较,2)P<0.01;与本组造模后3 h比较,3)P<0.01。
Note. 1) Compared with the blank group,P<0.01. 2) Compared with the saline group,P<0.01. 3) Compared with the same group at 3 h after modeling,P<0.01.
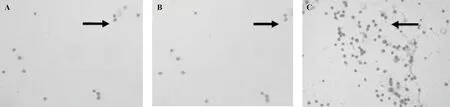
注:A.空白组; B.生理盐水组; C.模型组。箭头所指表示关节液中的炎性细胞。图2 造模后48 h各组大鼠踝关节液炎性细胞(HE染色,×200)Note. Arrows indicate inflammatory cells in the synovial fluid. A: Blank group B: Saline group C: Model group.Fig.2 Inflammatory cells in the ankle joint synovial fluid at 48 hours after modeling in the rats in each group(HE staining. ×200)

组别Groups3h4h24h48h72h空白组Blankgroup0.83±0.750.67±0.520.52±0.330.55±0.500.41±0.17生理盐水组Salinegroup2.00±0.891)1.67±0.521)3)0.55±0.500.52±0.330.52±0.33模型组Modelgroup2.17±0.411)3.33±0.821)2)3)6.17±0.981)2)10.17±0.981)10.33±1.031)组别Groups96h120h144h168h192h空白组Blankgroup0.55±0.500.52±0.330.41±0.170.41±0.170.52±0.33生理盐水组Salinegroup0.52±0.330.55±0.500.52±0.330.52±0.330.55±0.50模型组Modelgroup9.50±0.841)7.67±1.211)5.17±0.751)4.33±0.821)3.00±0.891)
注:与空白组比较,1)P<0.01;与生理盐水组比较,2)P<0.01;与本组造模后3 h比较,3)P<0.01。
Note. 1) Compared with the blank group,P<0.01. 2) Compared with the saline group,P<0.01. 3) Compared with the same group at 3 h after modeling,P<0.01.

注:A.空白组; B.生理盐水组; C.模型组。A、B中箭头所示正常滑膜组织,C中箭头所指表示滑膜组织有增生、大量炎性细胞浸润等。图3 造模后48 h各组大鼠踝关节滑膜组织病理(HE染色,×200)Note.A: Blank group; B: Saline group; C: Model group. A, B arrows refer to normal synovial tissue. C arrow refers to the proliferation of synovial tissue, a large number of inflammatory cell infiltration, etc.Fig.3 Histological changes of the ankle joint synovial tissues in the rats at 48 hours after modeling
3 讨论
动物模型是医药学研究的重要工具[13]。通过踝关节局部注射MSU晶体混悬液复制AGA大鼠模型,其操作简便,可控性高,重复性好,目前应用最多。与其它造模方法相比,该造模方法对动物创伤较小,不会造成不可逆性伤害,方便后续研究,且模型的病理变化与痛风急性发作时表现出的红肿热痛等趋势一致,其症状、体征也较符合痛风急性发作时的临床表现[14,15]。因此,本实验采用该造模方法复制AGA大鼠模型。
目前,判断AGA动物模型成模指标暂无统一标准[16]。梁莎等[15]将病理切片中关节腔内大量炎症细胞浸润、关节滑膜水肿作为判断成模的指标,仅从组织病理形态学改变判定是否成模,而实验过程中动物模型的表现是否与痛风发作时临床表现相一致尚不可知。若把模拟痛风发作时的表现与组织病理形态学改变相结合,共同作为判定成模的依据将更具说服力。为此,本实验选取与AGA密切相关的局部皮温、肿胀、步态、关节液炎性细胞数、关节组织病理形态学改变等指标来综合判断模型成功与否。造模后4 h时模型组踝关节局部出现明显红肿,皮温升高,行走迟缓、足爪卷曲,甚至出现跛行、右足蜷缩等,其外在表现与临床痛风急性发作时类似。与空白组比较,模型组踝关节肿胀明显,局部皮温升高,步态异常,踝关节液炎性细胞增多,滑膜组织增生、毛细血管充血、滑膜细胞排列紊乱,与空白组比较差异有显著性(P<0.01)。上述模型组表现出的红肿热痛与其微观上表现出的关节液炎性细胞增多、滑膜组织病理形态学变化一致,且这与临床痛风急性发作类似,提示本实验造模成功,所选取成模的判断指标可行。
在动物模型的研究中,保持模型稳定,减少复制模型的自愈率尤为重要[17]。本实验在造模后4~168 h观察到模型大鼠在肿胀、皮温、步态异常等方面较稳定,且踝关节液炎性细胞数及滑膜病理变化仍提示为AGA模型,说明该模型在造模后1周内保持稳定。由于沉积在关节腔中的尿酸盐持续刺激,在造模后192 h模型组痛风性关节炎外在表现虽消失,但炎性细胞数及滑膜病理仍未恢复正常,模型可能由痛风急性发作期进入慢性期。总之,造模结束后1周大鼠症状、体征、踝关节液炎性细胞数及滑膜病理变化均符合AGA大鼠模型的鉴定指标。
通过本实验证实,踝关节局部注射MSU混悬液引起的大鼠相关症状、体征及组织病理学改变与痛风急性发作时的临床表现类似,且造模后1周内模型依旧保持稳定,提示此法建立的AGA大鼠模型是确实可靠且相对稳定的,是构建AGA动物模型的理想方法。
[1] Richette P, Bardin T. Gout [J]. Lancet, 2010, 375(9711): 318-328.
[2] 杨玲玲, 黄丽贞, 邓家刚. 痛风性关节炎动物模型研究进展 [J]. 世界中医药, 2015, 10(9): 1461-1463.
[3] Sabina EP, Nagar S, Rasool M. A role of piperine on monosodium urate crystal-induced lnflammation - an experimental model of gouty arthritis [J]. lnflammation, 2011, 34(3): 184-192.
[4] 杨妍华, 尹莲, 王明艳, 等. 尿酸钠诱导HUVEC损伤的急性痛风模型研究 [J]. 中华中医药学刊, 2010, 28(3): 592-594.
[5] 李荣华, 聂慧, 刘友章. 痛风动物模型的研究现状及评价 [J]. 时珍国医国药, 2010, 21(6): 1510-1512.
[6] 钱伯初, 史红, 郑晓亮. 尿酸钠结晶诱导痛风性关节炎动物模型研究进展 [J]. 中国比较医学杂志, 2008, 18(6):65-69.
[7] 姚丽, 刘树民, 于书仪. 痛风性关节炎动物模型的改良 [J]. 中国实验动物学报, 2009, 17(3): 210-212.
[8] 中华人民共和国卫生部药政局. 新药(西药)临床前研究指导原则汇编(药学·药理学·毒理学)[S]. 1993: 120-121.
[9] Coderre, TJ, Wall PD. Ankle skin urate arthritis in rats provides a useful tool for the evaluation of analgesic and anti-arthritic agents [J]. Pharmacol Biochem Behav, 1988, 29(3): 461-466.
[10] Chen SY, Chen CL, Shen ML, et al. Clinical features of familial gout and effects of probable genetic association between gout and its related disorders [J]. Metabolism, 2001, 50(5): 1203-1207.
[11] 沈维增, 吕红梅, 陈晓峰, 等. 当归拈痛汤对急性痛风性关节炎模型大鼠步态和关节肿胀度的影响 [J]. 中华中医药学刊, 2012, 30(1): 165-166.
[12] 刘建文. 药理实验方法学—新技术与新方法 [M]. 2版, 北京: 化学工业出版社, 2008.
[13] 吕爱平. 病证结合动物模型研究:从理论创新到技术挑战 [J]. 中国中西医结合杂志, 2013, 33(1): 6-7.
[14] Pokharel K, Yadav BK, Jha AB, et al. Estimation of serum uric acid in cases of hyperuricaemia and gout [J]. JNMA J Nepal Med Assoc, 2011, 51(181): 15-20.
[15] 吕军, 方和金, 吴涛. 一种改进的痛风性关节炎大鼠模型制备方法 [J]. 中国现代医学杂志, 2014, 24(18): 17-21.
[16] 梁莎, 夏有兵, 朱毅, 等. 急性痛风性关节炎大鼠局部造模方法的改良 [J]. 中国现代医学杂志, 2014, 2(24): 10-13.
[17] 姚瑶, 林晓春, 雷晓林, 等. 慢性萎缩性胃炎大鼠模型的建立及稳定性评价 [J]. 中药药理与临床, 2013, 29(4): 162-166.
Establishmentofaratmodelofacutegoutyarthritisandobservationofthemodelmaintenancetime
CAI Tang-yan1, WANG Xu1, HE Zhen1, ZHENG Nai-xi1, ZHAN Zheng-xuan1, ZHANG Ying-jie1, ZHANG Yi-qiang1, SU You-xin1,2*
(1. Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China; 2. Fujian Health College, Fuzhou 350101, China)
ObjectiveTo establish a model of acute gouty arthritis(AGA) in rats and observe its maintenance time.MethodsThe AGA model of rats was established by injecting monosodium urate (MSU) at the concentration of 25 mg/mL into the ankle joint cavity. The rats were observed for 8 d at different time points. Skin temperature, degree of joint swelling, gait, inflammatory cells in synovial fluid, histopathological changes of synovial tissue and other indicators were observed to determine whether the modeling and maintenance time were successful.ResultsAt 3 h after modeling, differences in the swelling of ankle joint, increase of skin temperature, abnormal gait, the number of inflammatory cells in synovial fluid, synovial hyperplasia, capillary congestion, and disarrangement of synovial cells in the rats were observed in the saline group and the model group (P<0.01). At 4 hours after modeling, the above mentioned inflammatory changes in the saline group were significantly reduced, compared with that at 3 h, showing a significant difference (P<0.01), while the inflammatory changes of the model group were increased significantly compared with that at 3 hours (P<0.01), and showed significant difference compared with the saline group (P<0.01). At 24 h after modeling, the indexes in the rats of saline group returned to normal, but the inflammation of the model group was increased. At 48-72 h after modeling, the local inflammation such as ankle swelling, skin temperature, and abnormal gait of the rats in the model group reached a peak. The inflammation of the ankle joint in the model group was gradually reduced from 96 to 168 h after the model was established, but there were still significant differences in the indexes compared with the blank group (P<0.01). At 192 h after modeling, the joint swelling, skin temperature and abnormal gait of the rats in the model group returned to normal, however, there were significant differences in the number of inflammatory cells and the pathological changes of synovial membrane compared with the blank group (P<0.01).ConclusionsA rat model of AGA can be successfully prepared and identified at 4 h after modeling by injection of MSU crystal suspension into the ankle joint cavity. This rat model of AGA can be maintained at least 168 hours after modeling.
Acute gouty arthritis; Rat models; Monosodium urate, MSU; Maintenance time
SU You-xin. E-mail: suyouxin777@hotmail.com
Q95-33
A
1005-4847(2017) 05-0494-06
10.3969/j.issn.1005-4847.2017.05.005
2017-03-21
国家自然科学基金资助项目(No.81473495)。
蔡唐彦(1990-),女,硕士,主要研究方向:骨关节疾病的中医药防治与康复。E-mail: 790503018@qq.com
苏友新(1969-),男,博士,教授,主要研究方向:骨关节疾病康复的基础与临床研究。E-mail: suyouxin777@hotmail.com
