骨内单次注射小剂量辛伐他汀对大鼠心梗后血管新生的影响
2017-11-01刘灿海宝张稳祝俊雄王红李子健徐迎胜宋纯理
刘灿,海宝,张稳,祝俊雄,王红,2,李子健,徐迎胜,宋纯理,2*
(1. 北京大学第三医院骨科,北京 100191; 2. 脊柱疾病研究北京市重点实验室,北京 100191; 3. 北京大学第三医院心内科,北京 100191; 4. 北京大学第三医院神经内科,北京 100191)
研究报告
骨内单次注射小剂量辛伐他汀对大鼠心梗后血管新生的影响
刘灿1,海宝1,张稳1,祝俊雄1,王红1,2,李子健3,徐迎胜4,宋纯理1,2*
(1. 北京大学第三医院骨科,北京 100191; 2. 脊柱疾病研究北京市重点实验室,北京 100191; 3. 北京大学第三医院心内科,北京 100191; 4. 北京大学第三医院神经内科,北京 100191)
目的研究骨内局部单次注射小剂量辛伐他汀对大鼠心梗后血管新生和心功能的影响。方法Wistar 大鼠随机分为假手术组、心肌梗死模型组和骨内注射辛伐他汀组(n=12)。冠状动脉左前降支结扎建立大鼠心肌梗死模型。24 h后实验组左胫骨内单次注射辛伐他汀0.5 mg,4 周后分别通过小动物超声心动图评价左室功能,三苯基氯化四氮唑(TTC)染色计算心肌梗死面积,免疫荧光染色检测局部血管新生情况。结果超声心动图结果表明心肌梗死 4 周后左心室收缩功能明显下降,骨内注射辛伐他汀对大鼠心肌梗死后左心室功能未见明显改善;TTC染色发现骨内注射辛伐他汀组心肌梗死面积未见明显减少;免疫荧光染色显示,骨内注射辛伐他汀组心肌血管密度没有显著增加。结论大鼠心梗24 h后骨内单次注射小剂量辛伐他汀(0.5 mg),心肌梗死面积、血管新生及心脏功能无显著改善。
骨内注射;辛伐他汀;血管新生;心肌梗死;内皮祖细胞
传统观念认为骨骼是储藏钙磷、保护内脏的惰性器官。近年来研究发现骨骼还是重要的内分泌器官,被视为整合生理学的典范,不仅是靶器官,还是重要的调控器官[3,4],并通过“骨-血管轴”影响血管功能[5]。骨骼不仅包含成骨细胞、破骨细胞和骨细胞,还有丰富巨噬细胞、神经和脂肪组织等,更富集大量的内皮细胞、造血干细胞等。骨骼通过造血干细胞龛(niche),即骨龛和血管龛协同调控内皮祖细胞(endothelial progenitor cells, EPCs)的增殖、动员和分化[6,7],EPCs可募集至缺血损伤部位,参与血管新生、促进损伤修复[8]。
研究发现,目前广泛用于治疗高胆固醇血症的他汀类药物还具有促进成骨、成血管等多效作用[9,10],并促进EPCs的动员[11,12]。但他汀类药物的靶器官是肝脏,口服后不到5%能够进入血液循环,骨骼中的浓度更低[10],局部施用辛伐他汀将提高其降脂外作用的生物利用度。骨内注射(intraosseous injection, IO)方法已有近百年的历史,具有简单、快速的特点,骨内注射的药物能够很快进入血液循环[13],其局部药物停留时间短,而泊洛沙姆407温敏性水凝胶具有很好的药物缓释作用,可作为骨内注射药物的缓释载体[9],同时骨髓腔为骨内给药提供了绝佳的空间。我们在前期研究中发现,骨内单次注射小剂量辛伐他汀动员EPCs促进1型糖尿病大鼠创面组织的血管新生,加快糖尿病皮肤创面的愈合过程(实验结果另文发表)。我们由此设想骨内单次注射小剂量辛伐他汀是否也可以促进心肌梗死后的血管新生。
1 材料与方法
1.1材料
1.1.1 实验动物
SPF级雄性Wistar大鼠36只,6~7周龄,体重180~200 g,购于北京大学医学部实验动物科学部【SCXK(京)2016-0010】。所有大鼠组织取材于北京大学医学部实验动物中心动物实验设施内进行【SYXK(京)2016-0041】。所有动物实验设计均通过北京大学第三医院动物伦理审查委员会的批准。
1.1.2 仪器及试剂
小动物呼吸机(上海奥尔科特公司);Vevo2100型高分辨率小动物超声影像系统(加拿大Visual Sonics公司);显微镜(莱卡公司);冰冻切片机(莱卡公司);电子分析天平(上海精密仪器公司);三苯基氯化四氮唑(Sigma公司);OCT冰冻切片包埋剂(日本Tissue-Tek公司);免疫荧光所用抗体(vWF, Santa Cruz Biotechnology; α-SMA, Abcam; Alexa Flour 488/ 594, Life Technologies-Invitrogen; Hoechst 32442, 北京索莱宝公司)。
1.1.3 药物
按照本课题组的制备方法[9,14],配制温敏性辛伐他汀/泊洛沙姆407水凝胶。将泊洛沙姆407(BASF, Ludwigshafen, Germany; 25%, w/w)缓慢加入等张的磷酸盐缓冲液中(PBS, pH 7.4, 4℃),均匀搅拌直至溶液完全澄清。将辛伐他汀加入已配制好的泊洛沙姆溶液中(4℃),搅拌均匀,辛伐他汀终浓度为5 mg/mL。
1.2方法
1.2.1 大鼠心梗模型的制备
参照文献[15]制作大鼠心肌梗死模型,腹腔内注射10%的水合氯醛(3.3 mL/kg)麻醉,气管插管后应用动物呼吸机予以空气人工通气。开胸暴露出心脏,在左心耳根部与肺动脉圆锥交点下方大约2 mm处结扎冠状动脉左前降支,结扎成功可见心尖部位心肌变苍白。假手术组只穿线不结扎。术后关胸常规肌注30×104U青霉素。实验分为假手术组(Sham,n=12)、心梗模型组(MI,n=12)和胫骨内注射辛伐他汀0.5 mg组(Sim 0.5 mg,n=12)。
术后24 h,胫骨内注射辛伐他汀0.5 mg组大鼠腹腔注射麻醉,仰卧位固定大鼠,于大鼠左胫骨近端常规备皮,消毒,铺巾。在其左侧膝关节用1 mL注射器于髁间窝部向髓腔内注射辛伐他汀0.5 mg。
1.2.2 超声心动检测
使用Vevo 2100型高分辨率小动物超声影像系统,在二维图像的引导下取M型曲线并进行测量,测量的指标包括:左心室收缩末期前臂厚度(AWST)和舒张期前壁厚度(AWDT);左室收缩末期内径(LVESD)和舒张末期内径(LVEDD);左心室短轴缩短率(FS)=(LVEDD-LVESD)/LVEDD × 100%;左心室射血分数(EF)=SV/LVEDV × 100%。
1.2.3 大鼠心肌肥厚程度检测
将取出的心脏用预冷的PBS冲洗去血液,滤纸吸干游离的水分,称重。取大鼠胫骨,测量其长度。以心脏重量与胫骨长度的比值(HW/TI, mg/mm)来衡量心脏肥大程度[16]。
1.2.4 三苯基氯化四氮唑(TTC)染色
参照文献介绍的方法[17],大鼠心梗24 h后骨内注射辛伐他汀4周后,取心脏标本冷冻并沿心脏纵轴连续切片,将心室部分每隔2 mm横断切成4片,置入1% TTC溶液中,37℃避光孵育15 min,在体视显微镜下观察,Image J软件统计分析心肌梗死区面积。
1.2.5 免疫荧光
取材的创面组织4%多聚甲醛室温固定24 h后,PBS清洗。30%蔗糖溶液脱水24 h后,标本通过OCT包埋并液氮冻存。冰丙酮固定切好的冰冻切片(6 μm)10 min,0.3% Triton X孵育10 min,接着血清封闭液室温封闭30 min。一抗为小鼠抗vWF、兔抗α-SMA,二抗为Alexa Flour 488,Alexa Flour 594;Hoechst 32442复染细胞核。荧光显微镜下随机选取10个视野,Image J软件统计分析毛细血管及小动脉血管密度。
1.3统计学处理

2 结果
2.1骨内注射辛伐他汀未见其改善心梗后大鼠的心脏功能
心脏二维超声检测结果表明,在心梗术后第4周,左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室收缩末期前壁厚度(AWST)、左室舒张末期前壁厚度(AWDT)、左室短轴缩短率(FS)、左室射血分数(EF)等指标与假手术组相比明显下降,标志着心梗模型的成功建立(表1)。骨内注射辛伐他汀组与心肌梗死模型组相比,左室收缩期内径、左室舒张期内径、左室收缩期前壁厚度、左室舒张期前壁厚度、左室短轴缩短率及左室射血分数等指标差异无显著性(表1)。

表1 心脏二维超声检测结果Tab.1 Results of echocardiographic evaluation of the hearts
注:与假手术组比较,*P<0.05。
Note. Compared with the sham group,*P<0.05.
2.2心肌梗死后大鼠体重及心脏大体变化情况
实验期间每周监测大鼠的体重,大鼠心梗模型组体重与假手术组明显降低,且这种差异在整个实验观察期间都存在,骨内注射辛伐他汀组大鼠体重与心梗模型组相比差异无显著性(P>0.05,图1A),各组间心胫比结果差异无显著性(P>0.05,图1B)。处死取材后可见心肌梗死模型组左心室前下壁因缺血缺氧而明显变薄(图2)。
2.3骨内注射辛伐他汀对心肌梗死后面积的影响
心肌进行TTC染色,白色为心肌梗死区域,红色为正常心肌区域,我们发现在心肌梗死模型组和Sim 0.5 mg组,其梗死面积均在30%~40%之间,差异无显著性(图3,P>0.05)。
2.4骨内注射辛伐他汀对梗死后心肌的微血管密度的影响
选用vWF与α-SMA进行免疫荧光双标评价血管密度,其中vWF代表毛细血管、α-SMA代表小动脉血管密度(图4)。心肌梗死后其血管密度显著高于假手术组(P<0.05),但在心梗模型组与骨内注射辛伐他汀组之间血管密度差异无显著性(P>0.05)。
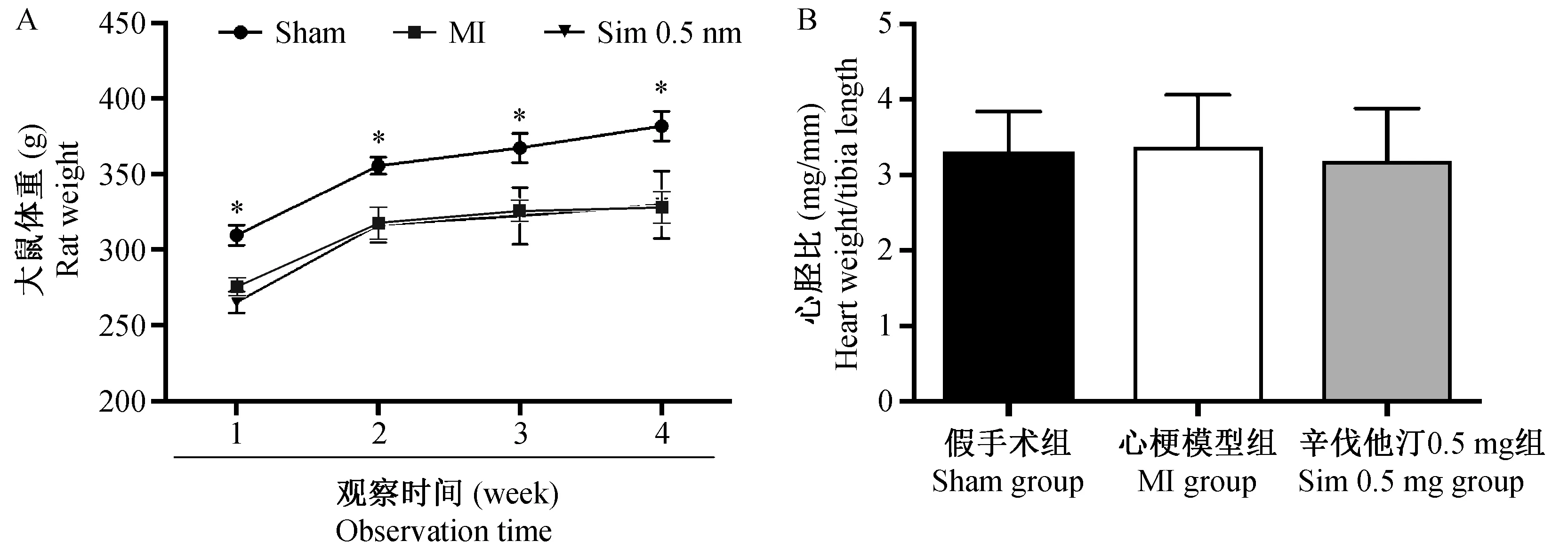
图1 大鼠体重动态变化(A)及心胫比统计图(B)。*P<0.05Fig.1 Dynamic changes of body weight and analysis of the heart weight/tibia length ratios

图2 骨内单次注射辛伐他汀(0.5 mg)4周后各组心脏大体观Fig.2 Gross appearance of the heart at 4 weeks after single intraosseous injection of simvastatin (0.5 mg)
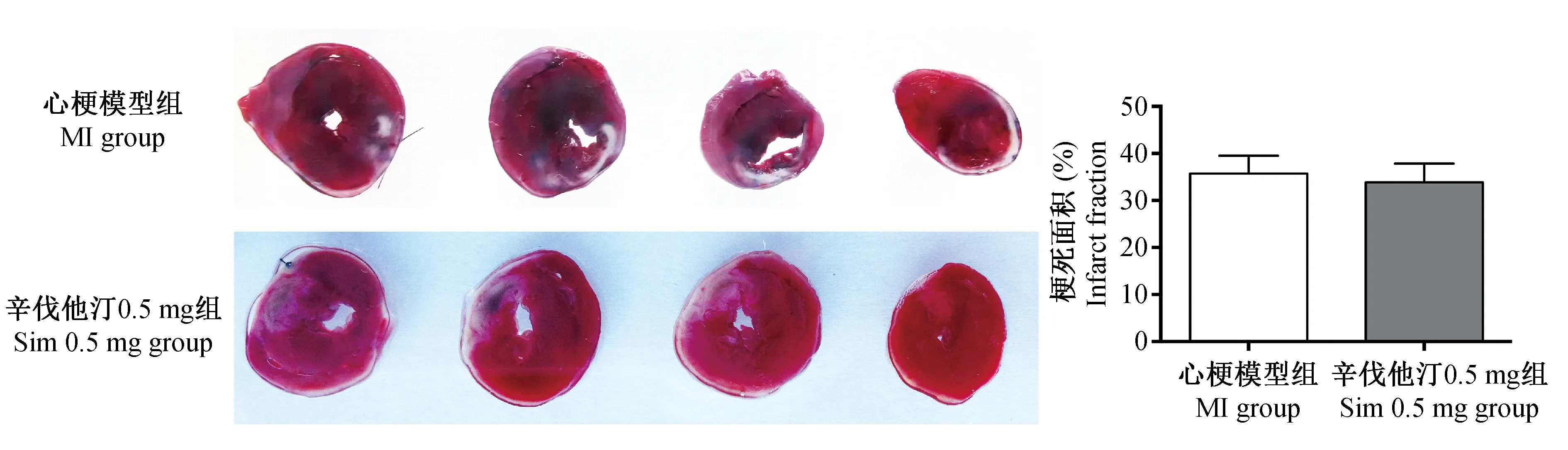
图3 大鼠心肌梗死24 h后IO辛伐他汀4周,TTC染色及梗死面积统计Fig.3 TTC staining and statistical analysis of the myocardial infarction at 4 weeks after intraosseous injection of simvastatin
3 讨论
传统观念认为骨骼是支持机体基本结构和参与运动及钙磷代谢的“惰性器官”,近年来研究发现骨骼也是重要的“内分泌器官”[18],骨骼中的成骨细胞、破骨细胞及骨细胞等能主动合成和分泌多种骨调节蛋白、细胞因子、和心血管活性肽等多种生物活性物质,通过外周血液循环以远距离分泌的方式来调节远隔器官组织的代谢和功能,被视为整合生理学的典范[3,4]。而“骨-血管轴”概念的提出更是表明骨骼与血管之间有着密切的联系,能相互调节[19]。骨骼不仅包含成骨细胞、破骨细胞和骨细胞,还有丰富的内皮细胞、巨噬细胞、神经和脂肪,更富集大量造血干细胞、骨髓基质干细胞。
本实验证实,通过结扎左冠状动脉前降支造成的大鼠心肌梗死模型,大鼠心梗后4周其左心室收缩泵血功能明显下降,同时左心室明显扩大,缺血区的心室壁变薄塌陷。大量研究证明,心肌梗死后通过刺激局部区域的血管新生和微血管侧支循环,使得心肌生长和血管系统之间保持一个相对均衡的状态,对于梗死或者缺血心肌的修复和心肌功能的提高至关重要[20]。心肌缺血可产生相应的刺激因子来启动血管新生,但不足以充分代偿冠脉阻塞造成的血供不足[2]。我们的结果也发现大鼠心肌梗死后其血管密度明显高于假手术组,表明心肌缺血缺氧后可通过上调促血管生成因子或者动员内源性的成血管细胞来促进血管新生。
目前临床上治疗心肌梗死的方法主要有4种:药物治疗、经皮冠脉介入术、冠脉旁路搭桥术和骨髓间充质干细胞移植术[21]。虽然这些治疗方法在临床上被普遍应用并取得了很大进展,但由于受多种因素的限制以及其治疗后的高复发率而不能满足临床治疗的需求。
治疗性血管新生是目前世界医学领域研究的热点,将外源性成血管因子或成血管细胞以不同的方式植入体内缺血部位,通过在原有的血管系统基础上促进或者诱导侧支血管的新生来恢复受损缺血心肌的血流恢复,从而改善患者的症状和预后[1,2]。内皮祖细胞(endothelial progenitor cells, EPCs)是一类能归巢于缺血部位并可以直接分化为血管内皮细胞的前体细胞,能参与血管新生及机体局部缺血组织的修复,这为改善心肌的灌注,从而提高心肌梗死后的心功能成为可能[22]。骨髓是EPCs的主要来源,而在正常生理状态下,骨髓中的EPCs位于骨髓龛中,处于静息状态,外周循环中EPCs的数量是非常有限的。正常人体,即使老年人也大量存在内源性的EPCs,如何通过动员内源性EPCs,使得外周血中EPCs数量大大增加,或为缺血性损伤的治疗带来新的希望。
有研究发现,他汀类药物能有效促进EPCs的增殖、分化、迁移和粘附能力[23],增强EPCs的动员,从而促进血管新生[11]。此外,他汀类药物一方面可直接通过不同作用机制延缓心梗后心室重构进程,从而对心功能起着一定的保护作用[12,24-29],另一方面还能促进心梗后的血管新生[30]。本课题前期研究发现,骨骼局部应用辛伐他汀能有效动员EPCs至外周循环血,并能通过促进EPCs动员及组织血管新生,而加快1型糖尿病大鼠创面愈合速率(实验数据另文发表)。因此基于以上理论基础,我们推测骨内局部注射辛伐他汀可通过动员EPCs促进大鼠心梗后血管新生,从而对心功能发挥保护作用。但本实验结果发现,心梗后4周通过小动物二维超声检测大鼠左心功能,发现其左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室收缩末期前壁厚度(AWST)、左室舒张末期前壁厚度(AWDT)、左室短轴缩短率(FS)、左室射血分数(EF)等左心功能指标显著下降,而未见骨内注射辛伐他汀显著改善心梗后心功能的作用。
虽然有报道他汀类药物可以通过其抗炎、减轻氧化应激等机制来改善心梗后心功能[26,27,29,31,32],但治疗时间长。在本实验中,我们给药的时间选择在造成心梗模型后24 h,可能因其错过了治疗时间窗而没能发挥促进血管新生的作用;或者骨内单次注射辛伐他汀可能因药物作用时间过短,而没能表现出心脏保护作用。正常情况下,缺血性损伤会动员内源性EPCs归巢至缺血损伤部位,参与血管新生、促进损伤修复。但在糖尿病、高血脂、衰老等病理状态下,EPCs的动员受到影响,使得缺血损伤诱导的血管新生障碍,从而影响组织再生修复[33,34]。我们之前的研究是在1型糖尿病大鼠模型中发现骨内单次注射辛伐他汀促进EPCs动员、血管新生和损伤修复,而在本研究中采用正常大鼠,其EPCs动员正常,而辛伐他汀骨内注射后并未显著促进EPCs动员,从而使得心梗后血管新生没有显著差异。
另外,心脏的循环血液供应不同于其他器官,心肌收缩过程中对供应心肌血供的血管产生快速挤压,循环中的EPCs难以在缺血损伤的心肌局部滞留继而发挥成血管作用,如同肿瘤细胞很难转移到心脏一样[35],即使大量的EPCs动员到循环中,仍难以在缺血损伤部位滞留从而发挥促进血管新生和损伤组织的修复再生作用。
总之,骨内注射小剂量辛伐他汀虽然可以动员内源性EPCs,促进糖尿病大鼠血管新生和缺血性损伤组织的修复,但对大鼠心肌梗死并未观察到明显的促血管新生作用,其中的原因和未来解决对策有待于进一步深入研究。
志谢:感谢首都医科大学医学实验与测试中心许晴老师对大鼠心梗超声心动检测的帮助。
[1] Deveza L, Choi J, Yang F. Therapeutic angiogenesis for treating cardiovascular diseases [J]. Theranostics, 2012, 2(8): 801-814.
[2] Mitsos S, Katsanos K, Koletsis E, et al. Therapeutic angiogenesis for myocardial ischemia revisited: basic biological concepts and focus on latest clinical trials [J]. Angiogenesis, 2012, 15(1): 1-22.
[3] Karsenty G, Ferron M. The contribution of bone to whole-organism physiology [J]. Nature, 2012, 481(7381): 314-320.
[4] Karsenty G, Oury F. Biology without walls: the novel endocrinology of bone [J]. Annu Rev Physiol, 2012, 74: 87-105.
[5] Thompson B, Towler DA. Arterial calcification and bone physiology: role of the bone-vascular axis [J]. Nat Rev Endocrinol, 2012, 8(9): 529-543.
[6] Bianco P. Bone and the hematopoietic niche: a tale of two stem cells [J]. Blood, 2011, 117(20): 5281-5288.
[7] Morrison SJ, Scadden DT. The bone marrow niche for haematopoietic stem cells [J]. Nature, 2014, 505(7483): 327-334.
[8] Li YF, Ren LN, Guo G, et al. Endothelial progenitor cells in ischemic stroke: an exploration from hypothesis to therapy [J]. J Hematol Oncol, 2015, 8: 33.
[9] Fu X, Tan J, Sun CG, et al. Intraosseous injection of simvastatin in poloxamer 407 hydrogel improves pedicle-screw fixation in ovariectomized minipigs [J]. J Bone Joint Surg Am, 2016, 98(22): 1924-1932.
[10] Tan J, Fu X, Sun CG, et al. A single CT-guided percutaneous intraosseous injection of thermosensitive simvastatin/poloxamer 407 hydrogel enhances vertebral bone formation in ovariectomized minipigs [J]. Osteoporos Int, 2016, 27(2): 757-767.
[11] Llevadot J, Murasawa S, Kureishi Y, et al. HMG-CoA reductase inhibitor mobilizes bone marrow—derived endothelial progenitor cells [J]. J Clin Invest, 2001, 108(3): 399-405.
[12] Sheng FQ, Xu R, Cheng LX, et al. In rats with myocardial infarction, interference by simvastatin with the TLR4 signal pathway attenuates ventricular remodelling [J]. Acta Cardiol, 2009, 64(6): 779-785.
[13] Luck RP, Haines C, Mull CC. Intraosseous access [J]. J Emerg Med, 2010, 39(4): 468-475.
[14] Liu H, Li W, Liu C, et al. Incorporating simvastatin/poloxamer 407 hydrogel into 3D-printed porous Ti6Al4V scaffolds for the promotion of angiogenesis, osseointegration and bone ingrowth [J]. Biofabrication, 2016, 8(4): 045012.
[15] Hou Y, Huang C, Cai X, et al. Improvements in the establishment of a rat myocardial infarction model [J]. J Int Med Res, 2011, 39(4): 1284-1292.
[16] 杨承志,田爱炬,李子健,等. 异丙肾上腺素诱导FVB/N小鼠心脏肥大模型的建立 [J]. 北京大学学报(医学版), 2014, 46(6): 906-910.
[17] 杨涛涛,肖颖,陈民利,等. 大鼠心肌梗死模型构建和评价方法的改良 [J]. 中国比较医学杂志, 2014, 24(2): 46-51.
[18] 段晓辉,屈晓旋,唐朝枢,等. 骨骼的内分泌功能 [J]. 生理学进展, 2010, 41(4): 248-255.
[19] Fadini GP, Rattazzi M, Matsumoto T, et al. Emerging role of circulating calcifying cells in the bone-vascular axis [J]. Circulation, 2012, 125(22): 2772-2781.
[20] van der Laan AM, Piek JJ, van Royen N. Targeting angiogenesis to restore the microcirculation after reperfused MI [J]. Nat Rev Cardiol, 2009, 6(8): 515-523.
[21] Reddy K, Khaliq A, Henning RJ. Recent advances in the diagnosis and treatment of acute myocardial infarction [J]. World J Cardiol, 2015, 7(5): 243-276.
[22] Kawamoto A, Gwon HC, Iwaguro H, et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia [J]. Circulation, 2001, 103(5): 634-637.
[23] Liu Y, Wei J, Hu S, et al. Beneficial effects of statins on endothelial progenitor cells [J]. Am J Med Sci, 2012, 344(3): 220-226.
[24] Hayashidani S, Tsutsui H, Shiomi T, et al. Fluvastatin, a 3-hydroxy-3-methylglutaryl coenzyme a reductase inhibitor, attenuates left ventricular remodeling and failure after experimental myocardial infarction [J]. Circulation, 2002, 105(7): 868-873.
[25] Zhou R, Xu Q, Zheng P, et al. Cardioprotective effect of fluvastatin on isoproterenol-induced myocardial infarction in rat [J]. Eur J Pharmacol, 2008, 586(1-3): 244-250.
[26] Martin JH, Connelly KA, Boyle A, et al. Effect of atorvastatin on cardiac remodelling and mortality in rats following hyperglycemia and myocardial infarction [J]. Int J Cardiol, 2010, 143(3): 353-360.
[27] Bauersachs J, Galuppo P, Fraccarollo D, et al. Improvement of left ventricular remodeling and function by hydroxymethylglutaryl coenzyme a reductase inhibition with cerivastatin in rats with heart failure after myocardial infarction [J]. Circulation, 2001, 104(9): 982-985.
[28] Lee TM, Chou TF, Tsai CH. Effects of pravastatin on cardiomyocyte hypertrophy and ventricular vulnerability in normolipidemic rats after myocardial infarction [J]. J Mol Cell Cardiol, 2003, 35(12): 1449-1459.
[29] Zhang J, Cheng X, Liao YH, et al. Simvastatin regulates myocardial cytokine expression and improves ventricular remodeling in rats after acute myocardial infarction [J]. Cardiovasc Drugs Ther, 2005, 19(1): 13-21.
[30] Thirunavukkarasu M, Selvaraju V, Dunna NR, et al. Simvastatin treatment inhibits hypoxia inducible factor 1-alpha-(HIF-1alpha)-prolyl-4-hydroxylase 3 (PHD-3) and increases angiogenesis after myocardial infarction in streptozotocin-induced diabetic rat [J]. Int J Cardiol, 2013, 168(3): 2474-2480.
[31] Shen W, Shi HM, Fan WH, et al. The effects of simvastatin on angiogenesis: studied by an original model of atherosclerosis and acute myocardial infarction in rabbit [J]. Mol Biol Rep, 2011, 38(6): 3821-3828.
[32] Cho KI, Koo SH, Cha TJ, et al. Simvastatin attenuates the oxidative stress, endothelial thrombogenicity and the inducibility of atrial fibrillation in a rat model of ischemic heart failure [J]. Int J Mol Sci, 2014, 15(8): 14803-14818.
[33] Tepper OM, Carr J, Allen RJ Jr, et al. Decreased circulating progenitor cell number and failed mechanisms of stromal cell-derived factor-1alpha mediated bone marrow mobilization impair diabetic tissue repair [J]. Diabetes, 2010, 59(8): 1974-1983.
[34] Zechariah A, ElAli A, Hagemann N, et al. Hyperlipidemia attenuates vascular endothelial growth factor-induced angiogenesis, impairs cerebral blood flow, and disturbs stroke recovery via decreased pericyte coverage of brain endothelial cells [J]. Arterioscler Thromb Vasc Biol, 2013, 33(7): 1561-1567.
[35] Ren DY, Fuller ND, Gilbert SA, et al. Cardiac tumors: clinical perspective and therapeutic considerations [J]. Curr Drug Targets, 2016, (E-pub Ahead of Print).
Effectofsingleintraosseousinjectionofsimvastatinonneoangiogenesisinmyocardialinfarctioninrats
LIU Can1, HAI Bao1, ZHANG Wen1, ZHU Jun-xiong1, WANG Hong1,2, LI Zi-jian3, XU Ying-sheng4, SONG Chun-li1,2*
(1. Department of Orthopedics, Peking University Third Hospital, Beijing 100191, China; 2. Beijing Key Laboratory of Spinal Diseases, Beijing 100191; 3. Department of Cardiology, Peking University Third Hospital, Beijing 100191; 4. Department of Neurology, Peking University Third Hospital, Beijing 100191)
ObjectiveTo explore the effect of single local intraosseous injection of small dose simvastatin on the angiogenesis and cardiac function in rats after myocardial infarction.MethodsAdult male Wistar rats were divided into sham operation group, myocardial infarction model group and intraosseous injection of simvastatin 0.5 mg group (alln=12 per group). The left anterior descending branch of coronary artery was ligated to establish a rat model of myocardial infarction. The left ventricular function was evaluated by small animal echocardiography at 4 weeks postoperatively. The rest of the rats were sacrificed, the myocardial infarct size was evaluated by TTC staining, and the myocardial neovascularization was detected by immunofluorescence staining.ResultsWe successfully established the rat model of myocardial infarction. The echocardiography showed that the left ventricular systolic function was decreased significantly at 4 weeks after myocardial infarction. Intraosseous injection of simvastatin (0.5 mg) did not improve the left ventricular function after myocardial infarction in the rats. TTC staining showed that intraosseous injection of simvastatin did not reduce myocardial infarct size. Immunofluorescence staining showed that the myocardial capillary density of simvastatin group was slightly higher than that of myocardial infarction model group, but showing no significant difference between them.ConclusionsIntraosseous injection of simvastatin 0.5 mg 24 hours after myocardial infarction cannot significantly promote myocardial angiogenesis, which is believed to be beneficial to the revascularization after ischemia, and thus failed to improve the cardiac function.
Intraosseous injection; Simvastatin; Neovascularization; Myocardial infarction; Endothelial progenitor cells
SONG Chun-li. Email: schl@bjmu.edu.cn
Q95-33
A
1005-4847(2017) 05-0506-07
10.3969/j.issn.1005-4847.2017.05.007
治疗性血管新生(therapeutic angiogenesis),又称“药物搭桥”,即通过药物等某些干预措施,促进缺血组织的血管新生,为缺血损伤提供了新的治疗策略[1]。有临床前实验表明,通过使用促血管生成因子重组蛋白、基因及干/祖细胞移植等方法能有效增强新的侧支血管形成来改善缺血症状[2]。但存在干细胞来源、伦理等限制。如何动员内源性干细胞,促进缺血损伤组织的血管新生将为治疗性血管新生提供新的研究方向。
2017-01-05
国家自然科学基金(NO.81672133,81641079);国家高技术研究发展计划(863计划NO.2015AA020304)。
刘灿(1991-),男,硕士研究生,专业:外科学。Email: lcdyx2014@126.com
宋纯理(1971-),男,博士生导师,研究员,研究方向:骨质疏松、骨折愈合。Email: schl@bjmu.edu.cn
