丹酚酸A改善ZDF大鼠视网膜病变及其作用机制
2017-11-01马全鑫陈小真戎亦骊黄俊杰朱科燕施佳君李园园陈民利
马全鑫,陈小真,2,戎亦骊,黄俊杰,朱科燕,陈 诚,施佳君,李园园,陈民利*
(1.浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053; 2.温州医科大学附属第二医院,浙江 温州 325027)
研究报告
丹酚酸A改善ZDF大鼠视网膜病变及其作用机制
马全鑫1,陈小真1,2,戎亦骊1,黄俊杰1,朱科燕1,陈 诚1,施佳君1,李园园1,陈民利1*
(1.浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053; 2.温州医科大学附属第二医院,浙江 温州 325027)
目的观察丹酚酸A(SAA)对Zucker糖尿病肥胖(ZDF)大鼠视网膜病变的干预作用,探讨SAA可能的作用机制。方法取7~8周龄雄性ZDF大鼠32只,Purina#5008饲料饲喂4周后,按血糖平均分为模型对照组,SAA高、低剂量组与二甲双胍(Met)组,每组8只。另取同龄雄性ZL大鼠8只作为正常对照。SAA低、高剂量组每日尾静脉注射SAA 0.5 mg/kg、1 mg/kg,Met组每日经口灌胃Met 200 mg/kg,连续给药12周,观察ZDF大鼠白内障发生率和视网膜病理学改变,并检测血糖血脂、糖化血红蛋白(HbA1c)和血清白介素1(IL-1)、IL-6、氧化性低密度脂蛋白(ox-LDL)、丙二醛(MDA)含量和脂蛋白相关磷脂酶A2(Lp-PLA2)的活性,以及尿液中转铁蛋白(TRF)、视黄醇结合蛋白(RBP)的含量。结果模型对照组大鼠血糖、血脂及HbA1c均上升,糖尿病性白内障发病率68.75 %,视网膜基底增厚和微血管病变,血清IL-1、IL-6、ox-LDL和MDA含量和Lp-PLA2活性显著升高,尿液中TRF和RBP含量亦显著升高。给予SAA后,ZDF大鼠白内障发病率降低,视网膜病理学形态有不同程度的改善,血清IL-1、IL-6、ox-LDL、MDA含量和Lp-PLA2活性下降,尿液中TRF、RBP含量亦下降。结论SAA能改善ZDF大鼠糖尿病视网膜病变,降低白内障发生率,其作用途径可能与抑制慢性炎症、防止脂质过氧化和降低Lp-PLA2活性有关。
2型糖尿病;视网膜病变;Lp-PLA2;ZDF大鼠
近年来,全球糖尿病发病率快速上升,其中2型糖尿病占85%[1]。2型糖尿病是一种代谢紊乱性疾病,可引发多种微血管和大血管并发症。糖尿病视网膜病变(diabetic retinopathy,DR)是2型糖尿病的主要并发症之一。长期的高血糖、高胰岛素及慢性炎症反应会引起视网膜不可逆的病理变化,具体表现为微动脉瘤、微血管病变、视网膜出血、出现视网膜新生血管及黄斑水肿等[2, 3],最终导致视网膜脱离而失明,严重影响患者的生活质量。因此改善或减缓糖尿病患者的视网膜病变至关重要。
丹酚酸A(salvianolic acid A,SAA)是我国传统药用植物丹参(SalviamiltiorrhizaBunge)中的活性最强的酚酸类物质。据报道,SAA具有显著的抗炎、抗氧化、保护血管内皮细胞、抗纤维化和防治1型糖尿病并发症等药理活性[4-6],这些药理作用在一定程度上与DR的防治机制相一致。因此,本文使用ZDF大鼠作为DR动物模型,观察SAA对DR的防治作用,并探讨SAA可能的作用机制,为SAA的临床应用提供参考。
1 材料和方法
1.1实验动物
32只SPF级7~8周龄雄性Zucker糖尿病肥胖(Zucker diabetic fatty,ZDF)大鼠,体重(200±10)g及8只同周龄的雄性Zucker瘦型(Zucker lean,ZL)大鼠,体重(170±10)g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2012-001];饲养于浙江中医药大学动物实验研究中心屏障实验室[SYXK(浙)2013-184],环境温度:(22±2)℃,相对湿度:50% ~60%,光照:12 h/12 h明暗交替,噪声<50 dB;在IVC笼内饲养,自由饮食。经浙江中医药大学实验动物伦理审查委员会通过,决议编号:ZSLL-2015-72。
1.2主要试剂与仪器
SAA粉针剂,由正大青春宝药业有限公司提供;盐酸二甲双胍片(metformin,Met),国药准字:H20023370,由中美上海施贵宝制药有限公司生产;血糖(glucose,GLU),总胆固醇(total cholestrol,TC)检测试剂,购自上海德赛诊断系统有限公司;糖化血红蛋白(hemoglobin A1c,HbA1c)检测试剂,购自Trinity Biotech公司;酶联免疫吸附法检测(ELISA)试剂盒:转铁蛋白(transferrin,TRF),视黄醇结合蛋白(retinol-binding protein,RBP),白细胞介素-1(interleukin-1,IL-1),白细胞介素-6(interleukin-6,IL-6),购自杭州诚维生物有限公司;丙二醛(malondialdehyde,MDA)测试盒购自南京建成生物工程研究所;脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)活性检测试剂盒,购自Abcam公司;改良FAA固定液:70%乙醇90 mL,冰醋酸5 mL,40%甲醛5 mL混合配制而成;PAS染色试剂盒,购自珠海贝索生物技术有限公司。
7020全自动生化分析仪(日本日立公司);Hb9210糖化血红蛋白分析仪(爱尔兰Trinity Biotech公司);Thermo多功能酶标仪(美国Thermo公司);AL204-电子分析天平(瑞士Mettler公司);Nana Zoomer 2.0 RS数字切片扫描设备(日本滨松公司);HM335E半自动石蜡切片机(德国Microm公司);自动染色机(德国Leica公司)。
1.3实验方法
1.3.1 实验动物分组
取32只7~8周龄雄性ZDF大鼠,饲喂Purina#5008饲料,另取8只同周龄ZL大鼠饲喂基础饲料,作为正常对照组。饲喂4周后,将ZDF大鼠按血糖水平分层随机分为均匀4组,即模型对照组,SAA高、低剂量组和Met组,每组8只。ZDF大鼠2只一笼,ZL大鼠4只一笼。SAA高、低剂量组ZDF大鼠每天经尾静脉注射SAA 1 mg/kg、0.5 mg/kg,Met组大鼠每天经口灌胃200 mg/kg,模型对照组和正常对照组每天尾静脉注射5 mL/kg生理盐水,连续给药12周。
1.3.2 一般情况观察
实验期间观察动物的饮食、饮水、粪便和排尿情况以及精神活动状态,并记录白内障发生数。
1.3.3 生化指标检测
在给药12周时,24 h代谢笼法收集的尿液,检测尿液中TRF、RBP含量,隔2 d后禁食不禁水12 h后,尾静脉取血约1 mL,一部分全血使用EDTA抗凝,用于检测HbA1c,另一部分分离血清,使用全自动生化检测仪检测GLU和TC,试剂盒检测IL-1、IL-6、ox-LDL、MDA含量和Lp-PLA2活性,具体方法按试剂盒说明书进行。
1.3.4 眼球病理组织学观察
取血后,对动物施行安死术,每组中随机选取4只大鼠,小心地取下眼球,置于4%中性甲醛固定24 h后,流水冲洗1 h,从睫状体后部经锯齿缘环形剪开虹膜,去除前眼部分,将眼杯以视乳头为中心,分切成3份均匀的橘瓣样片状,剥离视网膜层,PBS缓冲液中4℃浸泡过夜,用粗吸管轻吸出视网膜层,放入3%胰蛋白酶中消化2~3 h,10 mL消化1只眼视网膜,间隔20 min摇晃消化小瓶,终止消化,吸入蒸馏水中漂洗吹打,至仅剩下一层透明的视网膜血管网,用粗吸管将毛细血管网带水吸取置于洁净载玻片上,轻摇晃载玻片使水滴中血管网展开铺平,室温自然干燥后,按试剂盒说明书进行PAS染色。将另外4只大鼠眼球从眼眶中小心取出,直接置于改良FAA固定液,固定24 h后,以视乳头为中心,垂直于虹膜切开,固定、包埋、切片,进行HE染色并观察,随后在NDP.view2软件中,每只大鼠各选取黄斑区附近的5个点,测量从内界膜到视网膜色素上皮细胞层的厚度,并计算各组视网膜的平均厚度。
1.4统计学方法
2 结果
2.1对血液生化的影响
由表1可见,给药12周时,与正常对照组比较,模型对照组GLU、TC与HbA1c均升高(P< 0.01),与模型对照组比较,1.0 mg/kg SAA组HbA1c降低(P< 0.05),Met组GLU与HbA1c下降(P< 0.05,P< 0.01)。
2.2对白内障发生率与视网膜病变的影响
给药12周时,正常对照组未出现白内障,模型对照组发病率68.75%,0.5 mg/kg SAA组发病率为31.25%,1 mg/kg SAA组发病率为12.50%,Met组发病率为31.25%,见表2。
由图1 HE染色结果可见,正常对照组视网膜各层细胞排列紧密,边界清晰;模型对照组视网膜神经纤维层结构疏松,有黄斑区水肿,各层细胞排列紊乱,可见毛细血管壁增厚;0.5 mg/kg SAA组与1.0 mg/kg SAA组视网膜组织结构有不同程度的改善,血管壁增厚程度减少;经NDP.view2软件测量,与正常对照组比较,模型对照组视网膜增厚(P< 0.01),与模型对照组比较,SAA高、低剂量组与Met组视网膜厚度降低(P< 0.01),见图2。
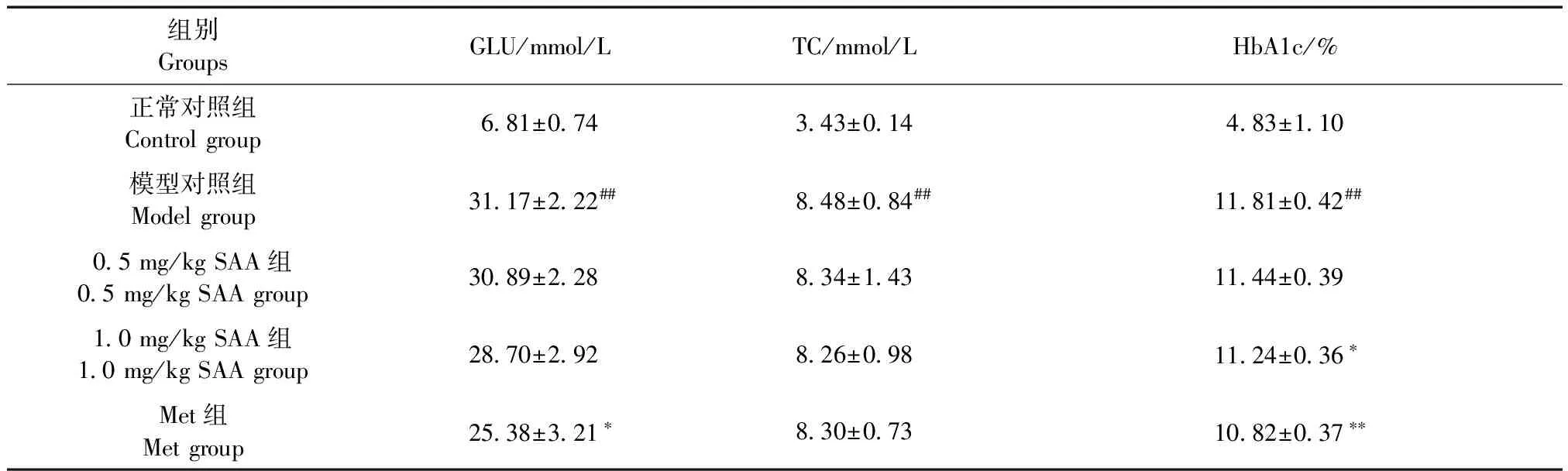
表1 SAA对ZDF大鼠血液生化指标的影响(n=8)
注:与正常对照组相比,##P< 0.01;与模型对照组相比,*P< 0.05,**P< 0.01。
Note: Compared with the control group,##P< 0.01; Compared with the model group,*P< 0.05,**P< 0.01.
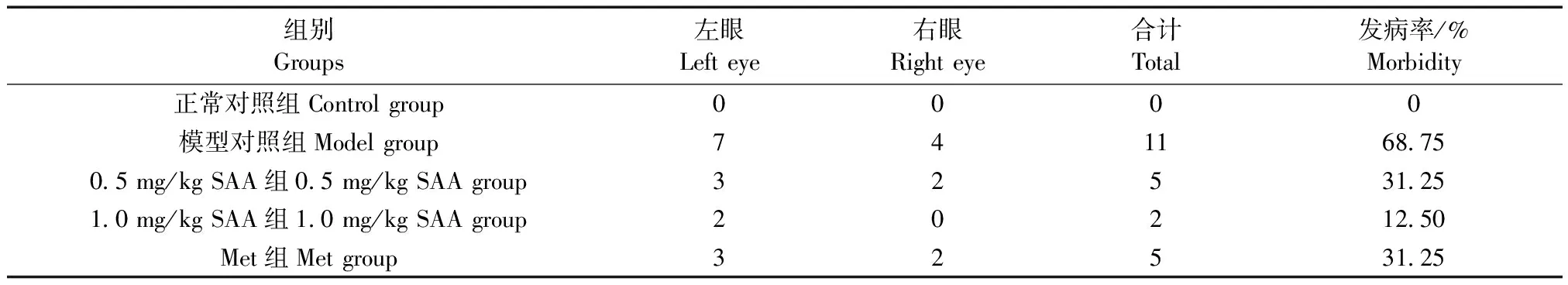
表2 SAA对ZDF大鼠白内障发生率的影响(n=8)

注:A:正常对照组;B:模型对照组;C:0.5 mg/kg SAA组;D:1.0 mg/kg SAA组;E:Met组。图1 SAA对ZDF大鼠视网膜的影响(HE染色)Note:A:Control group; B: Model group; C: 0.5 mg/kg SAA group; D:1.0 mg/kg SAA group; E: Met group.Fig.1 Effect of SAA on the retina of the ZDF rats.HE stain
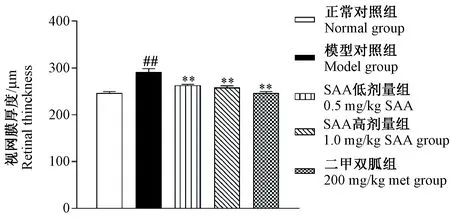
注:与正常对照组相比,##P< 0.01;与模型对照组相比,** P< 0.01。图2 SAA对ZDF大鼠视网膜厚度的影响Note: Compared with the control group, ##P< 0.01;Compared with the model group, ** P< 0.01.Fig.2 Effect of SAA on the thickness of retina of the ZDF rats
由图3视网膜血管消化铺片PAS染色结果可见,正常对照组视网膜血管形态完整,内皮细胞和周细胞分布规则;模型对照组视网膜内皮细胞增多且部分增生,细胞核大小不一,周细胞减少;各给药组视网膜微血管形态均有不同程度的改善,且1.0 mg/kg SAA组未发现明显的内皮细胞增生或周细胞减少现象。
2.2对尿TRF和尿RBP含量的影响
由图4可见,与正常对照组比较,模型对照组ZDF大鼠尿液中RBP和TRF含量均升高(P< 0.01);与模型对照组比较,SAA高、低剂量组和Met组尿液RBP均下降(P< 0.05);1 mg/kg SAA组尿液TRF含量下降(P< 0.05)。
2.3对血清炎症因子水平的影响
由图5可见,给药12周时,与正常对照组比较,模型对照组ZDF大鼠血清IL-1和IL-6含量上升(P< 0.01);与模型对照组比较,1.0 mg/kg SAA组ZDF大鼠血清IL-1和IL-6下降(P< 0.05),而200 mg/kg Met血清IL-1和IL-6亦有下降趋势,但差异无显著性(P> 0.05)。
2.4对血清脂质过氧化的影响
由图6可见,给药12周时,与正常对照组比较,模型对照组ZDF大鼠血清MDA和ox-LDL含量上升(P< 0.01);与模型对照组比较, SAA高、低剂量组和Met组血清MDA含量均下降(P< 0.01);1.0 mg/kg SAA组ox-LDL含量下降(P< 0.01),其余各给药组差异无显著性。
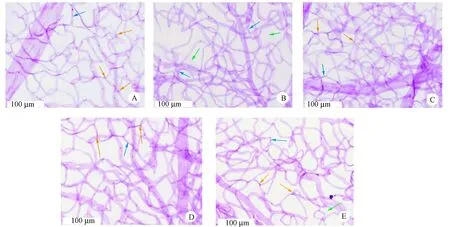
注:A:正常对照组;B:模型对照组;C:0.5 mg/kg SAA组;D:1.0 mg/kg SAA组;E:Met组。→: 周细胞;→:内皮细胞。→:无细胞毛细血管。图3 SAA对ZDF大鼠视网膜微血管形态的影响(PAS染色)Note:A:Control group; B:Model group; C:0.5 mg/kg SAA group; D:1.0 mg/kg SAA group; E: Met group.→: Pericytes;→:Endotheliocyte;→:Acellular capillaries.Fig.3 Effect of SAA on the retina microvessels of the ZDF rats.PAS stain
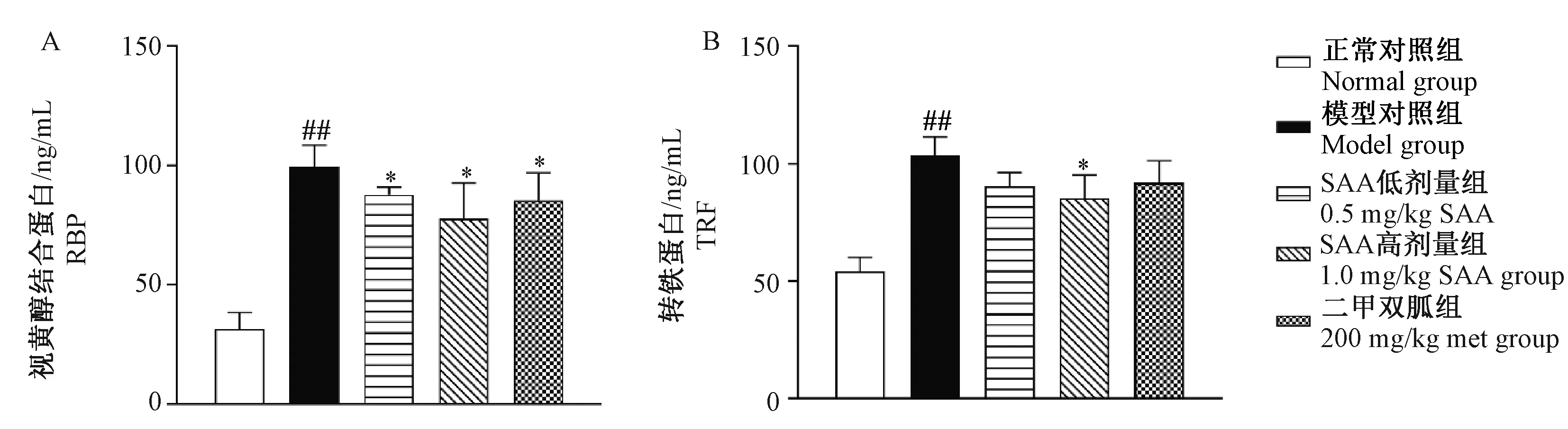
注:与正常对照组相比,##P< 0.01;与模型对照组相比,* P< 0.05。图4 SAA对ZDF大鼠尿RBP和尿TRF的影响Note: Compared with the control group, ##P< 0.01;Compared with the model group, * P< 0.05.Fig.4 Effect of SAA on RBP and TRF in urine of the ZDF rats
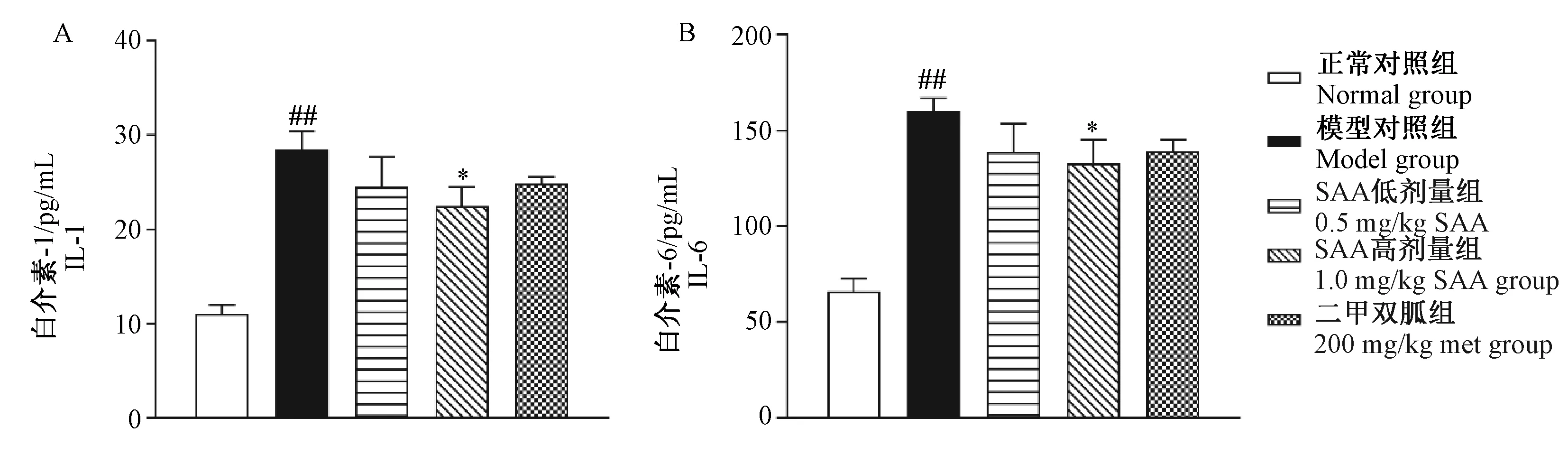
注:与正常对照组相比,##P< 0.01;与模型对照组相比,* P< 0.05。图5 SAA对ZDF大鼠血清炎症因子的影响Note: Compared with the control group, ##P< 0.01;Compared with the model group, * P< 0.05.Fig.5 Effect of SAA on inflammatory factor in serum of the ZDF rats
2.5对血清Lp-PLA2活性的影响
由图7可见,给药12周时,与正常对照组比较,模型对照组ZDF大鼠血清Lp-PLA2活性上升(P< 0.01);与模型对照组比较,SAA高、低剂量组和Met组Lp-PLA2活性均下降(P< 0.05,P< 0.01)。
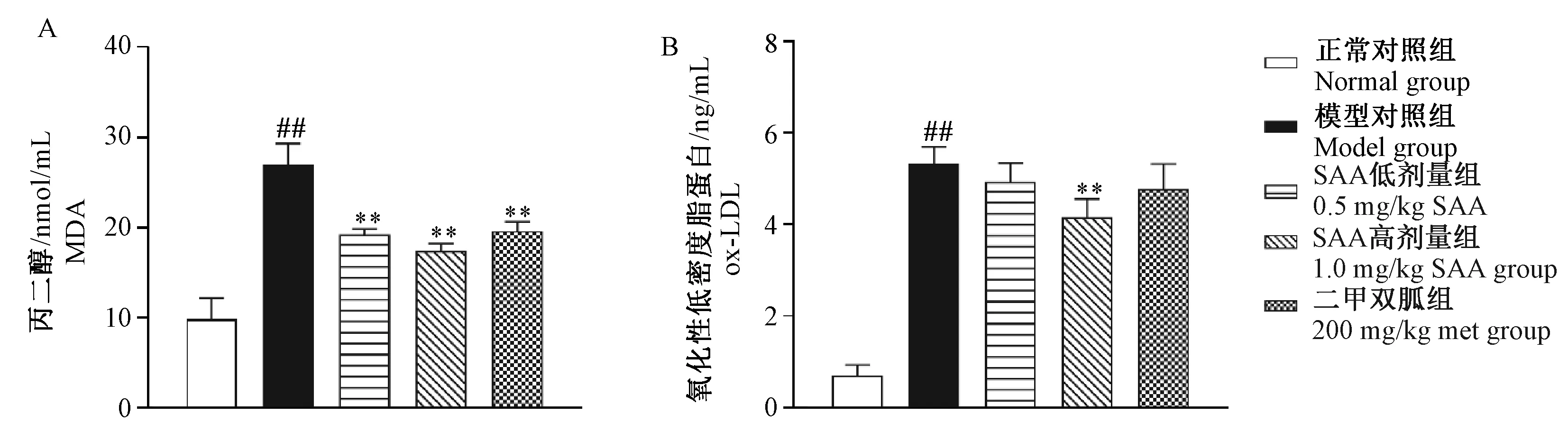
注:与正常对照组相比,##P< 0.01;与模型对照组相比,** P< 0.01。图6 SAA对ZDF大鼠脂质过氧化的影响Note: Compared with the control group, ##P<0.01;Compared with the model group, ** P< 0.01.Fig.6 Effect of SAA on lipid peroxidation of the ZDF rats
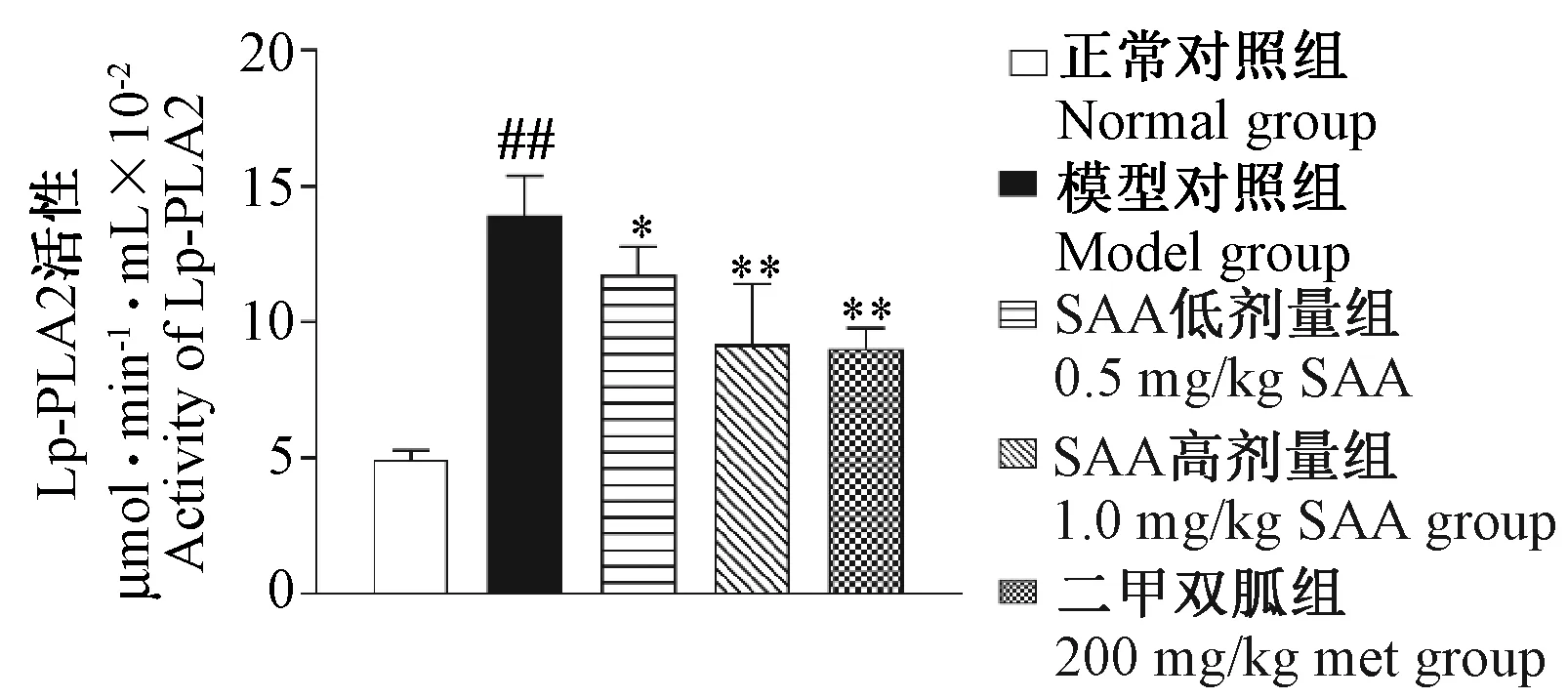
注:与正常对照组相比,##P< 0.01;与模型对照组相比,* P< 0.05,** P< 0.01。图7 SAA对ZDF大鼠血清Lp-PLA2活性的影响Note: Compared with the control group, ##P< 0.01;Compared with the model group, * P< 0.05,** P< 0.01.Fig.7 Effect of SAA on the activity of Lp-PLA2 in serum of the ZDF rats
3 讨论
DR是糖尿病常见的微血管并发症。国内常用的2型糖尿病DR动物模型多为链脲佐菌素诱导模型[7],而ZDF大鼠作为一种新引进的自发型2型糖尿病动物模型,具有微血管病变发病周期短,个体差异小,与人类临床症状相似等特点[8]。本实验研究发现,ZDF大鼠在20周龄时,出现血糖血脂升高、出现糖尿病性白内障、视网膜厚度增加、视网膜血管周细胞数目明显减少等特征性病变,给予SAA能有效降低白内障发病率、改善糖尿病视网膜微血管病变、抑制视网膜水肿,提示SAA具有抗DR的作用。
尿RBP、TRF与DR的发生和发展的严重程度密切相关,DR的程度可随尿RBP和TRF的增高而加重[9,10]。有学者认为,如果存在持续性的微量白蛋白尿,视网膜会出现旁中央区光敏度下降,甚至出现视野缺损[11]。因此,尿RBP、TRF可做为DR早期诊断的独立预测因子。本实验中,模型对照组ZDF大鼠尿RBP和TRF含量显著升高,SAA组均有不同程度的下降,且呈一定的剂量关系,进一步证实了SAA对糖尿病视网膜微血管的保护作用。本实验还发现,SAA具有一定的降糖作用但不显著,因此我们推测SAA并非通过调节血糖血脂抑制DR的形成,而是通过其他作用途径来实现的。
慢性炎症在DR的发生发展中扮演着重要而又复杂的角色。一方面,视网膜炎症反应可通过影响内皮型一氧化氮合酶导致眼内血压升高,并能通过产生血管内皮生长因子诱导新生血管形成,而这些血管渗透性高,易发生出血[12,13];另一方面,病变的视网膜中炎症介质和粘附因子表达升高,可导致白细胞粘附,加剧了局部的炎症反应,进一步诱发血管损伤[14]。因此,降低机体炎症反应是防治DR的重要策略之一。多项研究已证实SAA具有显著的抗炎活性[15,16],本研究同样发现,SAA能明显降低ZDF大鼠IL-1和IL-6等炎症标记物,而Met组并未显示出明显的抗炎作用,提示SAA能通过减轻机体炎症反应减缓DR的发展,而在抗炎方面的作用SAA优于Met。
氧化应激是指机体在遭受各种有害刺激时,自由基的产生和抗氧化防御系统之间的失衡,从而导致组织损伤的过程。在高糖状态下,氧化应激增强,产生过氧化产物,激活与糖尿病微血管并发症发生发展有关的信号传导通道[17]。本实验结果显示SAA能显著降低血清ox-LDL和MDA含量,而这两者是典型的脂质过氧化产物,说明SAA具有较强的抗氧化活性。Met也有降低MDA的作用,但在降低ox-LDL方面没有SAA作用明显,提示SAA具有显著的抗氧化活性,能通过减少脂质过氧化来降低对视网膜微血管的损伤作用。
Lp-PLA2是一种炎症性疾病的新型标记物,其活性的增加意味着血管功能出现障碍[18]。Lp-PLA2能水解ox-LDL产生溶血卵磷脂和氧化游离脂肪酸,二者是强烈的过氧化物质和促炎因子,对血管内皮细胞造成损伤,使血管通透性增加。近来有研究发现,降低Lp-PLA2活性能有效抑制糖尿病所致的血-视网膜屏障功能障碍,其作用机制为Lp-PLA2抑制剂能减少溶血卵磷脂的产生,减少血管内皮生长因子受体2信号通路的激活,从而降低血管通透性[19]。因此,Lp-PLA2可能成为治疗糖尿病患者黄斑水肿的新的治疗靶点。本实验研究发现,SAA能显著降低血清中Lp-PLA2活性,并呈一定的剂量关系,推测降低Lp-PLA2活性可能也是SAA改善ZDF大鼠视网膜病变的作用途径之一。然而其具体作用机制尚不明确,需更多实验加以阐释。
综上所述,SAA有减缓和改善糖尿病视网膜微血管病变的作用,其作用机制可能和抗炎、抗氧化以及降低Lp-PLA2活性有关。因此,SAA可以作为DR的一种有效辅助治疗药物,对于改善DR的预后有重要意义。
[1] Forouhi NG, Wareham NJ.Epidemiology of diabetes[J]. Medicine (Abingdon), 2014, 42(12):698-702.
[2] Hammes HP, Feng Y, Pfister F, et al. Diabetic retinopathy: targeting vasoregression[J]. Diabetes, 2011, 60(1): 9-16.
[3] Ferris FL, Nathan DM. Preventing diabetic retinopathy progression[J]. Ophthalmology, 2016, 123(9): 1840-1842.
[4] 张莉, 张维库, 赵莹, 等. 丹酚酸 A 的研究与进展[J]. 中国中药杂志, 2011, 36(19): 2603-2609.
[5] 鲁珽, 陈方明, 朱科燕, 等. 注射用丹酚酸 A 防治肝纤维化的实验研究[J]. 中国比较医学杂志, 2014, 24(7): 57-62.
[6] Chien MY, Chuang CH, Chern CM, et al. Salvianolic acid A alleviates ischemic brain injury through the inhibition of inflammation and apoptosis and the promotion of neurogenesis in mice[J].Free Radical Bio Med, 2016, 99: 508-519.
[7] 段惠惠, 黄建梅, 于素云, 等. STZ 糖尿病大鼠视网膜病变模型的再评价[J]. 中国比较医学杂志, 2013, 23(5): 12-18.
[8] 陈小真, 戎亦骊, 马全鑫, 等. 糖尿病 ZDF 大鼠早期微血管并发症的生化指标及病理组织学变化[J]. 中国比较医学杂志, 2016, 26(5): 63-70.
[9] 杨洪亮. 脂蛋白 (a), 尿视黄醇结合蛋白与糖尿病视网膜病变的相关性研究[J]. 微量元素与健康研究, 2015, 32(1): 13-14.
[10] 王芳, 徐莉. 内皮细胞损伤及尿微量蛋白与糖尿病视网膜病变的相关性研究[J]. 现代预防医学, 2008, 35(17): 3435-3436.
[11] Chen YH, Chen HS, Tarng DC. More impact of microalbuminuria on retinopathy than moderately reduced GFR among type 2 diabetic patients[J]. Diabetes Care, 2012, 35(4): 803-808.
[12] Van Hecke MV, Dekker JM, Nijpels G, et al. Inflammation and endothelial dysfunction are associated with retinopathy: the Hoorn Study[J]. Diabetologia, 2005, 48(7): 1300-1306.
[13] Spijkerman AMW, Gall MA, Tarnow L, et al. Endothelial dysfunction and low-grade inflammation and the progression of retinopathy in type 2 diabetes[J]. Diabetic Med, 2007, 24(9): 969-976.
[14] Stitt AW, Curtis TM, Chen M, et al. The progress in understanding and treatment of diabetic retinopathy[J]. Prog Retin Eye Res, 2016, 51: 156-186.
[15] Li L, Xu T, Du Y, et al. Salvianolic acid a attenuates cell apoptosis, oxidative stress, Akt and NF-κB activation in angiotensin-II induced murine peritoneal macrophages[J]. Curr Pharm Biot Echno, 2016, 17(3): 283-290.
[16] Huang J, Qin Y, Liu B, et al. In silico analysis and experimental validation of molecular mechanisms of salvianolic acid A-inhibited LPS-stimulated inflammation, in RAW264. 7 macrophages[J]. Cell Proliferat, 2013, 46(5): 595-605.
[17] Madsen-Bouterse SA, Kowluru RA. Oxidative stress and diabetic retinopathy: pathophysiological mechanisms and treatment perspectives[J]. Rev Endocr Met Ab Dis, 2008, 9(4): 315-327.
[18] Wilensky RL, Macphee CH. Lipoprotein-associated phospholipase A2 and atherosclerosis[J]. Curr Opin Lipidol, 2009, 20(5): 415-420.
[19] Canning P, Kenny BA, Prise V, et al. Lipoprotein-associated phospholipase A2 (Lp-PLA2) as a therapeutic target to prevent retinal vasopermeability during diabetes[J]. P Natl Acad Sci U S A, 2016, 113(26): 7213-7218.
EffectofsalvianolicacidAonretinopathyanditsmechanisminZDFrats
MA Quan-xin1, CHEN Xiao-zhen1,2, RONG Yi-li1, HUANG Jun-jie1, ZHU Ke-yan1, CHEN Cheng1, SHI Jia-jun1, LI Yuan-yuan1, CHEN Min-li1*
(1.Animal Experimental Research Center/Institute of Comparative Medicine, Zhejiang Chinese Medical University, Hangzhou 310053, China; 2.The Second Affiliated Hospital and Yuying Children’s Hospital of Wenzhou Medical University,Wenzhou 325027)
ObjectiveTo observe the intervention effect of salvianolic acid A (SAA) on retinopathy of Zucker diabetic fatty (ZDF) rats and explore the possible action mechanism of SAA to prevent and treat diabetic retinopathy (DR).MethodsThirty-two 7-8-week old ZDF rats were taken and fed with Purina rat chow for 4 weeks. The ZDF rats were equally divided by the blood glucose into model group, 0.5 mg/kg SAA group, 1.0 mg/kg SAA group and metformin (Met) group. 8 Zucker lean (ZL) rats were taken as control group. After 12-week administration, incidence of cataracts and retinal pathology was observed, and levels of GLU, TC and HbA1cin blood, transferrin (TRF) and retinol binding protein (RBP) in urine and levels of interleukin-1 (IL-1), interleukin-6 (IL-6), oxidized low density lipoprotein (ox-LDL), malondialdehyde (MDA) and lipoprotein related phospholipase A2 (Lp-PLA2) activity in serum were measured.ResultsIn the model group, GLU, TC, HbA1c, diabetic cataract incidence rate, retinal basement thickening and microangiopathy appeared in most of the rats. The levels of TRF and RBP in urine and levels of IL-1, IL-6, ox-LDL, MDA in serum were significantly increased, and Lp-PLA2 activity was also significantly increased. After SAA administration, the morbidity rate of cataract was reduced, and retinal pathological changes were improved in different degrees. The levels of TRF, RBP, IL-1, IL-6, ox-LDL, MDA and Lp-PLA2 activity was decreased.ConclusionsSAA can slow down the process of diabetic retinopathy in ZDF rats and reduce the incidence of cataract. The mechanisms of action may be related to inhibition of chronic inflammation, prevention of lipid peroxidation and reduction of Lp-PLA2 activity.
Type 2 diabetes mellitus; Retinopathy; Lp-PLA2; ZDF rats
R-33
A
1671-7856(2017) 10-0040-07
10.3969.j.issn.1671-7856. 2017.10.008
2017-04-12
浙江省中医药管理局重点项目(2015ZZ009);浙江中医药大学比较医学创新团队(XTD201301)。
马全鑫(1988-),男,硕士,研究方向:中药药理与比较医学。E-mail: mqx1025@hotmail.com
陈民利(1963-),女,教授,研究方向:实验动物与比较医学。E-mail: cmli991@aliyun.com
