钒暴露对大鼠小胶质细胞炎症反应和迁移的影响
2017-11-01余晓巍胡楚元熊志军
余晓巍,胡楚元,熊志军
(湖南省职业病防治院,长沙 410003)
研究报告
钒暴露对大鼠小胶质细胞炎症反应和迁移的影响
余晓巍,胡楚元,熊志军
(湖南省职业病防治院,长沙 410003)
目的观察偏钒酸钠(NaVO3·2H2O)暴露对小胶质细胞炎症反应和迁移的影响,探讨钒神经毒性的相关机制。方法偏钒酸钠孵育原代培养的SD大鼠小胶质细胞,免疫荧光技术显示小胶质细胞形态的变化及其特异性标志物Iba1的表达,免疫印迹技术检测iNOS、COX-2、ERK和p-ERK蛋白表达,酶联免疫吸附实验检测炎症因子TNF-α,IL-1β的释放水平;构建划痕迁移模型,免疫荧光技术记录偏钒酸钠对小胶质细胞迁移的影响。结果偏钒酸钠孵育小胶质细胞后,神经小胶质细胞形态由静息态的分支状向吞噬细胞样形态转变,其特异性标志物Iba1表达显著增加;iNOS和COX-2的蛋白表达和TNF-α,IL-1β释放水平与对照组相比较均显著升高;偏钒酸钠促进小胶质细胞的迁移。结论偏钒酸钠显著促进了小胶质细胞的炎症反应和迁移。
偏钒酸钠;小胶质细胞;炎性反应;迁移
钒是地球上广泛分布的微量元素。钒的大量开发与应用引发的环境问题日益严重,生产过程中产生的废气成为大气中钒的重要来源[1,2],厂区及附近的土壤、水源大都受到污染,尤以钒、锰、铜、铅为主[3,4],存在严重职业危害与环境污染。国内外研究显示,钒具有神经毒性[5],有研究发现钒甚至可以直接进入中枢神经系统,导致明显的神经毒性[6]。小胶质细胞是中枢免疫细胞,在正常生理状态下处“静息”状态,它们通过持续监控微环境的变化维持内环境的稳态[7]。而当中枢神经系统受损时,小胶质细胞被迅速“激活”并对外界刺激做出反应,如迁移、增殖、形态改变(从分枝状转变为阿米巴状)、释放免疫因子和炎性介质,并参与细胞碎片吞噬[8,9],这些作用对神经元的损伤和修复具有双重影响[10,11]。因此本研究拟通过观察钒暴露对原代培养大鼠小胶质细胞炎性反应和迁移的影响,探讨钒神经毒性的相关机制,以期为钒暴露导致的神经元损伤提供应对策略。
1 材料和方法
1.1实验动物
雌性SD乳鼠(出生24 h内),体重6.5~9.0 g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2016-0002],在湖南省职业病防治院毒理学实验室[SYXK(湘)2014-0003]进行实验。经实验动物使用与管理委员会(IACUC)批准[湘职防(2014)伦研批第006号]。
1.2主要试剂
偏钒酸钠(NaVO3·2H2O):分析纯,购自天津市光复精细化工研究所;iNOS和COX-2抗体购自美国Santa Cruz Biotechnology公司,OX- 42、Iba1、Hoechst 33258、ERK和p-ERK购自英国Abcam公司;荧光标记二抗、FITC和罗丹明购自美国Thermo Fisher公司;DMEM培养基和胰蛋白酶购自美国Hylone公司; ELISA试剂盒(TNF-α、IL-1β)购自北京中杉金桥公司。
1.3实验方法
1.3.1 大鼠皮层原代小胶质细胞的制备
将新生SD乳鼠在无菌条件下断头、开颅取脑后,置于冷PBS溶液中。分离大脑皮层、剪碎,0.125%的胰酶溶液于37℃消化20 min,2层纱布过滤后接种于多聚赖氨酸预先包被的75 mL培养瓶中,置于37℃,5% CO2培养箱中培养24 h后全量换液。之后每3 d换液一次,第14天将培养瓶旋紧密封,固定于37℃恒温水平摇床内,以220 r/min振荡3 h,收集脱落细胞悬液,接种于培养皿中,贴壁1 h后去除未贴壁细胞,加入含10%胎牛血清的DMEM继续培养。
1.3.2 小胶质细胞的鉴定
细胞爬片后,按免疫荧光法,用OX-42抗体标记细胞,荧光显微镜下观察。
1.3.3 免疫荧光检测小胶质细胞形态学的变化
细胞爬片后,25 μmol/L的偏钒酸钠孵育小胶质细胞12 h,用4%的多聚甲醛固定30 min,PBS浸洗3次,每次10 min,0.3% Triton X-100室温处理30 min后,加3% BSA室温封闭30 min;加入Iba1抗体(1∶200),4℃过夜;次日,PBS浸洗3次,每次10 min,加FITC标记荧光二抗或罗丹明,室温孵育1 h;PBS浸洗3次,每次10 min,甘油封片后,置于奥林巴斯FV1000荧光显微镜下观察、拍照。采用奥林巴斯FV10-ASW显微摄影图像分析系统摄取免疫荧光图像,随机测定5个视野细胞荧光强度,实验均重复5次(n=5)。
1.3.4 划痕迁移实验
在24孔板中按照5×105/孔进行细胞爬片后,用1 mL吸管尖端在玻片上进行划痕,用DMEM培养基浸洗3次后,25 μM的偏钒酸钠孵育小胶质细胞12 h,按免疫荧光法,用OX-42抗体标记细胞,置于奥林巴斯FV1000荧光显微镜下观察、拍照,并计算进入划痕区域的细胞数量。每次随机选取5个视野,取平均值作为1个样本。每次实验均重复 5 次;按免疫印迹法,检测 ERK和p-ERK蛋白表达,每次实验均重复3次(n=3)。
1.3.5 免疫印迹实验检测iNOS、COX-2蛋白表达
将小胶质细胞接种于6孔培养板,培养24 h,加入25 μM 的偏钒酸钠处理,分别于6、12和24 h后,经胰酶消化收集细胞,提取总蛋白。根据 BCA 蛋白定量试剂盒的说明蛋白定量后,进行10% SDS-PAGE电泳,然后100 mA 3.5 h电转至PVDF膜上,用浓度为5%的脱脂奶粉封闭1 h后,用PBST洗膜3次,每次10 min;将PVDF膜放入稀释好的iNOS抗体(1∶1000)、COX-2抗体(1∶500)中,4℃过夜;次日用PBST洗膜3次,每次10 min,将PVDF膜放入辣根过氧化物酶标记的二抗(1∶5000稀释)中,室温孵育2 h;PBST洗膜3次,每次20 min;加ECL发光剂孵育,在3 ~15 min内显影、定影,分析。每次实验均重复3次(n=3)。
1.3.6 酶联免疫吸附试验
将小胶质细胞接种于6孔培养板,培养24 h,加入25 μM 的偏钒酸钠处理,分别于6、12和24 h后收集细胞培养液,根据ELISA试剂盒说明书的相关步骤检测细胞培养液中炎性因子 TNF-α、IL-1β含量的变化。
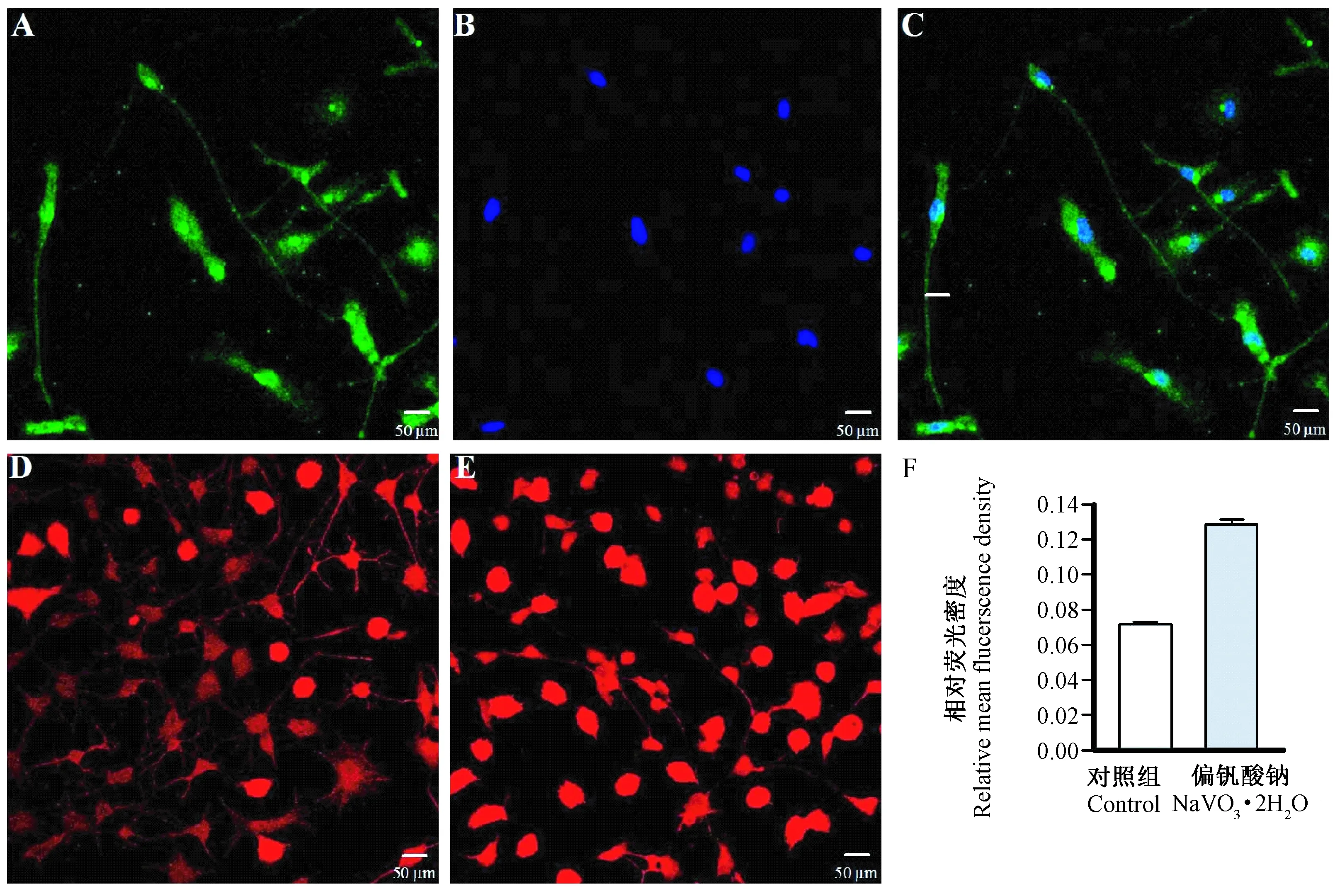
注:(A)OX- 42标记的小胶质细胞;(B)Hoechst 33258标记的细胞核;(C)A+B组合;(D)小胶质细胞对照组;(E)偏钒酸钠处理组(25 μmol/L);与对照组比较,** P< 0.01。图1 小胶质细胞鉴定以及偏钒酸钠对小胶质细胞形态学的影响Note.(A)Microglia labeled with OX- 42;(B)Cell nuclei labeled with Hoechst 33258;(C)Merged A and B;(D)Control group;(E)NaVO3·2H2O exposure group (25 μmol/L); Compared with the control group, ** P< 0.01.Fig.1 Microglia identification and the effect of NaVO3·2H2O on the morphology of microglia
1.4统计学方法

2 结果
2.1原代小胶质细胞的鉴定
小胶质细胞所占总体细胞比例达到99%以上,表明SD大鼠皮层原代小胶质细胞分离纯化成功(图1)。
2.2偏钒酸钠暴露对小胶质细胞形态的影响
未经处理的小胶质细胞形态呈现为细长分枝状,25 μM的偏钒酸钠孵育小胶质细胞12 h后,小胶质细胞形态由细长分枝状转变为阿米巴状,表现为突起回缩和形态变圆25 μM的偏钒酸钠孵育小胶质细胞12 h,Iba1的相对荧光强度与对照组比较显著增加,差异有显著性(P< 0.01),表明小胶质细胞被显著激活(图1)。
2.3偏钒酸钠暴露对小胶质细胞迁移的影响
与对照组比较,25 μM 的偏钒酸钠处理小胶质细胞12 h显著上调了ERK磷酸化水平,并增强了小胶质细胞的迁移能力,差异有显著性(P< 0.01)(图2)。
2.4偏钒酸钠暴露对小胶质细胞释放炎症因子的影响
小胶质细胞在静息状态时几乎不表达iNOS和COX-2,25 μM 偏钒酸钠处理的小胶质细胞炎症因子iNOS和COX-2的蛋白表达水平随时间的延长增加(P< 0.05或P< 0.01)(图3)。
小胶质细胞在静息状态时分泌少量TNF-α和IL-1β,在被偏钒酸钠激活后,小胶质细胞大量分泌TNF-α和IL-1β,且随时间的延长显著增加,与对照组比较,差异有显著性(P< 0.05或P< 0.01)(表1)。
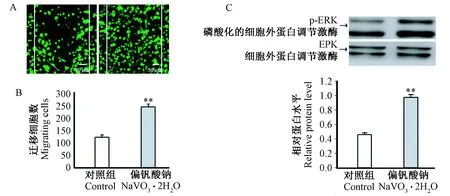
注:(A)免疫荧光检测小胶质细胞迁移情况;(B)小胶质细胞迁移数目统计分析;(C)免疫印迹实验检测p-ERK蛋白表达情况;与对照组比较,** P< 0.01。图2 偏钒酸钠对小胶质细胞迁移以及ERK磷酸化水平的影响Note:(A)Representative photomicrographs of the migrating cells before and after treatment with a NaVO3·2H2O (25 μM);(B)Statistical analysis of the number of microglia migration;(C)The expression of p-ERK determined by Western blotting analysis;Compared with the control group,** P< 0.01.Fig.2 Effect of NaVO3·2H2O on microglial migration and the expression of p-ERK
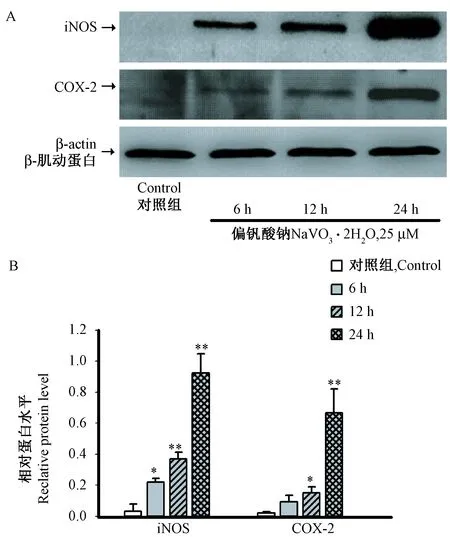
注:(A)免疫印迹实验检测小胶质细胞iNOS和COX-2蛋白表达;(B)灰度值统计分析;与对照组比较,* P< 0.05,** P< 0.01。图3 各组间小胶质细胞iNOS和COX-2的蛋白表达情况Note:(A)The expression of iNOS and COX-2 by Western blotting analysis;(B)Statistical analysis of the gray value;Compared with control grouo, * P< 0.05,** P< 0.01.Fig.3 The expression of iNOS and COX-2 in different groups
Tab.1Comparison of TNF-α and IL-1β levels in the supernatant of microglial cultures in different groups
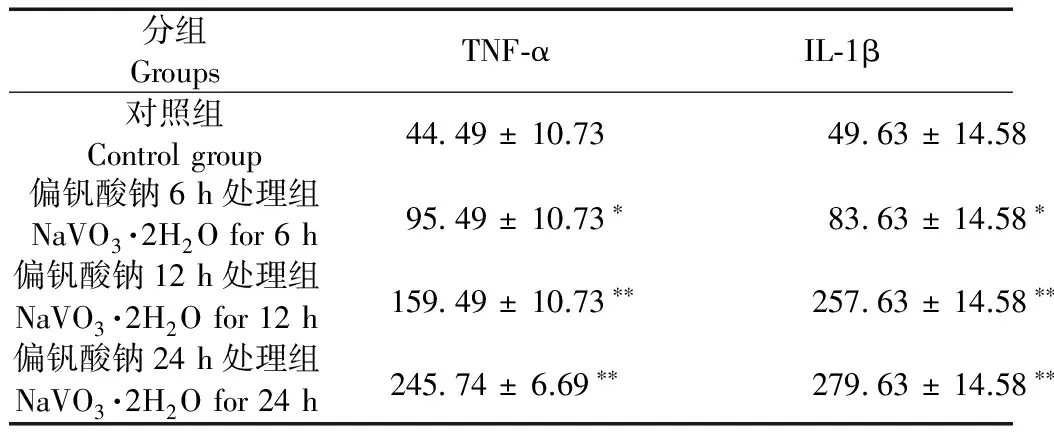
分组GroupsTNF⁃αIL⁃1β对照组Controlgroup4449±10.734963±14.58偏钒酸钠6h处理组NaVO3·2H2Ofor6h9549±10.73∗8363±14.58∗偏钒酸钠12h处理组NaVO3·2H2Ofor12h15949±10.73∗∗25763±14.58∗∗偏钒酸钠24h处理组NaVO3·2H2Ofor24h24574±6.69∗∗27963±14.58∗∗
注:与对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.
3 讨论
钒的毒性研究较多地集中在致畸,致癌,致突变作用方面。相比之下,对钒的神经毒性研究开展得相对有限和缺乏。越来越多的研究表明,钒具有神经毒性效应[12,13],钒甚至可以直接进入中枢神经系统,导致明显的神经毒性,例如神经衰弱、不安、震颤、狂躁症、抑郁症等[6]。近来,研究还发现受到钒刺激的少突胶质细胞和星形胶质细胞会产生大量的ROS而受损[14],少突胶质细胞是神经元髓鞘的重要组成部分,星形胶质细胞对于神经元发挥生理功能也是不可或缺。小胶质细胞是中枢神经系统内的固有免疫细胞,它在神经元的生存和整个生命活动中起着十分重要的作用[7]。而关于钒对小胶质细胞的相关作用目前尚未见任何报道。
迁移是小胶质细胞应对炎症刺激的一个重要的功能,ERK磷酸化在小胶质细胞的迁移中发挥关键性的调节作用[15]。本研究发现,偏钒酸钠诱导的小胶质细胞形态发生明显改变,细胞突起长度缩短、变圆,伴随着迁移能力的增强,其特异性标志物Iba1蛋白表达也明显增加。而Iba1蛋白属EF手性蛋白,是小胶质细胞和巨噬细胞的特异性表面标记物,因脑组织巨噬细胞含量极少,检测Iba1可视为特异性检测小胶质细胞。随着小胶质细胞的激活,Iba1的表达显著增加。这些指标表明偏钒酸钠诱导小胶质细胞活化,而激活的小胶质细胞是介导中枢炎症反应主要的细胞。小胶质细胞介导的神经炎症是一把双刃剑:精密调控下的神经炎症反应启动后可以发挥吞噬和修复的作用,最终恢复组织内环境的平衡[16,17];而过度的炎症反应使得小胶质细胞上调多种细胞表面受体,释放多种细胞因子,如炎症因子TNF-α、IL-1β、NO和活性氧类物质等,这些炎症介质不但对神经元产生毒性,还通过级联放大效应使得小胶质细胞产生更多的毒性因子,从而加剧神经毒性作用。而本研究发现,在偏钒酸钠作用下,小胶质细胞表达大量的炎性因子如iNOS、COX-2、TNF-α和IL-1β,并随着作用时间的延长而显著增加。
中枢神经系统中,iNOS主要存在于小胶质细胞和星形胶质细胞,过度激活的小胶质细胞生成大量的iNOS,进而导致高浓度的NO的生成,高浓度的NO能够抑制线粒体呼吸功能和糖酵解、抑制DNA合成、损害DNA结构、与超氧阴离子自由基反应生成过氧亚硝基,产生神经毒性作用[18]。COX-2为诱导型酶,正常生理状态下不表达,在受到炎症刺激时诱发性的高表达。COX-2除了本身具有一定的促炎作用之外,与iNOS之间存在“交互感应”。COX-2是NO合成的上游关键酶分子,而在炎性状态下,NO能够通过NO/cGMP通路上调COX-2的表达。TNF-α是小胶质细胞炎症反应释放的主要的炎性细胞因子,在神经毒性中发挥重要作用。已有研究表明,TNF-α可激活小胶质细胞上的TNF-α 受体从而启动级联反应,导致其它促炎因子如iNOS、COX-2等的合成,最终导致神经元的损伤、变性甚至死亡[19]。此外TNF-α可促进星形胶质细胞产生趋化因子和黏附分子,促进炎症因子如IL-1β、IL-6的产生,导致炎症的恶性循环[20]。IL-1β是中枢炎症级联反应中的关键因子,其不仅可以通过NF-κB途径进一步促进小胶质细胞的激活,还具有自分泌作用,进而通过炎症因子的级联放大反应,加重炎症损伤,促进神经毒性作用。这些炎性因子存在着一定程度的相互作用机制,共同促进炎症的发展。本研究显示小胶质细胞能够被偏钒酸钠激活,表达及高分泌iNOS、COX-2、TNF-α和IL-1β。
综上所述,钒暴露可在体外激活原代培养的小胶质细胞,导致炎症因子的大量表达,并显著促进小胶质细胞的迁移,为进一步深入研究偏钒酸钠的神经毒性机制奠定基础。
[1] 钟敏. 攀枝花地区钒的环境效应[J]. 广州化工, 2012, 40(2):24-25,46.
[2] 王秋霞, 马化龙. 我国钒资源和V2O5研究、生产的现状及前景[J]. 矿产保护与利用, 2009, (5):47-50.
[3] Nadal M, Schuhmacher M, Domingo JL. Metal pollution of soils and vegetation in an area with petrochemical industry[J]. Sci Total Environ, 2004, 321(1-3):59-69.
[4] Liu Y, Woodin MA, Smith TJ, et al. Exposure to fuel-oil ash and welding emissions during the overhaul of an oil-fired boiler[J]. J Occup Environ Hyg, 2005, 2(9):435-443.
[5] 崔鹂, 张勤, 兰亚佳. 钒及其化合物的神经行为毒性研究进展[J].毒理学杂志, 2013, 27(01): 64-67.
[6] Maciejczyk P, Chen LC. Effects of subchronic exposures to concentrated ambient particles(CAPs) in mice. VIII. Source-related daily variations in in vitro responses to CAPs[J]. Inhal Toxicol, 2005, 17(4-5):243-253.
[7] Nimmerjahn A, Kirchhoff F, Helmchen F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo[J]. Science, 2005, 308(5726):1314-1318.
[8] Prinz M, Mildner A. Microglia in the CNS: immigrants from another world[J]. Glia, 2011, 59(2): 177-187.
[9] Graeber MB. Changing face of microglia[J]. Science, 2010, 330(6005):783-788.
[10] Orre M, Kamphuis W, Osborn LM, et al. Isolation of glia from Alzheimer's mice reveals inflammation and dysfunction[J]. Neurobiol Aging, 2014, 35(12): 2746-2760.
[11] Prokop S, Miller KR, Heppner FL. Microglia actions in Alzheimer’s disease[J]. Acta Neuropathol, 2013, 126(4):461-477.
[12] Luo J, Sun Y, Lin H, et al. Activation of JNK by vanadate induces a Fas-associated death domain (FADD)-dependent death of cerebellar granule progenitors in vitro[J]. J Biol Chem, 2003, 278(7): 4542-4551.
[13] Afeseh Ngwa H, Kanthasamy A, Anantharam V, et al. Vanadium induces dopaminergic neurotoxicity via protein kinase Cdelta dependent oxidative signaling mechanisms: relevance to etiopathogenesis of Parkinson’s disease[J]. Toxicol Appl Pharmacol, 240(2):273-285.
[14] Todorich B, Olopade JO, Surguladze N, et al. The mechanism of vanadium-mediated developmental hypomyelination is related to destruction of oligodendrocyte progenitors through a relationship with ferritin and iron[J]. Neurotox Res, 2011, 19(3):361-373.
[15] Cudaback E, Li X, Montine KS, et al. Apolipoprotein E isoform-dependent microglia migration[J]. FASEB J, 2011, 25(6):2082-2091.
[16] Glass CK, Saijo K, Winner B, et al. Mechanisms underlying inflammation in neurodegeneration[J]. Cell, 2010, 140(6):918-934.
[17] Innamorato NG, Lastres-Becker I, Cuadrado A. Role of microglial redox balance in modulation of neuroinflammation[J]. Curr Opin Neurol, 2009, 22(3):308-314.
[18] Iadecola C, Anrather J. The immunology of stroke: from mechanisms to translation[J]. Nat Med, 2011, 17(7):796-808.
[19] Harms AS, Barnum CJ, Ruhn KA, et al. Delayed dominant-negative TNF gene therapy halts progressive loss of nigral dopaminergic neurons in a rat model of Parkinson’s disease[J]. Mol Ther, 2011, 19(1):46-52.
[20] Wake H, Moorhouse AJ, Nabekura J. Functions of microglia in the central nervous system—beyond the immune response[J]. Neuron Glia Biol, 2011, 7(1):47-53.
Exposuretovanadiumpromotesprimaryculturedratmicroglialinflammationandmigration
YU Xiao-wei, HU Chu-yuan, XIONG Zhi-jun
(Hunan Prevention and Treatment Institute for Occupational Diseases, Changsha 410003, China)
ObjectiveTo observe the changes of rat microglial inflammation and migration after exposure to sodium metavanadate(NaVO3·2H2O), and to analyze the possible mechanisms of vanadium neurotoxicity.MethodsPrimary cultured rat microglial cells were incubated with NaVO3·2H2O. Morphological changes and the Iba1 expression of microglia were tested by immunofluorescence assay. iNOS, Cox-2, ERK and p-ERK protein expressions were determined by western blotting. The levels of TNF-α and IL-1β in the culture medium were tested by enzyme-linked immunosorbent assay. The migration of microglia was tested by immunofluorescence staining using wound-healing assay.ResultsMicroglia changed from resting state with ramous shape to round shape in activated state after NaVO3·2H2O exposure, and the expression of Iba1 increased obviously. The protein expressions of iNOS and COX-2 increased significantly compared with the control. The levels of TNF-α and IL-1β were also increased significantly. NaVO3·2H2O promotes the migration of microglia through ERK pathway.ConclusionsExposure to NaVO3·2H2O promotes primary cultured rat microglial inflammation and migration. These results suggest that the inflammatory reaction of microglia may be one of the possible mechanisms of neurotoxicity caused by vanadium exposure.
Sodium metavanadate; Microglia; Inflammatory reaction; Migration
R-33
A
1671-7856(2017) 10-0055-05
10.3969.j.issn.1671-7856. 2017.10.011
2017-02-18
湖南省卫生与计划生育委员会科研基金(B2015-318)。
余晓巍(1984-),男,医学博士,主管药师,研究方向:毒理学研究。E-mail: yuxw0714@163.com
