胰腺癌LyP-1靶向性磁共振—荧光双模态分子探针实验
2017-11-01宋长恩施睿峰陆建平邓勇辉
史 张,宋长恩,施睿峰,陆建平,邓勇辉,蒋 涛*
(1.第二军医大学附属长海医院放射科,上海 200433;2.复旦大学化学系,上海 200433)
胰腺癌LyP-1靶向性磁共振—荧光双模态分子探针实验
史 张1,宋长恩1,施睿峰1,陆建平1,邓勇辉2*,蒋 涛1*
(1.第二军医大学附属长海医院放射科,上海 200433;2.复旦大学化学系,上海 200433)
目的构建胰腺癌LyP-1靶向性磁共振—荧光双模态分子探针,观察其表征并进行MR显像。方法构建50 nm核壳结构的磁共振—荧光双模态介孔探针,表面经环形多肽LyP-1(Cys-Gly-Asn-Lys-Arg-Thr-Arg-Gly-Cys)修饰,通过荧光及MR T2WI联合成像,验证该分子探针能否特异性识别并结合胰腺癌细胞。结果新型LyP-1靶向性磁共振—荧光双模态分子探针可用于小鼠原位胰腺癌的荧光显像和磁共振成像,可有效结合胰腺癌细胞并在体外使T2WI信号明显降低。体内实验表明,该分子探针可与荧光标记的胰腺癌组织靶向结合,并作为MRI对比剂显示C57BL/6小鼠原位胰腺癌。结论LyP-1靶向性磁共振—荧光双模态分子探针可靶向性地高效结合原位移植的小鼠胰腺癌细胞,用于早期胰腺癌诊断的转化研究。
胰腺肿瘤;分子探针;双模态;磁共振成像;荧光成像
由于多数胰腺癌在发现时已属晚期或已经存在远处转移,超过80%的胰腺癌患者无法进行治愈性切除,因此提高胰腺癌的早期诊断率尤为重要[1-2]。MRI广泛应用于对肿瘤的诊断,通过MRI对比剂可改变组织周围外部磁场以获得高质量的图像[3]。目前临床应用的主要MRI对比剂弛豫效率较低且缺乏组织特异性,新型MRI对比剂的研发已成为目前的研究热点。本研究通过在C57BL/6小鼠胰腺癌细胞株Pan02及其相应的裸鼠原位移植胰腺癌中p32的异常膜表达,设计一种新型环形多肽LyP-1(Cys-Gly-Asn-Lys-Arg-Thr-Arg-Gly-Cys)靶向性磁共振—荧光双模态分子探针,评价小鼠原位胰腺癌的免疫荧光显像和MR成像效果。
1 材料与方法
1.1 p32在胰腺癌组织和细胞系中的表达
1.1.1 胰腺癌细胞系和细胞培养 小鼠胰腺癌细胞系Pan02购自Frederick国家癌症研究实验室(Maryland,美国),保存于含有10%胎牛血清(fetal bovine serum, FBS)的RPMI 1640(Gibco公司,California,美国)和谷氨酰胺中。小鼠内皮细胞系MS1由中国科学院的样品培养保藏中心细胞库提供。所有细胞系均培养于5%CO2的37℃加湿器培养箱中。
1.1.2 建立C57BL/6小鼠原位胰腺癌模型 将15只6~8周龄、体质量18~22 g的雌性C57BL/6小鼠以1%戊巴比妥腹腔注射麻醉。参照Jiang等[4]的方法建立原位胰腺癌荷瘤C57BL/6小鼠模型。局部备皮、消毒后,于腹腔左上部位处行1.5 cm长的纵向切口。将脾脏掀起并暴露胰腺尾部,将含1×106个Pan02细胞的20 μL悬浮液用27号针头注射器注入胰腺实质,将脾脏和胰腺放回腹腔,并以连续2层丝线缝合封闭腹腔。在1周内每天监测小鼠的术后状态和伤口愈合情况。
1.1.3 p32蛋白免疫荧光染色 将人胰腺癌、正常胰腺组织、原位小鼠胰腺癌和小鼠正常组织(均购自上海斯莱克实验动物有限公司)切除后立即放入4%多聚甲醛,浸泡15 min,后放入10%蔗糖溶液中连续浸泡1 h,并在30%蔗糖溶液中浸泡至过夜。将组织放入OCT复合液中,于-20℃冷冻并进行4 μm组织切片。使用以下一抗:兔抗-p32(CST公司,美国)、山羊抗EpCAM(Santa-Cruz公司,美国)、Cy2-耦联的驴抗兔(Jackson Immuno Research公司,美国)和Cy3-耦联的驴抗山羊抗体(Jackson Immuno Research公司,美国)。二抗用于在荧光显微镜下与一抗交联发光。DAPI复染用于检测细胞核位置。
1.1.4 p32表达在细胞系和组织提取的总蛋白和膜蛋白检测 获得细胞系并用PBS漂洗2次后,用16 000 G离心力裂解细胞系并测得总蛋白。通过具有原位胰腺癌的C57BL/6小鼠获得新鲜肿瘤组织、胰腺、心脏、肝、脾、肺、肾,并在裂解液中进行匀浆,再用16 000 G离心力离心并测得总蛋白。使用跨膜蛋白提取试剂盒(Merck公司,德国)提取细胞系和组织的膜蛋白。按照BCA蛋白浓度测定试剂盒所测的蛋白质浓度,将总蛋白和被提取的膜蛋白用SDS-PAGE分离并转移至PVDF膜。对p32的检测:采用兔抗-p32(1∶1 000稀释)的一抗在4℃下孵育过夜,洗膜后加入辣根过氧化氢酶标记的羊抗兔IgG二抗继续孵育。最后,用增强型ECL发光试剂盒检测信号。
1.2 LyP-1靶向性磁共振—荧光双模态分子探针的合成和表征 所有化学试剂在使用前均被进一步纯化,实验中使用去离子水。
1.2.1 Fe3O4@SiO2-FITC@mSiO2探针的合成 根据Liang等[5]的方法合成均匀的磁性探针。将5 ml的磁铁矿正己烷分散体(约20 mg/mL)通过超声波处理10 min使其均匀分布。再将10 ml的乙醇与10 ml的曲拉通X-100的混合物加入50 ml的环己烷。后加入0.5 ml氢氧化铵溶液(28%重量浓度比),以形成稳定的逆微乳液。在连续机械搅拌下加入0.04 ml正硅酸乙酯(tetraethyl orthosilicate, TEOS),并反应24 h,以形成二氧化硅包被的磁性探针,即Fe3O4@SiO2分散体。同时,将0.02 g的3-氨丙基三乙氧基硅烷(aminopropyltriethoxysilane, APTS)溶解于包含有0.01 g异硫氰酸荧光素(fluorescein isothiocyanate, FITC)的5.0 ml乙醇。在暗箱中搅拌12 h后将所得溶液与TEOS(0.02 ml)一起加入Fe3O4@SiO2分散体,然后将其放于暗处连续反应12 h。对产物经磁分离技术进行纯化和分离,用乙醇洗涤3次,并在30℃真空干燥过夜,获得镶嵌有FITC的磁性二氧化硅探针,即Fe3O4@SiO2-FITC。收集获得的Fe3O4@SiO2-FITC@mSiO2探针并在磁性分离的乙醇溶液中洗涤后,重新分散于30 ml乙醇中备用。固体重量约为总重量的0.6%。

图1 p32在胰腺癌组织和细胞系中的表达 A.人和小鼠的胰腺癌和癌旁胰腺细胞中p32表达的荧光染色(绿色),同时标有EpCAM(红色),细胞核用DAPI复染(蓝色),比例尺为50 mm(×40); B、C.Western Blot检测p32总蛋白(B)表达和在提取细胞、组织中的膜蛋白表达(C)
1.2.2 LyP-1在Fe3O4@SiO2-FITC@mSiO2探针上的耦联 为进一步将功能性LyP-1分子黏附于Fe3O4@SiO2-FITC@mSiO2探针,将0.02 ml γ-巯丙基三乙氧基硅烷(γ-mercaptopropyltriethoxysilane, MPTS)加入20 ml含Fe3O4@SiO2-FITC@mSiO2探针的乙醇分散液(重量浓度比0.6%)。经12 h反应后,被—SH基团(巯基)修饰过的探针经磁场3次分离纯化以去除多余的MPTS后,将其分散到乙醇(40 ml)与马来酰亚胺-LyP-1的化合物中以备进一步反应。将2 ml马来酰亚胺-LyP-1肽(0.01 g)溶液加入乙醇分散探针溶液,反应6 h。通过离心收集样品,并用乙醇洗涤3次,于30℃真空干燥,最终获得Fe3O4@SiO2-FITC@mSiO2-LyP-1探针。
1.2.3 表征 采用BrukerD8高级X线衍射仪,通过Ni过滤Cu-Kα射线(40 kV,40 mA)记录粉末X线衍射(XRD)图像。采用Micromeritics ASAP 2420分析仪在77K下测量氮吸附等温线。在测量前,将探针样品于50℃下真空脱气4 h。用布鲁诺尔-埃米特-特勒(Bruknoll-Emmett Tler, BET)方法在吸附数据c表面积为0.05至0.35内计算特定网络连接中的相对压力范围。通过Barrett-Joyner-Halenda(BJH)模型,在相对压力P/P0为0.992时由吸附量估计总孔体积,计算来自等温线的吸附分支的孔体积和孔径分布。在200 kV下操作JEOL 2011透射电子显微镜拍摄探针图像。将探针样品首先分散于乙醇中,而后用覆碳铜栅进行分析。在20 kV时采用Philips XL30电子显微镜,记录扫描电子显微镜(scanning electron microscope, SEM)图像。在细金属薄膜上喷涂探针样品,以激光共聚焦显微镜拍摄玻片上Fe3O4@SiO2-FITC@mSiO2样品的荧光图像,激发波长为480 nm,发射波长的滤色片为515~565 nm。采用Vario ELⅢ元素分析仪测量C、H、N和S元素的含量。
1.3 与细胞系结合的探针数量测算 将Pan02及MS1细胞以1×106个/孔接种于6孔板,每孔加入2 ml完全培养基。过夜培养使细胞融合后,更换新鲜的细胞培养基,其中含有单一PBS、Fe3O4@SiO2-FITC@mSiO2-LyP-1或Fe3O4@SiO2-FITC@mSiO2(并按照梯度浓度5、10、20、40、80 μg/ml配制)。再次培养4 h,去除培养基。PBS洗涤细胞3次后用胰蛋白酶处理,2%多聚甲醛固定、离心,并悬浮于1 ml PBS中。采用Becton Dickinson FACS Calibur流式细胞仪分析进行检测,每个浓度设置3个重复测量。
1.4 细胞系的体外MRI 对6孔板浓度梯度培养的Fe3O4@SiO2-FITC@mSiO2-LyP-1或Fe3O4@SiO2-FITC@mSiO2探针细胞系(5、10、20、40 μg/ml)进行消化、离心后,细胞悬浮于1%的琼脂糖。采用Siemens Magnetom Trio 3.0T MR扫描仪,八阵列环形线圈。扫描序列与参数:T2WI,TE 13.8 ms,TR 4 000 ms,层厚2 mm,层间距1 mm,FOV 120 mm×120 mm,矩阵128×128,NEX 1。
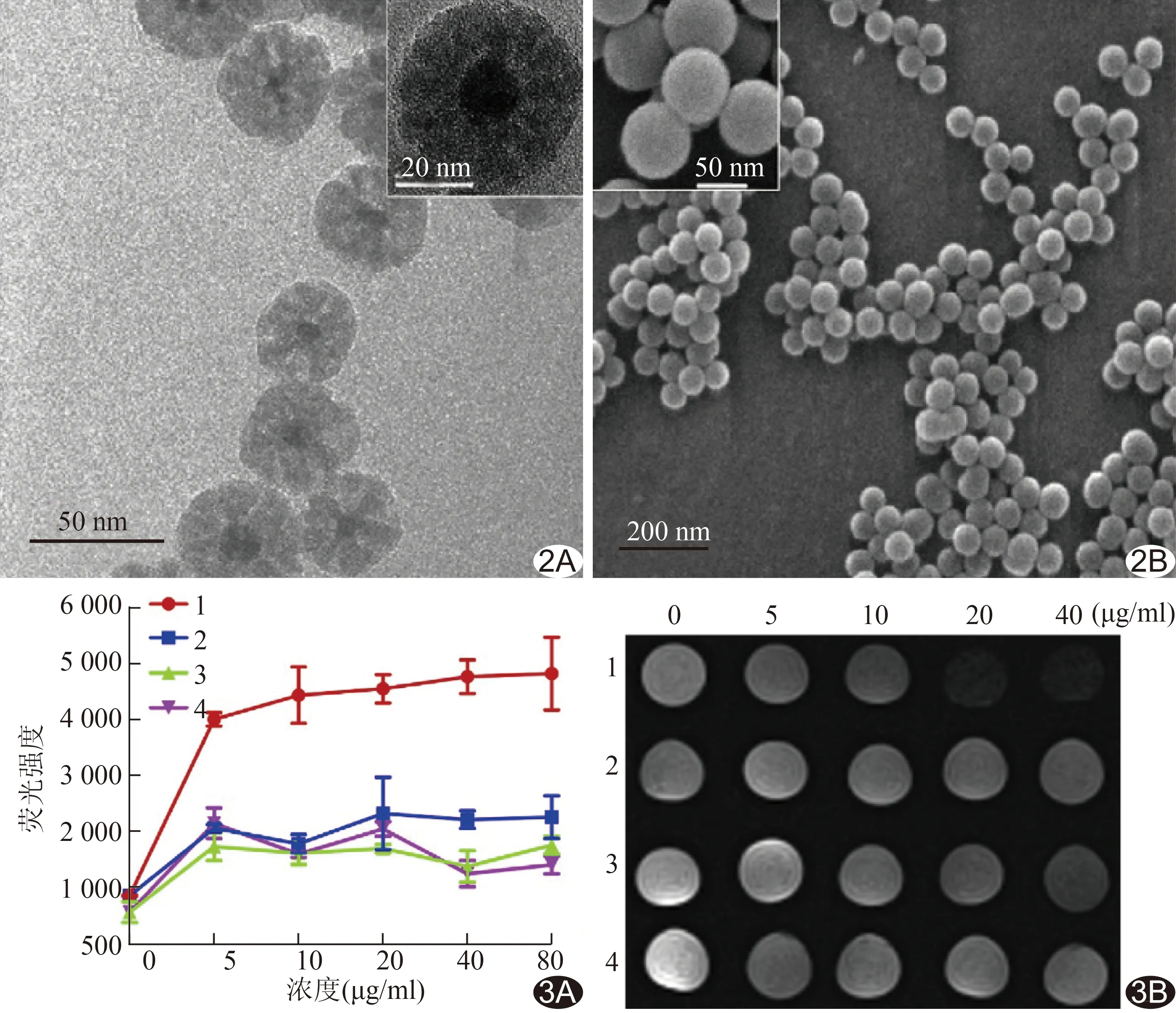
图2 磁共振-荧光双模态分子探针的形态特征 A.透射电子显微镜图像; B.扫描电子显微镜图像 图3 流式细胞术和体外磁共振成像的分析 A.平均荧光强度的比较; B.Pan02和MS1细胞与不同浓度的探针温育后的T2WI信号变化 (1:Pan02+Fe3O4@SiO2-FITC@mSiO2-LyP-1; 2:Pan02+Fe3O4@SiO2-FITC@mSiO2; 3:MS1+Fe3O4@SiO2-FITC@mSiO2-LyP-1; 4:MS1+Fe3O4@SiO2-FITC@mSiO2)
1.5 C57BL/6小鼠全身给药后观察探针在原位胰腺癌组织内的分布 对原位胰腺癌荷瘤C57BL/6小鼠于建模3周后腹腔注射1%戊巴比妥钠(70 mg/kg体质量),经尾静脉注射含Fe3O4@SiO2-FITC@mSiO2-LyP-1或Fe3O4@SiO2-FITC@mSiO2探针的分散PBS(铁浓度0.1 mM),共0.2 ml。4 h后,处死12只小鼠,并同时切除肿瘤、胰腺、肝、脾、肾、心、肺,固定、切片(厚度4 μm),荧光显微镜下观察。
1.6 C57BL/6小鼠原位胰腺肿瘤的体内MR成像 麻醉剩余的3只小鼠模型,进行MR扫描。经尾静脉注入含Fe3O4@SiO2-FITC@mSiO2-LyP-1或Fe3O4@SiO2-FITC@mSiO2探针的PBS 0.2 ml(铁浓度0.1 mM)。扫描序列与参数:T2WI,TR 2 000 ms,TE 22.5 ms,层厚1 mm,层间距1 mm,FOV 120 mm×120 mm,矩阵256×160,NEX 1。在Fe3O4@SiO2-FITC@mSiO2-LyP-1或Fe3O4@SiO2-FITC@mSiO2探针注射前、注射后1、2、4、24 h获取MR图像。
2 结果
2.1 p32在胰腺癌组织和细胞系中的表达 p32蛋白在C57BL/6衍生的胰腺癌细胞系和其相应的肿瘤组织中有表达。免疫组化染色可见胰腺癌组织中的p32蛋白表达;标记的EpCAM可区分癌细胞与基质细胞。多数p32表达细胞为上皮来源(EpCAM双阳性染色),少数表皮细胞来源于间质细胞,见图1A。
蛋白免疫印迹结果显示,小鼠胰腺癌细胞系Pan02和小鼠内皮细胞系MS1的总蛋白p32表达量相同,而Pan02膜表面的p32含量高于MS1。在肿瘤组织提取的膜蛋白中p32的表达水平也高于荷瘤C57BL/6小鼠正常器官中的相应部位,而在肿瘤组织和正常组织的全蛋白中p32表达水平相似,见图1B。
2.2 LyP-1靶向性磁共振-荧光双模态分子探针的特征 多功能探针表示为Fe3O4@SiO2-FITC@mSiO2,平均直径45 nm且具有良好的核-壳结构(图2A)。投射电子显微镜(transmission electron microscopy, TEM)图像可见暗的磁芯被灰色多孔二氧化硅壳包围,且孔隙直径约2.0 nm(图2A)。SEM图像显示多功能核-壳探针均有良好的分散性,其平均直径约45 nm,与TEM结果一致(图2B)。
2.3 流式细胞术测定和体外MR成像 与Fe3O4@SiO2-FITC@mSiO2-LyP-1探针共同培养4 h后,Pan02细胞平均荧光强度急剧增加(即使浓度低至5 μg/ml),见图3A。随浓度的增加,荧光强度略有增加,达平台期的浓度为40 μg/ml。而非靶向Fe3O4@SiO2-FITC@mSiO2探针培养的Pan02细胞的荧光强度仅为LyP-1探针培养的50%左右。
随Fe3O4@SiO2-FITC@mSiO2-LyP-1探针浓度增加,Pan02的T2WI信号明显减低,即越来越多的磁性探针与Pan02细胞结合。而Pan02细胞与Fe3O4@SiO2-FITC@mSiO2共培养后并未观察到明显的MR对比度变化,即两者结合不佳。MS1细胞组中无明显信号减低(图3B)。
2.4 多功能探针在带有原位胰腺癌的C57BL/6小鼠系统给药后的组织分布 在注射Fe3O4@SiO2-FITC@mSiO2-LyP-1探针的小鼠肿瘤组织中有FITC标记的探针积聚。虽然探针呈不均匀分布,但其分布与p32蛋白高度重叠。除几个粗荧光颗粒残留在肝脏和脾脏,在心脏、肺或肾中几乎均未检测到荧光探针。在注射Fe3O4@SiO2-FITC@mSiO2探针的荷瘤C57BL/6小鼠中,因缺乏高度分散的探针和肿瘤细胞的特异性相互作用,在肿瘤组织中无明显的荧光探针积累(图4)。
2.5 体内MRI 比较Fe3O4@SiO2-FITC@mSiO2-LyP-1探针给药前后的T2WI信号发现,给药后1 h在肿瘤区域的T2WI信号逐渐减少,4 h达到最低强度。即使在给药24 h后,由于二氧化硅壳的保护,磁性探针的稳定性仍良好,肿瘤区域的信号降低仍然存在(图5)。在注入Fe3O4@SiO2-FITC@mSiO2探针的小鼠肿瘤组织中未观察到明显的MRI信号变化。
3 讨论
本研究表明特有的p32蛋白在C57BL/6衍生的胰腺癌细胞系和其相应的肿瘤组织中均有表达,且p32在小鼠C57BL/6原位胰腺癌中的表达远多于其在癌旁胰腺组织中的表达。
在磁性探针的二氧化硅壳中掺入FITC有利于体外利用流式细胞术定量研究功能性探针与细胞的结合[6-7]。本研究结果证实,即使被固定于多功能探针的表面,LyP-1也可以特异结合Pan02细胞。由于MS1缺乏p32的表达,无论探针是否与LyP-1肽连接,MS1几乎不能捕获探针,产生的荧光强度也非常低。基于荧光标记和P32受体免疫组化染色,本研究表明LyP-1与其相应的p32受体结合具有高度靶向性。
MRI强度主要由探针的浓度决定[6-11]。本研究中,采用MRI用于研究测量Pan02和MS1细胞与不同浓度的探针孵育后的T2WI信号变化,体内实验进一步证实超微超顺磁性Fe3O4@SiO2-FITC@mSiO2-LyP-1探针因其具有超顺磁性,可用于MR成像,且耦联的LyP-1可实现其在胰腺癌的高度靶向性,从而在分子水平上实现MR成像。
本研究发现p32在小鼠胰腺癌细胞系Pan02及其同系原位移植瘤中膜异常表达。p32配体(LyP-1)与FITC标记的磁性介孔二氧化硅探针结合,可精确检测胰腺癌,为设计多功能LyP-1耦联的探针用于胰腺癌的早期诊断奠定了基础。此外,本研究胰腺癌模型建立于有免疫活性的C57BL/6小鼠,相信LyP-1耦联的磁性探针也可为胰腺癌免疫治疗的研究提供新的思路。
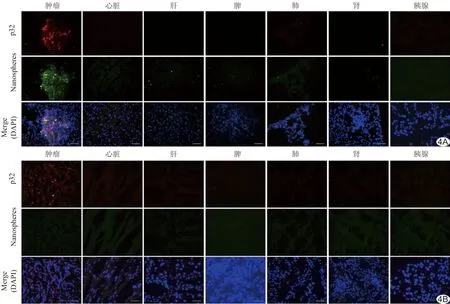
图4 多功能探针在带有原位胰腺癌的C57BL/6小鼠系统给药后的组织分布(×200) A.被注射Fe3O4@SiO2-FITC@mSiO2-LyP-1探针的小鼠; B.被注射Fe3O4@SiO2-FITC@mSiO2探针的荷瘤C57BL/6小鼠

图5 MRI比较载有胰腺癌的C57BL/6小鼠给药前后T2WI信号的变化 A.注入Fe3O4@SiO2-FITC@mSiO2-LyP-1探针后即刻(A)、1 h(B)、2 h(C)、4 h(D)、24 h(E);注入Fe3O4@SiO2-FITC@mSiO2探针后即刻(F)、1 h(G)、2 h(H)、4 h(I)、24 h(J)
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin, 2013,63(1):11-30.
[2] Paulson AS, Tran Cao HS, Tempero MA, et al. Therapeutic advances in pancreatic cancer. Gastroenterology, 2013,144(6):1316-1326.
[3] Liu Y, Hughes TC, Muir BW, et al. Water-dispersible magnetic carbon nanotubes as T2-weighted MRI contrast agents. Biomaterials, 2014,35(1):378-386.
[4] Jiang Y, Liu S, Zhang Y, et al. Magnetic mesoporous nanospheres anchored with LyP-1 as an efficient pancreatic cancer probe. Biomaterials, 2017,115:9-18.
[5] Liang X, Wang X, Zhuang J, et al. Synthesis of nearly monodisperse iron oxide and oxyhydroxide nanocrystals. Advanced Functional Materials, 2006,16(14):1805-1813.
[6] Li J, Zheng L, Cai H, et al. Polyethyleneimine-mediated synthesis of folic acid-targeted iron oxide nanoparticles for in vivo tumor MR imaging. Biomaterials, 2013,34(33):8382-8392.
[7] Li X, Li H, Yi W, et al. Acid-triggered core cross-linked nanomicelles for targeted drug delivery and magnetic resonance imaging in liver cancer cells. Int J Nanomedicine, 2013,8:3019-3031.
[8] Yang L, Mao H, Wang YA, et al. Single chain epidermal growth factor receptor antibody conjugated nanoparticles for in vivo tumor targeting and imaging. Small, 2009,5(2):235-243.
[9] Guo Q, Liu Y, Xu K, et al. Mouse lymphatic endothelial cell targeted probes: Anti-LYVE-1 antibody-based magnetic nanoparticles. Int J Nanomedicine, 2013,8:2273-2284.
[10] Zhang L, Gong F, Zhang F, et al. Targeted therapy for human hepatic carcinoma cells using folate-functionalized polymeric micelles loaded with superparamagnetic iron oxide and sorafenib in vitro. Int J Nanomedicine, 2013,8:1517-1524.
[11] Cheng Z, Dai Y, Kang X, et al. Gelatin-encapsulated iron oxide nanoparticles for platinum (Ⅳ) prodrug delivery, enzyme-stimulated release and MRI. Biomaterials, 2014,35(24):6359-6368.
MR-fluorescentdual-modalitymolecularprobesanchoredwithLyP-1forpancreaticcancer
SHIZhang1,SONGChang'en1,SHIRuifeng1,LUJianping1,DENGYonghui2*,JIANGTao1*
(1.DepartmentofRadiology,ChanghaiHospital,theSecondMilitaryMedicalUniversity,Shanghai200433,China; 2.DepartmentofChemistry,FudanUniversity,Shanghai200433,China)
ObjectiveTo construct the LyP-1 targeted MR fluorescence dual-modality molecular probe for pancreatic cancer, and to observe its features and MRI charicteristics.MethodsThe 50 nm MR-fluorescent dual-modality molecular probe with surface modified with cyclic nine-amino acid peptide LyP-1 (Cys-Gly-Asn-Lys-Arg-Thr-Arg-Gly-Cys) was rationally designed. Whether the molecular probe could specifically recognize the pancreatic cancer cells were validated by the combination of fluorescent imaging and MR T2WI.ResultsThe new MR-fluorescent dual-modality molecular probe anchored with LyP-1 could be used for the fluorescent imaging and MR T2WI of pancreatic cancer in mouse. And the molecular probe was demonstrated to be effective in conjugating with pancreatic cancer cells on fluorescent images and caused obvious MR signal reduction under T2 relaxometry in vitro. In vivo experiment, the molecular probe could be used for fluorescent labeling tumor tissue and detecting orthotopic pancreatic cancer in C57BL/6 mouse as MR contrast agent.ConclusionThe LyP-1 immobilized MR-fluorescent dual-modality molecular probe can actively target to mouse orthotopic xenograft of pancreatic cancer, which is hopeful to the application in early probing and diagnosis of pancreatic cancer by multimodal imaging.
Pancreatic neoplasms; Molecular probe; Dual-modality; Magnetic resonance imaging; Fluorescent imaging
10.13929/j.1003-3289.201704043
R-332; R445.2
A
1003-3289(2017)10-1447-06
国家自然科学基金(81402680、81371551)、长海医院1255科学创新基金(CH125541000)。
史张(1987—),男,陕西渭南人,在读硕士。研究方向:分子影像及血管成像。E-mail: shizhang2080007@126.com
邓勇辉,复旦大学化学系,200433。E-mail: yhdeng@fudan.edu.cn 蒋涛,第二军医大学附属长海医院放射科,200433。E-mail: laijiangtaotao@ 163.com
2017-04-10
2017-08-03
