人骨髓间充质干细胞靶向纳米基因载体制备及 体外细胞磁共振成像
2017-11-01庞鹏飞毛军杰胡晓俊张永裕
庞鹏飞,李 冰,毛军杰,周 斌,胡晓俊,张永裕,敖 峰,单 鸿*
(1.中山大学附属第五医院介入医学中心,2.眼科,广东 珠海 519000)
人骨髓间充质干细胞靶向纳米基因载体制备及体外细胞磁共振成像
庞鹏飞1,李 冰2,毛军杰1,周 斌1,胡晓俊1,张永裕1,敖 峰1,单 鸿1*
(1.中山大学附属第五医院介入医学中心,2.眼科,广东 珠海 519000)
目的探讨靶向纳米基因载体单链神经节苷脂抗体-聚乙二醇-聚乙烯亚胺-超顺磁性氧化铁(scAbGD2-PEG-g-PEI-SPION)转染人骨髓间充质干细胞(hBMSCs)的可行性、效率及体外细胞MR显像能力。方法合成scAbGD2-PEG-g-PEI-SPION后,采用凝胶阻滞实验评估其复合外源性基因的能力;动态光散射法测量scAbGD2-PEG-g-PEI-SPION/pDNA纳米复合物的粒径大小及表面电位;体外细胞毒性实验检测其对hBMSCs的细胞毒性。采用流式细胞仪检测scAbGD2-PEG-g-PEI-SPION靶向转染hBMSCs的效率,并设置PEG-g-PEI-SPION组、cAbGD2-PEG-g-PEI-SPION组、抗体竞争抑制(scAbGD2-PEG-g-PEI-SPION+free AbGD2)组和同型抗体(scAbIgG2a-PEG-g-PEI-SPION)组,通过激光共聚焦显微镜及普鲁士蓝染色观察hBMSCs对纳米复合物的摄入。通过体外细胞MR扫描验证scAbGD2-PEG-g-PEI-SPION的MR成像功能。结果scAbGD2-PEG-g-PEI-SPION细胞毒性小,复合外源性基因后能够形成稳定的纳米复合物,粒径80~100 nm。在相同的N/P比值下,scAbGD2-PEG-g-PEI-SPION组的转染率明显高于其他组(P<0.001)。N/P=20时,靶向组具有最高转染率[(59.60±4.50)%]。同时,scAbGD2-PEG-g-PEI-SPION中的SPION可有效标记hBMSCs,在MR T2/T2*加权图像上呈低信号。结论scAbGD2-PEG-g-PEI-SPION是一种MRI可视的、可有效转染hBMSCs的靶向纳米基因载体。
骨髓;间充质干细胞;磁共振成像;靶向基因载体;纳米医学
人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cells, hBMSCs)具有向肝样细胞分化的潜能,参与肝损伤的修复[1-2]。随着对治疗机制研究的深入,发现移植入肝脏的hBMSCs仅少数分化为肝样细胞,多数hBMSCs以旁分泌和免疫调节的方式参与肝损伤的修复,极大降低了其预期疗效[3]。有学者[4-6]研究发现hBMSCs可分化为肌成纤维样细胞,不仅未发挥治疗作用,反而加重了肝纤维化,甚至导致肝硬化。目前仍缺乏对hBMSCs生物学过程长期、实时示踪的有效手段[7-9]。纳米医学的发展和分子影像学技术的进步为解决间充质干细胞领域的共性难题提供了可能。本研究根据hBMSCs表面标记物二唾液酸神经节苷脂GD2(neural ganglioside)制备靶向纳米基因载体,评价制备该载体的可行性、效率及体外细胞MR显像功能。
1 材料与方法
1.1 材料 根据文献[10-11]的方法合成聚乙二醇-聚乙烯亚胺-超顺磁性氧化铁(PEG-g-PEI-SPION)。hBMSCs由中山大学干细胞中心惠赠。细胞培养基(Dulbecco's modified Eagle's medium,DMEM,low glucose)、胎牛血清(fetal bovine serum, FBS)、CCK-8试剂盒(Cell Counting Kit-8)购自美国Invitrogen公司。红色荧光染料popo-3、绿色荧光染料Oregon Green 488、细胞核荧光染料DAPI购自美国Molecular Probes公司。商品化的阳离子脂质体LipofectaminTM2000购自广州碧云天生物科技公司。增强型绿色荧光蛋白质粒(plasmid EGFP-C1, 4.70 kb)提取后采用1%凝胶电泳鉴定,浓度2.40 μg/μl。GD2抗体和GD2同型抗体购自美国BD Biosciene Pharmingen公司。
1.2 靶向纳米基因载体单链神经节苷脂抗体-聚乙二醇-聚乙烯亚胺-超顺磁性氧化铁(scAbGD2-PEG-g-PEI-SPION)的制备 室温下100 mg巯基乙胺溶于500 μl含20 μl EDTA(0.5 M,pH=8.0)的PBS中。200 μl GD2抗体与200 μl EDTA充分混合后加入到上述巯基乙胺溶液,37℃孵育90 min,获得单链GD2抗体(single chain AbGD2,scAbGD2)。将单链GD2抗体溶液转移至50 ml超滤离心管中(MWCO=10 kDa),加入15 ml含EDTA的PBS(pH=7.40,每500 μl含10 μl 0.5 M EDTA),于4℃恒温离心机中离心40 min,转速4 000 rpm,重复3次。加入200 μg mal-PEG-COOH,4℃孵育过夜,反应获得scAbGD2-PEG-COOH。加入15 ml PBS(pH7.4)于4℃恒温离心机中离心40 min,转速4 000 rpm,重复3次。取EDC和NHS各10 μg活化scAbGD2-PEG-COOH中的羧基15 min,加入PEG-g-PEI-SPION 200 μg,充分混合后于4℃反应过夜。超滤离心除去小分子杂质后将剩余的溶液转移至1.50 ml EP管,12 000 rpm离心除去游离抗体,收集离心后的沉淀,超声分散至蒸馏水中备用。
1.3 scAbGD2-PEG-g-PEI-SPION/pDNA纳米复合物的制备 将1 μg的pDNA与不同比例的scAb GD2-PEG-g-PEI-SPION分别溶于超纯水中,通过静电作用形成不同N/P比值(scAbGD2-PEG-g-PEI-SPION 的氮原子与pDNA的磷原子的摩尔比)的纳米复合物。
1.4 琼脂糖凝胶阻滞实验 制备不同N/P比值(2.1、2.2、2.3、2.4、2.5)的scAbGD2-PEG-g-PEI-SPION/pDNA纳米复合物,pDNA 1 μg,体系10 μl。纳米复合物与加样缓冲液充分混合后加入到1%的琼脂糖凝胶中电泳,电压120 V,时间25 min。
1.5 纳米复合物的粒径大小及表面电位测定 制备不同N/P比值(5、10、15、20、25、30、35、40)的PEG-g-PEI-SPION/pDNA和scAbGD2-PEG-g-PEI-SPION/pDNA纳米复合物,pDNA 2 μg,体系100 μl。室温下使用动态光散射仪(DLS,ELS-8000,Photal,Japan)测量纳米复合物的粒径大小及表面电位。
1.6 体外细胞毒性实验 hBMSCs以8 000个细胞/孔接种于96孔板,每孔加入100 μl全培养基(DMEM含10% FBS,1%青霉素,1%链霉素),于培养箱中(37℃,5% CO2)常规培养24 h。实验孔细胞与不同N/P比值(5、10、15、20、25、30、35、40)的PEG-g-PEI-SPION/pDNA和scAbGD2-PEG-g-PEI-SPION/pDNA纳米复合物(pDNA 0.15 μg,体系3 μl)共同培养24 h。然后向每孔加入10 μl CCK8溶液,继续培养3 h。采用酶标仪测定在450 nm处的吸光值。每个N/P比值设3个复孔,常规设置调零孔和对照孔。
1.7 体外转染实验 hBMSCs以2×105个细胞/孔接种于6孔板,每孔加入1 ml全培养基,细胞于培养箱中常规培养12 h。实验孔细胞与不同N/P比值(0、10、15、20、30、40)的纳米复合物(pDNA 4 μg,体系30 μl)共同培养12 h,PEG-g-PEI-SPION组和scAbGD2-PEG-g-PEI-SPION组的用量根据N/P比值计算。然后更换全培养基,继续培养40 h。对照组的转染采用商品化的阳离子脂质体Lipofectamine。每个样品均设3个复孔。同时设置抗体竞争抑制(scAbGD2-PEG-g-PEI-SPION+free AbGD2)组和同型抗体(scAbIgG2a-PEG-g-PEI-SPION)组进行抗体竞争抑制实验和同型抗体实验。转染实验结束后使用倒置荧光显微镜观察绿色荧光蛋白表达情况,并使用流式细胞分析仪(BD,美国)检测转染率。
1.8 激光共聚焦显微镜实验 绿色荧光染料Oregon Green 488采用超滤法标记纳米载体。红色荧光染料popo-3用于标记pDNA。Oregon Green 488标记的纳米载体与popo-3标记的pDNA按照N/P=20制备纳米复合物(pDNA 4 μg,体系30 μl)。2×105个hBMSCs接种于35 mm玻璃底培养皿,加入1 ml全培养基,常规培养12 h。将上述荧光标记的纳米复合物加入到培养基中共同培养6 h。弃去培养基,PBS洗涤3次,加入4%的多聚甲醛1 ml固定10 min后使用DAPI染核15 min。培养皿置于激光共聚焦显微镜(Carl Zeiss,德国)下观察并拍摄图像。
1.9 普鲁士蓝染色实验 hBMSCs以2×105个细胞/孔接种于6孔板,常规培养12 h。将纳米复合物(N/P=20,pDNA 4 μg,体系30 μl)加入到培养基中共同培养6 h。弃去培养基,PBS洗涤3次,加入4%的多聚甲醛1 ml固定10 min。每孔加入1 ml Perls液(2%的亚铁氰化钾与2%的盐酸水溶液等量混合)染色30 min后于显微镜下观察。
1.10 细胞MR显像 将hBMSCs以2×105个细胞/孔接种于6孔板,常规培养12 h。制备铁浓度为0、5、10、20、40、60 μg/ml的纳米复合物(N/P=20,pDNA 4 μg),共同培养6 h后收集细胞。采用1.5T MR扫描仪、3 inch表面线圈,对所得细胞进行扫描,获得T2/T2*加权图像。扫描结束后测量不同铁浓度下细胞的标准化信号强度。
1.11 统计学分析 采用SPSS 13.0统计分析软件,计量资料以±s表示。在相同的N/P比值下,scAbGD2-PEG-g-PEI-SPION与PEG-g-PEI-SPION的细胞毒性和Lipofectamine的转染率采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 凝胶阻滞实验 PEG-g-PEI-SPION和scAbGD2-PEG-g-PEI-SPION分别在N/P为2.3和2.4时完全复合pDNA,形成电中性或偏正电荷的纳米复合物(图1)。
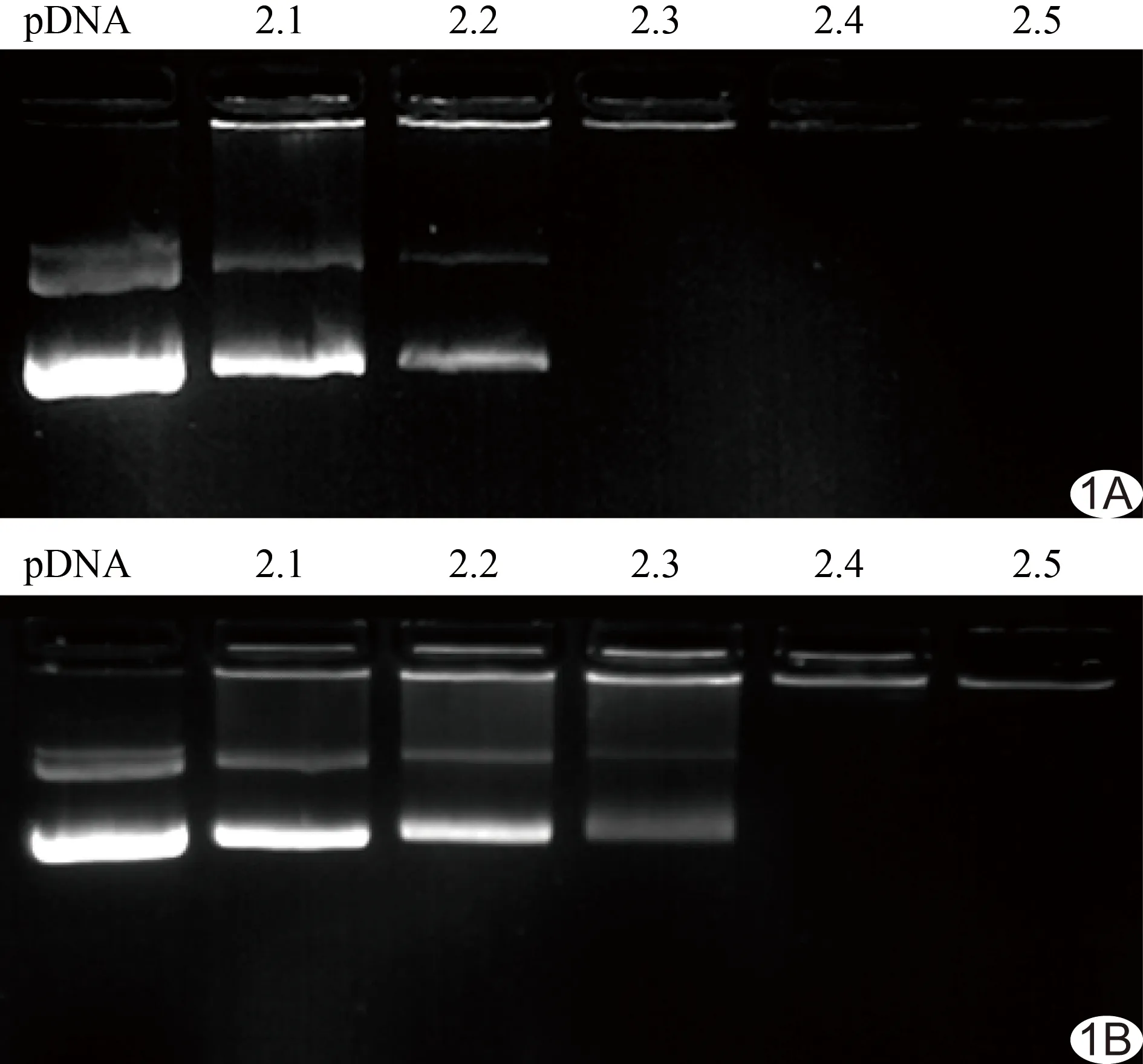
图1 凝胶阻滞实验 A.N/P=2.3时,PEG-g-PEI-SPION完全复合pDNA; B.N/P=2.4时,pDNA被scAbGD2-PEG-g-PEI-SPION完全复合,此时pDNA在电泳时的迁移被完全阻滞
2.2 纳米复合物的粒径大小及表面电位 PEG-g-PEI-SPIO和scAbGD2-PEG-g-PEI-SPION未复合pDNA时粒径大小约60 nm。N/P≥10时形成稳定的粒径为80~100 nm的纳米复合物,表面电位随N/P比值的增大而逐渐增加,见图2。
2.3 细胞毒性实验 纳米复合物的细胞毒性随N/P比值的增大而增加。N/P=20时靶向组细胞的存活率为(80.56±1.29)%,非靶向组细胞的存活率为(77.70±1.49)%,见图3。在相同的N/P比值下,scAbGD2-PEG-g-PEI-SPION与PEG-g-PEI-SPION的细胞毒性差异无统计学意义(P>0.05)。

图2 粒径大小及表面电位测定,两者未复合pDNA时粒径大小约为60 nm,N/P≥10时形成稳定的粒径80~100 nm的纳米复合物,表面电位随N/P比值的增大而增加 A.PEG-g-PEI-SPIO; B.scAbGD2-PEG-g-PEI-SPION 图3 细胞毒性实验 纳米复合物的细胞毒性随N/P比值的增大而增加
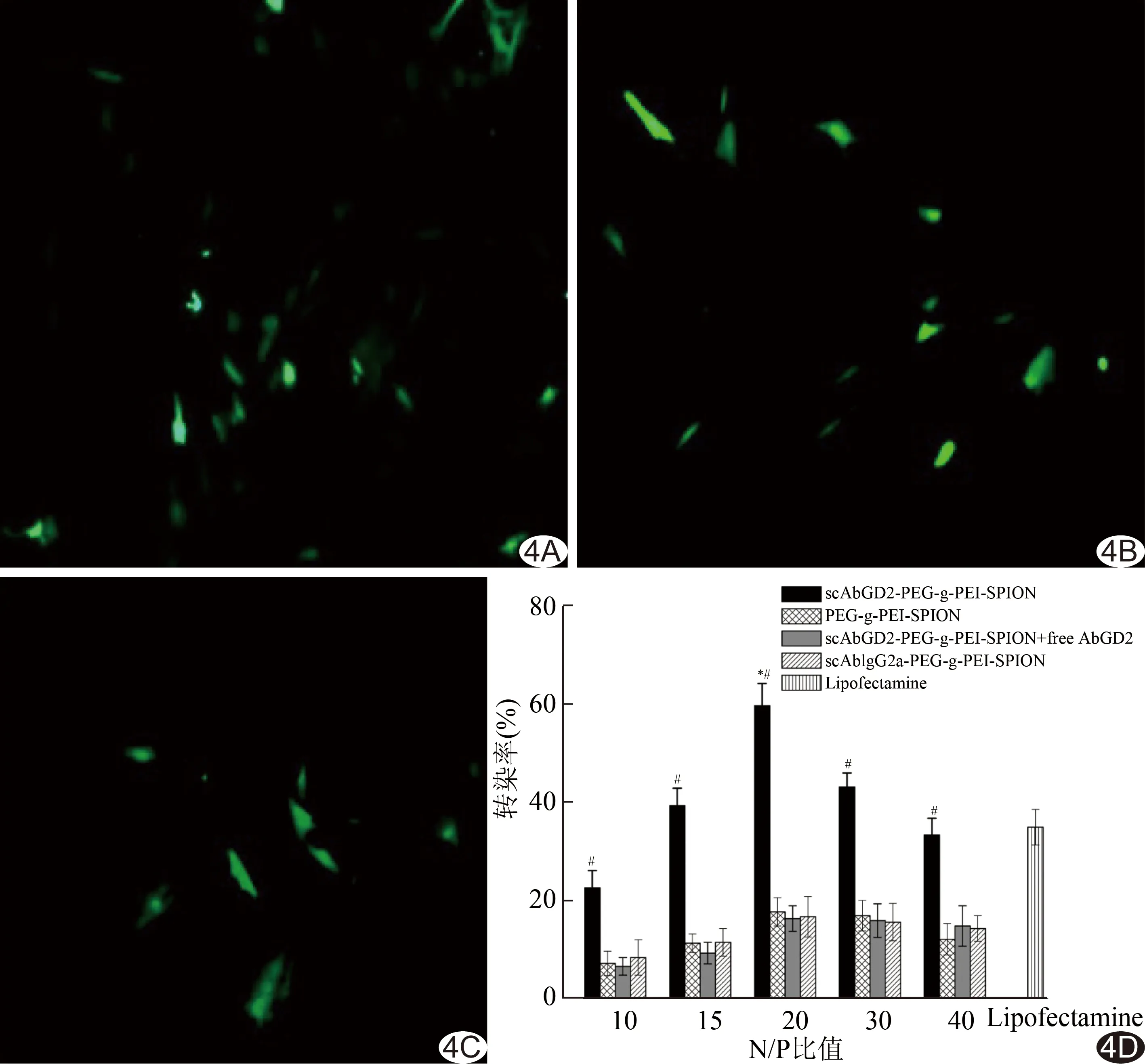
图4 不同载体转染hBMSCs的结果 A.N/P=20时,scAbGD2-PEG-g-PEI-SPION转染hBMSCs后绿色荧光蛋白表达情况(×100); B.10 μl Lipofectamine复合4 μg pDNA转染hBMSCs后绿色荧光蛋白表达情况(×100); C.N/P=20时PEG-g-PEI-SPION转染hBMSCs后绿色荧光蛋白表达情况(×100); D.流式细胞仪检测结果 (#:与相同的N/P比值下scAbGD2-PEG-g-PEI-SPION组比较,P<0.001;*:N/P=20时,与其余各组比较,P<0.001)
2.4 转染实验 在相同N/P比值下,不同组别间转染率差异有统计学意义(F=105.303,P<0.001)。scAbGD2-PEG-g-PEI-SPION组的转染率明显高于PEG-g-PEI-SPION组、scAbGD2-PEG-g-PEI-SPION+free AbGD2组和scAbIgG2a-PEG-g-PEI-SPION组(P均<0.001),余两两比较差异无统计学意义(P均>0.05)。N/P=20时,scAbGD2-PEG-g-PEI-SPION组转染率最高,为(59.60±4.50)%;PEG-g-PEI-SPION组的最高转染率为(17.70±2.90)%;scAbGD2-PEG-g-PEI-SPION+free AbGD2组的最高转染率为(16.30±2.60)%;scAbGD2a-PEG-g-PEI-SPION组的最高转染率为(16.70±4.10)%。Lipofectamine转染hBMSCs的最佳条件为4 μg pDNA与10 μl Lipofectamin复合,此时转染率为(34.90±3.60)%。N/P=0时无绿色荧光蛋白表达,转染率为零(数据未列出)。见图4。
2.5 激光共聚焦显微镜及普鲁士蓝染色实验 scAbGD2-PEG-g-PEI-SPION组细胞质内可见很强的颗粒状分布的绿色荧光和红色荧光(图5),即hBMSCs摄入了大量的纳米复合物。普鲁士蓝染色示scAbGD2-PEG-g-PEI-SPION组hBMSCs的胞质内可见较多蓝染铁颗粒(图6)。
2.6 细胞MR显像 scAbGD2-PEG-g-PEI-SPION组、PEG-g-PEI-SPION组及scAbGD2-PEG-g-PEI-SPION+free AbGD2组的细胞在MR T2/T2*加权图像上均呈低信号(图7)。随铁浓度的增加,细胞的标准化信号强度逐渐降低。在相同的铁浓度下,scAbGD2-PEG-g-PEI-SPION信号降低的程度明显高于PEG-g-PEI-SPION和scAbGD2-PEG-g-PEI-SPION+free AbGD2制组(图8)。

图5 hBMSCs摄取纳米复合物的激光共聚焦显微镜实验(×30) scAbGD2-PEG-g-PEI-SPION组hBMSCs细胞被DAPI(A)、Oregon Green 488(B)、popo-3(C)和Merge(D)标记后的图像,可见细胞质内有很强的绿色荧光和红色荧光;PEG-g-PEI-SPION组hBMSCs细胞被DAPI(E)、Oregon Green 488(F)、popo-3(G)和Merge(H)标记后的图像,及scAbGD2-PEG-g-PEI-SPION+free AbGD组hBMSCs细胞被DAPI(I)、Oregon Green 488(J)、popo-3(K)和Merge(L)标记后的图像,细胞质内仅可见到少量绿色荧光和红色荧光

图6 hBMSCs摄取靶向和非靶向纳米复合物的普鲁士蓝染色实验(×200) A.scAbGD2-PEG-g-PEI-SPION组hBMSCs的胞质内可见较多的蓝染铁颗粒; B.PEG-g-PEI-SPION组hBMSCs的细胞质内仅能见到少量的蓝染铁颗粒 图7 hBMSCs MR T2/T2*加权成像 A.T2WI; B.T2*WI (从上向下依次为scAbGD2-PEG-g-PEI-SPION组、PEG-g-PEI-SPION组及scAbGD2-PEG-g-PEI-SPION+free AbGD2组)
3 讨论
Ahn等[12]采用PEI为载体负载绿色荧光蛋白质粒,转染人脂肪来源的间充质干细胞,最高转染率仅19%。本研究PEG-g-PEI-SPION转染hBMSCs的最高转染率仅(17.70±2.90)%。为提高纳米载体的转染率,常采用靶向修饰纳米载体的方法。细胞靶向配体如糖基化分子、多肽、蛋白质和抗体等均可修饰纳米载体,用于细胞的靶向基因传输[13-15]。T淋巴细胞对病毒载体及非病毒载体的基因改造均不敏感,T细胞表面特异性高表达CD3分子。Chen等[16]利用CD3单链抗体修饰PEG-g-PEI,合成具有靶向基因传输功能的纳米载体scAbCD3-PEG-g-PEI,采用scAbCD3-PEG-g-PEI为载体靶向转染CD3+小鼠T淋巴细胞,所得转染率为非靶向载体PEG-g-PEI的16倍。因此,本研究旨在构建靶向载体,对hBMSCs进行靶向基因转染,以提高转染效率。
虽然hBMSCs表达多种表面分子,但特异性地高效识别早期hBMSCs仍较困难。近年来,新的表面分子二唾液酸神经节苷脂GD2备受关注[17-18],无论是新分离的还是体外培养的hBMSCs均可持续表达GD2,且是骨髓细胞中唯一表达该分子的细胞。GD2是一种含唾液酸的鞘糖脂分子,广泛分布于hBMSCs细胞膜外层,Martinez等[17]利用GD2抗体免疫磁珠分选从骨髓细胞中高效获取hBMSCs,免疫细胞化学和RT-PCR的结果均显示hBMSCs高表达GD2。因此,GD2可作为特异性识别hBMSCs的表面标志物。

图8 hBMSCs的MR显像标准化信号强度
本研究以GD2为靶点,成功制备了靶向纳米基因载体scAbGD2-PEG-g-PEI-SPION。将GD2双链抗体打开成为单链抗体scAbGD2,有利于减小纳米载体的粒径,同时可保留特异性结合GD2的能力。凝胶阻滞实验和细胞毒性实验表明,scAbGD2的存在并不影响scAbGD2-PEG-g-PEI-SPION复合外源性DNA的能力,也不增加scAbGD2-PEG-g-PEI-SPION的细胞毒性。scAbGD2-PEG-g-PEI-SPION复合外源性报告基因pDNA(pEGFP)后可形成稳定的纳米复合物scAbGD2-PEG-g-PEI-SPION/pDNA。scAbGD2-PEG-g-PEI-SPION/pDNA粒径大小及表面电位适中,细胞毒性较小,hBMSCs的转染率最高为(59.60±4.50)%,明显高于非靶向组和对照组的转染率。
为验证scAbGD2靶向转染的特异性,本研究进行了抗体竞争抑制实验、同型抗体实验、激光共聚焦显微镜实验及普鲁士蓝染色实验,结果均发现因scAbGD2与hBMSCs表面的GD2特异性结合,scAbGD2-PEG-g-PEI-SPION/pDNA组增加了细胞对靶向纳米复合物的摄入,进而提高其转染率,细胞内荧光强度的增加,以及细胞质内SPION颗粒的增多。scAbGD2-PEG-g-PEI-SPION同样具有良好的标记hBMSCs进行MR显像的能力。由于scAbGD2-PEG-g-PEI-SPION具有靶向性,因此有可能将scAbGD2-PEG-g-PEI-SPION作为磁性探针,对移植的GD2阳性的hBMSCs进行实时活体MR示踪显像。
总之,scAbGD2-PEG-g-PEI-SPION是一种MRI可视的,可有效转染hBMSCs的靶向纳米基因载体。
(致谢:感谢中山大学医学院干细胞中心赠予人骨髓间充质干细胞!)
[1] Haga H, Yan IK, Takahashi K, et al. Extracellular vesicles from bone marrow-derived mesenchymal stem cells improve survival from lethal hepatic failure in mice. Stem Cells Transl Med, 2017,6(4):1262-1272.
[2] 谢佩怡,胡晓俊,陈俊伟,等.过表达肝细胞核因子4 alpha对人骨髓间充质干细胞向肝样细胞分化的作用.中国医学影像技术,2014,30(7):991-995.
[3] Alison MR, Islam S, Lim S. Stem cells in liver regeneration, fibrosis and cancer:The good, the bad and the ugly. J Pathol, 2009,217(2):282-298.
[4] diBonzo LV, Ferrero I, Cravanzola C, et al. Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine: Engraftment and hepatocyte differentiation versus profibrogenic potential. Gut, 2008,57(2):223-231.
[5] Quintanilha LF, Mannheimer EG, Carvalho AB, et al. Bone marrow cell transplant does not prevent or reverse murine liver cirrhosis. Cell Transplant, 2008,17(8):943-953.
[6] Baertschiger RM, Serre-Beinier V, Morel P, et al. Fibrogenic potential of human multipotent mesenchymal stromal cells in injured liver. PLoS One, 2009,4(8):e6657.
[7] Cai J, Zhang X, Wang X, et al. In vivo MR imaging of magnetically labeled mesenchymal stem cells transplanted into rat liver through hepatic arterial injection. Contrast Media Mol Imaging, 2008,3(2):61-66.
[8] Bos C, Delmas Y, Desmoulière A, et al. In vivo MR imaging of intravascularly injected magnetically labeled mesenchymal stem cells in rat kidney and liver. Radiology, 2004,233(3):781-789.
[9] Wu C, Li J, Pang P, et al. Polymeric vector-mediated gene transfection of MSCs for dual bioluminescent and MR tracking in vivo. Biomaterials, 2014,35(28):8249-8260.
[10] Pang P, Wu C, Gong F, et al. Nanovector for gene transfection and MR imaging of mesenchymal stem cells. J Biomed Nanotechnol, 2015,11(4):644-656.
[11] 庞鹏飞,李冰,胡晓俊,等.多功能纳米基因载体转染人脂肪间充质干细胞及体外细胞磁共振显像.中华医学杂志,2014,94(13):1021-1024.
[12] Ahn HH, Lee JH, Kim KS, et al. Polyethyleneimine-mediated gene delivery into human adipose derived stem cells. Biomaterials, 2008,29(15):2415-2422.
[13] Suh W, Chung JK, Park SH, et al. Anti-JL1 antibody-conjugated poly (L-lysine) for targeted gene delivery to leukemia T cells. J Control Release, 2001,72(1-3):171-178.
[14] Lee Y, Kischuk E, Crist S, et al. Targeting and internalization of liposomes by bladder tumor cells using a fibronectin attachment protein-derived peptide-lipopolymer conjugate. Bioconjug Chem, 2017,28(5):1481-1490.
[15] Nasongkla N, Shuai X, Ai H, et al. cRGD-functionalized polymer micelles for targeted doxorubicin delivery. Angew Chem Int Ed Engl, 2004,43(46):6323-6327.
[16] Chen G, Chen W, Wu Z, et al. MRI-visible polymeric vector bearing CD3 single chain antibody for gene delivery to T cells for immunosuppression. Biomaterials, 2009,30(10):1962-1970.
[17] Martinez C, Hofmann TJ, Marino R, et al. Human bone marrow mesenchymal stromal cells express the neural ganglioside GD2: A novel surface marker for the identification of MSCs. Blood, 2007,109(10):4245-4248.
[18] Xu J, Liao W, Gu D, et al. Neural ganglioside GD2 identifies a subpopulation of mesenchymal stem cells in umbilical cord. Cell Physiol Biochem, 2009,23(4-6):415-424.
《中国医学影像技术》增刊征稿启事
《中国医学影像技术》杂志于1985年创刊,是由中国科学院主管,中国科学院声学研究所主办的国家级学术期刊。本刊是中国科技核心期刊、《中文核心期刊要目总览》收录期刊、中国科学引文数据库核心期刊,刊号ISSN 1003-3289,CN 11-1881/R。2017年度《中国医学影像技术》增刊拟定于2017年12月出版,现将有关事项通知如下:
1增刊稿件内容放射、超声、核医学、内镜、介入治疗、医学物理与工程学等方面的论文。
2投稿截止时间2017年11月30日。
3出刊时间2017年12月20日。
4增刊规格同正刊,大16开本。
5征稿要求①有一定的学术价值,论点鲜明,论述严谨;②格式按杂志要求制作,必须包含中英文标题,作者署名,作者单位、科室、地址、邮编,第一作者简介(出生年份、性别、民族、籍贯、学历、职称、研究方向),中英文摘要,关键词,正文,参考文献;③文字通顺,表达清楚,各种符号使用符合规范;④论著一般不超过5000字为宜;⑤经本刊退稿的文章投增刊时请注明原稿号;⑥直接发电子邮件至本刊投稿邮箱(cjmit@mail.ioa.ac.cn),邮件题目“增刊投稿+第一作者姓名+文章名(原稿号)”。
6收费标准版面费:论著、综述2500元/篇,经验交流1500元/篇,个案报道800元/篇;免稿件审理费;稿费按正刊标准支付。
7地址北京市海淀区北四环西路21号大猷楼,中国医学影像技术编辑部,邮编:100190。
8电话010-82547903
9投稿邮箱cjmit@mail.ioa.ac.cn
10网址www.cjmit.com
本刊编辑部自即日起接受增刊来稿,热诚期盼您的关注和支持!
《中国医学影像技术》期刊社
2017年7月20日
Targetednano-vectorforgenedeliveryintohumanbonemarrowmesenchymalstemcellsandcellularMRimaginginvitro
PANGPengfei1,LIBing2,MAOJunjie1,ZHOUBin1,HUXiaojun1,ZHANGYongyu1,AOFeng1,SHANHong1*
(1.InterventionalMedicineCenter, 2.DepartmentofOphthalmology,theFifthAffiliatedHospital,SunYat-senUniversity,Zhuhai519000,China)
ObjectiveTo explore the feasibility and efficacy of an MRI-visible, targeted, nano-vector which is synthesized by attaching a targeting ligand, the GD2 single chain antibody (scAb GD2), to the distal ends of PEG-g-PEI-SPION as a carrier for gene delivery into human bone marrow mesenchymal stem cells (hBMSCs) and in vitro cellular MR imaging.MethodsscAbGD2-PEG-g-PEI-SPION was synthesized as previously reported. Gel electrophoresis was performed to assess the pDNA condensation ability of scAbGD2-PEG-g-PEI-SPION. The particle size and Zeta potential of scAbGD2-PEG-g-PEI-SPION/pDNA nanocomplexes were observed by dynamic light scattering. Cytotoxicity of scAbGD2-PEG-g-PEI-SPION was evaluated by CCK-8 assay using hBMSCs. Gene transfection efficiency of scAbGD2-PEG-g-PEI-SPION in hBMSCs was quantified by flow cytometry, PEG-g-PEI-SPION, scAbGD2-PEG-g-PEI-SPION, scAbGD2-PEG-g-PEI-SPION+free AbGD2 and scAbIgG2a-PEG-g-PEI-SPION group was established. The cellular internalization of scAbGD2-PEG-g-PEI-SPION/pDNA nanocomplexes was observed by confocal laser scanning microscopy and Prussian blue staining. MRI of scAbGD2-PEG-g-PEI-SPION was performed by cellular MRI scanning in vitro.ResultsscAbGD2-PEG-g-PEI-SPION condensed pDNA to form stable nanocomplexes of 80—100 nm in diameter and showed low cytotoxicity to hBMSCs. At the same N/P ratio, the transfection efficiency of scAbGD2-PEG-g-PEI-SPION group was significantly higher than those of other groups (P<0.001). At the optimal N/P ratio of 20, scAbGD2-PEG-g-PEI-SPION/pDNA obtained the highest transfection efficiency of (59.60±4.50)% in hBMSCs. Furthermore, hBMSCs labeled with scAbGD2-PEG-g-PEI-SPION showed sensitive low signal intensity on MRI T2/T2*-weighted images in vitro.ConclusionscAbGD2-PEG-g-PEI-SPION is an efficient MRI-visible targeted nano-vector for gene delivery into hBMSCs.
Bone marrow; Mesenchymal stromal cell; Magnetic resonance imaging; Targeted gene vector; Nanomedicine
10.13929/j.1003-3289.201612120
R445.2
A
1003-3289(2017)10-1463-07
国家自然科学基金青年基金(81501561)、广东省自然科学基金(2014A030310043、2017A030313873)。
庞鹏飞(1980—),男,河南沈丘人,博士,副主任医师。研究方向:分子影像学。E-mail: pflb@sina.com
单鸿,中山大学附属第五医院介入医学中心,519000。E-mail: Shanhong@mail.sysu.edu.cn
2016-12-30
2017-07-27
