非小细胞肺癌表皮生长因子受体突变的检测与分子靶向治疗
2017-11-01方平王沣江富来林琳赵铁
方平 王沣 江富来 林琳 赵铁
·论著·
非小细胞肺癌表皮生长因子受体突变的检测与分子靶向治疗
方平 王沣 江富来 林琳 赵铁
目的探讨非小细胞肺癌患者表皮生长因子受体(EGFR)基因突变率和突变类型,分析其临床特征,并观察EGFR突变与表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)治疗疗效的相关性。方法收集203例非小细胞肺癌患者外科手术、淋巴结活检、经皮肺穿刺活检、气管镜活检和胸腔积液沉渣石蜡标本,应用ADx-ARMS法进行EGFR基因突变检测,分析基因的突变率及其与临床特征的关系;观察非小细胞肺癌(NSCLC)接受EGFR-TKIs治疗的非小细胞肺癌患者的疗效。应用SPSS23.0 软件进行统计学分析,计数资料比较采用χ2检验,采用Kaplan-Meier法计算患者的PFS,采用Log-Rank检验分析各种因素对生存期的影响。结果203例NSCLC 患者,男性116例,女性87例,年龄为25~82岁。吸烟指数≥400支/者61例,小于400支/年和不吸烟者142例,腺癌152例,鳞癌21例,腺鳞癌14例,其他NSCLC16例。203例NSCLC患者EGFR总突变率为51.2%(104/203),包括19外显子缺失突变51例(49.0%),21外显子L858R突变44例(42.3%),19del及L858R总突变率占所有突变的96.1%,18外显子G719X点突变3例(2.9%),19del+L858R双突变3例(2.9%),1例20ins,2例T790M突变分别为1例19del+T790M和1例L858R+T790M。EGFR基因阳性突变率女性组高于男性组(66.7%vs. 36.2%);非吸烟组高于吸烟组(63.4%vs. 16.4%);腺癌组高于鳞癌组(53.3%vs. 33.3%),P<0.05。而EGFR基因突变状况与标本类型如手术、淋巴结活检、肺穿刺活检、气管镜活检和胸腔积液沉渣标本间无统计学差异,P=0.418。101例接受TKI治疗的NSCLC患者客观缓解率(ORR)为61.4%,疾病控制率(DCR)为71.3%,中位疾病无进展生存期(PFS)为10个月。其中EGFR突变阳性患者接受EGFR-TKIs治疗的ORR及DCR均要显著高于EGFR突变阴性及EGFR突变状态未明确人群(88.6%vs. 16.7%vs. 43.1%,P=0.000;95.5%vs. 16.7%vs. 56.9%,P=0.000)。EGFR突变阳性患者接受EGFR-TKIs治疗的中位PFS较EGFR突变阴性及EGFR突变状态未明确患者延长,有统计学差异(P=0.001)。进一步分析EGFR突变阳性19del组NSCLC患者ORR、DCR均高于L858R组(91.2%vs. 85%,P=0.646;100%vs. 90%,P=0.201);19del组NSCLC患者TKI治疗后中位PFS 14.5个月较L858R组10个月长,有统计学差异(P=0.010)。结论非小细胞肺癌患者EGFR突变高,以女性、不吸烟、腺癌为优势人群,EGFR敏感突变阳性者对EGFR-TKI疗效好,EGFR突变中19del者较L858R疗效更佳,基因检测结果可以较好地预测分子靶向药物的疗效,降低肿瘤进展的风险。
非小细胞肺癌; 表皮生长因子受体; 靶向治疗
肺癌是当今世界范围内对人类健康和生命安全威胁最常见的恶性肿瘤之一,其患病率和病死率稳居恶性肿瘤的首位,每年估计新发肺癌患者将近140万,其中非小细胞肺癌大约占80%[1]。以铂类为基础的经典化疗疗效已进入瓶颈期,其1年生存率仅为30%~40%[2-4]。根据驱动基因来选择靶向治疗,延长患者生存时间及改善患者生活质量是当前研究的热点。针对表皮生长因子受体的第一代表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKIs)已成为EGFR突变型晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)重要的治疗手段。研究发现非小细胞肺癌患者的可发挥功能性驱动基因较多,有EGFR、KRAS、EML4-ALK融合基因、BRAF、HER2、PI3K、RET、ROS1等,每种驱动基因的治疗目前已取得突破性进展。EGFR-TKIs对于晚期肺癌患者,其有效率达70%~90%[5];EML4-ALK融合基因抑制剂克唑替尼对ALK 阳性非小细胞肺癌患者中位PFS 为7.7 个月,总体有效率(objective response rates, ORRs)为65%[6]。日前,美国食品药品管理局批准克唑替尼用于治疗ALK阳性的局部晚期和转移的NSCLC;针对KRAS的基因治疗也进入Ⅱ期临床。由于可发挥功能性驱动基因的发生率、临床病理特征因人种、地域差异均有所不同,为了取得更好疗效,进行基因分型对个体化靶向治疗至关重要。为掌握NSCLC患者EGFR基因分型情况以及EGFR-TKI治疗效果,本研究对203例NSCLC患者进行了EGFR基因突变检测,对EGFR基因突变阳性患者给予EGFR-TKI治疗,并观察其疗效,现报道如下。
对象与方法
一、研究对象
纳入2010年1月至2016年6月安徽省铜陵市人民医院及安徽省立医院呼吸科、胸外科、肿瘤科确诊为NSCLC 患者203例,其中铜陵市人民医院117例,安徽省立医院86例。所有入组患者术前、诊断前均未行化疗、放疗或靶向治疗,其中男性116例,女性87例,年龄为25~82岁,中位数年龄为62岁。吸烟指数大于或等于400支/年者61例,小于400支/年和不吸烟者142例。组织学分型依据2011年IASLC、ATS、ERS联合制定的肺和胸膜肿瘤分类标准,腺癌152例,鳞癌21例,腺鳞癌14例,其他NSCLC 16例。用于基因检测的标本来自患者原发灶或转移灶的石蜡组织样本,其中手术切除肿瘤组织石蜡标本142例,气管镜活检组织石蜡标本14例,肺穿刺活检组织石蜡标本19例,淋巴结活检组织石蜡标本12例,胸腔积液沉渣石蜡标本16例。分子靶向治疗患者101例,其中50例进行了基因检测,所有治疗患者均来自铜陵市人民医院。
二、研究方法
1. EGFR基因突变的检测: 对有足够的病理标本进行EGFR基因突变的检测,包括手术切除肿瘤组织、气管镜活检组织、肺穿刺活检组织石蜡标本、淋巴结活检组织、胸腔积液沉渣石蜡标本,使用ARMS法(蝎形探针扩增阻滞突变系统)进行18~21外显子9个位点的检测,包括19-del、G719A、L858R、G719S、G719C、T790M、L861Q、S768I、20-ins。
2. EGFR-TKIs治疗
(1)入组条件: 选择2010年1月至2016年6月安徽省铜陵市人民医院呼吸科、肿瘤科诊治的资料完整的晚期NSCLC 101例;所有患者经病理或细胞学诊断为晚期NSCLC(Ⅲb或Ⅳ期);至少有一个可测量的局部病灶或转移病灶;体力状况评分(PS)为0~3分;预计生存期>3个月;白细胞≥3.0×109/L;血小板≥100×109/L;胆红素在正常值上限的1.5倍以下范围内;肌酐清除率≥45 ml/min;无肿瘤病史;既往接受化疗次数不限;所有患者签署知情同意书。
(2)排除标准: 未控制的中枢神经系统转移;有严重心肺基础疾病,包括间质性肺病;有习惯性腹泻或便秘等影响药物吸收的胃肠道疾病;必须服用华法林和伊曲康唑等药物。
(3)治疗方法: 口服厄洛替尼 150 mg/d或吉非替尼 250 mg/d 或埃克替尼125 mg TID,持续服用直到疾病进展或出现不可耐受的毒副反应。所有患者都要进行全面的体检和详细的病史记录,包括患者吸烟史、家族史、病理类型、肿瘤分期、既往放化疗情况、治疗前后PS评分、实验室检查及影像学资料等均进行详细的记录。特别是影像学复查每月一次。靶向治疗期间不进行其他的全身抗肿瘤治疗,但孤立的、非评价的骨转移病灶,如果症状明显,可行姑息性放疗。
(4)临床评价标准: 临床观察指标包括症状的控制、临床疗效、无疾病进展生存时间(progression-free survival, PFS)、总生存时间(overall survival, OS)、不良反应等。疗效评价根据WHO实体瘤疗效评价标准(RECIST)分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progress disease, PD)。CR和PR在距离首次评价至少4周后进行确认,有效率(RR)为(CR+PR)/总人数。在数据截止时疾病未进展或死亡的患者以及研究中失访的患者,将其最后一次随访的日期作为截止数据进行分析。与药物相关的毒性反应根据美国国立肿瘤研究院通用毒性分级标准(CTC)2.0版进行分级。
三、统计学方法
应用SPSS23.0 软件进行统计学分析,计数资料比较采用χ2检验,采用Kaplan-Meier法计算患者的PFS,并绘制生存曲线。采用Log-Rank检验分析各种因素对生存期的影响,以P<0.05为差异有统计学意义。
结 果
一、EGFR基因突变状况
在入组的203例NSCLC患者中采用ARMS法检测,104例EGFR基因突变阳性,突变率为51.2%,见表1。
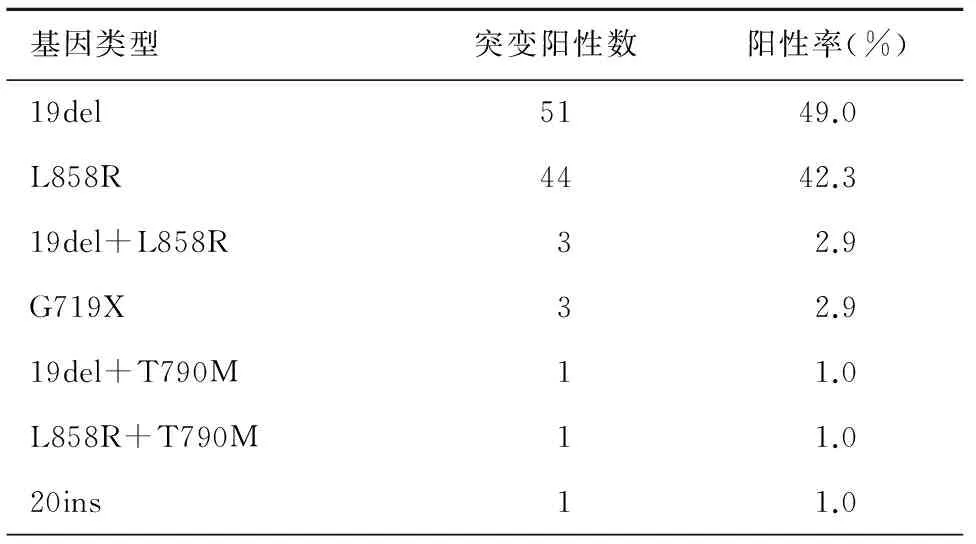
表1 104例EGFR突变类型分布
二、EGFR基因突变相关因素
在203例NSCLC患者 EGFR基因突变检测结果中,19del及L858R总突变率为49.3%(100/203),其中女性患者突变率较男性患者突变率高;非吸烟患者突变率较吸烟患者突变率高;在腺癌、鳞癌中,腺癌组患者EGFR突变率高,差异均有统计学意义。而EGFR基因突变状况与标本类型如手术、淋巴结活检、肺穿刺活检、气管镜活检和胸腔积液沉渣标本间无统计学差异,见表2。
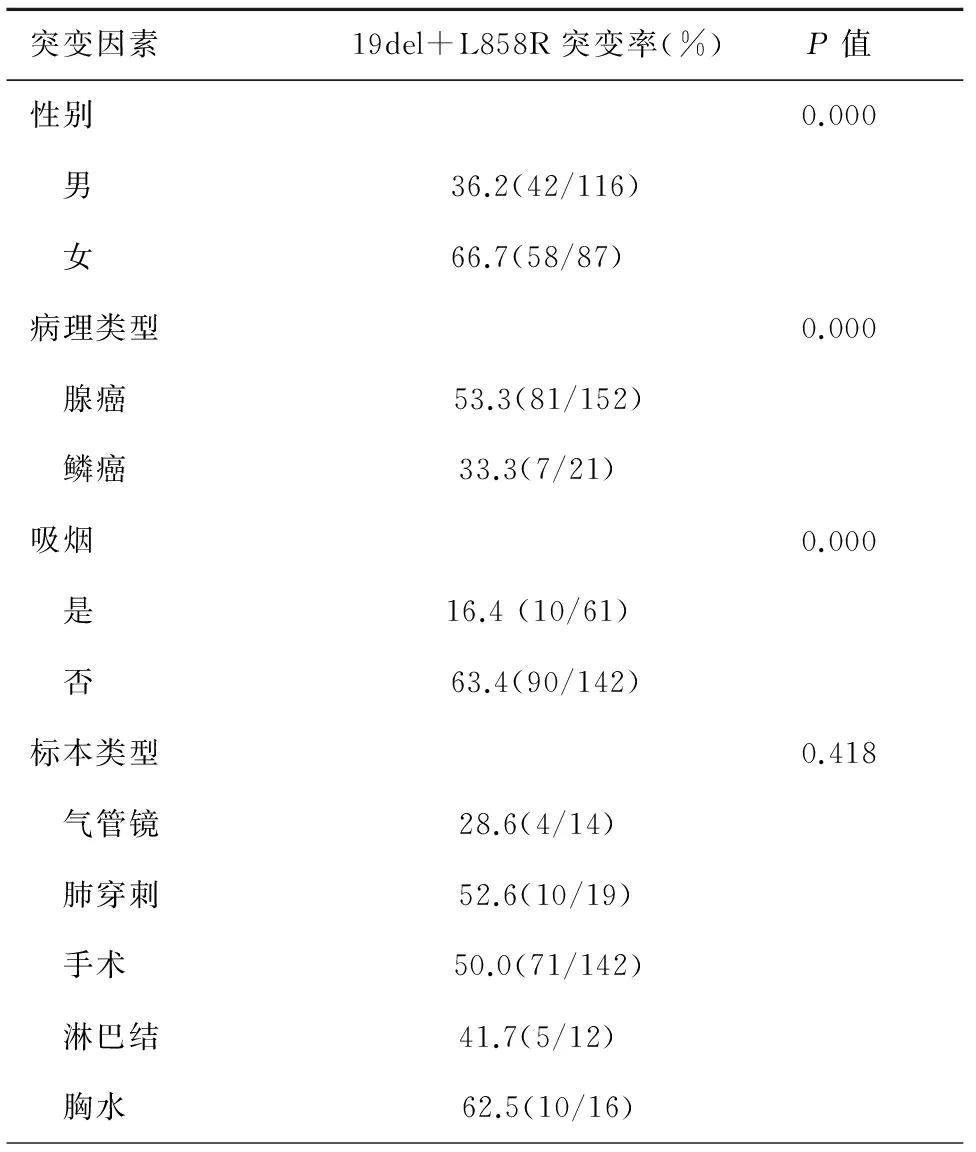
表2 EGFR基因突变相关因素
三、EGFR突变状态和TKI疗效间的关系
101例接受TKI治疗的NSCLC患者客观缓解率(ORR)为61.4%,疾病控制率(DCR)为71.3%,中位疾病无进展生存期(PFS)为10个月;EGFR突变阳性组、EGFR突变阴性组、EGFR突变状态未明组在临床分期、PS评分、性别、吸烟状况等方面无明显差异。 44例EGFR突变阳性NSCLC患者接受EGFR-TKIs治疗的ORR为88.6%,DCR为95.5%,中位PFS为12个月;EGFR突变阳性患者接受EGFR-TKIs治疗的ORR及DCR均要显著高于EGFR突变阴性及EGFR突变状态未明确人群。EGFR突变阳性患者接受EGFR-TKIs治疗的中位PFS较EGFR突变阴性及EGFR突变状态未明确患者延长,有统计学差异(P=0.001)。EGFR突变阳性19del组NSCLC患者ORR、DCR均高于L858R组(91.2%vs. 85.0%,P=0.646; 100%vs. 90%,P=0.201);19del组NSCLC患者TKI治疗后中位PFS 14.5个月较L858R组10个月长,有统计学差异(P=0.010),见表3~4、图1~2。
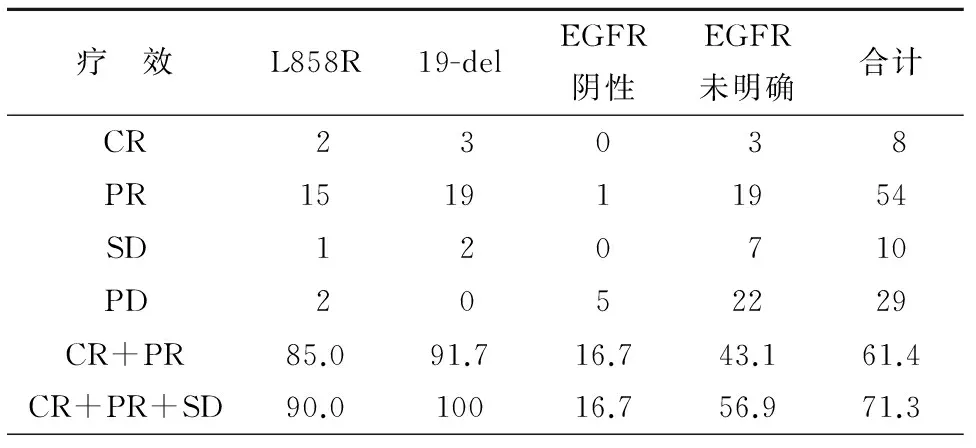
表3 101例NSCLC患者TKI治疗疗效[n(%)]
注:CR:完全缓解;PR:部分缓解;SD:疾病稳定;PD:疾病进展
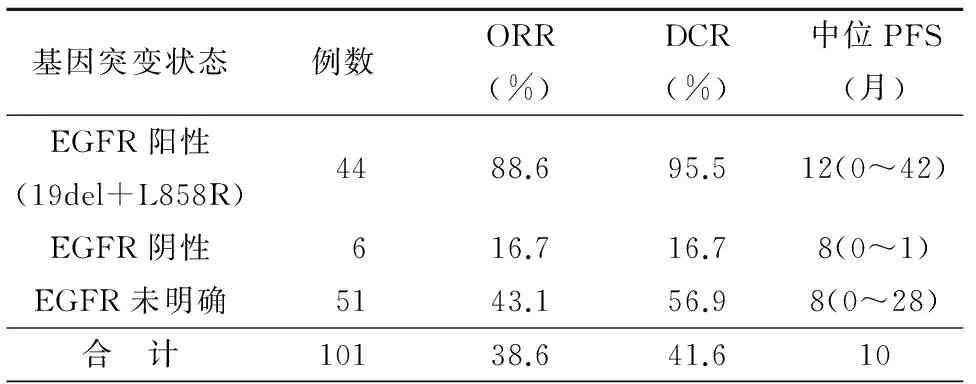
表4 101例接受TKI治疗的患者EGFR突变特征
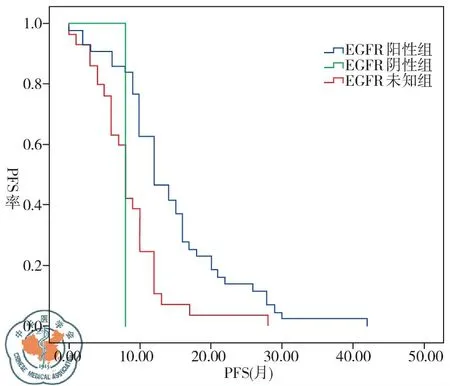
图1 不同EGFR突变状态NSCLC患者TKI治疗后PFS差异
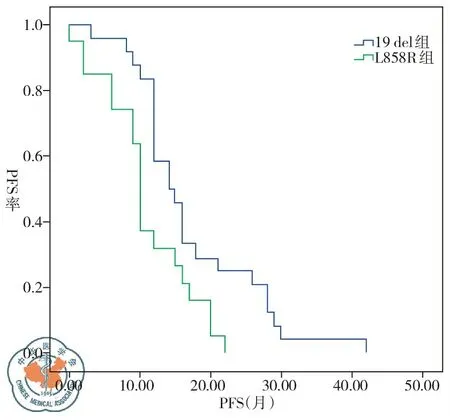
图2 EGFR 19del和L858R基因突变NSCLC患者TKI治疗后PFS差异
讨 论
近年来,与肺癌发生、发展相关的基因突变已成为学者们研究的热点。当前研究较多的是NSCLC驱动基因,包括EGFR基因突变、棘皮动物微管蛋白4-间变淋巴瘤激酶(echinoderm microtubule associated like 4-anaplastic lymphoma kinase, EML4-ALK)基因融合和KRAS基因。EGFR(ErbB1)是由原癌基因C-erb-1编码的酪氨酸激酶erbB家族成员之一,它参与肿瘤的生长、侵袭等过程。基因突变主要发生在EGFR酪氨酸激酶编码区(epidermal growth factor receptor tyramine kinase domain, EGFR-TK),也可分散在整个酪氨酸激酶编码区,但主要集中在第19外显子缺失和第21外显子L858R点突变,约占85%~90%[7]。EGFR突变的被确定为 NSCLC 中的第一代驱动基因,且多见于亚裔、女性、不吸烟、腺癌的患者[8-9]。
本研究对203例NSCLC 患者不同类型的标本进行了EGFR基因检测,发现 NSCLC 患者 EGFR基因突变率为51.2%,与先前报道的亚裔患者相近,高于西方人群[10-11]。本结果为解释本地区NSCLC患者对 EGFR-TKI 的高应答率提供了理论依据。杨宁等[12]采用 SurPlex-xTAG70plex 液相芯片技术平台检测中国430例NSCLC 患者的福尔马林固定石蜡包埋组织中 EGFR、KRAS、BRAF 和 PIK3CA 基因的突变状态,其中EGFR突变率为仅为41.2%,低于本研究结果,可能与本研究纳入的腺癌、非吸烟患者占多以及应用的ARMS法灵敏度高有关。104例EGFR突变患者中19、21外显子总突变大于90%,和以往的研究结果相一致[13]。本研究结果显示EGFR基因 19、21 外显子基因突变状态与患者的性别、病理类型和吸烟史有关,其中女性、腺癌、非吸烟人群突变阳性率高[8]。在本研究中发现1例腺癌患者EGFR L858R和ALK双突变,且患者在接受EGFR-TKI 治疗后明显获益。以往认为NSCLC 患者存在基因突变的互斥[14-15],同时存在 EGFR 和 ALK融合基因突变非常罕见。由于ALK融合基因突变率相对EGFR基因突变率低,临床实践中通常对EGFR野生型患者进行ALK基因分析。随着分子检测技术的不断改进,基因共存现象越来越多被报道。在ALK或者EGFR突变人群中两者双突变现象并不低[16],2014年Yang等[17]报导在ALK融合基因改变人群中合并EGFR基因突变为18.6%。EML4-ALK和EGFR双突变的病理类型主要是腺癌,EGFR既可以是19外显子缺失,也可以是21外显子点突变,但EML4-ALK主要是变体1的融合。
本研究入组患者中44例19、21外显子EGFR突变阳性患者进行了TKI治疗,其中位无疾病进展生存期(PFS)至今统计为12个月,与EGFR阴性及突变状态未明确患者中位PFS比较有明显延长,可见基因突变检测的重要性。此外研究发现EGFR阳性19del组NSCLC患者ORR、DCR均高于L858R组(91.2%vs. 85%,P=0.646;100%vs. 90%,P=0.201);19del组NSCLC患者TKI治疗后中位PFS 14.5个月较L858R组10个月长,有统计学差异(P=0.010),因此,在临床上EGFR突变19del型肺癌患者更值得推荐EGFR-TKI治疗。
耐药已成为限制EGFR-TKI 临床应用的瓶颈,即使是初始治疗有效的患者,大部分在用药10个月左右都会不可避免地出现耐药[18-19]。EGFR-TKI耐药包括原发性耐药和继发性耐药。EGFR基因T790M位点突变,被认为不仅是EGFR-TKI原发性耐药,亦是获得性耐药的主要原因[19-20]。研究表明,T790M改变了EGFR酪氨酸激酶结构域的空间构型,阻碍了TKI与 EGFR受体的结合,减弱了TKI与腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)的有效竞争能力,从而导致耐药[21]。本研究发现两例T790M突变,且与敏感EGFR突变19外显子缺失和21外显子点突变共存,随访的1例患者予以EGFR-TKI治疗后临床获益明显。EGFR-TKI继发耐药患者针对耐药突变选用新的小分子靶向药物是当前重要的临床策略。第二代高效双重非可逆性的酪氨酸激酶抑制剂阿法替尼在抑制T790M 激酶活性方面作用更强,已经被作为克服获得性耐药的有效药物。第三代口服、不可逆的选择性EGFR突变抑制剂AZD 9291,针对EGFR-TKI敏感突变和耐药突变T790M均具有良好的抗瘤效能和高度选择性。针对T790M阳性的患者其总反应率和临床获益率分别是64%和90%,大大超过T790M阴性的患者,PFS也达到13.5个月[22]。以上可见,EGFR基因突变检测对指导临床用药及预后评估十分重要,已经被指南强烈推荐。此外共存的敏感突变和耐药突变的动态监测,如突变丰度,可能对治疗药物选择的疗效预测具有暗示效果。耐药突变的检测为解释患者耐药机制和继发耐药后的治疗策略的选择提供了依据。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 Chen W, Zheng R, Zeng H, et al. Epidemiology of lung cancer in China[J]. Thoracic Cancer, 2015, 6(2): 209-215.
3 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
4 Patel JD, Krilov L, Adams S, et al. Clinical cancer advances 2013: annual report on progress against cancer from the American society of clinical oncology[J]. J Clin Oncol, 2014, 32(2):129-160.
5 Morita S, Okamoto I, Kobayashi K, et al. Combined survival analysis of prospective clinical trials of gefitinib for non-small cell lung cancer with EGFR mutations[J]. Clin Cancer Res, 2009, 15(13): 4493-4498.
6 Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J]. N Engl J Med, 2013, 368(25): 2385-2394.
7 Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012,13(3): 239-246.
8 Bordi P, Del Re M, Danesi R, et al. Circulating DNA in diagnosis and monitoring EGFR gene mutations in advanced non-small cell lung cancer[J]. Transl Lung Cancer Res, 2015, 4(5): 584-597.
9 Gazdar AF. Activating and resistance mutations of EGFR in non-small-cell lung cance:role in clinical response to EGFR tyrosine kinase inhibitors[J]. Oncogene, 2009, Suppl 1: S24-S31.
10 Xu Q, Zhu Y, Bai Y, et al. Detection of epidermal growth factor receptor mutation in lung cancer by droplet digital polymerase chain reaction[J]. Onco Targets Ther, 2015, 22(8): 1533-1541.
11 Won JK, Keam B, Koh J, et al. Concomitant ALK translocation and EGFR mutation in lung cancer: a comparison of direct sequencing and sensitive assays and the impact on responsiveness to tyrosine kinase inhibitor[J]. Ann Oncol, 2015, 26(2): 348-354.
12 杨宁, 郭妹, 宋玉兰, 等. 430例中国非小细胞肺癌患者EGFR、KRAS、BRAF 和 PIK3CA 基因突变状态及其临床意义[J]. 中国肿瘤生物治疗杂志, 2015, 22(6): 734-739.
13 许春伟, 王海艳, 吴永芳, 等. 2771例肺肿瘤临床病理特征分析临床与病理杂志[J]. 临床与病理杂志, 2016, 36(2): 173-184.
14 Jürgens J, Engel-Riedel W, Prickartz A, et al. Combined point mutation in KRAS or EGFR genes and EML4-ALK translocation in lung cancer patients[J]. Future Oncol, 2014, 10(4): 529-532.
15 Kim HR, Ahn JR, Lee JG, et al. The impact of cigarette smoking on the frequency of and qualitative differences in KRAS mutations in Korean patients with lung adenocarcinoma[J]. Yonsei Med J, 2013, 54(4): 865-874.
16 Jürgens J, Engel-Riedel W, Prickartz A, et al. Combined point mutation in KRAS or EGFR genes and EML4-ALK translocation in lung cancer patients[J]. Future Oncol, 2014, 10(4): 529-532.
17 Yang JJ, Zhang XC, Su J, et al. Lung cancers with concomitant EGFR mutations and ALK rearrangements: diverse responses to EGFR-TKI and crizotinib in relation to diverse receptors phosphorylation[J]. Clin Cancer Res, 2014, 20(5): 1383-1392.
18 Riely GJ, Yu HA. EGFR: The paradigm of an oncogene-driven lung cancer[J]. Clin Cancer Res, 2015, 21(10): 2221-2226.
19 Janne PA, Yang JC, Kim DW, et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(18): 1689-1699.
20 Yu HA, Arcila ME, Hellmann MD, et al. Poor response to erlotinib in patients with tumors containing baseline EGFR T790M mutations found by routine clinical molecular testing[J]. Ann Oncol, 2014, 25(2): 423-428.
21 Sequist LV, Waltman BA, Dias-Santagata D, et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors[J]. Sci Transl Med, 2011, 3(75): 75ra26.
22 Jänne PA, Yang JC, Kim DW, et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(18): 1689-1699.
DetectionofEGFRmutationsinnonsmallcelllungcancerandmoleculartargetedtherapy
FangPing,WangFeng,JiangFulai,LinLin,ZhaoTie.
DepartmentofRespiratoryDisease,TonglingPeople′sHospital,Tongling244002,China
FangPing,Email:fangping1964@126.com
ObjectiveTo detect epidermal growth factor receptor (EGFR) mutations in non-small cell lung cancer (NSCLC) patients, and to study the relationship between EGFR mutation and clinical features, pathological features, the therapy efficacy.MethodsCollect 203 NSCLC patients, specimens, including surgical specimen, lymph node tissues, transthoracic needle biopsyspecimen, bronchoscopy biopsy specimen and pleural effusion cells specimen. EGFR mutations in 203 NSCLC were analyzed by ADx-AMRS assay. The relationship between the muta-tions and the clinicopathologic features was further evaluated. And observed the clinical efficacy of EGFR-TKIs. SPSS23.0 software was used for statistical analysis, the data were compared with chi square test, PFS was calculated by Kaplan-Meier method, and the influence of various factors on survival was analyzed by Log-rank test.ResultsThe age of 203 NSCLC patients, inluding 116 male and 87 female, was range 25 years to 82 years. Smoking index was greater than or equal to 400 in 61 cases, less than 400 in 142 cases.The pathological characteristics of 203 cases were different,ininluding 152 cases of adenocarcinoma, 21 cases of squamous cell carcinoma, 14 cases of adenocarcinoma-squamous carcinoma, and other NSCLC 16 cases. The EGFR mutation rate of 203 cases in patients with NSCLC was 51.2% (104/203), including 51 deletions in exon 19(49.0%), 44 cases of exon 21 mutation, 3 cases of exon 18 mutation(2.9%), 1 case of exon 20 mutation, 3 exon 19/21 double mutation(2.9%), 1 case of 19del/T790M and 1 case of L858R/T790M. The mutation rate of 19del and L858R were higher 96.1% in 104 cases. The mutation rates of EGFR were higher in females than those in males(66.7%vs. 36.2%); Non smoking group EGFR mutation rate was higher than that in the smoking group(63.4%vs. 16.4%); EGFR mutation rate of patients, with lung adenocarcinoma was higher than that of squamous cell carcinoma(53.3%vs. 33.3%),P<0.05. Conversely, between EGFR gene mutation status and specimen type, including surgicai specimen, lymph node biopsy, lung biopsy, bronchoscopy, and pleural effusions, was no significant statistical difference (P=0.418 ). The objective response rate (ORR) to first-line TKI treatment of 101 patients was 61.4%. The disease control rate (DCR) was 71.3%, and the median progression-free survival (PFS) was 10 months. The ORR and DCR to EGFR-TKIs therapy of patients with EGFR mutation were significantly higher than those of patients with EGFR mutation/ undefined EGFR mutation (88.6%vs. 16.7%vs. 43.1%,P=0.000; 95.5%vs. 16.7%vs. 56.9%,P=0.000); the median PFS was also significantly longer (P=0.001). Furthermore, the ORR and DCR in 19-del group were higher than that of group L858R (91.2%vs. 85%,P=0.646 100%;vs. 90%,P=0.201); Patients with NSCLC in after TKI treatment, the median PFS was 14.5 months compared with 10 months in the L858R group, there were significant differences (P=0.010).ConclusionEGFR mutation rate was higher in NSCLC with the advantages of female, non smoking and adenocarcinoma. EGFR mutation detection can better predict the efficacy of molecular targeted drugs and reduce the risk of tumor progression,especialli in 19-del or L858R mutation.
Non-small cell lung cancer; Epidermal growth factor receptor; Targeted therapy
10.3877/cma.j.issn.1674-6902.2017.05.008
安徽省铜陵市卫生局科研基金[卫科研(2014)10]
244002 铜陵,铜陵人民医院呼吸内科
方平,Email: fangping1964@126.com
R563
A
2017-01-22)
(本文编辑:张大春)
方平,王沣,江富来,等. 非小细胞肺癌表皮生长因子受体突变的检测与分子靶向治疗[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(5): 543-548.
