不同钛表面形貌诱导大鼠骨髓间充质干细胞增殖与成骨分化的影响*
2017-11-01武东辉吴亚霖庞静雯庄秀妹
周 敏 武东辉 吴亚霖 庞静雯 庄秀妹
不同钛表面形貌诱导大鼠骨髓间充质干细胞增殖与成骨分化的影响*
周 敏 武东辉 吴亚霖 庞静雯 庄秀妹
目的:比较不同钛表面形貌对大鼠骨髓间充质干细胞(rat bonemarrow mesenchymal stem cells,rBMSCs)增殖与成骨分化的影响。方法:构建不同形貌钛表面,包括喷砂碱热高温组的纳米针状表面、喷砂碱热低温组的纳米网状表面、喷砂酸蚀的微米凹坑表面和对照组的光滑纯钛表面。各组钛片表面接种rBMSCs,在培养1、3、5、7天后采用CCK 8检测各组rBMSCs增殖情况,7、14天检测总蛋白浓度与碱性磷酸酶(alkaline phosphatase,ALP)活性,同时采用实时荧光定量PCR分析7天时成骨相关基因ALP、I型胶原(collagen-I,COL1)与成骨特异性转录因子(runt related transcription factor 2,RUNX 2)的m RNA表达量差异。采用SPSS13.0软件包对数据进行统计学分析。结果:相比光滑纯钛组与喷砂酸蚀组,具有微纳米表面形貌的喷砂碱热高温组与喷砂碱热低温组rBMSCs细胞增殖能力显著增强,总蛋白浓度升高,ALP活性增加,ALP、COL1与RUNX 2的mRNA表达水平明显上调。结论:钛表面微纳米形貌可促进rBMSCs增殖与成骨分化。
大鼠骨髓间充质干细胞;钛表面形貌;成骨分化;微纳米形貌
牙种植体因其修复效果好、不需要损伤健康基牙等优点已成为越来越多牙列缺损甚至牙列缺失患者的首选治疗方式[1]。然而,种植体骨结合时间长、因骨结合不良所引起种植体失败等问题仍是种植体临床应用中面临的巨大挑战[2]。
钛表面改性是目前促进种植体骨结合的研究热点。近年来,钛表面微米化处理已被广泛应用于商业种植体表面改性[3]。但是,越来越多的研究表明,纳米级表面形貌在种植体周围初期骨形成中起主要作用[4-6]。因此,制备微纳米级钛表面形貌、并探讨其与微米级形貌对骨形成的影响差异具有重要意义。本研究旨在通过喷砂、酸蚀、碱热等处理方式获得微米级、微纳米级钛表面形貌,比较其对大鼠骨髓间充质干细胞(ratbonemarrow mesenchymalstem cells,rBMSCs)增殖与成骨分化的影响,为钛表面微纳米形貌促进种植体早期骨结合提供实验基础。
1.材料与方法
1.1 不同钛表面形貌材料的制备与检测 将纯钛片经线性切割成直径10mm、厚度1mm的圆形样品,根据钛表面处理方法[7]分为:光滑纯钛组、喷砂酸蚀组、喷砂碱热高温组与喷砂碱热低温组。分别采用200目、400目、600目碳化硅砂纸逐级打磨抛光各组样品,依次置于无水乙醇、丙酮、去离子水中超声清洗各10m in,去离子水冲洗,室温下干燥备用。使用Peenmatic 620S喷砂机,调节气压为0.4MPa,采用直径为250μm的二氧化硅(silicon dioxide,SiO2)颗粒对除光滑纯钛组之外的样品进行垂直喷砂,喷砂距离为1cm。再用体积比为1∶1的HF和HNO3的混合溶液抛光5m in,去离子水冲洗,干燥备用。将喷砂酸蚀组的样品置于95℃、体积比为2∶4∶3的H2O、HCl和H2SO4的混合溶液中酸蚀10m in,去离子水冲洗,干燥,消毒备用。将喷砂碱热高温的样品置于5mol/LNaOH溶液中,放入180℃的高压锅中反应4h。室温下冷却,去离子水冲洗,干燥,消毒备用。将喷砂碱热低温组的样品置于5mol/L NaOH溶液中,放入80℃的密闭容器中。反应8h后室温下冷却,去离子水冲洗,干燥,消毒备用。采用S-4800冷场发射扫描电镜(H itachi,Japan)分析样品表面形貌。
1.2 rBMSCs的培养与传代 将3周龄健康SD大鼠处死后于无菌环境下剥离出股骨,用培养液冲洗骨髓后离心重悬细胞,采用全骨髓细胞贴壁法对rBMSCs原代培养,10天后细胞呈成纤维细胞样,细胞长至密度为90%左右时传代,纯化的细胞呈均一性,旋涡状或辐射状整齐有序排列,取前5代rBMSCs用于实验。
1.3 CCK 8检测 将4组钛片放入24孔板,每组3个复孔。钛片表面接种rBMSCs,接种密度为2×104/m L,每孔接种1m l细胞悬液,使用CCK-8法(Dojindo,Japan)分别在培养1、3、5和7天后检测细胞活性,在450nm波长下测量吸光度值,观察细胞增殖情况。
1.4 ALP活性检测 将4组钛片放入24孔板,每组3个复孔。钛片表面接种rBMSCs,接种密度为2×104/m L,每孔接种1m l细胞悬液,分别在培养7、14d后检测ALP活性,观察细胞分化情况。检测时先将细胞移人24孔板中,PBS清洗后,按ALP试剂盒(上海碧云天生物技术研究所)说明加细胞裂解液200μl,4℃冰箱过夜。取出培养板,振荡10m in后,使细胞破碎,制成悬液,每孔取30μl到96孔板,分别加入50μl缓冲液及基质液,37℃恒温水浴15m in,加150μl显色剂,于酶标仪520nm波长下测定ALP吸光度值。
1.5 总蛋白浓度测定 取上述细胞悬液25μl到96孔板,使用BCA-100蛋白质定量测试试剂盒(上海碧云天生物技术研究所),于酶标仪562nm波长下测定蛋白吸光度值。根据蛋白吸光度值,在牛血清白蛋白(bovine serum album in,BSA)标准曲线上读取相应的总蛋白质量浓度(μg/m l)。
1.6 实时定量PCR检测 采用Trizol法提取细胞中总RNA,测量RNA含量。取1μg RNA合成cDNA,按Takara公司QuantSYBRGreen PCR kit试剂盒操作说明进行扩增。引物序列如下,ALP(forw ard):5′-CGGAAGTGAGGCAGGTAG-3′,ALP(reverse):5′-AGAGCCCACAATGGACAG-3′;COL1(forw ar):5′-CTGCCCAGAAGAATATGT ATCACC-3′,COL1(reverse):5′-GAAGCAAA GTTTCCTCCAAGACC-3′;RUNX 2(forw ard):5′-GCTTCTCCAACCCACGAATG-3′,RUNX2(reverse):5′-GAACTGATAGGACGCTGACGA-3′;GAPDH(forw ard):5′-GGCAAGTTCAACGGCA CAGT-3′,GAPDH(reverse):5′-GCCAGTAGAC TCCACGACAT-3′。反应条件为:95℃(10s),60℃(30s)和72℃(30s),进行45个循环。求得各样品基因相对表达量,并将对照组基因相对表达量设定为1。
1.7 统计学处理 数据以表示。各实验至少重复3次,采用SPSS13.0软件包分析结果。对两组实验数据比较进行校正t检验,对多组实验数据采用单因素方差分析,若P<0.05则差异被视为有统计学意义。
2.结果
2.1 扫描电子显微镜下各组钛表面形貌特征扫描电子显微镜结果显示:光滑纯钛组表面相对光滑,伴均匀不规则划痕;喷砂酸蚀组表面表现为喷砂后的典型凹坑形态与酸蚀产生的微孔结构。喷砂碱热高温组与喷砂碱热低温组表面均在喷砂后凹坑形貌基础上出现三维纳米级结构,其中,喷砂碱热高温组表现为“草丛”样纳米针状结构,相邻距离为100-300nm,喷砂碱热低温组呈现三维网状纳米多孔结构,孔隙之间相互连通,直径为50-200nm,二者均为典型微纳米表面形貌(图1)。
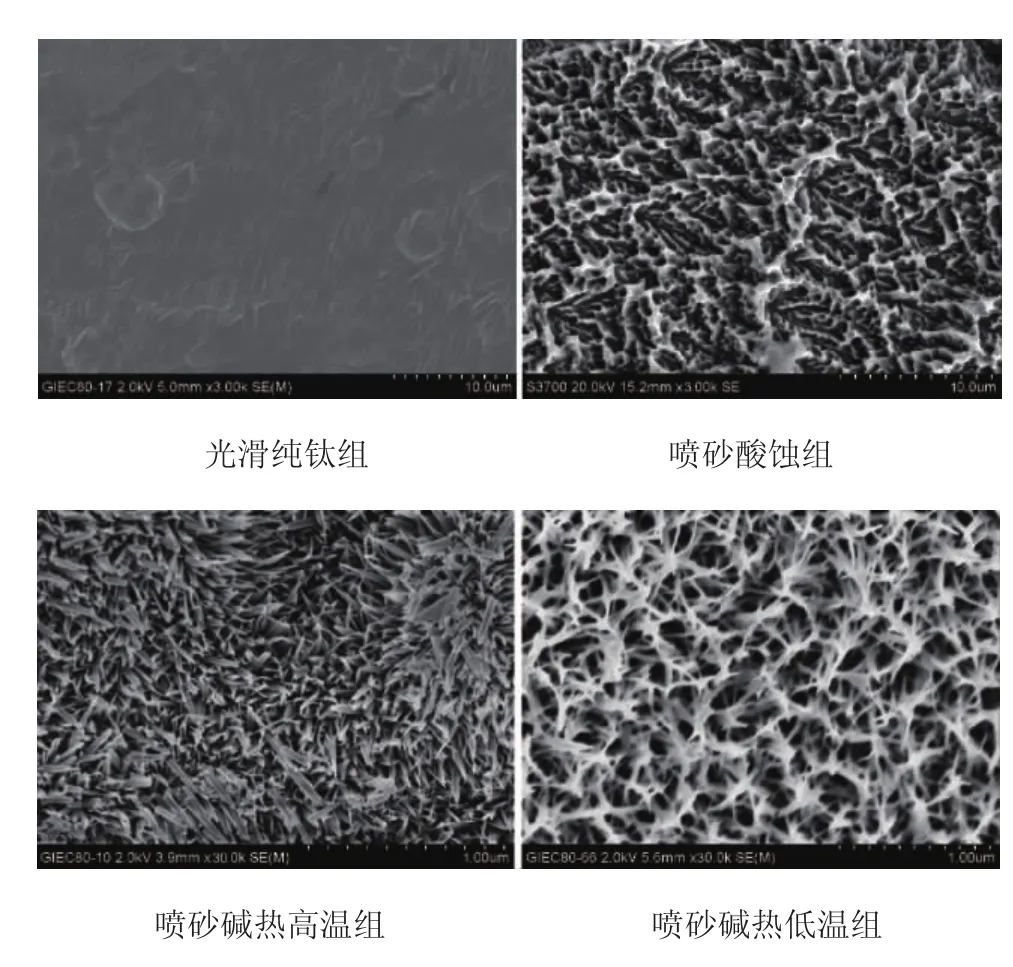
图1 不同处理组纯钛表面的形貌特点(光滑纯钛组、喷砂酸蚀组×3000倍,喷砂碱热高温组、喷砂碱热低温组×30000倍)
2.2 钛表面微纳米形貌促进rBMSCs增殖CCK 8结果显示,随着培养时间的延长,接种在各组钛片表面的rBMSCs细胞数均出现明显增长,说明各组表面形貌钛片对rBMSCs没有细胞毒性。然而,各组rBMSCs细胞增殖能力具有明显差异:喷砂碱热高温组、喷砂碱热低温组以及喷砂酸蚀组rBMSCs在接种3天、5天与7天后的细胞活性均较光滑纯钛组明显增加(P<0.05);同时,喷砂碱热高温组与喷砂碱热低温组的细胞活性也高于喷砂酸蚀组(P<0.05);此外,接种5天、7天后,喷砂碱热高温组细胞活性比喷砂碱热低温组更高(P<0.05),提示钛表面微米形貌与微纳米形貌均能促进rBMSCs增殖,钛表面微纳米形貌对rBMSCs增殖的促进作用更明显(图2)。

图2 rBMSCs在不同钛表面形貌的增殖情况(a:与同时间段光滑纯钛组比较;b:与同时间段喷砂酸蚀组比较;c:与同时间段喷砂碱热高温组比较;P<0.05)
总蛋白浓度检测结果证实,培养7天、14天时喷砂碱热高温组、喷砂碱热低温组与喷砂酸蚀组rBMSCs总蛋白浓度明显高于光滑纯钛组(P<0.05);7天时喷砂碱热低温组总蛋白浓度比喷砂碱热高温组与喷砂酸蚀组都要高(P<0.05);14天时喷砂碱热高温组与喷砂碱热低温组总蛋白浓度明显高于喷砂酸蚀组,喷砂碱热低温组亦高于喷砂碱热高温组(P<0.05),进一步说明钛表面微纳米形貌能明显促进rBMSCs细胞数量的增多(图3)。
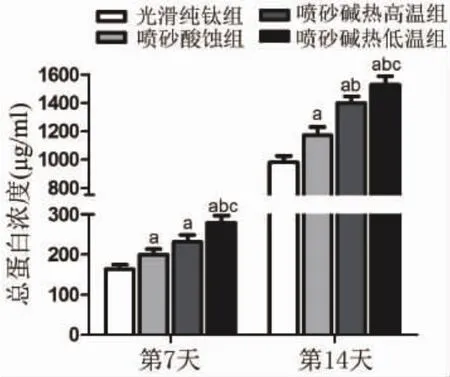
图3 接种在不同钛表面形貌rBMSCs的总蛋白浓度(a:与同时间段光滑纯钛组比较;b:与同时间段喷砂酸蚀组比较;c:与同时间段喷砂碱热高温组比较;P<0.05)
2.3 钛表面微纳米形貌促进rBMSCs成骨分化比较各组钛表面形貌对rBMSCs成骨分化的影响,ALP活性检测结果显示:第7天、14天时喷砂酸蚀组、喷砂碱热高温组与喷砂碱热低温组rBMSCs的ALP活性均高于光滑纯钛组,而喷砂碱热高温组和喷砂碱热低温组的ALP活性相较喷砂酸蚀组也明显升高,同时第7天时喷砂碱热低温组的ALP活性高于喷砂碱热高温组,结果具有统计学差异(P<0.05)。这说明相较光滑纯钛表面,微米级以及微纳米级钛表面形貌均可促进成骨分化;其中,微纳米形貌较微米形貌具有更强的促成骨能力(图4)。
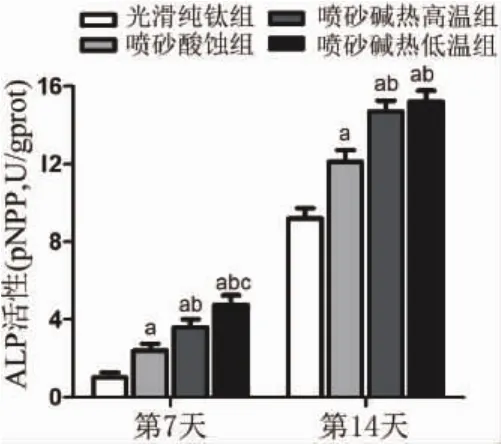
图4 接种在不同钛表面形貌rBMSCs的ALP活性(a:与同时间段光滑纯钛组比较;b:与同时间段喷砂酸蚀组比较;c:与同时间段喷砂碱热高温组比较;P<0.05)
进一步采用qRT-PCR分析7天时各组表面形貌钛片上rBMSCs成骨相关基因ALP、COL1与RUNX 2的m RNA水平差异,结果显示:喷砂酸蚀组、喷砂碱热高温组与喷砂碱热低温组rBMSCs的ALP、COL1与RUNX2水平均明显高于纯钛光滑组;同时,喷砂碱热高温组与喷砂碱热低温组的ALP、COL1与RUNX2表达水平相较喷砂酸蚀组也显著升高,而喷砂碱热低温组ALP、RUNX 2水平高于喷砂碱热高温组,结果具有统计学差异(P<0.05),进一步说明钛表面微纳米形貌具有更强的促rBMSCs成骨分化能力(图5)。
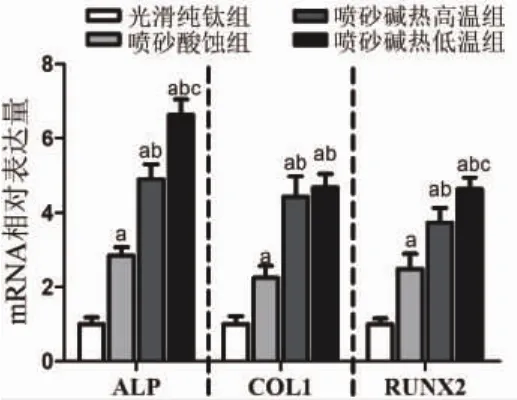
图5 第7d接种在不同钛表面形貌rBMSCs ALP、COL1与RUNX2的mRNA水平(a:与同时间段光滑纯钛组比较;b:与同时间段喷砂酸蚀组比较;c:与同时间段喷砂碱热高温组比较;P<0.05)
3.讨论
钛及其合金具有良好的机械性能和生物相容性,已被作为牙种植体材料广泛应用。钛种植体表面改性可改变材料的理化性质和生物活性,通过调控成骨细胞粘附、增殖与分化能力等方式进一步影响种植体界面新骨形成。目前,钛表面加工技术主要包括物理法、化学法和电化学法三大类。其中,物理法包括喷砂、物理气相沉积、等离子喷涂和激光熔覆等,化学法包括酸碱法、化学气相沉积、溶胶-凝胶沉积与离散晶体沉积等,电化学法包括粒子束辅助沉积、阳极氧化和微弧氧化等,这些技术被广泛应用于钛种植体的研发与临床应用[8]。
钛表面微米化处理可有效促进种植体周围骨新生,已在临床广泛应用[3]。喷砂、喷砂酸蚀是最常用的微米孔/凹形貌制备技术,本研究通过喷砂酸蚀技术成功获取典型微米凹坑形貌,证实该微米级形貌相较于光滑纯钛表面能明显促进rBMSCs细胞增殖与成骨分化。然而,长时间化学处理可能影响钛金属机械特性,例如酸蚀可引起钛表面微裂隙,降低种植体抗疲劳能力。
然而,越来越多的研究表明,种植体对骨组织的早期作用主要来自纳米级表面形貌[4,9]。纳米形貌具有更优异的生物学性能,促进种植体-骨界面新骨形成。目前认为,蛋白的吸附、细胞表面整合素信号的传递与细胞机械特性的改变是纳米形貌影响骨结合的主要因素[9,10]。然而,也有研究报道,纳米形貌修饰钛表面后成骨细胞的粘附、增殖与分化能力并未显著提高,单纯的纳米形貌不能保证良好的骨结合,微米形貌对骨结合的影响同样重要[11]。
兼具微米级与纳米级表面优点的钛表面微纳米形貌在种植体早期骨形成中意义重大:一方面,微米形貌增加骨结合面积,稳定血凝块与胞外基质蛋白支架,为成骨细胞提供稳定微环境;另一方面,纳米形貌模拟体内天然的细胞微环境,进一步促进蛋白吸附、成骨细胞粘附与分化[6,12-14]。目前,碱热处理是制备生物活性纳米结构的常用技术,通过纯钛与NaOH溶液反应形成钛酸钠凝胶,再经热处理后转变为更稳定的无定形钛酸钠,促进类骨磷灰石生成,增强骨结合能力[15]。
本研究首先通过喷砂技术将TiO2颗粒冲击钛表面形成微米级凹坑,然后分别采用碱热高温法与碱热低温法进一步制备纳米针状结构表面与纳米网状结构表面,并证实这两种方法制备的微纳米形貌比单纯微米形貌具有更优的促rBMSCs细胞增殖与成骨分化能力。该结论与我们课题组前期在前成骨细胞MC3T3-E1中的研究结果相一致[7]。
综上所述,本研究可通过喷砂碱热高温法与喷砂碱热低温法成功制备兼具微米-纳米结构的钛表面形貌,微纳米形貌显著促进rBMSCs增殖与成骨分化,有望应用于种植体表面改性与种植体周围骨形成的改善,但其具体作用分子机制仍有待进一步研究。
[1]庄秀妹,朱呈小露,邓飞龙,等.Osstell ISQTM监测种植体稳定性的临床研究[J].中国口腔种植学杂志,2013,18(3):133-137
[2]Davies JE,A jam iE,Moineddin R,etal.The rolesof different scale rangesof surface implant topography on the stability of thebone/implant interface[J].Biom aterials,2013,34(14):3535-3546
[3] Dohan E D,Vazquez L,Park Y J,et al.Identification card and codification of the chem ical and morphological characteristics of 14 dental implant surfaces[J].JOral Implantol,2011,37(5):525-542
[4]Mendonca G,Mendonca D B,A ragao F J,et al.Advancing dental implant surface technology--from m icron-to nanotopography[J].Biomaterials,2008,29(28):3822-3835
[5]许嘉允,邓飞龙,庄秀妹,等.纯钛微纳米复合形貌对成骨细胞生物学行为的影响[J].中华口腔医学研究杂志(电子版),2015,9(6):461-469
[6]李广文,宋艳艳,常 蓓,等.钛表面微纳米形貌对大鼠骨髓间充质干细胞形态与成骨功能的影响[J].牙体牙髓牙周病学杂志,2016,26(3):156-162
[7]Zhuang X M,Zhou B,Ouyang JL,et al.Enhanced MC3T3-E1 preosteoblast response and bone formation on the addition of nano-need le and nano-porous features to m icrotopograph ical titanium surfaces[J].Biomed Mater,2014,9(4):45001
[8]庄秀妹,邓飞龙.钛表面及其涂层纳米化对骨结合的影响和机制[J].国际口腔医学杂志,2014,41(4):427-430
[9]Zhang W,Cao H,Zhang X,et al.A strontium-incorporated nanoporous titanium im plant surface for rapid osseointegration[J].Nanoscale,2016,8(9):5291-5301
[10]Bezerra F,Ferreira M R,Fontes G N,et al.Nano hydroxyapatite-blasted titanium surfaceaffectspre-osteoblastmorphology by m odu lating critical intracellu lar pathw ays[J].BiotechnolBioeng,2017
[11]Meirelles L,A rvidsson A,A lbrek tsson T,et al.Increased bone form ation to unstab le nano rough titanium im plants[J].Clin Oral ImplantsRes,2007,18(3):326-332
[12]Liang J,Xu S,Shen M,et al.Osteogenic activity of titanium surfaces w ith hierarchicalm icro-/nano-structures obtained by hydrofluoric acid treatment[J].Int JNanomedicine,2017,12:1317-1328
[13]Jiang H,Ma X,Zhou W,et al.The Effects of H ierarchical M icro/Nano-Structured Titanium Surface on Osteoblast Proliferation and Differentiation Under Diabetic Conditions[J].Implant Dent,2017,26(2):263-269
[14]Gulati K,Prideaux M,Kogaw a M,et al.Anodized 3D-printed titanium implantsw ith dualm icro-and nano-scale topography p romote interaction w ith hum an osteoblasts and osteocy te-like cells[J].JTissue Eng Regen Med,2016
[15]Abdelrahim R A,Bad r N A,Baroudi K.Effect of anodization and alkali-heat treatment on the bioactivity of titanium implantm aterial(an in vitro study)[J].J Int Soc Prev Community Dent,2016,6(3):189-195
Role of different scale structures of titanium surface on the proliferation and osteogenic differentiation of rat bone marrow mesenchymalstem cells
ZHOU Min,WU Dong-hui,WU Ya-lin,PANG Jing-wen,ZHUANG Xiu-mei
(Guangzhou Haizhu District Hospital of Stomatology,Guangzhou 510220,China)
Objective:To investigate the effect of titanium surface scale structures on the cell viability and osteogenic differentiation in rat bonemarrow mesenchymal stem cells(rBMSCs).M ethods:A lkali heat treatment at high and low temperatures were utilized to nano-modify sandblasted titanium w ith m icrotopographical surfaces,compared w ith microtopographical surfaces of conventional sandblast-acid etching and smooth surface in titanium control.rBMSCswere seeding on these four titanium discs,and the cell viability was detected at1,3,5 and 7 days by CCK8 assay.Total protein values and alkaline phosphatase(ALP)activity were exam ined at 7 and 14 days.qRT-PCR was used to detectmRNA expression of ALP,collagen-I(COL1)and runt related transcription factor 2(RUNX2)at7 days.The datewas statistically analyzed w ith SPSS13.0 software package.Results:Compared w ith Ticontroland sandblast-acid etching surfaces,rBMSCs on them icro-nanotopographical surface discs in alkali heat treatment at high temperatures gourp and low temperatures group exhibited enhanced cell viability,increased total protein values,up-regulated ALP activity and overexpression of ALP,COL1 and RUNX2 levels.Conclusion:M icro-nanotopographical surface of titanium implant promotes cell viability and osteogenic differentiation of rBMSCs.
Rat bonemarrow mesenchymal stem cells;Scale structures of titanium surface;Osteogenic differentiation;M icro-nanotopographicalsurface
R783.4
A
1672-2973(2017)05-0261-05
国家自然科学基金青年基金项目(项目编号:81600899)
周 敏 广州市海珠区口腔医院 硕士生 主治医师 广东 510220
武东辉 广州市海珠区口腔医院 硕士生 副主任医师 广东 510220
吴亚霖 广州市至壹口腔门诊部 硕士生 医师 广东 510040
庞静雯 广州市海珠区口腔医院 硕士生 主治医师 广东 510220
庄秀妹 通讯作者 中山大学附属孙逸仙纪念医院口腔科 硕士生 主治医师 广东 510120
2017-05-15)
