细菌纤维素高产菌株的筛选及鉴定
2017-10-27葛含静
摘要:细菌纤维素具有高结晶度、生物可降解性和合成可调控性等优良特性,被公认为是一种性能较好的纤维素,广泛应用于食品、医学、造纸、声学等领域。笔者在研究中发现,实验室自制荞麦醋自然放置一段时间后,液面上长出厚厚的凝胶状膜,经成分分析,确定该膜成分为纤维素,结晶度为78%,Iα型纤维素含量为60%。取该荞麦醋的醪液,经富集、分离、初筛和复筛等,最终从108个单菌落中筛选出1株性能稳定的纤维素高产菌株J2,纤维素产量可达 8762 g/L(湿质量)。通过形态学与基于16S rRNA序列的分子生物学鉴定,确定菌株J2为汉森氏葡糖醋杆菌(Gluconacetobacter hansenii,GenBank登录号为GU213109)。
关键词:细菌纤维素;菌株;鉴定;汉森氏葡糖醋杆菌
中图分類号: S182文献标志码:
文章编号:1002-1302(2017)16-0282-04
收稿日期:2016-10-19
基金项目:陕西省科技厅自然科学基础研究计划(编号:2016JQ3036)。
作者简介:葛含静(1981—),女,陕西咸阳人,博士,讲师,主要从事粮食工程与发酵技术创新、食品化学与营养学等方面的研究。E-mail:gehanjing1981@163com。
细菌纤维素(bacterial cellulose,简称BC)是某些海洋生物(如被囊纲动物)、细菌(醋酸杆菌、假单胞杆菌、土壤杆菌、无色杆菌、八叠球菌等菌属的细菌)代谢产物,由β-1,4-D-吡喃葡萄糖聚合而成,不掺杂任何其他形式的多糖,纯度极高。与普通植物纤维相比,BC机械强度高、吸水保水率高、生物适应性良好,被认为是性能较好的纤维素,广泛应用于食品、医药、造纸、石油开采等领域。
目前,学术界对BC的合成研究主要是围绕培养基及培养条件的优化、菌株的代谢工程改造、高产菌株的自然选育及诱变选育等方面展开。陈军等利用糖厂副产物——酸化糖蜜生产BC,发现产量显著提高,且用红茶菌的复合菌种能更高效地利用碳源[3]。夏露等利用甲醇废水发酵生产BC,发现以木醋杆菌静态发酵,BC产量较低[4]。杨雪霞等研究发现,剪切力会影响纤维素产生菌的形态和生物量,不利于BC合成[5]。翁媛媛等以惰性吸附载体固态发酵生产BC,在避免剪切力的同时,增加了固液界面的表面积,BC产量为液态静置发酵产量的3倍,但后处理难度增加了很多。de Melo等对汉森氏葡糖醋杆菌(Gluconacetobacter hansenii) ATCC23769纤维素合成酶操纵子中部分基因进行克隆,采用过表达这些基因以期提高BC产量。周胜虎等从腐烂的水果中自然分离得到BC产生菌JX303335[8]。余晓斌等通过紫外诱变[9],杜双奎等通过高静水压诱变方法[10]实现了BC高产突变株的成功选育。尽管BC生物合成的研究在各个方面都取得了长足进展,但从源头上自然筛选出性能稳定的BC高产菌株,优化其发酵条件,表征其产BC性能相关指标,仍具有重要的研究意义。本研究初步筛选出了1株BC产量高且传代稳定的菌株J2,并拟对其进行鉴定,同时,拟对菌株J2所产BC的超微结构和超分子结构也作鉴定,为后续通过诱变或基因工程方法选育优良的BC产生菌株奠定基础。
1材料与方法
11试验材料
本试验所用材料为笔者所在实验室自制荞麦醋。
12试验试剂
细菌基因组提取试剂盒、2 000 bp DNA marker、Ex Taq酶,均购自日本TaKaRa公司。DNA胶纯化及回收试剂盒,购自美国Amersham Biosciences公司。细菌16S rRNA通用扩增引物F9/R1510及测序引物F9、R1510和F520,由生工生物工程(上海)股份有限公司合成。其他试剂均为分析纯级或生化试剂级。
13培养基
富集培养基:20 g/L葡萄糖,5 g/L酵母膏,1 g/L K2HPO4,10 g/L MgSO4·7H2O,无水乙醇体积分数为2%,005 g/L 制霉素,pH值自然。
基础种子培养基:20 g/L葡萄糖,5 g/L酵母膏,1 g/L K2HPO4,15 g/L MgSO4·7H2O,无水乙醇体积分数为2%,pH值自然。分离培养基、斜面保藏培养基配方在基础种子培养基的基础上加17%琼脂。
基础发酵培养基:20 g/L葡萄糖,5 g/L酵母膏,1 g/L K2HPO4,10 g/L MgSO4·7H2O,无水乙醇体积分数为2%,pH值自然。
所有培养基均于121 ℃高压灭菌15 min后备用。
14方法
141菌种筛选[11]富集:自制荞麦醋于自然条件放置一段时间,液面长出厚厚的凝胶状膜。经成分分析,确定为BC。吸取10 mL该醋样,加到90 mL富集培养基中,30 ℃培养 4 d,培养基表面长出BC。
分离:吸取1 mL长膜的富集培养液,用无菌生理盐水稀释成浓度梯度为10-1、10-2、…、10-7的溶液。吸取后3个浓度梯度的稀释液各02 mL,涂布于分离培养基平板,30 ℃培养5 d,选择菌落长势良好、分布均匀且菌落数适中的1个平板,挑取所有单菌落,接种于斜面培养基,30 ℃培养18~24 h,长出丰厚菌苔后,保藏于4 ℃冰箱。
初筛:将保藏的菌种各挑取1环,分别接种于10 mL基础发酵培养基,30 ℃培养5 d,筛选产BC的菌株,挑取其菌膜,连续2次划线分离,镜检为纯培养物后,斜面保藏于4 ℃冰箱。
复筛:挑取纯化的菌株接种于基础种子培养基,连续5代传代培养,测定每代菌株产生的BC湿质量,筛选出产量最高且稳定的菌株。培养方法:挑取1环活化的斜面菌苔,接种于100 mL基础种子培养基,30 ℃、130 r/min振荡培养24 h进行活化,再接入基础发酵培养基进行发酵培养,测定BC产量。
BC产量的测定:将活化的种子液按10%接种量(体积分数)接入1 L发酵培养基,用8层灭菌纱布封口,30 ℃静置培养5 d,测定处理后的BC产量。BC处理方法:用蒸馏水过夜冲洗BC膜,然后浸泡于05 mol/L NaOH溶液中并煮至乳白色半透明状[12]。处理后的BC膜在滤纸上沥干,称质量(即BC湿质量);将沥干的BC膜在烘箱中于105 ℃烘至恒质量,称质量(即BC干质量)。纤维素产量用单位体积培养液的纤维素质量表示。
142凝胶状膜成分分析[11]定性分析:在培养皿中放入1张新的载玻片,倒入蒸馏水,能覆盖载玻片即可。挑取培养 2 d 的凝胶状膜,自然平展于载玻片上,取出载玻片并晾干,向膜上滴665%硫酸,然后用碘液染色,在显微镜下观察显色情况。
酶解试验:取凝胶状膜,于105 ℃烘干至恒質量,准确称取0500 0 g,剪碎,加入纤维素酶溶液中,55 ℃长时间保温,若溶液变清亮且烘干后膜的质量减轻90%以上,则可确定凝胶状膜主要成分为纤维素。
143BC结构鉴定超微结构表征:用扫描电子显微镜(scanning electronic microscope,简称SEM)观察。BC干膜用双胶碳导电带安装在1截铜段上,用铂涂层设备为BC膜涂铂,室温进行扫描电镜拍照。
超分子结构表征:用固态13C-核磁共振光谱(muclear magnetic resonance,简称NMR)测定过夜水洗并烘干的纤维素的结晶度、晶体类型。测试频率7546 MHz,脉冲宽度 38 kHz,接触时间1 ms,转子转速5~6 kHz,转角547°,循环时间3 s,每个光谱2 400次扫描。
144菌种鉴定形态学鉴定:取对数期菌体,结晶紫染色后用光学显微镜观察菌体形态;同时,取对数期菌体划线接种于种子培养基平板,30 ℃培养3~5 d,观察菌落形态。
分子生物学鉴定:用细菌基因组提取试剂盒提取BC产生菌株基因组DNA。以基因组为模板、F9/R1510为引物扩增16S rRNA序列。产物用2%琼脂糖凝胶电泳检测,由生工生物工程(上海)股份有限公司测序。序列在美国国立生物技术信息中心(NCBI)的核酸数据库中进行BLAST同源性比对,用MEGA4绘制系统发育树,结合表型特征确定其生物学地位。
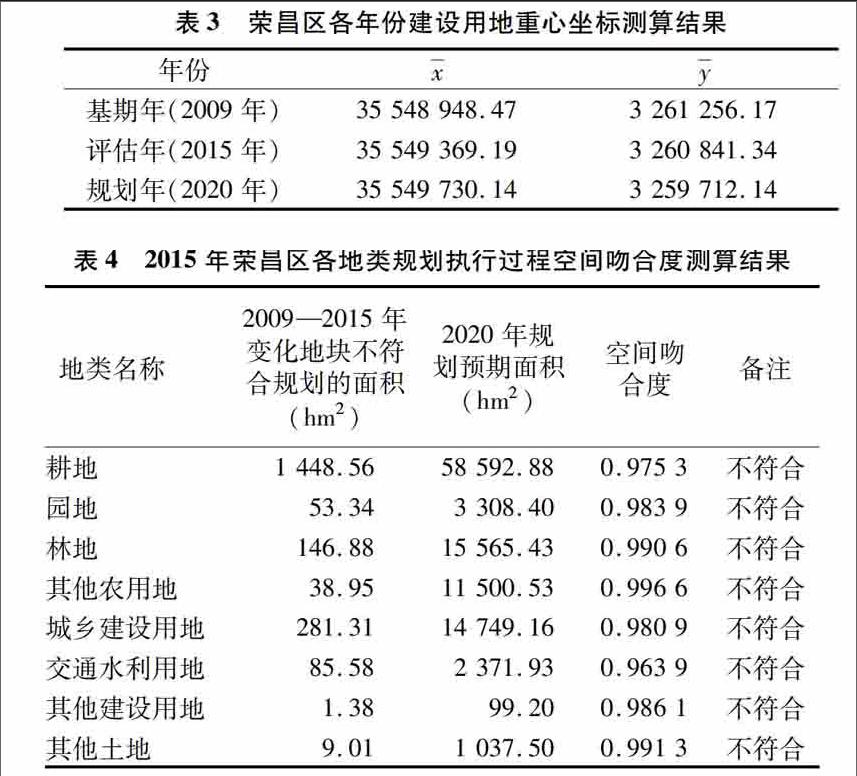
2结果与分析
21BC产生菌株筛选
涂布分离得到108个单菌落(依次编号为J1,J2,…,J108)。初筛发现,有9株菌能产凝胶状膜,3株所产凝胶状膜松软、有空洞。对能产膜的9株菌连续5代传代培养,发现编号J2的菌株的每一代培养物性状稳定、凝胶状膜产量最高(平均为8762 g/L),且膜外观结实、平滑、有弹性。
22凝胶状膜成分分析
被染色为深蓝色的物质在显微镜下呈无规则层状分布,包裹着未染色的杆状菌体细胞。初步判断,凝胶状膜主要成分为纤维素。酶解50 h后溶液变清亮,酶解前膜质量 0500 2 g,酶解后质量0023 6 g,因此可以算出,纤维素含量为(0500 2~0023 6)/0500 2×100%=9528%。可以判断,凝胶状膜的主要成分为纤维素。
23BC结构鉴定
超微结构:如图1所示,碱煮处理的BC中菌体残留更少;水洗与碱煮后BC超微结构没有变化,说明纯化方法对纤维素的微观结构没有影响,这与McKenna等的研究结果一致。此外,BC的微纤维直径不足01 μm,呈密集网状,很多根微纤维组成纤维丝带,进而形成不计其数的不规则、相互叠加的孔穴,即三维网状结构。这种结构持水保水性能良好,也有利于吸附有机试剂,因而BC可用作吸水材料和吸附材料,用于食品加工及药物缓释体系中[14]。
超分子结构:对比天然纤维素的NMR图谱(图2),图3中信号均为纤维素信号,说明菌株J2所产BC纯度高,进一步测定发现,该纤维素结晶度达78%,Iα型纤维含量达60%。生物材料的结晶度与其拉伸性能、尺寸稳定性及密度呈正相关[15],因此可知,菌株J2所产BC拉伸性能及尺寸稳定性良好、密度高。Iα型是纤维素的亚稳态结构,在一定条件下可转化为稳定的Iβ晶型,BC具有很强的生物适应性且在环境中易于分解,很可能是由于其中Iα型纤维含量高[16]。因此,与高等植物相比(后者Iα型纤维含量为30%[17]),菌株J2所产BC生物适应性良好。
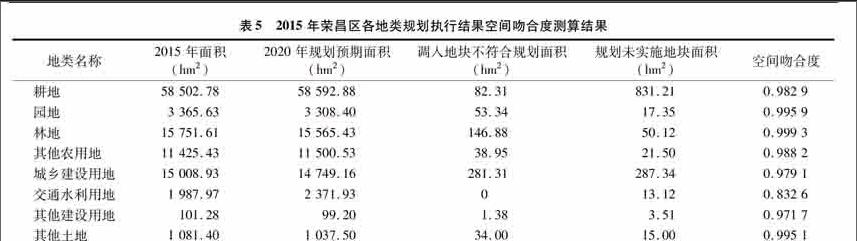
24菌种鉴定
241形态学鉴定J2菌体细胞呈杆状,单个或成对,大小为(212~418)μm×(081~092)μm;菌落呈圆形,表面光滑,凸起,不透明,乳白色,大小为09~14 mm,详见图4,可初步判断菌株J2为醋酸杆菌属。
242分子生物学鉴定对菌株J2进行16S rRNA序列扩增及系统发育分析,如图5、图6所示,菌株J2与菌株Ga hansenii NBRC14817、Ga hansenii NBRC14816和Ga hanseniiNBRC14820同支,相似度达100%。
微生物的分类鉴定从来没有一个黄金指标。表型特征虽然可进行表型分群,但分类学结果不够精准,因而只能用于描述微生物的表型性状特征。遗传学分类法,即根据核酸分析得到的遗传相关性所作的分类,以决定生物表型特征的遗传特征DNA和RNA作为比较的准绳,是一种更客观和高度可信的分类方法。因此,表型鉴定与遗传学分类法结合,可以更为准确地对未知微生物进行分类鉴定。结合形态学鉴定与基于16S rRNA序列扩增的分子生物学鉴定,即可确定菌株J2是汉森氏葡糖醋杆菌(Ga hansenii)。
3结论
本研究以笔者所在实验室自制荞麦醋为材料,将该荞麦醋放置一段时间后,从其表面凝胶状膜中自然分离出1株性能良好的BC高产菌株J2,其BC结晶度为78%,Iα型纤维含量为60%,表明BC密度高,拉伸性、尺寸稳定性和生物适应性均良好。通过形态学鉴定与基于16S rRNA序列的分子生物学鉴定,确定菌株J2为汉森氏葡糖醋杆菌(Ga hansenii)。
参考文献:
吕鸿皓,夏秀芳,党苗苗,等 细菌纤维素特性及其应用[J] 食品安全质量检测学报,2015,6(1):170-175
咸赫,史素娟,毛静静,等 一株细菌纤维素生产菌株Gluconacetobacter xylinus的分离鉴定及其产物分析[J] 纤维素科学与技术,2016,24(2):77-84
[3]陈军,杨雪霞,陈琳,等 利用糖蜜制备细菌纤维素的研究[J] 纤维素科学与技术,2013,21(2):15-21
[4]夏露,朱艳彬,刘振鸿,等 甲醇产纤维素菌株的静态发酵动力学研究[J] 生物技术,2011,21(2):70-73
[5]杨雪霞,董超,陈琳,等 剪切力对木葡糖醋杆菌及细菌纤维素合成的影响[J] 纤维素科学与技术,2013,21(2):9-14
[6]翁媛媛,陈洪章 惰性吸附载体固态发酵细菌纤维素的研究[J] 纤维素科学与技术,2010,18(4):1-7
[7]de Melo C V,Souza-Moreira T,Valentini S R,et al Cloning of upstream region and cellulose synthase operon genes involved in bacterial cellulose biosynthesis by Gluconacetobacter hansenii ATCC23769[J] BMC Proceedings,2014,8(S4):176
[8]周胜虎,薛齐佳,刘传凤,等 细菌纤维素高产菌株的筛选和初步鉴定[J] 湖北农业科学,2013,52(15):3514-3517[HJ]
[9]余晓斌,卞玉荣,全文海,等 细菌纤维素高产菌的选育[J] 纤维素科学与技术,1999,7(4):63-66
[10]杜双奎,李志西,毋锐琴,等 细菌纤维素菌株超高压诱变选育及其发酵培养基的优化[J] 高压物理学报,2011,25(1):79-88
[11]葛含静 细菌纤维素高产菌株高压诱变选育及其机理研究[D] 杨凌:西北农林科技大学,2012
[12]Son H J,Heo M S,Kim Y G,et al Optimization of fermentation conditions for the production of bacterial cellulose by a newly isolated Acetobacter sp A9 in shaking cultures[J] Biotechnology and Applied Biochemistry,2001,33(1):1-5
[13]McKenna B A,Mikkelsen D,Wehr J B,et al Mechanical and structural properties of native and alkalitreated bacterial cellulose produced by Gluconacetobacter xylinus strain ATCC 53524[J] Cellulose,2009,16(6):1047-1055
[14]熊犍,王紫蓉,叶君 Nata气凝胶的制备及结构分析[J] 现代食品科技,2016,32(5):144-150
[15]馬建锋,杨淑敏,田根林,等 拉曼光谱在天然纤维素结构研究中的应用进展[J] 光谱学与光谱分析,2016,36(6):1734-1739
[16]Imai T,Sugiyama J Nanodomains of Iα and Iβ cellulose in algal microfibrils[J] Macromolecules,1998,31(18):6275-6279
[17]Saxena I M,Brown R M Jr Cellulose biosynthesis:current views and evolving concepts[J] Annals of Bontany,2005,96(1):9-21
[18]何建新,王善元 天然纤维素的核磁共振碳谱表征[J] 纺织学报,2008,29(5):1-5
