牛樟芝se原核表达载体构建及重组蛋白的表达、纯化
2017-10-27李晶李芳娜林雄杰
李晶 李芳娜 林雄杰
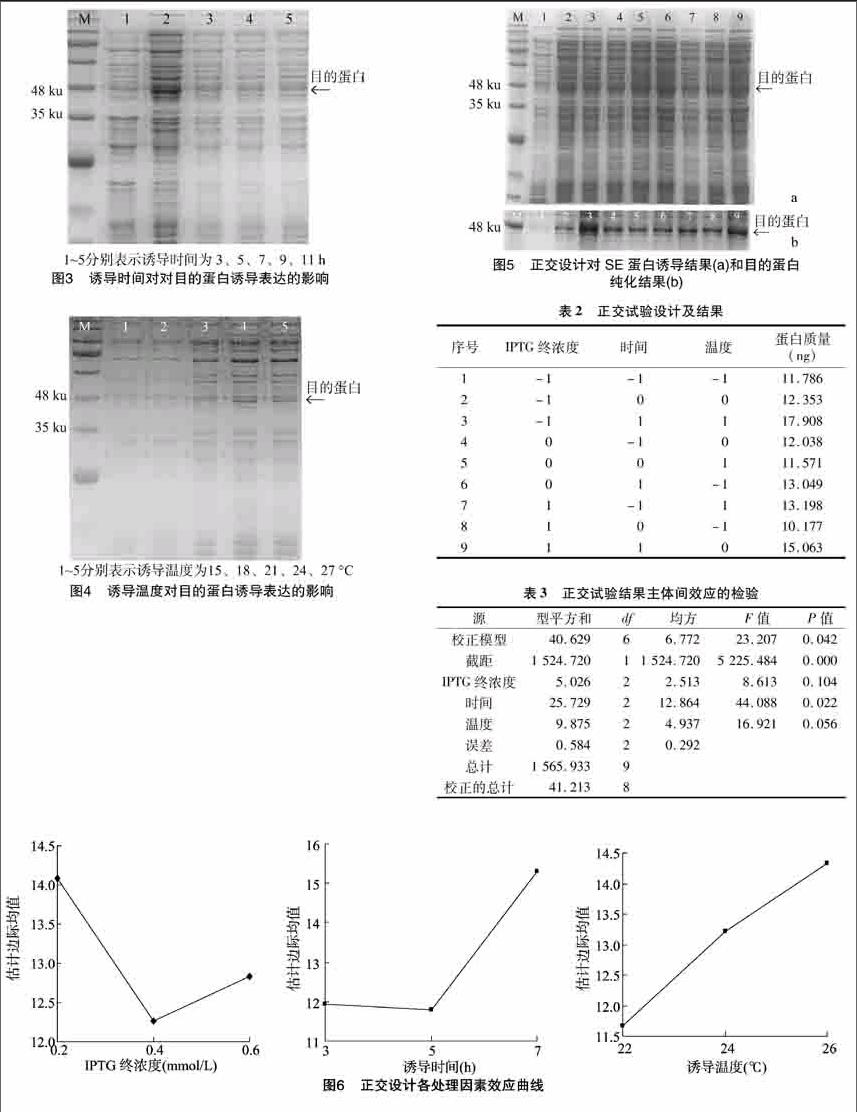

摘要:鲨烯环氧酶(squalene epoxidase,SE)是多数中草药植物、药用菌中三萜合成途径中的限速酶,能影响三萜含量的积累。构建了牛樟芝鲨烯环氧酶基因(se)原核表达载体,并进行其重组蛋白诱导表达条件优化。以牛樟芝cDNA为模板扩增se,纯化后将其克隆到pMD18-T载体上,筛选阳性克隆并将其连接到原核表达载体pET28a,构建重组质粒pET-28a-se,经酶切验证后转化Ecoil BL21(DE3)感受态细胞进行诱导表达,利用L9(34)[JP2]正交试验优化目的蛋白诱导表达条件及纯化。结果表明,不同正交处理间的蛋白表达差异显著(P<005),其诱导因素的主次为时间>温度>IPTG浓度,诱导时间对重组蛋白表达影响最显著(P<005)。而IPTG浓度和温度对重组蛋白表达影响并不显著(P>005),且当IPTG终浓度为02 mmol/L,诱导时间为7 h,诱导温度为26 ℃时,对SE重组蛋白的诱导效果最佳。
关键词:牛樟芝;鲨烯环氧酶;原核表达;正交设计
中图分类号: S5673+901文献标志码:
文章编号:1002-1302(2017)16-0050-04
收稿日期:2016-04-10
基金项目:福建农林大学发展研究基金(编号:KF2015111);福建省2011计划(编号:K80ND8002)。
作者简介:李晶(1985—),女,湖北武汉人,博士,助理研究员,主要从事食用菌研究。E-mail:13959197195@163com。
通信作者:林占熺,研究员,主要从事菌草技术推广研究。E-mail:lzxjuncao@163com。
三萜是多数食药用菌和药用植物中重要的活性物质之一,研究表明三萜具有保肝、抗炎症、抗过敏和抗肿瘤等功效,因此具有显著的经济效益。鲨烯环氧酶(squalene epoxidase,SE)是三萜合成途径中的一种重要调控酶,它位于内质网的微粒体中,催化鲨烯(squalene,SQ)合成2,3-氧化鲨烯(2,3-oxidosqualene),可进一步合成三萜、甾醇、胆固醇等重要萜类物质[2-3]。同时,SE也催化氧原子插入到C-C双键在P450类型反应中形成环氧结构的重要酶[4]。目前,已在人类、动物、植物和真菌中克隆到鲨烯环氧酶基因(se),王森等对中草药五味子se的研究表明其mRNA的表达量与三萜的生成量呈正相关[5];Han等在人参根中克隆se后利用RNAi技术抑制其表达后三萜的产量显著下降,因此SE被认为是三萜生物合成中限速酶;人参SE蛋白的表达证实了其与人参皂苷含量相关。
牛樟芝(Antrodia cinnamomea),别称樟芝、牛樟菇、樟生薄孔菌,是20世纪90年代发现于我国台湾的传统药用菌,通常生长在空心、腐烂的牛樟木中[8],其生长极其缓慢,但三萜类化合物含量较高,对抗肿瘤、降血脂、降血糖等具有良好的疗效,深受消费者欢迎[9]。在牛樟芝中SE催化生成的2,3-氧化鲨烯是合成羊毛甾醇(Lanosterol)的重要底物,进而形成胆固醇、三萜等化合物,SE作为反应中的限速酶具有重要意义[10]。大肠杆菌(Escherichia coli,Ecoil)BL21(DE3)是高效表達异源蛋白常用的原核表达菌株之一,具有表达效率高等优点,但是外源蛋白的表达效率,受到培养时间、培养温度和诱导剂等因素的影响差别较大[11],为在体外获得牛樟芝SE蛋白表达的最佳条件,将pET28a-se重组质粒导入Ecoil BL21(DE3)中,利用异丙基-β-D-硫代半乳糖苷(IPTG)、诱导时间和诱导温度进行筛选,通过正交试验优化诱导条件,筛选出牛樟芝se原核表达最佳条件,为进一步探讨牛樟芝SE蛋白活性和三萜合成机制奠定基础。
1材料与方法
11材料与试剂
台湾牛樟芝菌株AC001(GenBank登录号:KM925002)由台湾神农真菌生物技术有限公司惠赠,保存于国家菌草工程技术研究中心;原核表达载体pET28a由福建农林大学功能基因组学研究中心提供。
2×Taq Master Mix、Ecoli DH5α、Ecoli BL21(DE3)感受态细胞购于天根生化科技(北京)有限公司;His60 Ni Superflow Resin、pMDTM18-T购于TaKaRa公司;D2000 Plus Marker、Direct-load Color prestained Marker、N,N,N′,N′-四甲基乙二胺(TEMED)购于Genestar公司;TRIzol试剂购于Invitrogen公司;反转录试剂盒购于TOYOBO公司;质粒提取试剂盒、胶回收试剂盒购于OMEAG公司;氨苄(Amp)、卡那霉素(Kan)、IPTG、丙烯酰胺(Acr)、十二烷基磺酸钠(SDS)、三羟基甲基氨基甲烷(Tris)等购自北京索莱宝科技有限公司;限制性内切酶、T4连接酶购于Thermo公司;其他药品均为国产分析纯。引物合成及测序均由铂尚生物技术(上海)有限公司完成。
12方法
121牛樟芝菌丝体RNA提取及cDNA合成
收集液体培养基中培养14 d的新鲜牛樟芝菌丝体,按TRIzol法提取样品RNA[12],检测纯度和浓度合格后,按反转录试剂盒操作说明合成cDNA,每20 μL体系中含有500 ng RNA样品,产物保存于-20 ℃备用。
122se的扩增及回收
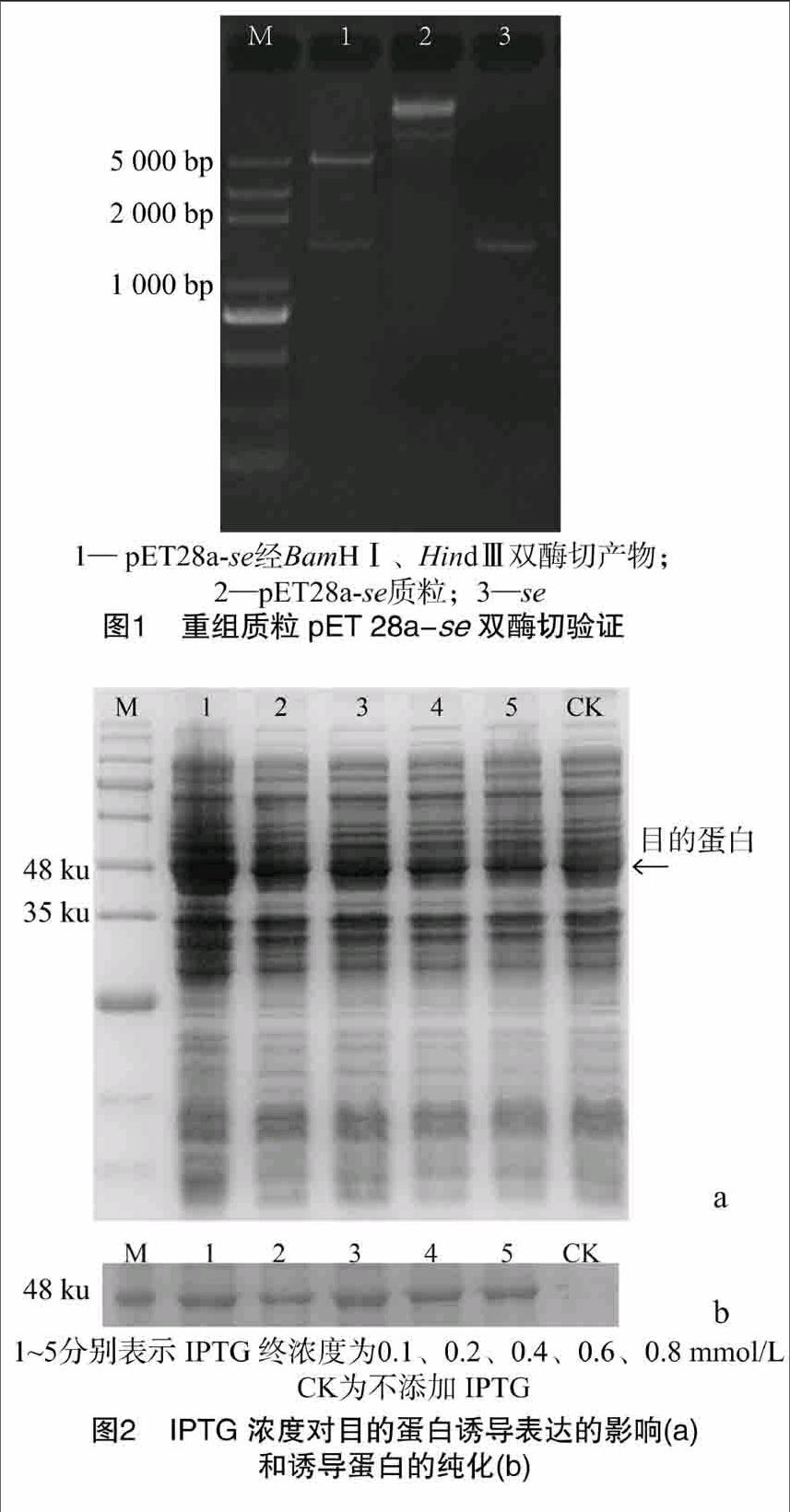
从已克隆并上传至NCBI的se序列(GenBank 登录号:KT070558)设计引物se-pe-F:CG-GGATCCATGTGGTCAACTAACTACG和se-pe-R:CCCA-AGCTTTCACCACCACCGAATCTC,上下游引物中分别加入BamHⅠ和Hind Ⅲ酶切位点及相应的保护碱基,PCR扩增反应条件为95 ℃预变性3 min;32个循环进行94 ℃变性30 s,623 ℃退火40 s,72 ℃延伸100 s;最后72 ℃延伸7 min。PCR产物经电泳后回收,克隆到pMDTM18-T载体上,转化到Ecoli DH5α感受态细胞中,筛选阳性克隆,进一步扩大培养后提取质粒并送样测序。
123重组质粒pET28a-se的构建
将测序正确的的pMD18-se和pET28a质粒分别用BamHⅠ和HindⅢ进行双切,酶反应体系为30 μL:含3 μL 10×Fast Digest Buffer,20 μL pMD18-se或pET28a质粒,BamHⅠ、HindⅢ各 15 μL、4 μL ddH2O,反应条件为37 ℃ 20 min,80 ℃灭活 10 min。酶切产物经电泳后回收后用T4连接酶进行连接,连接产物转化到Ecoli BL21(DE3)感受态细胞,并筛选阳性转化子,进一步扩大培养后提取质粒,进行酶切验证,将验证后的菌液保存备用。
124pET28a-se融合蛋白诱导的单因素筛选
针对影响蛋白诱导表达的3个因素,分别进行单因素试验和正交试验。蛋白诱导表达及纯化方法参考林雄杰等的方法进行,分别取10 μL破碎后上清液及沉淀样品进行SDS-PAGE电泳检测,结果表明目的蛋白位于样品上清中。
IPTG浓度对目的蛋白诱导表达的影响:将培养液中的IPTG终浓度分别设为01、02、04、06、08 mmol/L,15 ℃ 200 r/min振荡培养5 h后收集菌体并用超声波破碎后进行SDS-PAGE电泳检测,以不添加IPTG试验组为对照(CK)。
培养时间对目的蛋白诱导表达的影响:培养液的IPTG终浓度为06 mmol/L,培养温度为15 ℃,200 r/min分别振荡培养3、5、7、9、11 h,收集菌体破碎后进行SDS-PAGE电泳检测。
培养温度对目的蛋白诱导表达的影响:培养液的IPTG终浓度为06 mmol/L,培养温度分别为15、18、21、24、27 ℃,200 r/min振荡培养5 h后收集菌体破碎后进行SDS-PAGE电泳检测。
125L9(34)正交试验对目的蛋白诱导及纯化
根据单因素试验结果设计L9(34)正交试验(表1),进行蛋白诱导表达及纯化,提取样品总蛋白和纯化后的目的蛋白进行SDS-PAGE电泳(5%浓缩胶,12%分离胶),观察试验结果。
126数据处理
利用ExPASy数据库预测分子量、等电点;通过Gel Pro Analysis软件对SDS-PAGE电泳结果进行分析;利用SPSS 200对正交试验设计结果进行方差分析。
2结果与分析
21pET-28a-se表达载体的构建及验证
以牛樟芝菌丝体cDNA为模板进行se片段的PCR扩增,产物经1%琼脂糖凝胶电泳检测,获得与预期片段大小相符的单一条带(1 446 bp),将其纯化后克隆至pMD18-T载体,筛选出阳性克隆并提取质粒,用BamHⅠ和Hind Ⅲ双酶切后与经相同的酶双切的pET28a载体相连,转入Ecoli DH5α后获得阳性克隆后提取其质粒,进行BamHⅠ和Hind Ⅲ双酶切验证,结果得到与目的片段大小相同的条带(图1),表明载体pET28a-Se已构建成功。
22原核表达条件优化及目的蛋白纯化
目的蛋白表达量太低不利于后续的蛋白纯化,因此本试验采用单因素正交试验设计进行原核蛋白诱导表达条件的优化。将验证好的重组质粒pET28a-se转化到Ecoli BL21(DE3),利用不同诱导时间、诱导温度及IPTG浓度进行优化。结果表明,随着IPTG终浓度的逐渐升高,目的蛋白表达量也逐渐增加,当浓度为01~06 mmol/L时,其表达量相当(图2-a),对IPTG单因素诱导表达的蛋白进行纯化后表明其大小约为50 ku(图2-b); 当诱导时间为3~5 h时, 目
的蛋白表达量逐渐上升,但当诱导时间大于7 h后,其表达量开始下降(图3);当温度为15~27 ℃时,随着温度的升高,目的蛋白的表达量呈先增加后降低的趋势,当温度达到或高于26 ℃时,其表达量下降(图4)。
23正交试验对目的蛋白诱导优化及纯化
采用L34正交试验设计对诱导剂IPTG终浓度、诱导时间和诱导温度进行优化,并将诱导表达后的蛋白用His60 Ni纯化后进行SDS-PAGE,利用Gel Pro Analysis对蛋白浓度进行预测(图5-a、图5-b,表2),SPSS 20对正交试验的主体间效应及处理因素效应曲线分析结果表明,当IPTG终浓度为02 mmol/L,诱导时间为7 h,诱导温度为26 ℃时,se表达量达到最佳,模型具有显著性差异(R2=0986,调整R2=0943,P<005)(表3、图6),且对SE目的蛋白表达的诱导因素的主次为时间>温度>IPTG终浓度,且时间对目的蛋白的表达具有显著影响(P<005),而IPTG终浓度和温度对目的蛋白的表达不具有显著性(P>005)。
3讨论与结论
三萜牛樟芝子实体和菌丝体中重要的活性物质,具有抗氧化[14]、防止细胞凋亡[15]等显著药用价值和经济效益。SE是三萜类化合物合成途径中重要的限速酶之一[10],目前已从人参[16]、刺五加[17]、绞股蓝[18]等中草药中克隆到se。李宝财等发现se的表达量与刺五加叶中皂苷含量之间存在显著正相关性[19];蒋世翠等研究发西洋参须根、侧根、茎、叶片、叶柄
等14个器官中的皂苷含量也与鲨烯合酶基因(sqs)和se呈正相关[20]。胡薇等对人参中se原核表达和活性测定結果发现,其与人参皂苷的合成相关性较大。因此,SE重组蛋白的纯化和制备体系的建立为牛樟芝菌丝体、子实体中三萜合成的研究奠定了基础。
通常研究蛋白功能的主要手段为原核重组,且Ecoli是表达重组蛋白功能最强大的系统之一[21]。常见的原核表达载体pET28a中连有T7噬菌体转录系统,其mRNA的合成速度是大肠杆菌的5倍,能使目的基因高效表达。同时,该载体中N、C端还含有组氨酸标签(His-Tag),能够特异地与镍等金属离子结合,且不影响重组蛋白的结构和功能,提高目的蛋白的纯化效率,是原核表达常用载体之一[21],选用该载体对牛樟芝se进行原核表达,具有高效、快速和准确等有点。
反应条件通常是生物反应中影响反应结果的主要因素,研究人员常常需要通过不同方式找到最佳的反应条件和影响反应的主次因素。通过单因素试验和正交设计来考察原核表达的主要因素(诱导剂IPTG终浓度、诱导时间、诱导温度3个因素)对se表达效率的影响,该方法具有处理次数少、试验结果直观、效率高等优点[22],通过破碎Ecoil BL21菌体所获得上清蛋白SDS-PAGE电泳与标准蛋白电泳观察结果和Gel Pro Analysis软件分析电泳结果,可为研究SE理化性质和酶活等奠定基础。
本研究结果表明,牛樟芝se最佳诱导条件为IPTG终浓度为02 mmol/L,诱导时间为7 h,诱导温度为26 ℃,诱导的主次因素为时间、温度和IPTG终浓度,它对于大量蛋白样品的收集具有指导意义,为se高效表达及后续功能验证奠定了良好的基础。
[HS22]参考文献:
[ZK(#]赵云生,万德光,陈新,等 五环三萜皂苷生物合成与调控的研究进展[J] 中草药,2009(2):327-330
Jandrositz A,Turnowsky F,Hgenauer G The gene encoding squalene epoxidase from Saccharomyces cerevisiae:cloning and characterization[J] Gene,1991,107(1):155-160
[3]Kajikawa M,Kinohira S,Ando A,et al Accumulation of squalene in a microalga Chlamydomonas reinhardtii by genetic modification of squalene synthase and squalene epoxidase genes[J] PLoS One,2015,10(3):e0120446
[4]Spanova M,Daum G Squalene-biochemistry,molecular biology,process biotechnology,and applications[J] European Journal of Lipid Science and Technology,2011,113(11):1299-1320
[5]王森,張建国 五味子的研究概况及其开发前景[J] 经济林研究,2003,21(4):126-127
[6]Han J Y,In J G,Kwon Y S,et al Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng[J] Phytochemistry,2010,71(1):36-46
[7]胡薇,刘宁,田玉华,等 人参鲨烯环氧酶基因的克隆与原核表达[J] 西北农林科技大学学报(自然科学版),2012,40(10):207-212
[8]Chang T,Chou W Antrodia cinnamomea sp Nov on Cinnamomum kanehirai in Taiwan[J] Mycological Research,1995,99(6):756-758
[9]Lu M C,El-Shazly M,Wu T Y,et al Recent research and development of Antrodia cinnamomea[J] Pharmacology & Therapeutics,2013,139(2):124-156
[10][ZK(#]Lu M Y,Fan W L,Wang W F,et al Genomic and transcriptomic analyses of the medicinal fungus Antrodia cinnamomea for its metabolite biosynthesis and sexual development[J] Proceedings of the National Academy of Sciences of the United States of America,2014,111(44):E4743-E4752
[11]Turunen O,Winqvist R,Pakkanen R,et al Cytovillin,a microvillar Mr 75,000 protein cDNA sequence,prokaryotic expression,and chromosomal localization[J] Journal of Biological Chemistry,1989,264(28):16727-16732
[12]Rio D C,Ares M,Hannon G J,et al Purification of RNA using TRIzol (TRI reagent)[J] Cold Spring Harbor Protocols,2010(6):pdbprot5439
[13]林雄杰,王琴秋,陈少华,等 稻瘟病菌Rab5蛋白的表达及互作蛋白的初步筛选[J] 热带作物学报,2011,32(7):1352-1355
[14]Wu M D,Cheng M J,Wang B C,et al Maleimide and maleic anhydride derivatives from the mycelia of Antrodia cinnamomea and their nitric oxide inhibitory activities in macrophages[J] Journal of Natural Products,2008,71(7):1258-1261
[15]Lu M K,Cheng J J,Lai W L,et al Fermented Antrodia cinnamomea extract protects rat PC12 cells from serum deprivation-induced apoptosis:the role of the MAPK family[J] Journal of Agricultural and Food Chemistry,2008,56(3):865-874
[16]侯双利,刘翠晶,杨利民,等 人參鲨烯环氧酶基因的克隆与序列分析[J] 吉林农业大学学报,2014,36(2):149-152,170
[17]邢朝斌,曹蕾,陈龙,等 刺五加鲨烯环氧酶基因cDNA的克隆及序列分析[J] 中国中药杂志,2012,37(2):172-175
[18]蒋军富,李雄英,吴耀生,等 绞股蓝鲨烯环氧酶基因的克隆与序列分析[J] 西北植物学报,2010,30(8):1520-1526
[19]李宝财,修乐山,周秘,等 刺五加鲨烯环氧酶基因的表达及其与刺五加皂苷含量的相关性分析[J] 中药材,2013,44(7):1063-1066
[20]蒋世翠,刘伟灿,王义,等 西洋参不同器官中皂苷量与鲨烯合成酶和鲨烯环氧酶基因表达的相关性[J] 中草药,2011,42(3):579-584
[21]Wang R,Shen W B,Liu L L,et al Prokaryotic expression,purification and characterization of a novel rice seed lipoxygenase gene [WTBX][STBX]OsLOX1[WTBZ][STBZ][J] Rice Science,2008,15(2):88-94
[22]Bunger M K,Cargile B J,Sevinsky J R,et al Detection and validation of non-synonymous coding SNPs from orthogonal analysis of shotgun proteomics data[J] Journal of Proteome Research,2007,6(6):2331-2340
