解偶联蛋白在肥胖导致的心力衰竭中的作用
2017-10-24晋华晋帅
晋华,晋帅
1.山西运城凤英中医冠心病专科医院,运城 044000;2.中国人民解放军总医院,北京 100853
解偶联蛋白在肥胖导致的心力衰竭中的作用
晋华1,晋帅2
1.山西运城凤英中医冠心病专科医院,运城 044000;2.中国人民解放军总医院,北京 100853
肥胖、代谢综合症、Ⅱ型糖尿病等代谢系统疾病,经常导致线粒体呼吸复合物中活性氧(ROS)生成增加,进而导致脂肪在心肌细胞、脂肪细胞、骨骼肌、肝细胞中积累。动物实验表明,在心肌细胞中,脂质积累会产生脂毒性,从而进一步导致细胞凋亡、心脏衰竭。因此,心肌细胞等通过高表达解偶联蛋白(UCP)来进行抗氧化应激和脂毒性适应。在肥胖的啮齿类动物和人类心脏中,UCP2和UCP3通过下调细胞程序死亡,使心肌细胞免于死亡以致心力衰竭。UCP激活后通过减少ROS的生成和细胞凋亡,影响细胞色素c和促凋亡蛋白的释放。本综述简要总结了UCP如何通过抗ROS生成及维持生物能量代谢平衡来起到保护心肌细胞、保护心脏的作用。
解偶联蛋白;肥胖;心力衰竭
肥胖是由于脂肪细胞生成游离脂肪酸(FFA)增加,使得心肌细胞脂肪变性导致的一系列综合征,包括氧化应激、线粒体损害、甘油三酯(TG)积累导致的心功能不全[1]。心肌中脂质的积累可以提高线粒体活性氧(ROS)水平,使氧化应激增强,从而进一步使肥胖及糖尿病患者的心力衰竭几率增加[2]。FFA增加、线粒体ROS生成及轻度的氧化磷酸化解偶联导致的解偶联蛋白UCP2/UCP3过表达均提示早期心力衰竭[3]。
线粒体是细胞生产生活必需的供能细胞器,同时,绝大多数ROS都在线粒体中发生。在病理条件下,如代谢综合征、肥胖、饱和脂肪酸的β氧化作用、脂毒性和过量活性氧生成,心肌细胞和心肌结构受损[4]。为了对抗过量活性氧的生成和氧化损伤,细胞进化出一系列防御机制,在线粒体水平上表现为解偶联蛋白(uncoupling proteins,UCP)的过表达。当UCP缺失或被药物抑制后,氧化应激和超氧阴离子的产生增加。在缺血性心肌病中,UCP3的遗传缺失使细胞凋亡增加从而引起心力衰竭。UCP的药物或遗传诱导则可以增强氧化稳态,减少氧化应激。氧化应激引起大分子水平的损伤,从而进一步导致心血管系统中细胞的坏死和凋亡。UCP的过表达通过减少线粒体ROS生成来下调细胞程序死亡,提高细胞存活率[5-6]。该过程是通过线粒体内的细胞色素c及凋亡前体蛋白跨膜进入细胞质来实现的[6]。线粒体中细胞色素c的释放被认为是凋亡启动过程中的重要步骤[7]。在此,我们将对UCP的分子特征、生化性质做一般性描述,并讨论UCP2和UCP3在细胞死亡和心力衰竭以及肥胖中的作用。
1 UCP的分子特征
UCP位于线粒体内膜中,在不同生物体如酵母、植物、鸟类、哺乳动物中广泛分布。UCP呈典型三联体结构,共有UCP1~UCP5等5种异构体。UCP1、UCP2、UCP3的相对分子质量为 30 000~34 000,UCP4、UCP5 为 36 000~38 000[8]。UCP1在棕色脂肪与胸腺中特异性表达[9];UCP3在骨骼肌和心肌中高表达,并有54%~59%的氨基酸序列与UCP1同源;UCP4主要位于肾脏和中枢神经系统;UCP5又名脑线粒体载体蛋白(BMCP1)。UCP4和UCP5的含量相比UCP家族的其他3种蛋白较低。
1.1 心肌UCP2和UCP3的调节
UCP2、UCP3由GTP、ATP、GDP等嘌呤核苷酸负调节。FFA作为UCP的直接激动剂,可以增加电导并将H+电化学能转化为热能。UCP2、UCP3由FFA正调节,并与油酸、亚油酸等不饱和脂肪酸极度亲和;UCP2、UCP3也可由超氧离子负反馈调节。动物实验表明,肥胖、禁食等因素,以及脂肪动员、甲状腺激素治疗导致的血浆FFA增加,可以诱导UCP2与UCP3的过表达,而这些均与心肌细胞的氧化应激、代谢应激密切相关,可以进一步导致心力衰竭的发生。高脂高糖饮食导致的FFA增加、甲状腺激素过高等因素,会使心肌中UCP2、UCP3的表达升高,随之使心肌细胞轻度解偶联、线粒体ROS生成减少、心肌凋亡减慢,从而改善心肌功能[10-11]。
此外,UCP2通过催化苹果酸酶、草酰乙酸酶、天冬氨酸酶的磷酸化,以及通过从线粒体中输出碳物质来调节供能。UCP2同样可以通过调节葡萄糖代谢及脂肪酸氧化来供能,使细胞增殖、存活,从而在心肌细胞耐受缺氧、再灌注损伤及氧化应激中发挥作用[12]。在心脏缺血再灌注实验中,UCP3敲除的心脏比普通心脏产生更多的ROS。UCP3敲除心脏在解偶联剂处理后,心肌缺血后的功能恢复明显加快[13]。
在升主动脉收缩引起的压力过载导致的心力衰竭动物模型中,UCP2、UCP3表达下调,线粒体ROS生成增加,导致心肌细胞肥大[14]。但这个模型不涉及FFA诱导的UCP表达上调。
1.2 UCP的表达调控
在UCP1基因下游约2.4 kb位置,一段200 bp的基因序列可以通过cAMP通路与β肾上腺素受体结合,使UCP的表达增强。该序列拥有类视黄醇、甲状腺激素、过氧化物酶体增殖剂激活受体γ(PPARγ)、PPARα、过氧化物酶体增殖活化受体γ共激活因子1α(PGC-1α)的结合位点,并决定了UCP1的表达。因此,UCP1在棕色脂肪中选择性高表达[15]。相应地,UCP2、UCP3的启动子序列中也有PPARα、PPARγ、PPARδ的结合位点。PPAR介导的UCP表达随不同组织和发育阶段而不同。在小鼠心肌和骨骼肌中,FFA主要诱导PPARα来调控UCP的表达。胰岛素生长因子(IGF)1和2、成纤维细胞生长因子21(FGF21)等参与控制葡萄糖稳态、胰岛素敏感性和酮体生成的生长因子,均被发现诱导线粒体UCP2、UCP3的表达。同时,超氧化物歧化酶2(SOD-2)参与心肌细胞的抗氧化途径来预防炎性反应和心肌细胞肥大。UCP3的遗传缺失会导致线粒体功能障碍,在缺氧或缺血性心肌病时,会增加ROS的产生,促进心肌细胞凋亡。因此,UCP2与UCP3可能是心肌梗死面积、缺血后心脏重塑、患者存活的一个重要决定因素[16-17]。
2 UCP、ROS生成和细胞存活
研究表明,FFA、葡萄糖、脂多糖,病理条件如肥胖、代谢综合征、Ⅱ型糖尿病等共同决定UCP在氧化应激和线粒体ROS生成中的作用[18]。图1说明了UCP在防止线粒体超氧化和H2O2生成介导的心肌细胞凋亡和坏死中的作用机制。
2.1 ROS生成和细胞死亡
细胞存活过程中线粒体ROS生成和氧化信号传导的作用已被广泛证实。细胞是存活还是死亡取决于ROS生成量,低水平的ROS可以使信号通路活化、细胞存活;而线粒体ROS生成过量,超过细胞抗氧化代偿能力时,会导致细胞损伤甚至死亡。在代谢系统疾病中,线粒体ROS为主要致病因素。它通过可逆氧化翻译后复合物Ⅱ的修饰(Cys100B亚基和Cys103)引起复合物Ⅰ、Ⅱ的氧化改变,从而影响酶的催化活性、蛋白的相互作用、氧化磷酸化和线粒体功能[19]。
2.2 UCP的解偶联和细胞存活
UCP的轻度和重度解偶联均会导致线粒体ROS生成减少,但重度解偶联会引起ATP消耗和细胞坏死。一种线粒体质子载体2,4二甲基苯酚(DNP)口服控释片可以间接产生轻度解偶联,减轻高甘油三酯血症、胰岛素抵抗、肝脂肪变性和糖尿病大鼠模型的非酒精性脂肪肝。该实验指出UCP可能通过轻度解偶联来保护细胞,使之免受脂毒性和氧化损伤。其他几个体外实验也表明UCP催化H+流导致轻度解偶联,从而在影响产热、脂肪酸氧化的调节等生理活动的同时不影响ATP合成。UCP3或低浓度的DNP导致的线粒体膜电位轻度解偶联也保护心脏免受缺血/再灌注损伤(I/R)[19-20]。
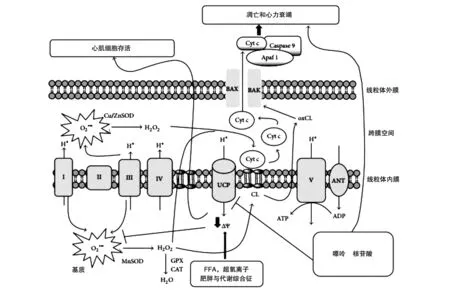
图1 UCP调节对细胞死亡或存活的作用
3 脂毒性和UCP2:从细胞存活到细胞死亡
流行病学和动物研究显示,肥胖是心力衰竭的重要患病因素并影响其预后。针对肥胖个体的研究发现心脏异位脂肪沉积与心脏功能障碍有关[21]。在肥胖中,改变的生化参数主要是TG和FFA,它们的慢性升高会导致心脏中脂质的积聚。脂肪酸代谢是心脏健康功能中重要的调节系统之一。心脏中的脂肪酸主要来源于TG的水解。通过脂蛋白酶和血管内脂蛋白颗粒如乳糜颗粒和极低密度脂蛋白(VLDL)的作用,脂肪酸形成FFA的氧化底物。生理条件下,通过β氧化、膜生物合成、脂质信号分子生成、蛋白修饰和转录调节等多个通路,游离脂肪酸被用于多个系统。在胰岛素抵抗的肥胖患者中,脂肪组织中脂肪分解活性升高,FFA生成过量。细胞内FFA输入过多、利用通路受损,从而导致细胞内脂质累积,引起心脏内FFA氧化和储存功能失调。人类和动物肥胖模型的几项研究表明,TG及其在心脏中的水解产物的过量积累可以诱导氧化应激、损害正常细胞信号传导,导致细胞功能障碍和细胞死亡,进一步导致心力衰竭[22]。TG或FFA过量导致的脂毒性可以通过过量脂肪酸影响神经酰胺生物合成和膜磷脂组分变化,从而导致ROS生成等多个生物机制,致细胞凋亡和坏死[23]。
4 UCP和脂肪酸氧化
UCP2和UCP3在脂毒性条件下的过表达提示UCP可以使细胞免受脂肪酸过度代谢和过度储存的危害。当心脏中UCP2和UCP3高表达时,脂肪酸氧化供能增加。在胰岛素抵抗、糖尿病、心肌缺血应激等病理状况下,长期暴露在高FFA环境下的细胞会通过提高UCP的表达来使自身免受FFA负荷带来的负面影响。事实上,糖尿病心脏的特征性表现为UCP3过表达、脂肪酸氧化增加、心肌耗氧量增加、心率下降[14,16,24]。
5 线粒体脂肪酸代谢和心肌细胞功能障碍

图2 UCP2/3保护心肌细胞免受线粒体中LCFA积累和TG、FFA流入细胞所诱导的脂毒性的作用
图2说明了UCP2和UCP3在线粒体中针对过量的长链脂肪酸(LCFA)积累的解毒作用。正常情况下,FFA过量时会被引导至TG的生物合成。然而在病理条件下,TG的储存超过极限或TG过量水解时,可以引起脂毒性,导致线粒体脂肪酸氧化缺陷。这一过程发生在肥胖早期并与血浆游离脂肪酸浓度增加密切相关[1]。在肥胖的大鼠模型中,无法代谢的FFA(主要是饱和脂肪酸)直接作用于线粒体,诱导线粒体膜通透性转变,细胞色素c释放,并进而导致心脏细胞凋亡。同时,UCP2下调可导致LCFA在基质中积累,诱导线粒体功能障碍,脂毒性和细胞死亡[1,25]。
6 结语
实验证据表明,心肌细胞的凋亡和心力衰竭与心肌中的ROS产生、氧化应激和FFA积累密切相关。UCP2/UCP3在肥胖和代谢综合征中的过表达引起的轻度解偶联,对内源性ROS生存、线粒体LCFA的积累有着解毒作用。UCP的过表达以及药理学方法导致的轻度解偶联,是针对肥胖诱发的心力衰竭的一种有效的解决方法和未来的研究方向。
[1]Kankaanpaa M,Lehto H R,Parkka J P,et al.Myocar⁃dial triglyceride content and epicardial fat mass in hu⁃man obesity:relationship to left ventricular function and serum free fatty acid levels[J].J Clin Endocrinol Metab,2006,11:4689-4695.
[2]Schilling J D.The mitochondria in diabetic heart fail⁃ure:from pathogenesis to therapeutic promise schilling[J].Antioxid Redox Signal,2015,22(17):1515-1526.
[3]Laskowski K R,Russell R R III.Uncoupling proteins in heart failure[J].Curr Heart Failure Rep,2008,5(2):75-79.
[4]Liu S,Geng B,Zou L,et al.Development of hypertro⁃phic cardiomyopathy in perilipin-1 null mice with adi⁃pose tissue dysfunction[J].Cardiovasc Res,2015,105:20-30.
[5]Jin X,Xiang Z,Chen Y P,et al.Uncoupling protein and nonalcoholic fatty liver disease[J].Chin Med J,2013,16:3151-3155.
[6]Petrosillo G,Ruggiero F M,Paradies G.Role of reac⁃tive oxygen species and cardiolipin in the release of cytochrome c from mitochondria[J].FASEB J,2003,17(15):2202-2208.
[7]Wu C C,Bratton S B.Regulation of the intrinsic apoptosis pathway by reactive oxygen species[J].Anti⁃oxid Redox Signal,2013,19(6):546-558.
[8]Ledesma A,de Lacoba M G,Rial E.The mitochondrial uncoupling proteins[J].Genome Biol,2002,12:3015.
[9]Nicholls D G.A history of UCPI[J].Biochem Soc Transactions,2001,29:751-755.
[10]Echtay K S,Roussel D,St-Plerre J,et al.Superoxide activates mitochondrial uncoupling proteins[J].Nature,2002,415:96-99.
[11]Cadenas S,Buckingham J A,Samec S,et al.UCP2 and UCP3 rise in starved rat skeletal muscle but mito⁃chondrial proton conductance is unchanged[J].FEBS Lett,1999,462:257-260.
[12]Vozza A,Parisi G,de Leonardis F,et al.UCP2 trans⁃ports C4 metabolites out of mitochondria,regulating glucose and glutamine oxidation[J].Proc Natl AcadSci USA,2014,111:960-965.
[13]Teshima Y,Akao M,Jones S P,et al.Uncoupling pro⁃tein-2 overexpression inhibits mitochondrial death path⁃way in cardiomyocytes[J]. Circ Res,2003,93:192-200.
[14]Ji X B,Li X R,Hao D,et al.Inhibition of uncou⁃pling protein 2 attenuates cardiac hypertrophy induced by transverse aortic constriction in mice[J].Cell Physi⁃ol Biochem,2015,36:1688-1698.
[15]Villarroya F,Iglesias R,Giralt M.PPARs in the con⁃trol of uncoupling proteins gene expression[J].PPAR Res,2007,2007:74364.
[16]Planavila A,Redondo Angulo I,Ribas F,et al.Fibro⁃blast growth factor 21 protects the heart from oxida⁃tive stress[J].Cardiovasc Res,2015,106:19-31.
[17]van der Lee K A J M,Willemsen P H M,van der Vusse J G,et al.Effects of fatty acids on uncoupling protein-expression in the rat heart[J].FASEB J,2000,14:495-502.
[18]Chen Y,Liu J,Zheng Y,et al.Uncoupling protein 3 mediates H2O2preconditioning-afforded cardioprotec⁃tion through the inhibition of MPTP opening[J]. Car⁃diovasc Res,2015,105(2):192-202.
[19]Condorelli G,Morisco C,Stassi G,et al.Increased cardiomy-ocyte apoptosis and changes in proapoptotic and antiapoptotic genes bax and bcl-2 during left ven⁃tricularadaptationsto chronic pressure overload in the rat[J].Circulation,1999,99(23):3071-3078.
[20]Perry R J,Zhang D,Zhang X M,et al.Controlled-re⁃lease mitochondrial protonophore reverses diabetes and protonophore reverses diabetes and steatohepatitis in rats[J].Science,2015,347:1253-1256.
[21]Young M E,Guthrie P H,Razeghi P,et al.Impaired long-chain fatty acid oxidation and contractile dys⁃function in the obese Zucker rat heart[J].Diabetes,2002,51:2587-2595.
[22]Martinez L,Torres S,Baulies A,et al.Myristic acid poten-tiates palmitic acid-induced lipotoxicity and ste⁃atohepatitis associated with lipodystrophy by sustaning de novo ceramide synthesis[J].Oncotarget,2015,6(39):41479-41496.
[23]Pucci G,Battista F,de Vuono S,et al.Pericardial fat,insulin resistance,and leftventricularstructure and function in morbid obesity[J].Nutr Metab Cardio⁃vasc Dis,2014,24(4):440-446.
[24]Schrauwen P,Hoeks J,Schaart G,et al.Uncoupling protein 3 as a mitochondrial fatty acid anion exporter[J].FASEB J,2003,17:2272-2274.
[25]Pagano C,Calcagno A,Granzotto M,et al.Heart lip⁃id accumulation in obese non-diabetic rats:effect of weight loss[J].Nutr Metab Cardiovasc Dis,2008,18(3):189-197.
Role of Uncoulping Proteins in Heart Failure with Obesity
JIN Hua1,JIN Shuai2*
1.Yuncheng Fengying Chinese Medicine Coronary Heart Disease Hospital,Yuncheng 044000;2.China PLA General Hospital,Beijing 100853;China
Metabolic diseases such as obesity,metabolic syndrome,and typeⅡ diabetes are often characterized by increased reactive oxygen species(ROS) generation in mitochondrial respiratory complexes,associated with fat accumulation in cardiomyocytes,skeletal muscle,and hepatocytes.Several rodents studies showed that lipid accumu⁃lation in cardiac myocytes produces lipotoxicity that causes apoptosis and leads to heart failure,a dynamic patho⁃logical process.Meanwhile,several tissues including cardiac tissue develop an adaptive mechanism against oxida⁃tive stress and lipotoxicity by overexpressing uncoupling proteins(UCP).In heart from rodent and human with obe⁃sity,UCP2 and UCP3 may protect cardiomyocytes from death and from a state progressing to heart failure by down-regulating programmed cell death.UCP activation may affect cytochrome c and proapoptotic protein release from mitochondria by reducing ROS generation and apoptotic cell death.Therefore the aim of this review is to dis⁃cuss recent findings regarding the role that UCP play in cardiomyocyte survival by protecting against ROS genera⁃tion and maintaining bioenergetic metabolism homeostasis to promote heart protection.
uncoulping proteins;obesity;heart failure
Q24;Q51
A
1009-0002(2017)05-0694-06
10.3969/j.issn.1009-
*Corresponding author,E-mail:512048487@qq.com
2017-01-04
晋华(1978- ),女,主治医师,(E-mail)825511419@qq.com
晋帅,(E-mail)512048487@qq.com
