RRAGD-EGFP融合蛋白在MDA-MB-436细胞中的表达定位
2017-10-24张峥嵘郑幽阮班展王嫚娜梁剑青李世崇黄红艳闫敏陈昭烈刘真真孙强
张峥嵘,郑幽,阮班展,王嫚娜,梁剑青,李世崇,黄红艳,闫敏,陈昭烈,刘真真,孙强
1.郑州大学附属肿瘤医院 乳腺科,河南 郑州 450008;2.军事医学科学院 生物工程研究所,北京 100071;3.首都医科大学附属北京世纪坛医院 肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038
RRAGD-EGFP融合蛋白在MDA-MB-436细胞中的表达定位
张峥嵘1,2,郑幽2,阮班展2,王嫚娜2,梁剑青2,李世崇2,黄红艳3,闫敏1,陈昭烈2,刘真真1,孙强2
1.郑州大学附属肿瘤医院 乳腺科,河南 郑州 450008;2.军事医学科学院 生物工程研究所,北京 100071;3.首都医科大学附属北京世纪坛医院 肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038
目的:构建RRAGD-EGFP融合基因表达载体pQCXIP-RRAGD-EGFP,并检测RRAGD-EGFP融合蛋白在MDA-MB-436细胞中的表达定位。方法:提取HEK293细胞总RNA,逆转录得到cDNA并扩增RRAGD基因,克隆入逆转录载体pQCXIP-EGFP-N1,病毒包装后感染人乳腺癌细胞系MDA-MB-436,活细胞观察其在细胞内的表达定位。结果:构建获得逆转录病毒载体pQCXIP-RRAGD-EGFP,融合蛋白RRAGD-EGFP定位于胞浆囊泡和细胞核。结论:RRAGD-EGFP融合蛋白在MDA-MB-436细胞中表达定位于胞浆囊泡,与其参与溶酶体调节功能一致,为后续分析RRAGD在cell-in-cell中的作用奠定了基础。
Ras相关GTP结合蛋白D(RRAGD);基因克隆;cell-in-cell
Ras相关GTP结合蛋白D(Ras-related GTP binding protein D,RRAGD)由400个氨基酸残基组成,相对分子质量为45 588。RRAGD基因位于染色体6q15,编码区长1200 bp[1]。
RRAGD是GTR/RAG GTP结合蛋白家族的一员,哺乳动物体内的该家族成员还包括RRAGA、RRAGB、RRAGC[2-3]。这4种蛋白在结构上均有能与GTP/GDP结合的Loop环和异二聚化结构域,从而决定了其在功能上具有小G蛋白活性和异二聚化的能力。因此,它们作为一个分子开关参与生物过程[4]。另外,它们两两结合,形成了RRAG A/B-C/D异二聚体(其中RRAGA和RRAGB、RRAGC与RRAGD是同源类似物),又称Rag复合体(Rag complex)[3,5-8]。该复合体可与溶酶体上的Ragulator结合并被氨基酸激活,促进mTORC1(mTOR complex 1)从胞浆转移到溶酶体膜表面,并被溶酶体膜上重要的小G蛋白Rheb(Ras ho⁃molog enriched in brain)激活[9-11]。
为了在活细胞中研究RRAGD的定位分布,我们拟构建RRAGD与绿色荧光蛋白的融合表达载体。为此,我们提取了HEK293细胞中的RNA,逆转录得到cDNA后扩增RRAGD基因,连入逆转录表达载体pQCXIP-EGFP-N1得到pQCXIPRRAGD-EGFP,进一步在MDA-MB-436细胞中检查了融合蛋白的亚细胞定位。
1 材料和方法
1.1 材料
MDA-MB-436细胞系来自美国ATCC细胞库,293FT细胞和HEK293细胞为本实验室保存(均采用Macgene公司的DMEM培养基培养);大肠杆菌Trans10和反转录试剂盒购自北京全式金生物技术有限公司;载体pQCXIP-EGFP-N1由本实验保存;琼脂糖凝胶回收试剂盒、质粒快速提取试剂盒和质粒无内毒素提取试剂盒均购自天根公司;TRIzol购自Ambion公司;T载体购自Pro⁃mega公司;Q5高保真DNA聚合酶,限制性内切酶BglⅡ、AgeⅠ、XhoⅠ,T4DNA 连接酶购自NEB 公司;LipofectAMINE 2000、嘌呤霉素均购自Invitro⁃gen公司;玻璃底30 mm培养皿购自NEST公司。
1.2 HEK293总RNA的提取和反转录PCR
收获2×107HEK293细胞,加入1 mL TRIzol,吹打数次后吸入离心管,室温静止5 min使其充分裂解;加入0.2 mL氯仿,振荡混匀后室温静置10 min,4℃、12 000 r/min离心15 min;取上清至另一离心管中,加入等量的异丙醇,将管中液体轻轻混匀,室温静置10 min,4℃、12 000 r/min离心10 min,弃上清;加入1 mL 75%乙醇,轻轻悬浮沉淀,4℃、7500 r/min离心 5 min,弃上清;晾干,加入 20 μL DEPC 水溶解(65℃,促溶 10~15 min);定量RNA。取1 μg总RNA进行反转录(反转录体系:1 μg RNA,1 μL Primer,10 μL Re⁃action Mix,1 μL Enzyme Mix,1 μL Remover,DHPC水补齐至20 μL),将上述体系混匀,42℃、30 min反转录,85℃、5 min使反转录酶失活。
1.3 RRAGD基因扩增和RRAGD-EGFP融合基因表达载体构建
以得到的cDNA为模板扩增RRAGD基因,引物 为 F1(5'-CGCTCGAGATGAGCCAGGTGCTGGG GAAGC-3')和 R1(5'-CGACCGGTCGCAGCAGCA CTCTAGGGGTCCCAT-3')。PCR 扩 增 条 件 :95℃10 s,62℃ 15 s,72℃ 45 s,30个循环。PCR使用Q5高保真聚合酶。胶回收扩增产物,用Taq酶加A后连入pGEM-T载体,经XhoⅠ/AgeⅠ酶切鉴定正确后测序,测序正确后回收目的片段,连入pQCXIP-EGFP-N1载体的XhoⅠ/AgeⅠ位点,得到逆转录表达载体pQCXIP-RRAGD-EGFP(图1)。
1.4 病毒包装、感染
293FT细胞按 1×106/孔接种于6孔板,37℃、5%CO2条件下培养过夜。将目的逆转录病毒载体与包装质粒Gag/Pol、VSVG-R用脂质体Lipo⁃fectAMINE 2000共转染293FT细胞,6 h后换液,于24、48、72 h收取上清,用4.5 μm滤器过滤。将MDA-MB-436细胞按2×105/孔的密度接种于6孔板,每孔加入1 mL DMEM培养基、1 mL病毒上清和1.5 μL Polybrene,48 h后用嘌呤霉素(1 μg/mL)筛选4~5 d,获得稳定目的细胞株。
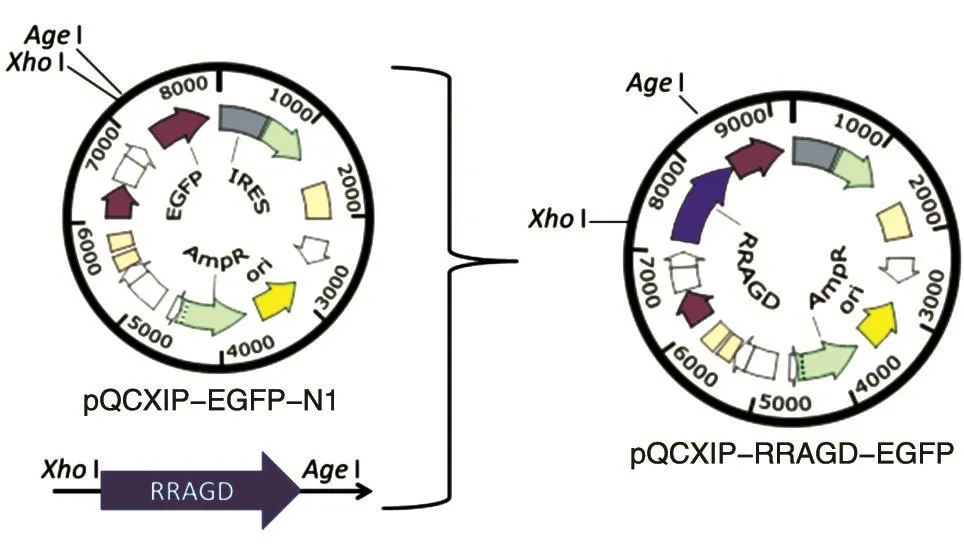
图1 pQCXIP-RRAGD-EGFP表达载体的构建示意图
1.5 活细胞观察RRAGD-EGFP融合蛋白在MDAMB-436细胞中的分布
分别取目的细胞与未转染的普通MDA-MB-436细胞2×105个,种于30 mm玻璃底培养皿中,37℃、5%CO2条件下培养过夜,12 h后在宽场活细胞荧光显微镜下,在FITC和明场下对RRAGDEGFP阳性细胞拍摄照片。
2 结果
2.1 pQCXIP-RRAGD-EGFP表达载体的构建
用引物F1和R1扩增所得产物约为1200 bp,与预期大小相符,提示扩增成功(图2A)。将扩增所得片段连入T载体,用XhoⅠ/AgeⅠ酶切鉴定,电泳显示片段大小正常(图2B),同时测序显示序列无突变(序列未示)。胶回收目的片段,连入逆转录病毒载体pQCXIP-EGFP-N1,转化后挑2个克隆(C1、C2),分别用XhoⅠ/AgeⅠ、BglⅡ/AgeⅠ双酶切鉴定,DNA电泳片段和模式与预期相符(图2C),测序显示插入序列正确无误(序列未示),证明pQCXIP-RRAGD-EGFP表达载体构建成功。

图2 RRAGD基因的PCR扩增和表达载体酶切鉴定
2.2 RRAGD-EGFP融合基因的表达定位分析
已知RRAGD蛋白主要分布于细胞的胞浆、胞核和溶酶体,可能依赖于与其相关的核苷酸结合状态而进出胞核。与此一致,我们发现MDAMB-436细胞中的RRAGD-EGFP蛋白表达分布在胞浆和胞核中,同时在胞浆囊泡中有特异性分布(图3)。研究表明,在entosis(细胞侵入性死亡)的后期,mTORC1所调节的液泡分裂参与内部死亡细胞的代谢[12],而RRAGD作为募集mTORC1的关键分子,其在cell-in-cell结构中的表达分布仍未见报道,因此我们利用活细胞工作站观察RRAGD-EGFP在cell-in-cell结构中的表达分布变化。结果显示当内部细胞进入死亡状态时,外部细胞的RRAGD-EGFP会聚集在内部细胞周围,有明显的聚集效应;而内部细胞处于活的状态时,无此聚集效应(图3)。提示RRAGD可能参与了cell-in-cell结构中内部细胞的死亡及代谢过程。
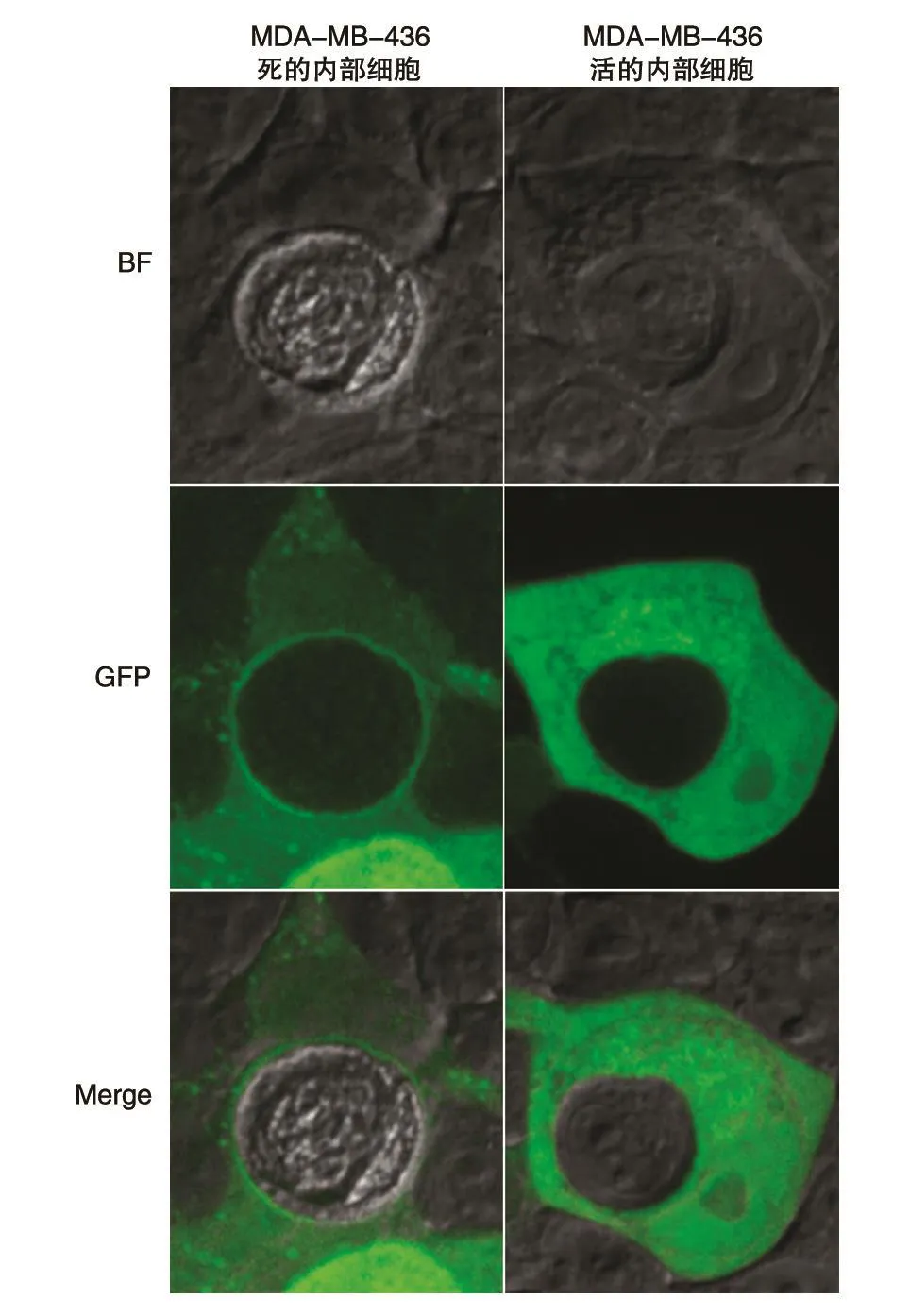
图3 Cell-in-cell结构中外部细胞的RRAGD-EGFP融合蛋白定位
3 讨论
通过建立表达RRAGD-EGFP融合蛋白的细胞系,为我们在活细胞水平研究RRAGD的表达及功能提供了便利:一方面,EGFP是无毒的,对细胞的生存状态没有影响,因此便于在荧光显微镜下长时间进行活细胞观察,明确其表达分布的变化;另一方面,可以省去复杂的免疫荧光染色,同时简化Western印迹实验的抗体选择。
RRAGD在多种组织,如皮肤、心脏、脊髓、睾丸和视网膜等中均有表达。RRAGD可以参与多种信号通路,尤其是其异二聚体复合物调节mTORC1活性的功能,具有很重要的生理意义[7]。我们前期研究发现RRADG在乳腺癌细胞系的不同单克隆细胞株中表达差异很大,同时与乳腺癌细胞的cell-in-cell形成率具有一定的相关性,因此,通过构建表达RRAGD-EGFP融合蛋白的细胞系,为探讨RRAGD对cell-in-cell形成能力的作用及机制研究提供了合适的研究模型。
此外,在cell-in-cell结构中,内部细胞是被外部细胞所形成的液泡包裹的,部分液泡的命运与吞噬小体类似——液泡在外部细胞内经历一定的事件后达到成熟,其成熟末期的标志即液泡的分解,液泡分裂后其内部营养和遗传物质进入外部细胞并被利用[12]。在我们的实验中发现,内部细胞处于死亡状态时,外部细胞的RRAGD-EGFP有明显的聚集效应,这一过程是否是通过募集mTORC1参与调节液泡的成熟,进而促进内部细胞的死亡还有待研究。同时,RRAGD及其形成的异二聚体复合物的活化是否能决定cell-in-cell结构中内部细胞的命运,也值得深入探索。
[1]Mungall A J,Palmer S A,Sims S K,et al.The DNA sequence and analysis of human chromosome 6[J].Nature,2003,425(6960):805-811.
[2]Kim E,Goraksha-Hicks P,Li L,et al.Regulation of TORC1 by Rag GTPases in nutrient response[J].Nat Cell Biol,2008,10(8):935-945.
[3]Sancak Y,Peterson T R,Shaul Y D,et al.The Rag GTPases bind raptor and mediate amino acid signal⁃ing to mTORC1[J].Science,2008,320(5882):1496-1501.
[4]Sekiguchi T,Todaka Y,Wang Y,et al.A novel hu⁃man nucleolar protein,Nop132,binds to the G pro⁃teins,RRAG A/C/D[J].JBiolChem,2004,279(9):8343-8350.
[5]Hirose E,Nakashima N,Sekiguchi T,et al.RagA is a functional homologue of S.cerevisiae Gtr1p involved in the Ran/Gsp1-GTPase pathway[J].J Cell Sci,1998,111(1):11-21.
[6]Schürmann A,Brauers A,Massmann S,et al.Cloning of a novel family of mammalian GTP-binding proteins(RagA,RagBs,RagB1)with remote similarity to the Ras-related GTPases[J].JBiolChem,1996,270(48):28982-28988.
[7]Sekiguchi T,Hirose E,Nakashima N,et al.Novel G proteins,Rag C and Rag D,interact with GTP-bind⁃ing proteins,Rag A and Rag B[J].J Biol Chem,2001,276(10):7246-7257.
[8]Kim Y M,Stone M,Hwang T H,et al.SH3BP4 is a negative regulator of amino acid-Rag GTPasemTORC1 signaling[J].Mol Cell,2012,46(6):833-846.
[9]Oshiro N,Rapley J,Avruch J.Amino acids activate mammalian target of rapamycin(mTOR)complex 1 with⁃out changing Rag GTPase guanyl nucleotide charging[J].J Biol Chem,2013,289(5):2658-2674.
[10]Roccio M,Bos J L,Zwartkruis F J.Regulation of the smallGTPase Rheb by amino acids[J].Oncogene,2006,25(5):657-664.
[11]Sancak Y,Bar-Peled L,Zoncu R,et al.Ragulator-Rag complex targets mTORC1 to the lysosomal sur⁃face and is necessary for its activation by amino acids[J].Cell,2010,141(2):290-303.
[12]Krajcovic M,Krishna S,Akkari L,et al.mTOR regu⁃lates phagosome and entotic vacuole fission[J].Mol Bi⁃ol Cell,2013,24(23):3736-3745.
Expression and Subcellular Localization of RRAGD-EGFP Fusion Protein in MDA-MB-436 Cells
ZHANG Zheng-Rong1,2,ZHENG You2,RUAN Ban-Zhan2,WANG Man-Na2,LIANG Jian-Qing2,LI Shi-Chong2,HUANG Hong-Yan3,YAN Min1,CHEN Zhao-Lie2,LIU Zhen-Zhen1*,SUN Qiang2*
1.Department of Breast,Cancer Hospital,Zhengzhou University,Zhengzhou 450008;2.Beijing Institute of Biotech⁃nology,Beijing 100071;3.Beijing Key Laboratory of Oncology and Oncology Vaccine,Beijing Shijitan Hospital,Capital University of Medical Sciences,Beijing 100038;China
Objective:To construct the retroviral expression vector for RRAGD-EGFP fusion protein,and exam⁃ine its subcellular localization in MDA-MB-436 cells.Methods:Total RNA was extracted from HEK293 cells and reverse transcribed into cDNA.RRAGD(Ras-related GTP binding protein D)gene was amplified by PCR and cloned into the retroviral expression vector pQCXIP-EGFP-N1 to construct pQCXIP-RRAGD-EGFP,followed by retrovirus was made and infected MDA-MB-436,a cell line of breast cancer.Afterwards,time lapse imaging was performed.Results:The retroviral expression vector for RRAGD-EGFP fusion protein was successfully constructed.RRAGD-EGFP fusion protein was found in cytoplasmic vesicles and nucleus.Conclusion:Localization of RRAGDEGFP fusion protein in cytoplasmic vesicles is consistent with its role in lysosomal biogenesis,which has laid foun⁃dation for the further study on the role of RRAGD in cell-in-cell.
Ras-related GTP binding protein D(RRAGD);gene cloning;cell-in-cell
Q78
A
1009-0002(2017)05-0639-04
10.3969/j.issn.1009-
*Co-corresponding authors,LIU Zhen-Zhen,E-mail:Liuzhenzhen73@163.com;SUN Qiang,E-mail:sunq@bmi.ac.cn
2017-04-05
国家自然科学基金(81572799,31671432);国家重点研发计划(2016YFC1303303);北京市自然科学基金(7162091)
张峥嵘(1991- ),男,硕士研究生,(E-mail)18703605958@163.com;郑幽(1989- ),女,助理研究员;二者为共同第一作者
刘真真,(E-mail)Liuzhenzhen73@163.com;孙强,(E-mail)sunq@bmi.ac.cn
