可溶性泛素样特异性蛋白酶1的表达及活性鉴定
2017-10-24冯丽丽陈海燕刘毓侠郭彦周国利任银玲
冯丽丽,陈海燕,刘毓侠,郭彦,周国利,任银玲
1.河南省农业科学院 农业经济与信息研究所,河南 郑州 450002;2.聊城大学 生命科学学院,山东 聊城 252059
可溶性泛素样特异性蛋白酶1的表达及活性鉴定
冯丽丽1,陈海燕1,刘毓侠1,郭彦2,周国利2,任银玲1
1.河南省农业科学院 农业经济与信息研究所,河南 郑州 450002;2.聊城大学 生命科学学院,山东 聊城 252059
目的:高效可溶性表达泛素样特异性蛋白酶1(ULP1)。方法:根据大肠杆菌密码子的偏好性优化合成编码ULP1的基因片段序列,将其克隆到原核表达载体pGEX-6P-1中,转化大肠杆菌BL21(DE3),用0.5 mmol/L IPTG于37℃诱导表达8 h,观察重组蛋白ULP1的表达情况;优化诱导时间及IPTG浓度,并鉴定重组蛋白ULP1的生物学活性。结果:重组蛋白ULP1表达的最佳条件为37℃、0.1 mmol/L的IPTG诱导表达5 h,目的蛋白以可溶性表达为主;Western印迹结果表明,重组蛋白ULP1能够被His单克隆抗体识别,重组蛋白ULP1能够特异性酶切SUMO-GFP。结论:表达了具有生物学活性的SUMO蛋白酶ULP1。
泛素样特异性蛋白酶1(ULP1);SUMO蛋白酶;表达;纯化;生物学活性
泛素样特异性蛋白酶(ubiquitin-like specific protease,ULP)为半胱氨酸蛋白酶超家族成员,在真核生物体内可将小分子泛素样修饰物(small ubiquitin-related modifier,SUMO)底物蛋白偶合物水解成SUMO和底物,此过程称为去SUMO化(de⁃sumoylation)[1-4]。酿酒酵母中含有2种SUMO蛋白酶,即ULP1和ULP2。ULP1位于核孔复合体中,ULP2则主要位于细胞核内。目前对ULP1的研究较多。ULP1由621个氨基酸残基组成,至少含有2个结构域,C端蛋白酶折叠区域(432~621 aa)保守性高,N端结构域(1~432 aa)保守性弱,其中第403~621 aa片段具有全长ULP1的酶切活性,且可水解以α氨基连接的SUMO蛋白[5-6]。
SUMO蛋白广泛存在于真核细胞中,具有重要的生物学功能,参与多种生命过程[7]。SUMO标签能显著增加重组蛋白的表达量、促进靶蛋白的正确折叠及防止蛋白酶水解,被广泛应用于重组蛋白表达的融合标签[8]。利用SUMO表达系统体外表达重组蛋白,须以SUMO蛋白酶为切割工具分离靶蛋白[9-10]。ULP1能够识别含SUMO标签蛋白的蛋白质序列,且可高效地将SUMO标签蛋白与融合蛋白切割开。ULP1的酶切反应特异性高,可在较宽范围的反应体系中保持较高的活力,如pH值(5.5~9.5)、温度(4~30℃)等。因此,表达活力高和特异性强的SUMO蛋白酶具有十分重要的经济价值。在本研究中,我们根据GenBank公布的ULP1(Q02724)氨基酸序列,结合大肠杆菌密码子偏好性优化合成ULP1基因序列,并设计相应的表达引物,PCR扩增编码ULP1第403~621 aa活性片段的基因序列,将其克隆到原核表达载体中,转化大肠杆菌BL21(DE3)感受态细胞,以期表达出高活力和高特异性的重组ULP1,为带SU⁃MO标签融合蛋白的高效纯化奠定基础。
1 材料和方法
1.1 材料
大肠杆菌BL21(DE3)及JM109感受态细胞购自大连宝生物工程有限公司;pGEX-6P-1表达载体购自Amersham公司。根据大肠杆菌密码子偏好性优化编码ULP1的基因片段,由生工生物(上海)股份有限公司合成。
His标签单克隆抗体、HRP标记的羊抗鼠IgG购自Abcam公司;限制性内切酶BamHⅠ、XhoⅠ及T4DNA连接酶购自Promega公司;IPTG诱导剂购自INALCO公司;质粒提取试剂盒购自Omega公司;蛋白质marker、DNA聚合酶、DNA凝胶回收试剂盒购自大连宝生物工程有限公司;AEC显色试剂盒购自中杉金桥公司;其他试剂均为国产分析纯产品。
1.2 ULP1基因及表达引物的设计与合成
根据GenBank公布的ULP1蛋白序列(Q02724),按照大肠杆菌密码子偏好性优化ULP1基因序列,并设计表达引物ULP1-F(5'-TG GGATCCATGCTTGTTCCTGAATTAAA-3',下 划 线部分为BamHⅠ酶切位点)和ULP1-R(5'-AATCT CGAGTTAGTGATGATGATGATGATG-3',下划线部分为XhoⅠ酶切位点)。ULP1基因片段及引物均由生工生物工程(上海)股份有限公司合成。
1.3 重组表达载体构建
应用引物ULP1-F/R,以合成的ULP1基因片段为模板进行PCR扩增,获得ULP1基因片段;用BamHⅠ、XhoⅠ分别双酶切目的基因片段和pGEX-6P-1载体,用T4DNA连接酶按3∶1的比例连接,转化大肠杆菌JM109,经菌液PCR鉴定,对阳性结果的质粒进行测序,将测序正确的阳性菌株命名为pGEX-ULP1;将提取的阳性菌株质粒转化大肠杆菌BL21(DE3),用于重组蛋白表达。
1.4 重组蛋白ULP1的表达与可溶性分析
将pGEX-ULP1菌液按1∶1000的比例接种至5 mL含50 μg/mL氨苄西林的LB液体培养基中,过夜37℃培养;按1∶100的比例接种到50 mL LB培养基中,培养至D450nm约为0.6时,加入终浓度为0.5 mmol/L的IPTG,诱导培养8 h;收集细菌培养液,4℃、12 000 r/min离心10 min后弃上清,向沉淀中加入2 mL PBS缓冲液,将重悬的菌体进行超声波破碎,4℃、12 000 r/min离心10 min,SDSPAGE检测;在15 V、1 h条件下,用电转仪将目的蛋白转移至硝酸纤维素膜(NC膜),用5%的脱脂奶于4℃封闭过夜,以His单克隆抗体(1∶5000稀释)为一抗孵育60 min,以HRP标记的羊抗鼠IgG(1∶5000稀释)为二抗孵育30 min,AEC显色,观察目的蛋白的表达。
1.5 重组蛋白ULP1的表达条件优化
分别对IPTG诱导浓度、诱导时间进行优化。在IPTG浓度为0.5 mmol/L、温度为37℃条件下,诱导时间分别选择 2、4、5、6、7、8、9 h;在温度37℃、诱导5 h条件下,分别选择0.1、0.3、0.6、0.9、1 mmol/L的IPTG浓度。将以上条件下的表达产物进行SDS-PAGE检测,以确定重组蛋白的最佳诱导条件。
1.6 重组蛋白ULP1的纯化
采用Ni亲和柱纯化,先用结合缓冲液(含10 mmol/L咪唑)平衡Ni亲和柱,将裂解液缓慢流过Ni亲和柱,用含20 mmol/L咪唑的洗涤缓冲液洗涤Ni亲和柱,最后用含250 mmol/L咪唑的洗脱缓冲液洗脱表达的目的蛋白。
1.7 重组蛋白ULP1的酶切活性鉴定
分别选用本研究纯化获得的ULP1及商品化的ULP1对SUMO-GFP蛋白进行酶切反应。商品化酶反应体系:40 μL SUMO-GFP融合蛋白,2 μL(10 U/μL)SUMO 蛋白酶,10 μL 10×SUMO 蛋白酶缓冲液,加ddH2O至总体积为80 μL;重组ULP1反应体系:40 μL SUMO-GFP融合蛋白,10 μL SUMO蛋白酶,8 μL 10×SUMO蛋白酶缓冲液,加ddH2O至总体积为80 μL。上述反应体系在30℃反应4 h,反应产物进行SDS-PAGE检测,以确定纯化后重组蛋白的酶切活性。
2 结果
2.1 ULP1基因的PCR扩增及pGEX-ULP1重组表达质粒的鉴定
用引物ULP1-F/R进行PCR扩增,在约700 bp处出现特异性条带,与预期ULP1基因片段大小一致(图1);将扩增的ULP1基因片段克隆至pGEX-6P-1载体,菌液PCR鉴定结果显示为阳性(图2);提取阳性菌株的质粒并进行双酶切鉴定,在约700 bp处有预期目的条带(图3)。将阳性质粒送样测序,结果表明重组表达质粒pGEX-ULP1构建成功。
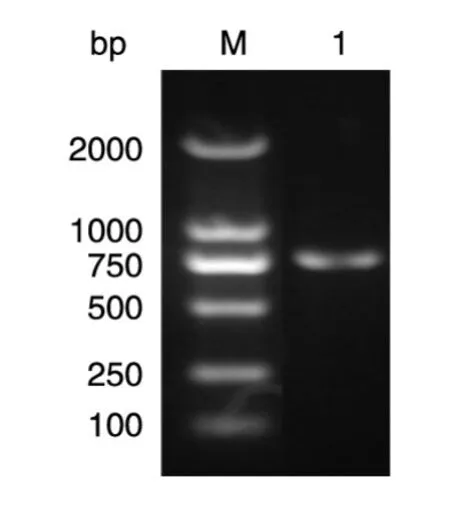
图1 ULP1片段PCR扩增结果
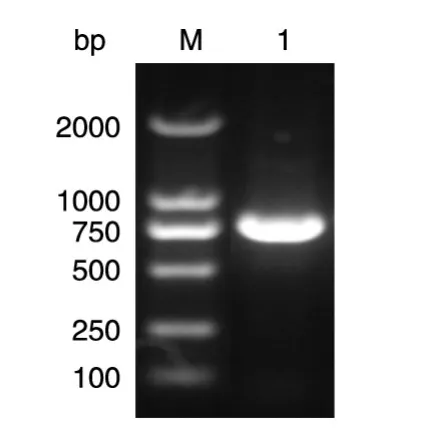
图2 pGEX-ULP1菌液PCR鉴定结果

图3 pGEX-ULP1双酶切鉴定结果
2.2 重组蛋白ULP1的诱导表达及可溶性分析
超声波破碎处理的样品上清及沉淀分别进行SDS-PAGE及Western印迹鉴定,结果表明,在相对分子质量48 000处有特异的蛋白质条带,与预测的ULP1重组蛋白大小一致,目的蛋白大部分以可溶性形式存在,且能与抗His标签单克隆抗体特异性结合(图4)。
2.3 重组蛋白ULP1的表达条件优化
分别对诱导表达重组蛋白ULP1的诱导时间、IPTG浓度进行优化,结果发现,诱导5 h时表达量达到最高,故选择5 h作为最佳诱导表达时间(图5)。当IPTG浓度为0.1 mmol/L时,目的蛋白的表达量明显高于0.3 mmol/L;而IPTG浓度高于0.3 mmol/L时的表达变化不很明显,故选择0.1 mmol/L作为最佳IPTG诱导浓度(图6)。

图5 0.5 mol/L IPTG诱导不同时间的重组蛋白ULP1的表达
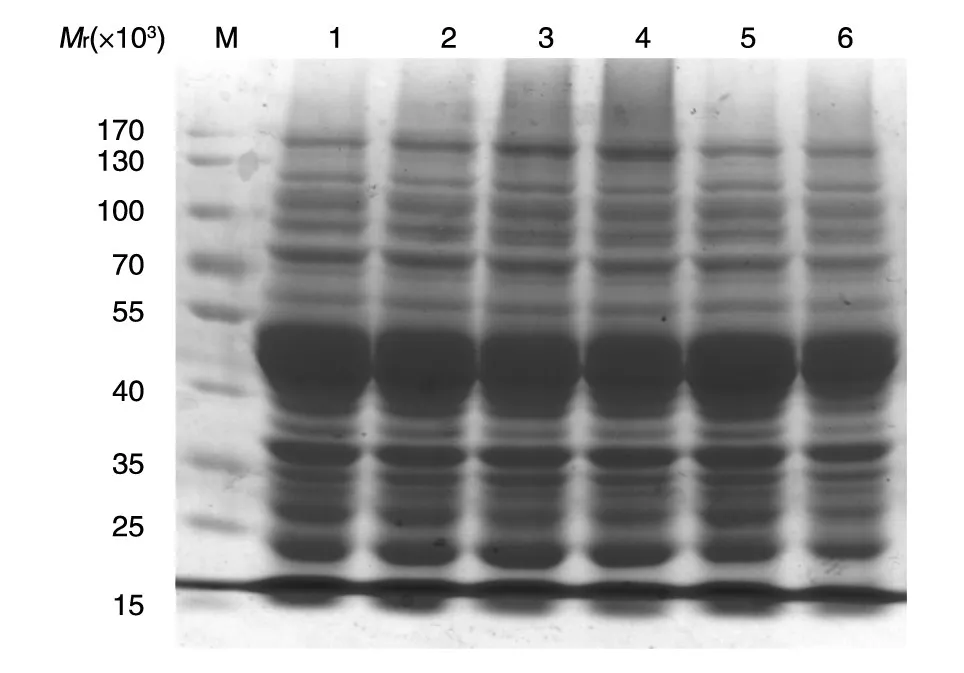
图6 不同IPTG浓度诱导5 h的重组蛋白ULP1的表达
2.4 重组蛋白ULP1的纯化
分别采用Ni-NTA亲和树脂及阳离子交换层析纯化目的蛋白。图7为Ni柱亲和层析纯化结果,重组蛋白与Ni柱结合良好,特异性强,经亲和纯化后目的蛋白纯度较高,可达95%。
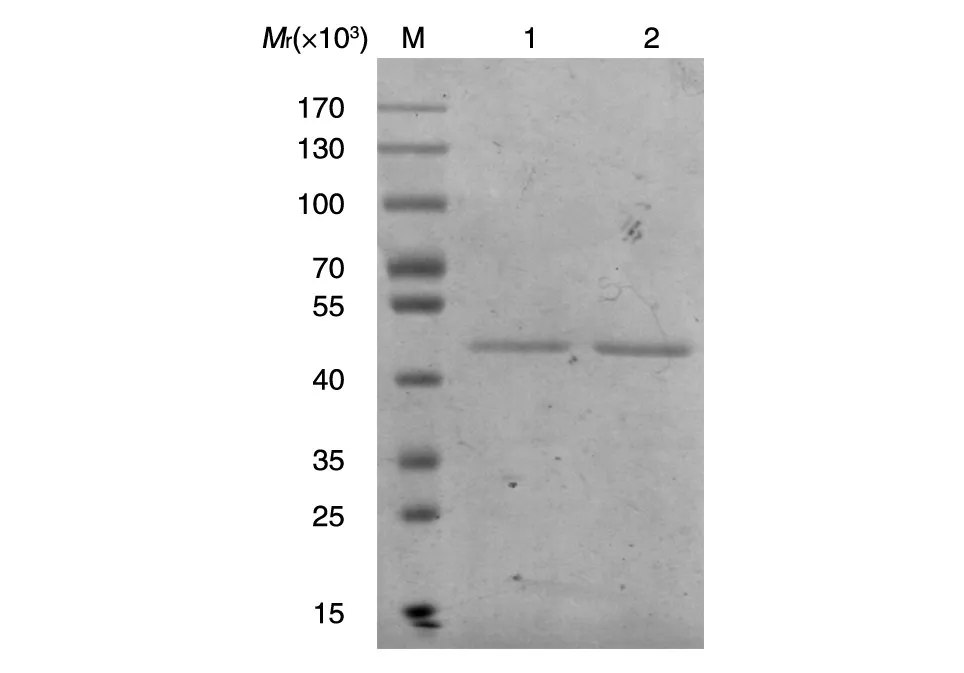
图7 重组蛋白ULP1的Ni柱亲和层析纯化
2.5 重组蛋白ULP1的酶切活性鉴定
从图8可以看出,纯化的重组蛋白ULP1可将SUMO-GFP完全切开,出现相对分子质量分别约为26 000和18 000的2条带。可见,表达的重组蛋白ULP1具有SUMO蛋白酶活性。

图8 重组蛋白ULP1的活性鉴定
3 讨论
我们构建并高效表达了可溶性ULP1活性片段,利用重组蛋白ULP1的6×His标签进行Ni-NTA纯化后,其纯度达95%以上。重组蛋白ULP1与商品化SUMO蛋白酶对SUMO-GFP的切割结果一致,表明本研究表达的重组蛋白具有天然ULP1的酶切活性。
ULP1专一性强,识别蛋白质的三维结构,且其可从SUMO末端将目的蛋白切割下来,切割后不存在任何氨基酸残留。此外,SUMO融合标签分子较小,可促进蛋白可溶性表达、正确折叠,防止蛋白降解[11-13]。鉴于以上优点,SUMO表达系统被广泛应用,其切割酶ULP1的需求量也随之增加。但ULP1在正常真核细胞中的表达量非常低,故本研究按照大肠杆菌密码子的偏好性来优化合成SUMO蛋白酶活性片段ULP1基因,使得ULP1能够高水平表达,经纯化得到活性较强的SUMO蛋白酶ULP1。
[1]Eckhoff J,Dohmen R J.In vitro characterization of chain depolymerization activities of SUMO-specific pro⁃teases[J].Methods Mol Biol,2016,1475:123-135.
[2]Guerrero F,Ciragan A,Iwaï H.Tandem SUMO fusion vectors for improving soluble protein expression and purification[J].Protein Expr Purif,2015,116:42-49.
[3]Malakhov M P,Mattern M R,Malakhova O A,et al.SUMO fusions and SUMO-specific protease for effi⁃cient expression and purification of proteins[J].J Struct Funct Genomics,2004,5(1/2):75-86.
[4]Kuo D,Nie M,Courey A J.SUMO as a solubility tag and in vivo cleavage of SUMO fusion proteins with Ulp1[J].Methods Mol Biol,2014,1177:71-80.
[5]Reverter D,Lima C D.Preparation of SUMO proteas⁃es and kinetic analysis using endogenous substrates[J].Methods Mol Biol,2009,497:225-239.
[6]Hay R T.SUMO-specific proteases:a twist in the tail[J].Trends Cell Biol,2007,17(8):370-376.
[7]Wang Z,Li N,Wang Y,et al.Ubiquitin-intein and SUMO2-intein fusion systems forenhanced protein production and purification[J]. Protein Expr Purif,2012,82(1):174-178.
[8]Panavas T,Sanders C,Butt T R.SUMO fusion tech⁃nology for enhanced protein production in prokaryotic and eukaryotic expression systems[J].Methods Mol Bi⁃ol,2009,497:303-317.
[9]HayR T.Protein modification by SUMO[J].Annu Rev Biochem,2004,73(1):355-382.
[10]Dohmen R J.SUMO protein modification[J].Biochim Biophys Acta Mol Cell Res,2004,1695(3):113.
[11]姜媛媛,尹成凯,李晋南,等.利用SUMO融合系统高效表达可溶性重组蛋白的研究[J].东北农业大学学报,2008,39(10):57-62.
[12]曲栗,尹杰超,李宁,等.利用SUMO表达系统高效可溶性表达鸡传染性法氏囊病病毒VP3基因[J].中国预防兽医学报,2011,33(3):199-202.
[13]Guo H C,Sun S Q,Jin Y,et al.Foot-and-mouth dis⁃ease virus-like particles produced by a SUMO fusion protein system in Escherichia coli,induce potent pro⁃tective immune responses in guinea pigs,swine and cat⁃tle[J].Vet Res,2013,44(1):48.
Souble Expression and Biological Activity Identification of Ubiquitin-Like Specific Protease 1
FENG Li-Li1,CHEN Hai-Yan1,LIU Yu-Xia1,GUO Yan2,ZHOU Guo-Li2,REN Yin-Ling1*
1.Institute of Agricultural Economics and Information,Henan Academy of Agriculture Sciences,Zhengzhou 450002;2.College of Life Science,Liaocheng University,Liaocheng 252059;China
Obective:To obtain souble expressive ubiquitin-like specific protease 1(ULP1).Methods:ULP1 gene was optimized according to the preference codon usage ofE.coli.ULP1 gene was synthesized and then cloned into pGEX-6P-1 vector,and transformed intoE.coliBL21(DE3) competent cells.Inducing time and con⁃centration of IPTG were optimized,and ULP1 was induced by 0.5 mmol/L IPTG at 37℃for 5 h.Results:The best inducing conditions of was in 0.1 mmol/L IPTG,and expressed as a souble fusion protein.The catalytic reac⁃tion of ULP1 to SUMO-GFP showed high specificity and activity.Conclusion:The souble fusion ULP1 with bio⁃logical activity was successful expressed.
ubiquitin-like specific protease 1(ULP1);SUMO protease;expression;purification;biological activity
Q786
A
1009-0002(2017)05-0629-05
10.3969/j.issn.1009-
*Corresponding author,E-mail:916797076@qq.com
2017-03-01
国家自然科学基金(31571274);山东省自然科学基金(ZR2015CM025);河南省农业科学院高层次人才科研启动项目
冯丽丽(1983- ),女,博士,助理研究员,(E-mail)707642217@qq.com
任银玲,(E-mail)916797076@qq.com
