人细小病毒B19基因组编码蛋白真核表达质粒的构建与鉴定
2017-10-24钟亚迪贾俊婷范瑞马丽敏马玉媛章金刚
钟亚迪,贾俊婷,范瑞,马丽敏,马玉媛,章金刚
军事医学科学院 野战输血研究所,北京 100850
人细小病毒B19基因组编码蛋白真核表达质粒的构建与鉴定
钟亚迪,贾俊婷,范瑞,马丽敏,马玉媛,章金刚
军事医学科学院 野战输血研究所,北京 100850
目的:构建人细小病毒B19(B19V)基因组编码蛋白的真核表达质粒,并对其表达进行鉴定,为研究B19V蛋白功能提供支持。方法:设计并合成B19V基因组编码蛋白VP1、VP2、NS1、11kDa、X、7.5kDa和VP1独特区域(VP1u)的PCR扩增引物,以B19V感染性克隆pB19-M20为模板,PCR扩增基因组编码蛋白的核苷酸序列,将其插入真核表达载体pcDNA3.1(+)-HA-Flag,并进行酶切鉴定和核苷酸序列测定;将鉴定正确的重组质粒转染HEK293T细胞,通过免疫印迹分别检测病毒蛋白的表达情况。结果:构建了B19V 7种蛋白的真核表达质粒,免疫印迹鉴定表明均可表达相应的目的蛋白。结论:构建了B19V 7种蛋白的真核表达质粒,为深入研究B19V蛋白功能及其在致病机制中的作用奠定了基础。
人细小病毒B19;病毒蛋白;真核表达质粒
1975年,人细小病毒B19(Human parvovirusB19,B19V)首次发现于英国南伦敦输血中心病毒参考实验室[1],是无囊膜结构的单链DNA病毒,呈正二十面体结构,直径仅20.5~25.0 nm,属于细小病毒科(Parvoviridae)、细小病毒亚科(Parvoviri⁃nae)、红病毒属(Erythrovirus)[2]。
B19V主要经呼吸道传播,也可经母婴垂直传播,而经血液及血液制品传播具有更重要的临床意义,一直倍受人们关注[3]。儿童感染B19V可引起最为常见的传染性红斑(也称为“第五病”)[4],健康成人感染多表现为轻型自限性疾病。特殊人群感染B19V之后则易出现严重后果:免疫功能缺陷人群感染可以引起慢性贫血;存在血液性疾病的病人感染可以引起暂时性再障危象等[5];孕妇感染可能引起胎儿水肿、流产和死胎等[6]。此外,据文献报道,B19V感染与肝炎、心肌炎、脑炎、急性横惯性脊髓炎等[7-10]以及多种自身免疫性疾病也存在相关性[11]。
B19V基因组长约5.6 kb,包含2个大的开放读框(open reading frame,ORF)。左侧的ORF编码非结构蛋白NS1,右侧ORF编码衣壳蛋白VP1和VP2,VP1的N端比VP2多226个氨基酸残基,称为 VP1独特区域(VP1-unique region,VP1u)。B19V还有3个小的非结构蛋白,即11kDa、X和7.5kDa[2]。了解B19V的基因组结构和蛋白功能,对于深入研究B19V和宿主细胞的相互作用,以及揭示B19V的致病机制具有重要意义。
本研究以B19V感染性克隆pB19-M20为模板,构建B19V编码的所有蛋白真核表达质粒,并对其在HEK293T细胞中的表达进行了鉴定,将为深入研究B19V蛋白的功能奠定基础。
1 材料和方法
1.1 材料
人胚肾293T(HEK293T)细胞和真核表达载体pcDNA3.1(+)-HA-Flag均为本实验室保存;B19V感染性克隆pB19-M20由美国NIH心肺血液研究所Susan Wong博士惠赠;大肠杆菌感受态细胞DH5α、T4DNA连接酶(TaKaRa公司);DMEM Basic培养液、Opti-MEM培养液(Gibco公司);胎牛血清(杭州四季青公司);Phusion-HF DNA聚合酶、限制性内切酶EcoRⅠ和NotⅠ(NEB公司);高纯度质粒小提试剂盒(Tiangen公司);胶回收和去内毒素质粒大提试剂盒(Qiagen公司);RIPA裂解液(碧云天公司);BCA蛋白定量测定试剂盒(北京鼎国昌盛公司);蛋白酶抑制剂(Amresco公司);鼠抗HA抗体(Cell Signaling公司);鼠抗βactin抗体(Proteintech公司);羊抗鼠荧光抗体(LI-COR公司)。
1.2 引物设计与合成
从GenBank下载B19V J35毒株的核苷酸序列(登录号:AY386330.1),用Primer Premier 5.0软件,分别根据B19V基因组编码蛋白VP1、VP2、NS1、11kDa、X、7.5kDa和VP1u的核苷酸序列,设计相应的扩增引物(表1),由北京中美泰和生物技术公司合成。
1.3 真核表达质粒的构建
以B19V的感染性克隆pB19-M20为模板,PCR扩增上述B19V所有蛋白的核苷酸序列。扩增体系:1 ng感染性克隆pB19-M20为模板,5×Phusion 缓冲液10 μL,dNTPs 200 μmol/L,上、下游引物各0.5 μmol/L,Phusion-HF DNA聚合酶1 U,加无菌去离子水至50 μL。扩增条件:98℃预变性3 min;98℃变性30 s,72℃退火(其中,NS1蛋白的退火温度为67℃)30 s,72℃延伸1 min,35个循环;72℃延伸5 min。用胶回收试剂盒回收7种PCR产物,限制性内切酶EcoRⅠ和NotⅠ切割pcDNA3.1(+)-HA-Flag载体和回收的PCR产物,用T4DNA连接酶进行连接。
1.4 重组质粒的鉴定
连接产物分别转化大肠杆菌感受态细胞DH5α,经氨苄西林抗性筛选后,分别挑选12个单菌落进行菌落PCR鉴定。挑选阳性克隆单菌落,扩大培养并提取质粒。用限制性内切酶NotⅠ和EcoRⅠ对质粒进行单、双酶切,于37℃酶切反应15 min,反应产物经1%琼脂糖凝胶电泳。酶切鉴定正确的质粒送中美泰和生物公司行核苷酸序列测定。
1.5 蛋白表达的免疫印迹鉴定
用含10%胎牛血清的DMEM Basic培养液,于37℃、5%CO2环境培养HEK293T细胞。将HEK293T细胞(6×105/孔)接种于6孔板,待细胞汇合度达80%进行转染。按照PEI转染方法,转染前1 h把细胞培养液更换为无血清的Opti-MEM培养液。将6 μg质粒与500 μL Opti-MEM培养液混合并振荡均匀,再将 18 μL PEI与 500 μL Opti-MEM培养液混合并振荡均匀,室温放置20 min,加入细胞培养孔中。37℃、5%CO2孵箱中培养细胞,1 h后加入含10%胎牛血清的DMEM Ba⁃sic培养液2 mL。转染后的细胞于37℃、5%CO2环境下培养。
转染72 h后收集细胞,用RIPA裂解液(含1×蛋白酶抑制剂)裂解细胞,14 000×g低温离心5 min收集细胞总蛋白;用BCA蛋白定量测定试剂盒测定蛋白含量,加入5×SDS蛋白电泳上样缓冲液,煮沸10 min,稍离心,取80 μg蛋白样品进行SDS-PAGE;蛋白转移至PVDF膜,封闭1 h,加入1∶1000稀释的鼠源HA标签抗体,4℃轻摇过夜;TBST洗膜3次,5 min/次,加入1∶10 000稀释的羊抗鼠荧光抗体,室温轻摇孵育2 h;TBST洗膜3次,5 min/次,用红外荧光扫描成像系统显影。
2 结果
2.1 真核表达质粒的构建
以B19V感染性克隆pB19-M20为模板,PCR扩增B19V所有蛋白的编码区序列,反应产物经1%琼脂糖凝胶电泳。扩增VP1、VP2、VP1u和NS1编码序列的电泳结果显示产物长度符合预期(依次为 2366、1685、701和 2035 bp),扩增 11kDa、X和7.5kDa编码序列的电泳结果显示产物长度符合预期(依次为304、265和244 bp)(图1)。将各扩增产物分别插入pcDNA3.1(+)-HA-Flag载体,获得B19V所有蛋白的真核表达质粒,分别为pcDNA3.1(+)-HA-Flag-VP1、pcDNA3.1(+)-HAFlag-VP2、pcDNA3.1(+)-HA-Flag-VP1u、pcD⁃NA3.1(+)-HA-Flag-NS1、pcDNA3.1(+)-HAFlag-11kDa、pcDNA3.1(+)-HA-Flag-X 和 pcD⁃NA3.1(+)-HA-Flag-7.5kDa。

表1 B19V基因组编码蛋白的编码区序列扩增引物

图1 PCR扩增B19V所有蛋白编码序列的电泳图
2.2 重组质粒的鉴定
将B19V各蛋白编码区序列与pcDNA3.1(+)-HA-Flag载体的连接产物分别转化大肠杆菌感受态细胞DH5α,经氨苄西林抗性筛选后,通过菌落PCR筛选阳性克隆扩大培养,提取质粒后用限制性内切酶NotⅠ和EcoRⅠ分别进行单、双酶切鉴定,结果显示构建的B19V 7种蛋白真核表达重组质粒均能获得预期的酶切结果(图2)。酶切鉴定正确的质粒送中美泰和公司进行核苷酸序列测定,结果表明构建的B19V 7种蛋白真核表达重组质粒的序列正确(序列略)。
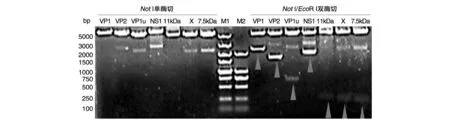
图2 用NotⅠ和EcoRⅠ进行单、双酶切鉴定的电泳图
2.3 蛋白表达的免疫印迹鉴定
将B19V基因组编码蛋白真核表达质粒分别转染HEK293T细胞,72 h后收集细胞蛋白进行免疫印迹检测,结果显示能检测到各目的蛋白的特异性条带,蛋白大小与预期相符(图3)。表明构建的真核表达质粒能够在HEK293T细胞中实现表达。
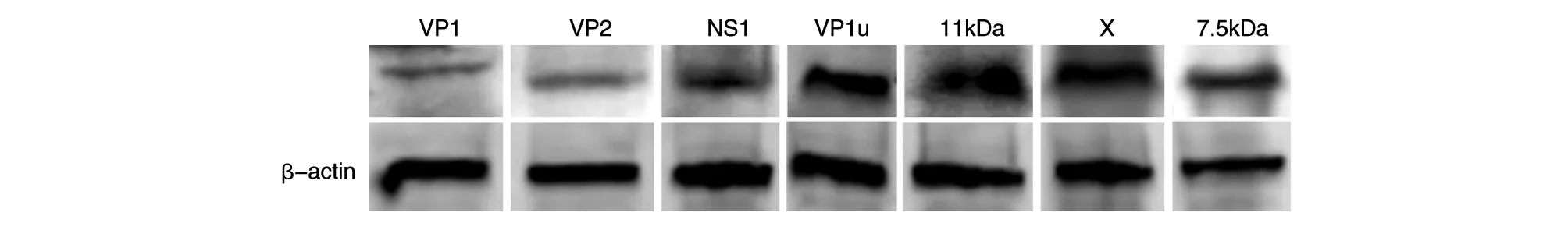
图3 重组质粒表达目的蛋白的免疫印迹
3 讨论
B19V是可经血液与血液制品传播并导致人类疾病的病原体,长期以来在输血领域受到关注。随着研究的深入,B19V表现出广谱致病性和持续性感染的特征,可造成机体多个器官/系统受累,与多种血液病、炎症性疾病甚至多种自身免疫性疾病相关,但B19V的致病机制仍不明确。加强对病毒蛋白的生物学功能研究,将有助于探讨B19V致病机制和免疫逃逸机制。
B19V结构简单,仅编码6种蛋白。结构蛋白VP1和VP2组成病毒衣壳,其中VP2占95%,是主要蛋白,对于B19病毒样颗粒(VLPs)的形成是必需的[12];VP1只占5%,为次要蛋白,单独VP1蛋白不能组装成VLPs。VP1u区暴露于病毒衣壳的外部,其线性表位能够被中和抗体所识别[13]。VP1u区具有磷脂酶A2(PLA2)基序,为病毒感染性所必需[14]。NS1是B19V最主要的非结构蛋白,具有核酸酶和解旋酶活性以及反式激活作用,在病毒复制过程中起关键作用[13]。另外,NS1蛋白还具有细胞毒性效应,可通过TNF-α激活的死亡受体途径(外源途径)诱导红系祖细胞凋亡,被认为是B19V感染引发贫血、再生障碍危象、非免疫性胎儿水肿等多种临床症状的诱因[15]。2010年,Chen等发现,在CD36+红系祖细胞中,B19V的另一小非结构蛋白11kDa起到了比NS1蛋白更主要的诱导细胞凋亡的作用[16]。但是,目前对于11kDa蛋白及另外2种小非结构蛋白(X和7.5kDa蛋白)在病毒复制、转录及其生活周期中的具体作用仍不明确。
综上所述,目前对B19V蛋白尤其是3种主要蛋白(VP1、VP2和NS1)的功能研究已取得一定进展,但3种小的非结构蛋白的功能还未完全阐明,有关B19V与宿主细胞的相互作用机理等仍有待进一步探索。本研究构建了B19V所有编码蛋白的真核表达质粒,通过免疫印迹鉴定各蛋白真核表达质粒在HEK293T细胞中均能实现表达,为深入开展B19V各蛋白功能及其在致病机制中的作用奠定了基础。
[1]Cossart Y E,Field A M,Cant B,et al.Parvoviruslike particles in human sera[J].Lancet,1975,305(7898):72-73.
[2]King A M Q,Adams M J,Carstens E B,et al.Virus taxonomy,ninth report of the International Committee on Taxonomy of Viruses[M].London:Elsevier Academ⁃ic Press,2011:412.
[3]马玉媛,贾俊婷,章金刚.血液及血液制品中人细小病毒B19的检测及其意义[J].临床输血与检验,2016,18(3):201-203.
[4]Servey J T,Reamy B V,Hodge J.Clinical presenta⁃tions of parvovirus B19 infection[J].Am Fam Physi⁃cian,2007,75(3):373-376.
[5]Young N S,Brown K E.Parvovirus B19[J].N Engl J Med,2004,350(6):586-597.
[6]Zhou Y,Bian G,Zhou Q,et al.Detection of cytomeg⁃alovirus,human parvovirus B19,and herpes simplex virus-1/2 in women with first-trimesterspontaneous abortions[J].J Med Virol,2015,87(10):1749-1753.
[7]Bihari C,Rastogi A,Rangegowda D,et al.Parvovirus B19 associated acute hepatitis and hepatosplenomegaly[J].Clin Res Hepatol Gastroenterol,2014,38(1):e9-10.
[8]Pankuweit S,Klingel K.Viral myocarditis:from experi⁃mental models to molecular diagnosis in patients[J].Heart Fail Rev,2013,18(6):683-702.
[9]Watanabe T,Kawashima H.Acute encephalitis and en⁃cephalopathy associated with human parvovirus B19 in⁃fection in children[J].World J Clin Pediatr,2015,4(4):126-134.
[10]Suzuki M,Yoto Y,Ishikawa A,et al.Acute trans⁃verse myelitis associated with human parvovirus B19 infection[J].J Child Neurol,2014,29(2):280-282.
[11]Kerr J R.The role of parvovirus B19 in the pathogen⁃esis of autoimmunity and autoimmune disease[J].J Clin Pathol,2016,69(4):279-291.
[12]Kajigaya S,Fujii H,Field A,et al.Self-assembled B19 parvovirus capsids,produced in a baculovirus sys⁃tem,are antigenically and immunogenically similar to native virions[J].Proc Natl Acad Sci USA,1991,88(11):4646-4650.
[13]Ozawa K,Young N.Characterization of capsid and noncapsid proteins of B19 parvovirus propagated in hu⁃man erythroid bone marrow cell cultures[J].J Virol,1987,61(8):2627-2630.
[14]Leisi R,Ruprecht N,Kempf C,et al.Parvovirus B19 uptake is a highly selective process controlled by VP1u,a novel determinant of viral tropism[J].J Virol,2013,87(24):13161-13167.
[15]Morita E,Nakashima A,Asao H,et al.Human parvo⁃virus B19 nonstructural protein(NS1)induces cell cy⁃cle arrest at G1 phase[J].J Virol,2003,77(5):2915-2921.
[16]Chen A Y,Zhang E Y,Guan W,et al.The small 11kDa nonstructural protein of human parvovirus B19 plays a key role in inducing apoptosis during B19 vi⁃rus infection of primary erythroid progenitor cells[J].Blood,2010,115(5):1070-1080.
Construction and Identification of Eukaryotic Expression Plasmids ofHuman parvovirusB19 Genome-Encoded Pro⁃teins
ZHONG Ya-Di,JIA Jun-Ting,FAN Rui,MA Li-Min,MA Yu-Yuan*,ZHANG Jin-Gang*
Institute of Transfusion Medicine,Academy of Military Medical Sciences,Beijing 100850,China
Objective:To construct and identify eukaryotic expression plasmid ofHuman parvovirusB19(B19V)genome-encoded proteins to support the functional research of the proteins.Methods:First of all,the coding se⁃quences of B19V proteins were amplified from B19V infectious clone pB19-M20 by PCR method using specific primers.Secondly,the amplicons were cloned into the pcDNA3.1(+)-HA-Flag vector respectively,and then the positive clones were confirmed by restriction digestion and sequencing.Finally,the constructed recombinant plas⁃mids containing the target genes were transfected into HEK293T cells,followed by Western blot analysis for target proteins expression.Results:Recombinant eukaryotic expression plasmids of B19V genome-encoded proteins were constructed and their expression was confirmed in HEK293T cells.Conclusion:Our study has laid a foundation for further exploring the function of B19V proteins and their roles in the pathogenesis of B19V associated diseas⁃es.
Human parvovirusB19;virus proteins;eukaryotic expression plasmids
Q78
A
1009-0002(2017)05-0618-05
10.3969/j.issn.1009-
*Co-corresponding authors,MA Yu-Yuan,E-mail:mayuyuan07@hotmail.com;ZHANG Jin-Gang,E-mail:zhangjg@bmi.ac.cn
2017-03-24
国家自然科学基金(81570169);北京市自然科学基金(7162147)
钟亚迪(1992- ),男,硕士研究生,(E-mail)zhongyadi101@sina.com;贾俊婷(1987- ),女,博士;二者为共同第一作者
马玉媛,(E-mail)mayuyuan07@hotmail.com;章金刚,(E-mail)zhangjg@bmi.ac.cn
