CRISPR/Cas9技术敲除水稻B R降解相关基因的研究
2017-10-24叶照楠张琳琳李飞飞刘文真
叶照楠,何 璐,张琳琳,李飞飞,刘文真
(1.浙江农林大学农业与食品科学学院,浙江 临安 311300;2.中国水稻研究所,水稻生物学国家重点实验室,浙江 富阳 311400)
CRISPR/Cas9技术敲除水稻B R降解相关基因的研究
叶照楠1,2,何 璐1,张琳琳1,李飞飞1,刘文真2
(1.浙江农林大学农业与食品科学学院,浙江 临安 311300;2.中国水稻研究所,水稻生物学国家重点实验室,浙江 富阳 311400)
油菜素内酯(BR)是一种常见的植物类激素,在植物的生长发育过程中起重要的调控作用,对水稻株型改良和抗逆性有重要作用。研究首先构建了水稻4个BR降解相关基因的CRISPR/Cas9载体;然后利用农杆菌介导法,将构建好的4个BR降解相关基因的 CRISPR/Cas9载体分别转化水稻中花11的愈伤组织,用50 mg/L的潮霉素作为筛选标记,共获得395株转基因植株。其中,有270株属于野生型,61株属于杂合子类型,64株属于突变类型;64株突变体中有39株是杂合突变体,25株是纯合突变体,纯合突变的概率为6.25%。4个基因均获得了突变材料,但不同基因的突变效率不同,其中转LW26的植株突变率高达41%。
油菜素内酯(BR)相关基因;CRISPR/Cas9系统;水稻遗传转化;靶位点鉴定
CRISPR/Cas9是最新出现的一种由RNA指导Cas9核酸酶对靶基因进行定向编辑的技术,是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。CRISPR/Cas9系统属于CRISPR系统中的Ⅱ型系统,该系统主要包含crRNA(CRISPR RNA)、tracrRNA(transactivating crRNA)和核酸内切酶Cas9。利用CRISPR/Cas9系统进行基因编辑起关键作用的是Cas9蛋白。crRNA通过碱基配对与tracrRNA结合形成双链RNA,此tracrRNA/crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶定位点切断双链DNA[1]。在基因组编辑过程中,tracrRNA和crRNA可以融合成为1条引导RNA(sgRNA)[2],具有和crRNA与tracr RNA配合使用的相同功能,但因为sgRNA的结构得到了简化,所以更方便研究者使用。CRISPR/Cas9操作简单,对基因组的效率高。要编辑某一个靶位点的时候,不用改造Cas9核酸酶,只需表达相应的sgRNA就可对任何物种的基因组进行高效率的定向编辑。
油菜素内酯(BR)是植物界广泛存在的一类植物激素[3]。研究表明,BR在植物的生长发育、细胞分裂和伸长、维管束分化、光形态发生、雄性生育能力、开花、衰老和种子萌发等过程中都起着重要作用[4]。Wu等[5]在试验中发现水稻BR缺失突变体表现为叶窄而直立、植株矮小,且产量明显增加。Qian等[6]也进一步在试验中证实缺少油菜素内酯的brd3-D突变型水稻具有较矮的株型、较高的每穗粒数与结实率。Wu等研究表明在水稻根、茎、叶中特异性过量表达BR合成基因可以得到C22-羟化酶,从而提高水稻的分蘖数、灌浆率、每穗粒数、千粒重及产量。现代农业是以大田机械化及密集种植为前提的,油菜素内酯能控制水稻节间长度,从而降低植株高度,使植株更有利于进行光合作用及机械化作业[7]。因此,缺失BR有利于改善水稻品性,提高水稻产量。
研究拟利用CRIPSR/Cas9系统定向敲除水稻基因组上BR降解相关的同源基因,首先构建了4个水稻BR降解相关基因的CRISPR/Cas9敲除载体,通过农杆菌介导法转化水稻中花11的愈伤组织,获得转CRISPR/Cas9-BR基因的T0代水稻植株。提取转基因水稻植株的DNA,进行PCR扩增和测序,与野生型序列进行比对,获得BR降解相关基因敲除的突变体植株,为突变体遗传选育以及了解4个BR降解相关基因在水稻体内的功能奠定了基础。
1 材料与方法
1.1 基因和载体
试验BR降解相关的4个同源基因分别为CYP734A2、CYP734A5、CYP734A6和CYP734A4;最终载体PC1300-Cas9(图1a)和中间载体SK-gRNA(图1b)。供试水稻品种为水稻中花11。

图1 试验所用的载体图
1.2 引物合成
每个基因设计2个敲除位的引物,如表1所示,正向引物序列加GGCA,反向互补引物序列前加AAAC。
对获得4个载体的转基因水稻进行编号,分别是LW23、LW24、LW25和LW26,设计4对引物,如表2所示。

表1 4个BR降解相关的同源基因敲除载体的引物序列
1.3 CRISPR/Cas9敲除载体构建
1.3.1 引物退火和SK-gRNA酶切将8对引物的浓度稀释到100 μmol/L,前引物和后引物各10 μL混合在一起,放入PCR仪中进行退火[8]。反应条件:95℃ 10 min,85℃ 1 min,75℃ 1 min,65℃ 1 min,55℃ 1 min,45℃ 1 min,35℃ 1 min,25℃ 1 min,最后4℃条件下保存引物。用AarⅠ酶切SK-gRNA载体体系(100 μL),37℃酶切 3 h。
1.3.2 中间载体1和2的构建首先将退火的8对引物分别与酶切后的中间载体SK-gRNA进行连接,构建成8个中间载体1。16℃条件下在PCR仪中运行4 h或者在4℃条件下(冰箱)保存过夜。8个中间载体1分别进行大肠杆菌的转化、菌液培养及质粒DNA提取。中间载体1分别编号为SKgRNA-A2-a,SKgRNA-A2-b,SKgRNA-A5-a,SKgRNA-A5-b,SKgRNA-A6-a,SKgRNA-A6-b,SKgRNA-A4-a,SKgRNA-A4-b。

表2 转基因植株突变位点的鉴定引物
用BamHⅠ0.5 μL,KpnⅠ0.5 μL酶切8个中间载体1。将酶切产物进行电泳,电泳条件为96 V,根据目标产物大小设定电泳时间,约40 min,待目标产物跑至胶体一半时即可结束电泳。电泳结束后,将琼脂糖凝胶放入凝胶成像系统中观察。
在连接反应体系[10×T4 Buffer 1μL,T4连接酶(ligise)1 μL,胶回收大片段 2 μL,胶回收小片段6 μL]下将酶切产物分别连接成为中间载体2。SKgRNA-A2-a和SKgRNA-A2-b连接产物编号为SKgRNA-A2-ab;SKgRNA-A5-a和 SKgRNA-A5-b连接产物编号为SKgRNA-A5-ab;SKgRNA-A6-a和SKgRNA-A6-b连接产物编号为SKgRNA-A6-ab;SKgRNA-A4-a和SKgRNA-A4-b连接产物编号为SKgRNA-A4-ab。16℃条件下在PCR仪中运行4 h 或者在4℃条件下(冰箱)保存过夜。
1.3.3 终载体的构建先用KpnⅠ和BglⅡ进行4个中间载体2以及最终载体PC1300-Cas9的酶切,回收酶切产物。再用T4连接酶将目的片段与PC1300-Cas9载体连接,将构建好的终载体送去测序公司测序以及酶切验证。
1.4 CRISPR/Cas9-BR降解相关基因转化水稻愈伤组织和植株再生
将含有CRISPR/Cas9-BR降解相关基因载体的农杆菌菌液培养过夜,用菌液稀释培养基R1(N6培养基+B5维生素+500 mg/L脯氨酸+300 mg/L水解酪蛋白+30 g/L蔗糖+20 mg/L乙酰丁香酮)至OD值为0.6~0.8,侵染水稻的胚性愈伤组织15 min,期间不停晃动,之后用滤纸吸干多余的菌液,放在铺有滤纸的共培养培养基R2(N6培养基+B5维生素+500 mg/L脯氨酸+300 mg/L水解酪蛋白+30 g/L蔗糖+4.0 g/Lphytalgel+20 mg/L乙酰丁香酮)上暗培养2 d,培养后的胚性愈伤组织用含有500 mg/L头孢霉素的无菌水洗2次,用滤纸吸干水分,转接抗性选择培养基R3(N6培养基+B5维生素+2 mg/L2.4-D+500 mg/L脯氨酸+300 mg/L水解酪蛋白+500 mg/L谷氨酰胺+30 g/L蔗糖+4.0 g/L phytalgel +500 mg/L头孢霉素+50 mg/L潮霉素)上筛选3次。每15 d 继代一次。3轮选择后挑取抗性愈伤组织系,进行编号,并转接在分化培养基R4(N6培养基+B5维生素+ 0.5 mg/L NAA +3 mg/L 6-BA+500 mg/L脯氨酸+300 mg/L水解酪蛋白+500 mg/L谷氨酰胺+30 g/L蔗糖+4.0 g/L phytalgel)上进行分化培养,同时提取抗性愈伤组织系的DNA,进行PCR检测,统计转化率。胚性愈伤组织出现的绿点进一步分化出不定芽,待不定芽长到2~3 cm,转接在生根培养基R5(1/2 N6培养基+1/2 B5维生素+20 g/L蔗糖+8.0 g/L琼脂)上,待苗长到10 cm,并有大量的根,移栽营养钵成活后,再移至大田成活,收种[9]。
1.5 转基因水稻植株的突变位点鉴定
转CRISPR/Cas9-BR降解相关基因的水稻植株,分别编号为LW23,LW24,LW25和LW26。其中,LW23转入CRISPR/Cas9-A2载体,LW24转入CRISPR/Cas9-A5载体,LW25转入CRISPR/Cas9-A6载体,LW26转入CRISPR/Cas9-A4载体。分别用表2的引物,对每个载体获得的100株转基因植株进行PCR扩增,对扩增出的片段测序,将检测结果与参考序列进行比对,筛选出纯合突变体、杂合突变体和野生型。
2 结果与分析
2.1 CRISPR/Cas9-BR敲除载体的酶切验证
将CRISPR/Cas9-BR终载体中的PC1300-Cas9载体用限制性内切酶KpnⅠ和BamHⅠ进行酶切,将酶切后回收的含有两个gRNA的基因片段连接到最终载体上。同时,以PC1300-Cas9空载体和中间载体2作为对照。载体PC1300-Cas9的大小约为14 633 bp,双酶切切掉的片段仅3 bp,所以空载体酶切后在电泳图上应该只会出现一条大小约为15 000 bp的条带;中间载体经双酶切后,会出现两条条带,分别为大小约3 000 bp的条带和含有2个gRNA的大小约1 000 bp的条带;终载体酶切后,也会出现两条条带,分别为大小约15 000 bp的条带和含有2个gRNA的大小约1 000 bp的条带。根据凝胶电泳结果(图2)显示,说明含有两段目的序列的基因片段确实连接到终载体中。
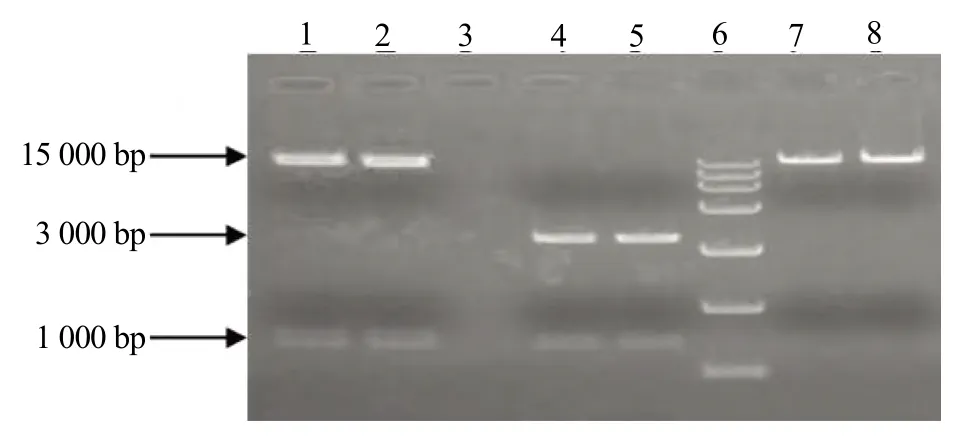
图2 PC1300-Cas9基因终载体酶切验证图
2.2 转CRISPR/Cas9-BR基因水稻植株的PCR检测结果
4个载体分别转化水稻中花11的愈伤组织,经过2个月左右,获得大量的分化绿点。在保证每个载体都能获得一些突变的前提下,为了减少后续的继代工作量,针对每个载体选取100株转基因水稻小苗进行炼苗移栽。从400株转化植株上取叶片样本,提取其基因组DNA,分别用对应的引物进行PCR扩增。图3是LW23部分样品扩增的结果,共有395个样本能扩增出对应的条带。将PCR检测结果呈阳性的DNA样本及其相对应的引物送往生物公司进行测序。

图3 LW23转基因植株的PCR检测结果
2.3 转基因水稻的突变位点鉴定
对395株转化植株DNA序列的测序结果进行分析,可以统计出转基因水稻的突变位点,如表3所示,270株为野生型,即两条染色体和参考序列一致;61株为杂合子,即一条染色体和参考序列一致,另一条发生缺失或插入的突变;64株为突变体,其中39个样本为杂合突变体,即两条染色体发了不同的突变(一条缺失,另一条插入),25个样本为纯合突变体,即两条染色体均发生了相同的突变(都是插入或者缺失)(图4)。所有材料的平均突变率为16.20%,突变率较高,但是4种材料的第二个位点均没有发生突变。
从表3中还可以看出,CRISPR/Cas 9系统定向敲除LW26材料CYP734A4基因的效率最高,在100个样本中,野生体35株,突变体41株,其中包括杂合突变体27株,纯合突变体14株。计算出突变率高达41%,纯合突变率也高达14%。转CRISPR/Cas 9-BR降解相关基因LW26这个材料突变率极高,是未来进行突变体表型分析的优秀材料。LW24第一个位点的突变率也很高,总突变率高达23%。

表3 4个材料的转化情况 (株)
3 讨 论
利用CRISPR / Cas9系统定点敲除基因在水稻基因功能研究及育种领域早有应用。Zhang 等[10]在两个水稻亚种中设计了11个靶序列,在水稻胚性细胞第一次分裂前就有接近半数完成了目的基因的编辑,说明CRISPR / Cas9系统在水稻中的应用非常高效。针对水稻抗除草剂基因BEL,Xu等[11]设计了3个不同的gRNAs,进行基因敲除,结果发现水稻植株的突变效率在2%~16%之间。中科院高彩霞实验室利用CRISPR/Cas9系统敲除了水稻和小麦2种作物的OsPDS和TaMLO等5个基因[12],其中,水稻中突变效率为4.0%~9.4%,在T0代获得了水稻纯合pds突变体,表现型为植株矮小并且白化,与预期相符[13]。首次证实CRISPR/Cas9系统能够用于植物的基因组编辑。Feng等[14]通过偏好性优化原核生物Cas9的密码子,利用35S启动子驱动Cas9进行表达,在Cas9的C端添加核定位信号,在水稻上成功的实现了Cas9系统的定点突变;首先,利用OsU6-2启动子对sgDNA进行驱动,分别构建载体,再通过农杆菌介导法转化水稻的愈伤组织,最终获得了水稻的SPP、ROC5与YSA3个基因的定点突变。还有研究表明,利用CRISPR/Cas9系统来转化水稻的愈伤组织,发现了OsBADH2基因的突变率为7.1%,OsPDS-SP1基因的突变率为9.4%,转化原生质体之后,有3个水稻基因(OsBADH2、OsMPK2以及Os02g23823)和一个小麦基因TaMLO,它们的突变率为26.5%~38%[15]。总体来看,CRISPR/Cas9系统可以对水稻进行基因序列的无选择性编辑,有效地提高了研究效率,能够通过基因序列的准确编辑,更加快速地获得具有优良性状的新品种。
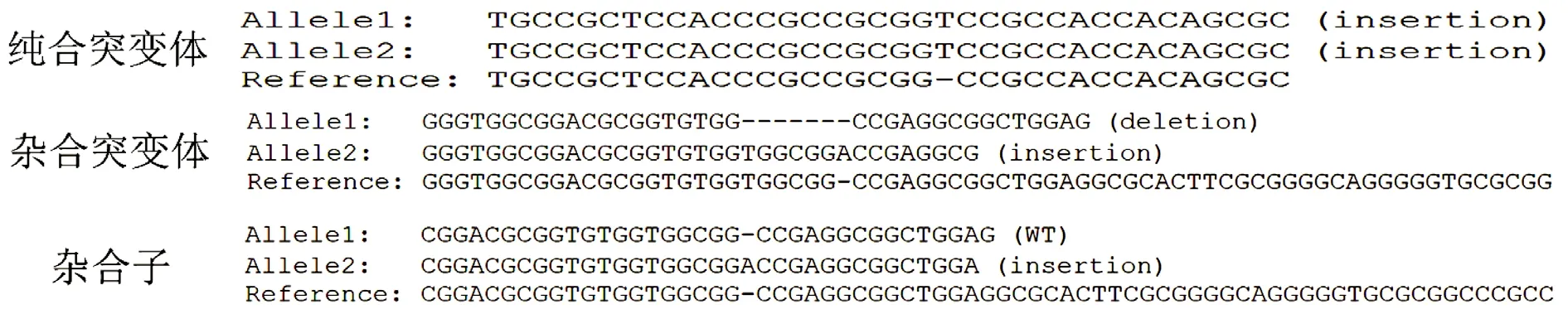
图4 DNA测序发现的突变位点
利用水稻转基因技术,该研究成功获得转CRISPR/Cas9-BR降解相关基因的水稻,其中转基因材料LW26,基因发生的突变率高达41%,说明利用CRISPR / Cas9成功获得敲除水稻基因的突变体植株,为未来进行突变体功能验证提供了材料。对此突变体的试验预期结果为BR降解相关基因功能丧失,油菜素内酯在水稻体内大量积累。另外,从纯合的转CRISPR/Cas9-BR降解相关基因突变体的表型上看,与野生型发生了一些较为明显的区别,主要有叶夹角变大,种子变大等。另外,转CRISPR/Cas9-BR基因突变体水稻在产量相关的表型上的变化,如千粒重、每穗粒重,每株穗数、株高、分蘖数等也是今后表型分析的重点研究方向[16]。
4 结 论
该研究将水稻BR降解相关基因的4个同源基因CYP734A2、CYP734A5、CYP734A6和 CYP734A6分别设置了2个敲除位点,通过限制性内切酶KpnⅠ、BglⅡ和BamHⅠ,进行3次连接反应,2次酶切反应,经过中间载体SK-gRNA,最终将这4个同源基因的靶序列构建到终载体PC1300-Cas9中,用于转化水稻植株。通过PCR扩增技术结合测序结果分析,在395株PCR检测呈阳性的水稻转化植株中,得到25株转CRISPR/Cas 9-BR基因的纯合突变体。同时,筛选到转CRISPR/Cas 9-BR降解相关基因突变效率极高的水稻材料LW26。得到了14株纯合突变体和27株杂合突变体,为下一步进行突变体表型分析提供了有力的理论依据,为今后探究BR基因在水稻中的功能奠定了基础。
[1] 左其生,李 东. CRISPR/Cas9介导的基因编辑工具[J]. 生物技术通报,2014,(7):37-43.
[2] Bland C,Ramsey T L,Sabree F,et al. CRISPR recognition tool(CRT):a tool for automatic detection of clustered regularly interspaced palindromic repeats[J]. BMC bioinformatics,2007,8(1):209-216.
[3] Richter H,Randau L,Plagens A. Exploiting CRISPR/Cas:Interference mechanisms and applications[J]. International journal of molecular sciences,2013,14(7):14518-14531.
[4] Bajguz A. Brassinosteroids-occurence and chemical structures in plants[M]. Brassinosteroids:A Class of Plant Hormone. Springer Netherlands,2011.
[5] Wu C Y,Pennell R I. Brassinosteroids regulate grain filling in rice[J].Plant Cell,2008,20(8):2130-2145.
[6] Qian W J,Wu C,Fu Y P,et al. Novel rice mutants overexpressing the brassinosteroid catabolic gene CYP734A4[J]. Plant Molecular Biology,2016,93(1-2):197-208.
[7] 颜 雯,李海涛. CRISPR-Cas基因组改造技术研究进展[J]. 广东农业科学,2014,(2):149-152.
[8] Dicarlo J E,Norville J E,Mali P,et al. Genome engineer in Saccharomyces cerevisiae using CRISPR-Cas systems[J]. Nucleic Acids Research,2013,41(7):4336-4343.
[9] 徐云姬,黄钻华,王志琴,等. 油菜素甾醇类化合物在水稻生长发育及抗逆中的研究进展[J]. 中国农学通报,2012,28(9):1-5.
[10] Zhang H,Zhang J,Wei P,et al. The CRISPR/Cas9 system produces specific and homozygous targeted gene editing in rice in one generation[J]. Plant biotechnology journal,2014,12(6):797-807.
[11] Xu R F,Li H,Qin R Y,et al. Gene targeting using the Agrobacterium tumefaciens-mediated CRISPR-Cas system in rice[J]. Rice,2014,7(1):5-8.
[12] Hyun Y,Kim J,Cho S W,et al. Site-directed mutagenesis in Arabidopsis thaliana using dividing tissue-targeted RGEN of the CRISPR/Cas system to generate heritable null alleles[J]. Planta,2015,241:271-284.
[13] 刘志国. CRISPR/Cas9系统基因组编辑的研究进展[J]. 畜牧兽医学报,2014,45(10):1567-1583.
[14] Feng Z Y, Zhang B T, Ding W N,et al. Efficient genome editing in plants using a CRISPR/Cas system[J]. Cell Rearch,2013,23(10):1229-1232.
[15] Shan Q W,Wang Y,Li J,et al. Targeted genome modification of crop plants using a CRISPR/Cas system[J]. Nat Biotechnol,2013,31(8):686-688.
[16] 李 君,张 毅. CRISPR/Cas9系统:RNA靶向的基因组定向编辑新技术[J]. 遗传,2013,35(11):1265-1273.
Rice (Oryza sativa) BR Degradation Related Genes Knockout by CRISPR/Cas9 Technology
YE Zhao-nan1,2,HE Lu1,ZHANG Lin-lin1,LI Fei-fei1,LIU Wen-zhen2
(1. Zhejiang Agriculture and Forestry University, Lin’an 311300, PRC; 2. National Key Laboratory of Rice Biology, China National Rice Research Institute, Fuyang 311400, PRC)
Brassinolide (BR) as a common plant hormone plays an important regulation role in the growth and development of plants, especially in the rice plant type improvement and stress resistance. In this study, CRISPR/Cas9 knockout carriers of four rice BR degradation related genes were constructed, then the carriers of the four genes were transformed into rice (Oryza sativa L.) via Agrobacterium tumefaciens-mediated genetic transformation of rice variety Zhonghua 11 callus, and 395 transgenic plants were obtained after the callus was screened, each carrier with 50 mg/L hygromycin as a screening marker; and PCR product was amplified with the primers on both sides of the target site and sequenced. The results showed that the 395 transgenic plants included 270 plants belonging to wild type, 61 to heterozygote type and 64 to mutant type. Of the 64 mutants, 39 were heterozygous mutants and 25 were homozygous mutants, and the frequency of homozygous mutation is 6.25%. The mutant alleles were found in all the four genes, but the mutation efficiencies of different genes were different; and among them, the mutation frequency of the LW26 transgenic plants was 41%. These transgenic plants could be used as a foundation for the breeding of homozygous progeny and the identification of mutation expression in the future.
rice; BR related gene; CRISPR/Cas9 system; genetic transformation; target site identification
Q943.2
A
1006-060X(2017)09-0001-05
10.16498/j.cnki.hnnykx.2017.009.001
2017-07-10
国家自然科学基金青年基金(31401461);2016年浙江农林大学校级教改项目(KG16001);2017年浙江农林大学学生科研训练项目(113-2013200060)
叶照楠(1996-),女,浙江台州市人,本科生,农学专业。
李飞飞,刘文真
(责任编辑:成 平)
