β-葡萄糖苷酶生产菌筛选及酶学特性
2017-10-24刘文龙王兴吉盛花开曹世源
刘文龙,王兴吉,盛花开,曹世源
(山东隆科特酶制剂有限公司,山东 临沂 276400)
β-葡萄糖苷酶生产菌筛选及酶学特性
刘文龙,王兴吉,盛花开,曹世源
(山东隆科特酶制剂有限公司,山东 临沂 276400)
以黑曲霉(Aspergillus niger)AN为出发菌株,通过亚硝基胍(NTG)诱变方法获得了一株高产β-葡萄糖苷酶的突变株AN-17。该黑曲霉突变株AN-17在摇瓶中的β-葡萄糖苷酶酶活>291 U/mL,且传代发酵稳定性良好。所产β-葡萄糖苷酶对葡萄糖有良好的耐受性,在葡萄糖含量18%条件下相对酶活为95%;且该酶耐酸耐热性良好,在pH3.0~6.5条件下处理1 h或75℃保温处理40 min后,相对酶活>70%。
黑曲霉;β-葡萄糖苷酶;亚硝基胍诱变;耐糖;耐酸
β-葡萄糖苷酶(β-glucosidase)又称β-D-葡萄糖苷葡萄糖水解酶。其属于纤维素酶类,能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[1]。β-葡萄糖苷酶存在于自然界许多植物、昆虫、真菌及细菌体内,在纤维素降解[2]、食品去苦增香[3]、果酒增香[4]、医药[5]、病虫害防治[6]等方面有广泛应用,另外在生产大豆异黄酮活性苷元[7]、天然栀子蓝[8]、表面活性剂[9]等方面也有应用。
黑曲霉(Aspergillusniger)是常见的食品安全菌种,所产的β-葡萄糖苷酶在食品、医药等领域中有很好的发展前景。以黑曲霉AN为出发菌株,通过亚硝基胍(nitroso-guanidin,NTG)诱变获得黑曲霉β-葡萄糖苷酶突变株,以期能够筛选得到高产菌株,并且获得性能良好的β-葡萄糖苷酶,以提高其应用价值。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
黑曲霉(Aspergillus niger)AN:本公司研发中心实验室保存。
1.1.2 培养基
初筛培养基:葡萄糖0.3%,纤维糖粉0.5%,蛋白胨0.08%,KH2PO40.2%,MgSO4·7H2O 0.02%,FeSO4·7H2O 0.001%,脱氧胆酸钠0.1%,琼脂0.15%,冷却后加入0.1%对硝基苯基-β-D-葡萄糖苷(p-nitrophenyl-β-D-galactopyranoside,p-NPG),pH自然。
复筛发酵培养基:葡萄糖2%,纤维糖粉1%,玉米浆1%,KH2PO40.2%,MgSO4·7H2O 0.02%,FeSO4·7H2O0.001%,pH自然。
斜面培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。
1.1.3 试剂及原料
蛋白胨:北京奥博星生物技术有限责任公司;亚硝基胍、对硝基苯葡萄糖苷(分析纯):美国Sigma公司。其他均为国药集团分析纯试剂。
1.2 仪器与设备
ZWY-211C恒温摇床、ZXSD-AI270恒温培养箱、ZHJHCI214B超净工作台:智城分析仪器有限公司;GI80TW高压蒸汽灭菌锅:致微仪器有限公司;HH-2恒温水浴锅:上海梅香仪器有限公司;FA2004B电子天平:上海精科天美科学仪器有限公司;5810R型离心机:德国Eppendorf公司。
1.3 方法
1.3.1 诱变筛选方法
(1)孢子悬液的制备
取无菌生理盐水洗下黑曲霉AN新鲜斜面上的孢子,将其转移入盛有玻璃珠的三角瓶,在摇床上振荡打散40min,制成菌悬液,四层擦镜纸过滤,并进行梯度稀释,于血球计数板计数并调整孢子浓度为106个/mL左右[10]。
(2)亚硝基胍诱变[11]
诱变剂量选择[12]:用处理好的孢子悬浮液,分别以亚硝基胍溶液终质量浓度为0.2mg/mL、0.4mg/mL、0.6mg/mL、0.8mg/mL、1.0mg/mL的体系对孢子菌悬液诱变处理60min,吸取处理后的孢子悬浮液涂布于PDA培养平板上,30℃培养2~3 d,计算致死率,以选择合适的亚硝基胍处理液质量浓度。
诱变处理:根据上述方法选择出的诱变剂量对黑曲霉孢子悬浮液进行亚硝基胍诱变处理,处理后的孢子悬液涂初筛平板。
(3)初筛
初筛培养基冷却至60℃后,加入0.1%p-NPG,将诱变处理的孢子悬液涂布在初筛培养平板上,30℃培养2~4 d,p-NPG被酶解后会产生对硝基苯酚(p-nitrophenol,p-NP),喷洒1 mol/L的Na2CO3后显淡黄色,挑选其中黄色较深圈较大的菌落进一步筛选[13]。
(4)复筛
初筛挑选的菌落接种于装有30 mL复筛液体发酵培养基的三角瓶中。30℃、200 r/min培养2~4 d,测β-葡萄糖苷酶酶活。
1.3.2 遗传稳定性[14]
对突变株进行连续传代发酵,30℃、200 r/min培养传代8次,测定每一代的β-葡萄糖苷酶酶活,每代设置至少三个平行样,判断其遗传稳定性。
1.3.3 β-葡萄糖苷酶的葡萄糖耐受性、热稳定性、pH稳定性
以发酵液上清液为样品,分别在反应体系中添加含量0~20%的葡萄糖,测定β-葡萄糖苷酶活力。
以发酵液上清液为样品,在pH4.8缓冲液条件下,样品分别在60~85℃条件下(梯度为5℃)保温处理70 min,每10min取样测定剩余β-葡萄糖苷酶酶活,以不作处理的β-葡萄糖苷酶酶活为100%。
以发酵液上清液为样品,在50℃条件下,分别在pH 2.0~9.0的缓冲液中处理1 h,然后测定β-葡萄糖苷酶活力,以不作处理的样品酶活为100%。
1.3.4 β-葡萄糖苷酶酶活测定[15]
酶活定义:每分钟释放出1 μmol p-NP所需的酶量为一个酶活力单位(U)。
测定方法:发酵液3 000 r/min离心10 min,得上清液为粗酶液,准确吸取0.1 mL粗酶液,加入0.9 mL磷酸氢二钠-柠檬酸缓冲液(pH4.8),50℃恒温水浴锅预热5 min,加入1 mL预热的5 mmol/L的p-NPG,秒表计时50℃反应10 min,立即加入1 mL 1 mol/L的碳酸钠溶液终止反应。在波长420 nm处测定吸光度值。
2 结果与分析
2.1 诱变方法的确定

表1 不同NTG诱变剂量对菌株的致死率Table 1 Lethality rate of strains induced by different NTG doses
从表1可看出,随着亚硝基胍诱变剂量的增加,黑曲霉存活率下降,诱变剂量0.8 mg/mL时,致死率达到97.8%,剂量达到1.0 mg/mL时,致死率达到100%。通常致死率为90%~99%时,正向突变的突变株较多。因此选择0.8mg/mL亚硝基胍诱变剂量。
2.2 菌株筛选
根据初筛结果,选取14株黄色较深圈较大的菌落,进行发酵摇瓶复筛,经过3批摇瓶发酵试验,筛选产酶较高的菌株,结果见表2。

表2 NTG诱变复筛的结果Table 2 Secondary screening results of NTG mutagenesis
由表2可知,突变株AN-17的β-葡萄糖苷酶酶活最高,在复筛培养基中可达到291.2 U/mL。
2.3 遗传稳定性
选取产β-葡萄糖苷酶酶活最高的菌株AN-17,传代8次,进行稳定性研究,结果见表3。

表3 突变株AN-17发酵稳定性Table 3 Fermentation stability of mutant strain AN-17
由表3可知,连续传8代,酶活并没有降低,因此确定突变株AN-17具有良好的遗传稳定性,可以用于进一步优化中。
2.4 β-葡萄糖苷酶的葡萄糖耐受性、热稳定性、pH稳定性
2.4.1 β-葡萄糖苷酶的葡萄糖耐受性
由图1可知,在葡萄糖含量<16%时对酶活有增强作用,可能是葡萄糖使β-葡萄糖苷酶作用位点发生改变[16],使酶活增强,在葡萄糖含量为18%时,相对酶活为95%,说明突变株AN-17所产β-葡萄糖苷酶具有较高的葡萄糖耐受性。

图1 β-葡萄糖苷酶的葡萄糖耐受性曲线Fig.1 Glucose tolerance curve of β-glucosidase
2.4.2 β-葡萄糖苷酶的热稳定性
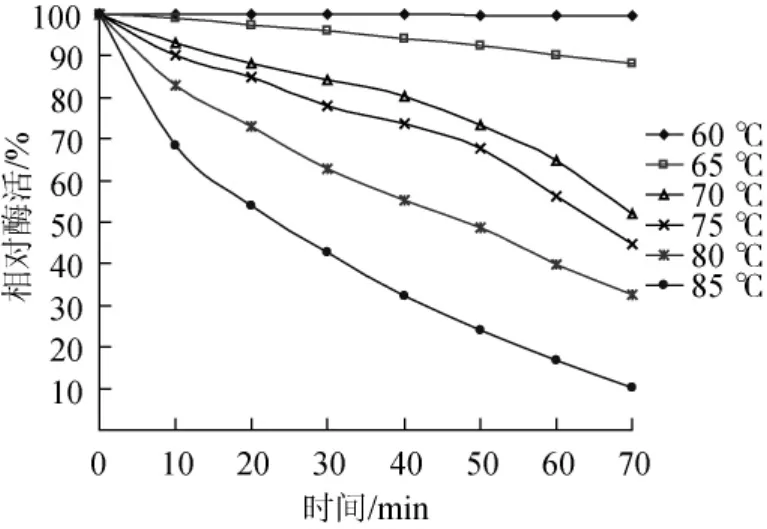
图2 β-葡萄糖苷酶的热稳定性曲线Fig.2 Thermal stability curves of β-glucosidase
由图2可知,60℃条件下其酶活基本没有降低,65℃稍有下降,75℃处理40min时,该酶相对酶活仍为70%以上,85℃处理20 min相对酶活仍有53%左右,说明该β-葡萄糖苷酶具有较好的热稳定性。
2.4.3 β-葡萄糖苷酶的pH稳定性

图3 β-葡萄糖苷酶的pH稳定性Fig.3 pH stability of β-glucosidase
由图3可知,在pH 3.0~6.5条件下处理1 h相对酶活仍保留70%以上,具有较好的耐酸性,但是在pH<3.0或pH>7.0的条件下,相对酶活较低。
3 结论
本研究通过NTG诱变方法获得了一株高产β-葡萄糖苷酶的黑曲霉突变株AN-17,并对所产β-葡萄糖苷酶的性质进行了研究。结果表明,该黑曲霉突变株AN-17在摇瓶发酵中的β-葡萄糖苷酶酶活在291 U/mL以上,且连续传8代,酶活并没有降低,遗传稳定性良好。该突变株所产β-葡萄糖苷酶对葡萄糖有良好的耐受性,在葡萄糖含量18%条件下,相对酶活为95%;该酶耐酸耐热性良好,在pH3.0~6.5条件下处理1h或75℃保温处理40min后,相对酶活>70%。鉴于该黑曲霉突变株AN-17及所产β-葡萄糖苷酶的良好特性,可进一步进行优化,并用于生产放大。
[1]潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-807.
[2]SALOHEIMO M,PANULA J K,YLOSMAKI E,et al.Enzymatic properties and intracellular localization of the novelTrichoderma reesei β-glucosidase BGLII(Cel1A)[J].Appl Environ Microbiol,2002,68(9):4546-4553.
[3]李 平,宛晓春,陶文沂,等.黑曲霉β-葡萄糖苷酶的食品增香应用[J].食品与发酵工业,2000,26(2):5-6.
[4]桑 苇.黑曲霉β-葡萄糖苷酶对葡萄酒酶解增香调控及风味物质影响的研究[D].无锡:江南大学,2015.
[5]鲁 玮,岳冬冬,刘新育,等.黑曲霉产β-葡萄糖苷酶的纯化及对中药糖苷类成分的转化[J].中国医药工业杂志,2014,45(3):220-223.
[6]王 晓,沈程文,周跃斌.β-葡萄糖苷酶与茶增香及抗病虫害的研究进展[J].茶叶通讯,2014,41(4):8-12.
[7]Y H PYO,T C LEE,Y C LEE.Enrichment of bioactive isoflavones in soymilk fermented with β-glucosidase-producing lactic acid bacteria[J].Food Res Int,2005,38:551-559.
[8]FUJIKKAWA.Skyblue pigment formation from gardenia fruits[J].J Ferment Technol,1987,65(4):419-424.
[9]T R YAN,J C LIAU.Synthesis of alkyl β-glucosides from cellobiose withAspergillus nigerβ-glucosidaseⅡ[J].Biotechnol Lett,1998,20(7):653-657.
[10]佘秋生,杨海波,杨冠军,等.紫外诱变黑曲霉筛选高产果胶酶菌种[J].中国酿造,2012,31(6):134-137.
[11]赵 鑫,肖玉平,廖延智,等.L-精氨酸高产菌株的亚硝基胍诱变选育和种子培养基的优化研究[J].中国酿造,2014,33(9):81-85.
[12]李 宁,马莉岷,战伟超,等.富产琥珀酸米曲霉菌株的诱变选育[J].中国酿造,2015,34(1):72-75.
[13]侯晓瑞,王 婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[14]辛国芹,董佩佩,汪祥燕,等.产葡萄糖氧化酶菌株的诱变筛选及遗传稳定性研究[J].中国酿造,2016,35(11):69-72.
[15]李 华,高 丽.β-葡萄糖苷酶活性测定方法的研究进展[J].食品与生物技术学报,2007,26(2):107-114.
[16]张 敏,李佳益,倪永清,等.产β-葡萄糖苷酶非酿酒酵母的筛选及酶学特性研究[J].中国酿造,2016,35(5):97-101.
Screening of β-glucosidase-producing strain and the enzymatic characteristic
LIU Wenlong,WANG Xingji,SHENG Huakai,CAO Shiyuan
(Shandong Long Kete Enzyme Co.,Ltd.,Linyi 276400,China)
UsingAspergillus nigerAN as original strain,mutant strain AN-17 with high yield β-glucosidase was obtained by nitrosoguanidine(NTG)mutagenesis.The β-glucosidase activity ofA.nigerAN-17 in shake flask was above 291 U/ml,and its generation fermentation stability was good.The β-glucosidase had good tolerance to glucose,the relative activity retained 95%in 18%glucose concentration.The β-glucosidase had good acid and heat resistance;the relative activity remained above 70%under the treatment condition of pH 3.0-6.5 for 1 h or 75℃for 40 min.
Aspergillus niger;β-glucosidase;nitroso-guanidine mutagenesis;glucose tolerance;acid tolerance
TQ925
0254-5071(2017)09-0120-03
10.11882/j.issn.0254-5071.2017.09.026
2017-07-06
山东省技术创新项目(201520515022)
刘文龙(1982-),男,工程师,硕士,研究方向为酶制剂生产与开发。
