产水解银杏黄酮苷的β-葡萄糖苷酶菌株的筛选及鉴定
2017-10-24朱啟会高泽鑫何腊平李翠芹张富豪
朱啟会,高泽鑫,何腊平,2*,高 冰,李翠芹,熊 江,张富豪
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025;3.湖北工业大学 生物工程与食品学院,湖北 武汉 430068;4.贵州大学 化学与化工学院贵州 贵阳 550025)
产水解银杏黄酮苷的β-葡萄糖苷酶菌株的筛选及鉴定
朱啟会1,高泽鑫1,何腊平1,2*,高 冰3,李翠芹4,熊 江1,张富豪1
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025;3.湖北工业大学 生物工程与食品学院,湖北 武汉 430068;4.贵州大学 化学与化工学院贵州 贵阳 550025)
以银杏提取物为唯一碳源,利用栀子苷-谷氨酸钠显色法,从贵州银杏树土壤样品中分离产水解银杏黄酮苷的β-葡萄糖苷酶菌株。采用3,5-二硝基水杨酸(DNS)法测定β-葡萄糖苷酶酶活。得到一株酶活为1.03 U/mL的菌株NY-13,并且该菌株能水解芦丁生成槲皮素。经生理生化特征及16S rRNA分子生物学鉴定,菌株NY-13为解鸟氨酸柔武氏菌(Raoultella ornithinolytica)。
β-葡萄糖苷酶;银杏黄酮苷;筛选鉴定;解鸟氨酸柔武氏菌
银杏叶(Ginkgo bi1obaL.)提取物中的黄酮类物质主要是以黄酮糖苷的形式存在,占银杏叶提取物总含量的22%~24%[1]。主要是由山奈酚、槲皮素以及异鼠李素等黄酮苷元与葡萄糖等单糖以O-糖苷键连接而成,以糖苷键形式存在的黄酮占到提取物黄酮总含量的95%[2]。银杏黄酮类物质是治疗心血管疾病的天然药物[3],具有降低全血黏稠度、扩张血管、增加血流量、抗氧化等作用[4-5],除此之外,银杏黄酮类物质在防治青光眼、糖尿病,抗癌、抗菌、抗衰老等方面也有显著的效果[6-7]。由于银杏黄酮大部分以糖苷形式存在,少部分以苷元型黄酮形式存在,不易被肠道吸收,难以达到疗效。经体外抗自由基氧化实验研究发现,黄酮苷元清除自由基的能力比黄酮苷强,苷元抗氧化能力也明显优于黄酮苷。因此,将黄酮苷转化为黄酮苷元的研究吸引了多数人的目光。
β-葡萄糖苷酶能参与水解黄酮苷类化合物的各种糖苷键,能水解O-糖苷以及C-糖苷,生成黄酮苷元被大肠直接吸收[8]。β-葡萄糖苷酶广泛存在于真菌、细菌和植物中,来源广泛。伍毅等[3]采用固定商业β-葡萄糖苷酶水解银杏黄酮苷,取得了较好结果。但是,利用非商业β-葡萄糖苷酶水解银杏黄酮苷还极少见报道。由于商业β-葡萄糖苷酶价格昂贵,因此,本发明选择自己筛选产水解银杏黄酮的β-葡萄糖苷酶的菌株,为银杏黄酮苷元的工业化生产奠定基础,降低转化成本。大量掉落的银杏叶被土壤中的微生物分解利用,可认为土壤中含有产β-葡萄糖苷酶且能生物利用银杏黄酮的微生物。本研究主要从银杏树下的土壤中分离筛选出能生物利用银杏黄酮苷高产β-葡萄糖苷酶的菌株,并利用该菌株转化银杏黄酮苷生成利于吸收的黄酮苷元,以期为工业化发酵生产银杏黄酮苷元提供有利条件。
1 材料与方法
1.1 材料与试剂
土壤样品:贵州大学南校区银杏树下土壤。
种子培养基:硫酸铵2g/L,硫酸镁0.5g/L,氯化钠2 g/L,碳酸钙2 g/L,磷酸二氢钾0.5 g/L,银杏叶提取物5 g/L。
筛选培养基:银杏叶提取物5 g/L,琼脂20 g/L,硫酸镁0.5 g/L,磷酸二氢钾10 g/L,栀子苷0.1 g/L,谷氨酸钠10 g/L,硫酸铵2 g/L。
发酵培养基:酵母提取物5 g/L,蛋白胨10 g/L,葡萄糖10 g/L。
银杏提取物:西安瑞盈生物有限公司;谷氨酸钠(分析纯):索莱宝生物科技有限公司;水杨苷:西安欣禄生物科技有限公司;葡萄糖(分析纯):上海国药集团;芦丁标准品(色谱纯):上海源叶生物有限公司;甲醇(色谱纯):天津市富宇精细化工有限公司;甲酸(色谱纯):上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-10超净工作台:苏州净化有限公司;LS-B75L立式压力蒸汽灭菌器:江阴滨江医疗设备有限公司;101-1ASB电热鼓风干燥箱:北京科伟永兴仪器有限公司;DW-86L286立式超低温保存箱:青岛海尔特种电器有限公司;CX21SF1奥林巴斯生物显微镜:奥林巴斯(中国)有限公司;TU-1810PC紫外可见分光光度计:北京普析通用仪器有限公司;pHS-3C pH计:成都世纪方舟科技有限公司;1260型高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦有限公司。
1.3 实验方法
1.3.1 菌株初筛
称取5 g土壤样品,加入45 mL灭菌备用的种子培养基中,30℃、180 r/min振荡培养24 h;取上清液用0.85%生理盐水稀释,分别取10-3~10-8梯度的稀释液200 μL涂布于筛选培养基上,分别于28℃和37℃培养48 h后,挑选蓝色菌圈较大、颜色较深的单菌落进行纯化培养。经革兰氏染色镜检为单一菌种后,斜面保藏和甘油保藏备用。
1.3.2 菌株复筛
挑取一环斜面保藏的初筛菌株接入种子培养基中,30℃、180 r/min培养24 h,按照8%的接种量接入揺瓶发酵培养基中,30℃、180 r/min培养48 h,测定发酵液酶活,筛选产酶最高菌株。
1.3.3 β-葡萄糖苷酶酶活力测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[9-10]测定β-葡萄糖苷酶酶活力:发酵液经细胞破碎后,8 000 r/min、4℃离心10 min,取上清液为粗酶液。取15 mL具塞刻度试管加入底物(1%水杨苷)1.8mL,50℃预热3min,加入粗酶液0.2 mL,50℃水浴30 min,加入DNS试剂3 mL,沸水浴10min,冷却至室温,定容至15mL。以灭活的酶液为空白对照,于波长540 nm处测定吸光度值。根据葡萄糖标准溶液回归方程计算粗酶液中葡萄糖质量浓度。
酶活力单位定义:在测定条件下,每分钟水解水杨苷产生1 μmol还原糖(以葡萄糖计)所需酶量定义为一个酶活力单位(U/mL)。
葡萄糖标准曲线的绘制:吸取1 mg/mL葡萄糖溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于具塞刻度试管中,补水至2 mL,加DNS试剂3 mL,混合后于沸水中煮10 min,冷却后加水定容至15 mL,于波长540 nm处测吸光度值。以吸光度值(y)为纵坐标,葡萄糖质量浓度(x)为横坐标,绘制葡萄糖标准曲线,获得线性回归方程为:y=0.465x-0.004,相关系数R2=0.999。
1.3.4 银杏黄酮苷生物转化
粗酶液制备:从斜面培养基上挑取2环菌种,接种于装液量为50 mL/250 mL的种子培养基中,30℃、180 r/min振荡培养24 h,按8%接种量接种于发酵产酶培养基中,30℃、180r/min振荡培养48h,发酵液经细胞破碎后,4℃、8000r/min离心10 min,取上清液为粗酶液。
银杏黄酮苷生物转化:取粗酶液9 mL,加入1 mL 0.34 mg/mL的芦丁标准品溶液,50℃、180 r/min摇床振荡转化4 h,经0.45 μm膜过滤后用HPLC检测转化结果。
银杏黄酮苷高效液相色谱检测条件[11]:以1%甲酸(A)和甲醇(B)为流动相进行梯度洗脱,洗脱顺序如表1所示,流速0.5mL/min,进样量5μL,柱温30℃,检测波长360 nm,WatersC18反相色谱柱(4μm,3.9mm×150 mm)。

表1 梯度洗脱程序Table 1 Gradient elution program
1.3.5 菌株形态特征及生理生化试验
对获得的可产水解银杏黄酮苷的β-葡萄糖苷酶的菌株进行形态及培养特征观察,依据《伯杰细菌鉴定手册》对菌种进行生理生化特征的测定,观察并记录结果[12]。
1.3.6 16S rRNA分子生物学鉴定
DNA提取:从斜面中直接挑取一环菌,加入100 μL无菌水中,混匀后,沸水浴2 min,12 000 r/min离心5 min,取上清液用于聚合酶链反应(polymerase chain reaction,PCR)扩增。
反应体系:扩增反应体积50 μL,5×PCR buffer 5 μL;2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2μL;Taq酶0.4μL,模板1μL;10μmol/L正向引物和反向引物各1 μL;加双蒸水至50 μL。
扩增条件:95℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸2 min,共进行29个循环。
PCR产物检测:扩增反应完毕后,取产物与加样缓冲液混合,用微量移液器将样品加入到预先制备0.8%的琼脂糖凝胶的加样孔中进行电泳,电泳完后在紫外检测仪下观察。
序列分析:使用BLAST在GeneBank数据库中进行同源性搜索。从GeneBank中选择近缘菌株的部分菌的基因序列,采用生物学软件MEGA5.0构建系统进化树,从而确定菌株的分类地位及亲缘关系。
2 结果与分析
2.1 菌株筛选结果
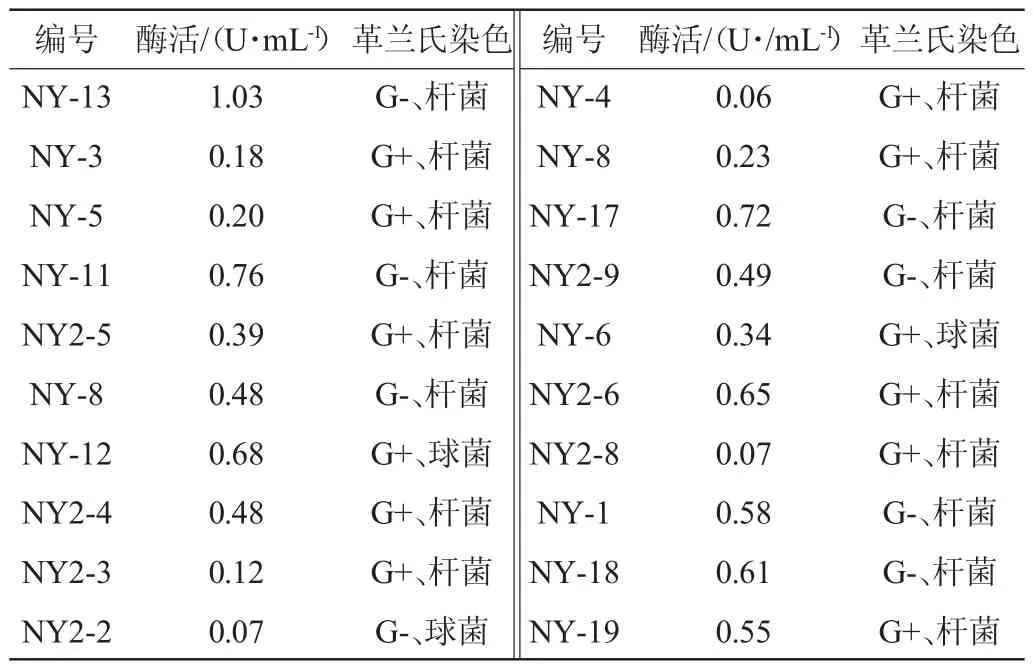
表2 初筛菌株的β-葡萄糖苷酶酶活及菌落形态Table 2 β-glucosidase activity and colony morphology of the preliminary screening strains

图1 筛选菌株菌落形态(A)和菌体特征(B)Fig.1 Colony morphology(A)and bacteria characteristics(B)of screened strain
利用微生物产β-葡萄糖苷酶水解培养基中的栀子苷产生栀子苷元,与谷氨酸钠结合形成蓝色栀子苷蓝[13-14],共从银杏树下土壤样品中筛选出20株具有蓝色菌圈的菌株,用DNS法测定20株菌的β-葡萄糖苷酶酶活力,结果见表2。由表2可知,其中酶活最高的为菌株NY-13(1.03 U/mL),在筛选培养基上培养48 h后可产生较大蓝色菌圈,菌落呈白色,湿润,革兰氏阴性杆菌(见图1)。为进一步确定菌株对银杏黄酮苷的生物利用情况,选择菌株NY-13进行下一步银杏黄酮苷的生物转化试验。
2.2 银杏黄酮苷生物转化
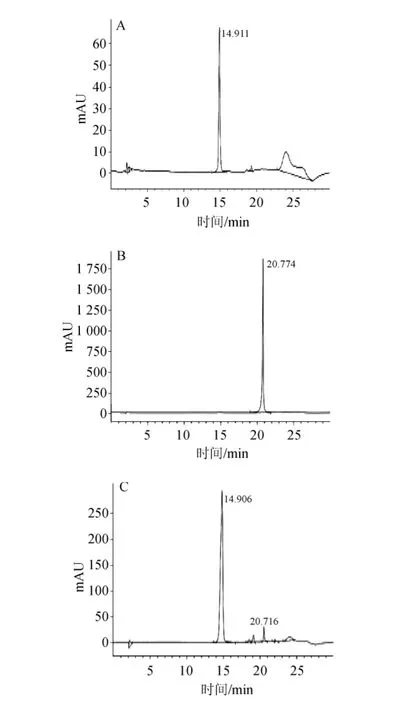
图2 芦丁标准品(A)、槲皮素标准品(B)和菌株NY-13粗酶液转化芦丁(C)高效液相色谱图Fig.2 HPLC chromatogram of rutin standard(A),quercetin standard(B)and rutin transformed by crude enzyme solution of strain NY-13(C)
按照1.3.4方法进行银杏黄酮苷转化,并用高效液相色谱仪检测其转化结果。用酸水解银杏黄酮苷可水解所有的糖苷键生成黄酮苷元,但是由于酸解条件激烈且酸对环境有一定的影响,其酸解产物在用于食品或保健品时对产物的安全性和稳定性有一定的考虑;而且酸解破坏了银杏叶提取物中的其他活性成分。采用酶水解银杏黄酮苷反应条件温和,安全性高,产物较稳定。为方便观察菌株对银杏黄酮苷的转化结果,这里选择银杏黄酮中的主要成分之一芦丁标准品为水解底物,检测β-葡萄糖苷酶对银杏黄酮苷的水解作用。菌株NY-13粗酶液转化芦丁结果如图2所示。由图2A可知,芦丁标准品的出峰时间为14.911 min,由图2B可知,槲皮素标准品的出峰时间为20.774 min,由图2C可知,在20.716 min有色谱峰出现,表明菌株NY-13的粗酶液可转化芦丁生成槲皮素。
2.3 菌株鉴定
2.3.1 生理生化特性
依据《伯杰细菌鉴定手册》对菌种进行生理生化特征的测定,菌株NY-13生理生化特征见表3。由表3可知,菌株NY-13吲哚试验、柠檬酸盐利用、尿素分解为阳性反应,H2S产气及明胶分解呈阴性反应,与郑艳等[15]筛选的土生拉乌尔菌生理生化试验一致。菌株NY-13可水解利用七叶灵、麦芽糖、蔗糖、纤维二糖、熊果苷、L-阿拉伯糖等物质,不能水解利用苦杏仁苷、D-阿拉伯糖等化合物,可见菌株NY-13可水解部分糖苷键。

表3 菌株NY-13生理生化特性Table 3 Strain NY-13 physiological and biochemical characteristics,enzyme activity,carbon source oxidation
2.3.2 分子生物学鉴定
采用琼脂糖凝胶对菌株NY-13的PCR扩增产物进行电泳检测。将所测得的16S rRNA基因序列提交到NCBI,通过Blast工具在GenBank数据库中进行比对,选取同源性较高菌株构用MEGA5.0建系统发育树,结果如图3所示。

图3 基于16S rRNA基因序列的菌株NY-13系统发育树Fig.3 Phylogenetic tree of strain NY-13 based on 16S rRNA gene sequence
由图3可知,菌株NY-13与解鸟氨酸柔武氏菌(Raoultella ornithinolytica)JCM 6096(T)属于同一个最小分支,且同源性为69%,结合菌落形态、生理生化特性,菌株NY-13被鉴定为解鸟氨酸柔武氏菌(Raoultella ornithinolytica)。
3 结论
本研究以银杏叶提取物为唯一碳源,利用栀子苷—谷氨酸钠显色法,从银杏树下土壤样品中筛选产水解银杏黄酮的β-葡萄糖苷酶的菌株。根据酶活力测定及银杏黄酮转化检测,得到菌株NY-13的β-葡萄糖苷酶酶活力最高且能水解银杏叶提取物中的主要物质芦丁生成槲皮素。经形态学、生理生化试验和16SrRNA生物分子学鉴定,菌株NY-13为鸟氨酸柔武氏菌(Raoultella ornithinolytica)。丰富了β-葡萄糖苷酶产生菌的菌种资源,也为其在转化银杏黄酮苷生成苷元方面的应用奠定基础。
[1]SINGH B,KAUR P,GOPICHAND,et al.Biology and chemistry of Ginkgo biloba[J].Fitoterapia,2008,79(6):401-418.
[2]张 弘.银杏叶黄酮类活性物质的提取条件研究[J].食品研究与开发,2014,35(5):49-50.
[3]伍 毅,王洪新,马朝阳.固定化β-葡萄糖苷酶水解糖苷型银杏黄酮的研究[J].哈尔滨工程大学学报:英文版,2009,30(5):584-588.
[4]MENKU A,KOC R K,TAYFUR V,et al.Effects of mexiletine,Ginkgo bilobaextract(EGb 761),and their combination on experimental head injury[J].Neurosurg Rev,2003,26(4):288-291.
[5]EVANS J R.Ginkgo bilobaextract for age-related macular degeneration[J].Cochrane Database Syst Rev,2013,1:D1775.
[6]SAKATANI K,TANIDA M,HIRAO N,et al.Ginkobiloba extract improves working memory performance in middle-aged women:role of asymmetry of prefrontal cortex activity during a working memory task[J].Adv Experim Med Biol,2014,812(3):295-301.
[7]SCRIPNIKOV A,KHOMENKO A,NAPRYEYENKO O,et al.Effects of Ginkgo bilobaextract EGb 761 on neuropsychiatric symptoms of dementia:findings from a randomised controlled trial[J].Wien Med Wochenschr,2007,157(13-14):295-300.
[8]孙丽萍,徐 响,廖 磊,等.油菜蜂花粉黄酮醇苷的体内外抗氧化研究[J].食品科学,2010,31(19):359-362.
[9]黄 琴,朱 婷,蒋承建,等.产β-葡萄糖苷酶的菌种的筛选鉴定及其酶学特性[J].基因组学与应用生物学,2011,30(5):590-595.
[10]SHEN H,WU X G,WANG X,et al.Screening of β-glucanase-producing microorganisms and medium optimization for β-glucanase production[J].China Brewing,2011,226(1):55-58.
[11]LIU X G,YANG H,CHENG X L,et al.Direct analysis of 18 flavonol glycosides,aglycones and terpene trilactones inGinkgo bilobatablets by matrix solid phase dispersion coupled with ultra-high performance liquid chromatography tandem triple quadrupole mass spectrometry[J].J Pharm Biomed Anal,2014,97:123-128.
[12]朱宏阳,姚 俊,冯 珊,等.1株产细菌纤维素芽胞杆菌的分离及鉴定[J].生物加工过程,2014(5):80-84.
[13]万丽花,姚 忠,倪 芳,等.两相体系中β-葡萄糖苷酶催化栀子苷水解制备京尼平[J].化工学报,2014,65(9):3583-3591.
[14]XU Y Z,LIANG H Z,CHEN H,et al.Study on preparation and stability of high color value gardenia blue[J].Modern Food Sci Technol,2011,4:440-443.
[15]郑 艳,李 超.乳糖酸生产菌株的筛选与鉴定[J].食品工业科技,2013,34(4):189-192.
Screening and identification of β-glucosidase-producing strain with hydrolysis of Ginkgo bilobaflavonoid glycoside
ZHU Qihui1,GAO Zexin1,HE Laping1,2*,GAO Bing3,LI Cuiqin4,XIONG Jiang1,ZHANG Fuhao1
(1.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Agricultural and Animal Products Store&Processing of Guizhou Province,Guizhou University,Guiyang 550025,China;3.College of Bioengineering and Food Science,Hubei University of Technology,Wuhan 430068,China;4.School of Chemistry and Chemical Engineering,Guizhou University,Guiyang 550025,China)
Using theGinkgo bilobaextract as the sole carbon source,by the geniposide-sodium glutamate color method,the β-glucosidase-producing strain which hydrolyzedGinkgo bilobaflavonoid glycoside was screened from GuizhouGinkgo bilobatrees soil samples.The β-glucosidase activity was determined by 3,5-dinitrosalicylic acid (DNS).A strain NY-13 with 1.03 U/ml of β-glucosidase activity was obtained,and the strain could hydrolyze rutin to produce quercetin.Through physiological and biochemical characteristics and 16S rRNA molecular biological identification,strain NY-13 was identified asRaoultella ornithinolytica.
β-glucosidase;Ginkgo bilobaflavonoid glycoside;screening and identification;Raoultella ornithinolytica
TQ920.6
0254-5071(2017)09-0102-05
10.11882/j.issn.0254-5071.2017.09.022
2017-04-28
国家自然科学基金(31160002);黔科合重大专项字[2015]6004-5号;黔科合支撑[2016]2580号
朱啟会(1992-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:何腊平(1972-),男,教授,博士,研究方向为发酵工程、生物催化与生物转化。
