清香型白酒乳酸利用菌的筛选及鉴定
2017-10-24王宇鹏
李 伟,李 佳,王宇鹏,杨 帆,赵 华*
(天津科技大学 生物工程学院,天津 300457)
清香型白酒乳酸利用菌的筛选及鉴定
李 伟,李 佳,王宇鹏,杨 帆,赵 华*
(天津科技大学 生物工程学院,天津 300457)
利用透明圈法,从清香型白酒大曲中筛选出两株可以产生透明圈的菌株B4-1和B36-1。通过对两株菌株进行16S rRNA基因测序鉴定,并构建系统发育树,结合生理生化试验结果,最终确定两菌株均为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。单一碳源发酵及葡萄糖-乳酸混合发酵试验结果表明,在葡萄糖存在的情况下菌株B4-1和B36-1的乳酸利用量分别为1.91 g/L和1.26 g/L,符合乳酸利用菌的筛选特征。因此两株菌均可以作为清香型白酒的乳酸利用菌。
透明圈法;乳酸利用菌;菌株鉴定;解淀粉芽孢杆菌
乳酸乙酯和乙酸乙酯是清香型白酒的两种主体酯类,乳酸和乙酸的量比关系(乳乙比例)直接影响清香型白酒的口感和质量。当乳酸乙酯含量过高时,会使酒体沉闷,放香小、欠爽口或有苦涩感;而乙酸乙酯含量过高则会使酒体有调香感[1-2]。清香型白酒由于乳酸乙酯含量过高造成乳乙比例失衡,感官质量下降,是目前普遍存在的问题。
乳酸乙酯主要是由乳酸菌代谢产生乳酸,乳酸在转酰基酶作用下生成乳酰辅酶A,再在酯酶催化作用下与乙醇酯化生成乳酸乙酯[3-5]。并且由于乳酸乙酯性质稳定,在白酒发酵和储藏过程中不易降解。而乳酸菌在大曲、环境、水和原料中大量存在,生产工艺和开放式的生产环境又不能有效控制乳酸菌的数量[6]。所以,利用微生物减少乳酸乙酯的前体物质乳酸的积累是当前降低白酒中乳酸乙酯的主要方式。
目前,在浓香型酒中添加丙酸菌将乳酸转化为丙酸和少量乙酸的研究较多[7-9]。而丙酸及其酯类在清香型白酒中几乎不存在,利用丙酸菌作为乳酸利用菌不符合清香型白酒香气成分简单,口感清爽、醇净的特点[10]。淀粉水解产生的葡萄糖等单糖是白酒生产中的主要碳源,也是乳酸利用菌筛选中的主要干扰碳源。能否在葡萄糖等单糖存在的情况下利用乳酸,是菌株能否作为乳酸利用菌的关键指标。目前对于筛选可以将乳酸转化为乙酸的乳酸利用菌的研究鲜见报道,因此筛选出一株可以将乳酸转化为乙酸的乳酸利用菌对于降低清香型白酒中乳酸乙酯含量具有重要的意义,不仅可以增加乙酸乙酯的含量,平衡乳酸乙酯与乙酸乙酯比例,而且不会对清香型白酒的口感产生影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌源
清香型大曲粉:取自安徽省绩溪县龙川酒厂。
1.1.2 试剂
氯化钠、碘化钾、乳酸、(NH4)2SO4、MnSO4·H2O、柠檬酸钠、Na2HPO4·12H2O、CaCl2、NH4H2PO4、氢氧化钠、牛肉膏、蛋白胨、葡萄糖、酸水解酪素、甲基红、浓HCl、酚红、明胶:国药集团化学试剂有限公司;KH2PO4、MgSO4·7H2O、氯仿、异戊醇、乙醇、甲醛次硫酸钠、碘、胰蛋白胨:上海麦克林生化科技有限公司;FeSO4·7H2O、肌酸:萨恩化学技术(上海)有限公司;ZnSO4·7H2O:西陇化工股份有限公司;H3BO3、十二烷基硫酸钠(sodiumdodecylsulfate,SDS)、异丙醇、亚硝酸钠:北京华威锐科化工有限公司;琼脂、Tris-HCl(pH8.0)、醋酸铅试纸:上海阿拉丁生化科技股份有限公司;乙酸铵:天津市科密欧化学试剂有限公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(pH8.0):北京索莱宝科技有限公司;苯酚、巯基醋酸钠:北京百灵威科技有限公司;对二甲基氨基苯甲醛:天津市瑞金特化学品有限公司;葡萄糖、乳酸、乙酸(色谱级):天津市化学试剂二厂色谱技术开发公司。所用试剂均为分析纯。
1.1.3 培养基[11]
营养肉汤培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂17 g/L,pH=7.0;121℃灭菌20 min。使用时,添加20 μg/mL的制霉菌素[12-13]抑制霉菌生长。
Lu-Ye培养基:乳酸5g/L,(NH4)2SO42g/L,Na2HPO4·12H2O 14.3 g/L,KH2PO43 g/L,MnSO4·H2O 0.28 mg/L,FeSO4·7H2O 0.3mg/L,MgSO4·7H2O0.06mg/L,CaCl21mg/L,CuSO4·5H2O 0.05 mg/L,ZnSO4·7H2O 0.05 mg/L,H3BO30.05 mg/L,琼脂15 g/L,pH=7.0;分装后115℃灭菌30 min。
复筛培养基:Lu-Ye培养基+0.3%轻质CaCO3。
葡萄糖发酵培养基:分别以5g/L、10g/L、15g/L葡萄糖代替Lu-Ye培养基中的乳酸,其余成分不变配制液体培养基。
1.2 仪器与设备
Agilent1260Infinity液相色谱仪:美国安捷伦科技有限公司;HPX-87H色谱柱:美国Bio-RAD公司;Lab-1D-50真空冷冻干燥机:北京博医康实验仪器有限公司;Tanon1600凝胶成像系统:上海天能科技有限公司;Mastercycler nexus聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司:生物传感仪SBA-50:山东省科学院生物研究所;DYY-4C型稳压稳流电泳仪:北京百晶生物技术有限公司。
1.3 方法
1.3.1 菌种筛选
菌种分离:称取5g大曲粉于100 mL无菌水中加玻璃珠振荡均匀,制得菌悬液;吸取200 μL上清菌悬液涂布于营养肉汤平板上,在30℃条件下倒置培养3 d,设置一组平行。以单菌落菌株为目标菌株,进行下一步筛选。
菌种初筛:挑取上一步分离的单菌落菌株,点样于Lu-Ye培养基上,30℃倒置培养3d。观察菌株的生长情况,并以生长良好,菌落较大的菌株为目标菌株,进行下一步筛选。
菌种复筛:挑取初筛菌种点样接种于复筛培养基,30℃倒置培养3 d,以出现透明圈的菌株为目标菌株,进行下一步筛选。
菌种纯化复筛:取复筛菌株于Lu-Ye培养基上进行3区划线,30℃培养3 d。挑取单菌落接种于复筛培养基。以出现透明圈的菌株为目标菌株。取目标菌株于斜面试管划线,30℃培养3 d后于4℃冰箱保藏备用,作为后续试验菌种。
1.3.2 培养及生理特征
菌落形态:将菌种点样接种于营养肉汤培养基上,30℃倒置培养3d。在10倍物镜下观察并记录菌种单菌落的大小、形状、边缘、光泽、质地、颜色和透明程度。
菌体观察:对2株菌进行革兰氏染色,观察菌体形态,是否产芽孢等。
1.3.3 菌种16S rRNA鉴定
(1)菌种基因组提取:挑取斜面菌种接种于装有营养肉汤液体培养基的试管中,30℃、180 r/min培养12 h并设置一组平行。按照溶菌酶+SDS法[14]提取菌种基因组。
(2)16S rRNA特异性片段PCR:
引物为细菌通用引物,引物序列如下:

反应体系(25 μL):Template 2 μL,上游引物 1 μL,下游引物1 μL,10×PCR buffer 2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(各2.5 mmol/L)2 μL,TaqDNA聚合酶0.5 μL,ddH2O 16 μL。
PCR反应条件:94℃预变性5 min;94℃变性30 s;53℃退火45 s;72℃延伸1 min;72℃后延伸10 min。
取2~5 μL扩增产物用0.8%的琼脂糖凝胶电泳验证,余下的4℃保存备用。将扩增产物送苏州金唯智生物工程有限公司测序。利用EZbioCloud(www.ezbiocloud.net)数据库对测序结果进行比对,选择相似性较高的结果,利用MEGA7软件构建系统发育树。
1.3.4 生理生化特征
根据常见细菌系统鉴定手册,对两株菌进行接触酶试验、甲基红试验、V-P试验、淀粉水解试验、硝酸盐还原试验、吲哚试验、明胶液化试验、H2S试验、苯丙氨酸脱氨酶试验。
1.3.5 单一碳源发酵试验
菌种活化:接种一环菌种斜面培养物于4 mL营养肉汤试管中,30℃、180 r/min培养12 h,每个菌株各设置一组平行和空白试验。
种子制备:将活化好的菌种接种于100 mL营养肉汤液体培养基,接种量为5%,30℃、180 r/min培养12 h。
将种子分别接种于装有200 mL的Lu-Ye培养基和三种不同浓度的葡萄糖发酵培养基的三角瓶中,接种量为5%,30℃条件下加入20 mL液体石蜡液封后静置培养5 d。发酵结束后测量剩余乳酸和葡萄糖含量。
1.3.6 混合碳源发酵试验
以5 g乳酸和5 g葡萄糖替代Lu-Ye培养基中的乳酸,其余成分不变配制液体培养基。菌种活化、种子制备和接种操作同方法1.3.5,共取样8次,测样品菌干质量、乳酸、乙酸和葡萄糖含量。
1.3.7 测定方法
生物量[15]:采用干质量法测定生物量。
葡萄糖含量:采用生物传感仪进行测定。准确配制不同浓度梯度葡萄糖标准溶液,测量并记录相应电流值,绘制标准曲线。将样品稀释后测电流值,根据标准曲线得到样品的葡萄糖含量。
乳酸、乙酸含量:采用高效液相色谱法(high performance liquid chromatography,HPLC)进行测定。
2 结果与分析
2.1 菌种筛选
根据菌株是否在营养肉汤培养基、Lu-Ye培养基上生长,是否可以产生透明圈从大曲中筛选可以利用乳酸产生透明圈的菌株,结果见图1。

图1 菌种复筛结果Fig.1 Secondary screening results of strains
由图1可知,菌株B4-1、B36-1可利用乳酸产生透明圈。因培养基中只有乳酸作为唯一碳源,并加入了CaCO3,所以推测是由于2株菌利用乳酸产酸与CaCO3反应产生透明圈。通过验证,这2株菌株在纯化复筛后仍可以产透明圈。2株菌的培养及生理特征见表1。

表1 菌株B4-1、B36-1的形态特征Table 1 Morphological character of strain B4-1 and B36-1
由表1可知,两株菌都是革兰氏阳性短杆菌,菌株B36-1观察到芽孢,两株菌菌落形态明显不同。
2.2 菌株B4-1和B36-1的生理生化特征
对菌株B4-1和B36-1进行生理生化试验,结果见表2。
由表2可知,根据参考文献[16-20],两株菌均符合解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的生理生化特征,初步鉴定两株菌都为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。

表2 菌株B4-1和B36-1的生理生化特征Table 2 Physiological and biochemical property of strain B4-1 and B36-1
2.3 菌种16S rRNA鉴定
将2株菌株接种于营养肉汤液体培养基中培养12 h后,按照1.3.3的步骤提取其基因组,并进行特异性扩增。在0.8%的琼脂糖凝胶上进行DNA电泳检验,电泳结果见图2。

图2 菌株B4-1和B36-1的PCR扩增产物Fig.2 PCR amplification products of strain B4-1 and B36-1
由图2可知,在(1.0~2.5)kbp之间出现一条清晰且无弥散的条带,说明得到了较高质量的扩增产物。然后将扩增产物送样测序,选取相似度较高的比对结果利用MEGA7软件,N-J法构建系统发育树,Bootstrap值设为1000,结果见图3、图4。

图3 菌株B4-1的系统发育树Fig.3 Phylogenetic tree of strain B4-1
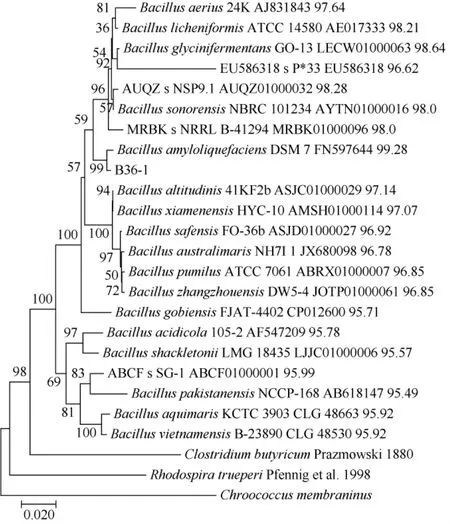
图4 菌株B36-1的系统发育树Fig.4 Phylogenetic tree of strain B36-1
由图3、图4可知,两株菌均与芽孢杆菌属内种有较高相似性,且相似度都>90%。菌株B4-1与B36-1与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的自展值分别为95和99,两株菌均与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)有较高亲缘性。
2.4 单一碳源发酵
对两株菌进行单一碳源试验,结果见表3。
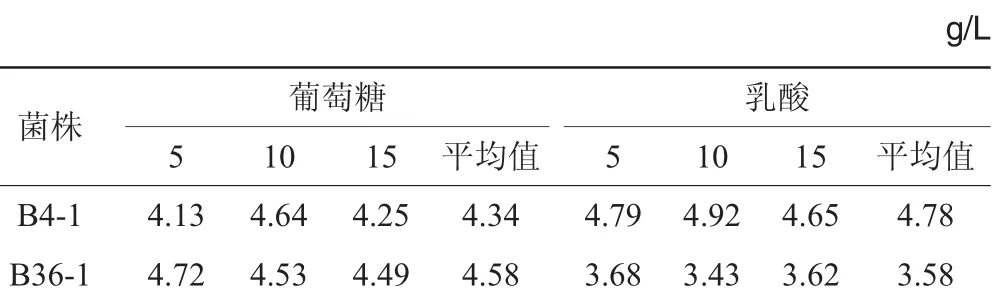
表3 2株菌对葡萄糖、乳酸利用量的比较Table 3 Utilization comparison of strains on glucose and lactic acid
由表3可知,菌株B4-1与B36-1的平均葡萄糖利用量分别为4.34g/L和4.58g/L,两株菌对葡萄糖利用能力相当。菌株B4-1与B36-1的平均乳酸利用量分别为4.90 g/L和3.58 g/L,菌株B4-1对乳酸的利用量较高。由于两株菌对葡萄糖、乳酸利用量均<5 g/L,所以进行混合发酵试验,选用5 g/L乳酸和5 g/L葡萄糖作为混合碳源。
2.5 葡萄糖-乳酸混合发酵
菌株B4-1葡萄糖-乳酸混合发酵试验结果见图5,菌株B36-1葡萄糖-乳酸混合发酵试验结果见图6。
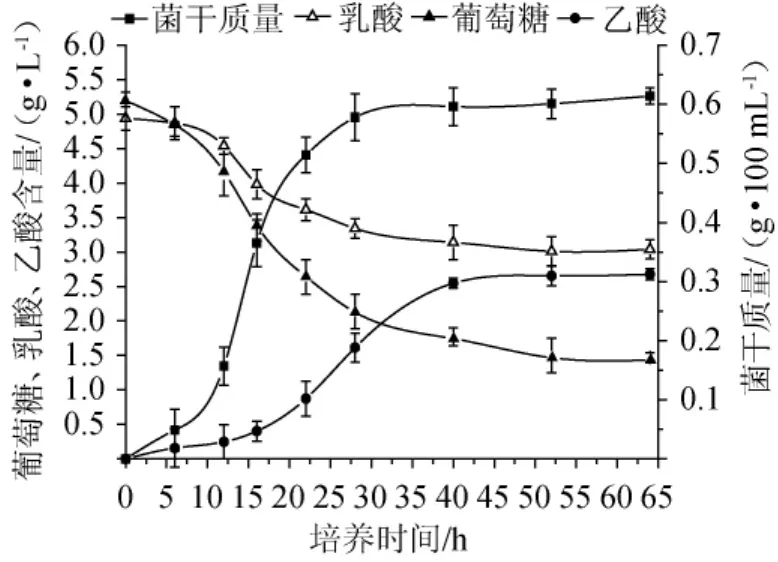
图5 菌株B4-1葡萄糖、乳酸混合发酵结果Fig.5 Results of mixed fermentation with glucose and lactic acid of strain B4-1
由图5可知,在发酵过程中,菌株B4-1的菌体干质量可达到0.614 g/100 mL,证明B4-1在厌氧条件下生长良好;乳酸和葡萄糖能被同时利用,利用量分别为1.91g/L和3.65g/L,葡萄糖利用量高于乳酸利用量;乙酸在发酵中期大量积累,含量为2.68 g/L。

图6 菌株B36-1葡萄糖、乳酸混合发酵结果Fig.6 Results of mixed fermentation with glucose and lactic acid of strain B36-1
由图6可知,在发酵过程中,菌株B36-1菌体干质量可达到0.774 g/100 mL,略大于菌株B4-1,在厌氧条件下生长良好;乳酸、葡萄糖的利用趋势同菌株B4-1相同,利用量分别为1.26 g/L和4.61 g/L;乙酸在发酵中期大量积累,含量为2.35 g/L,但积累量低于菌株B4-1发酵过程中的乳酸含量。
3 结论
利用透明圈法,从清香型白酒大曲中筛选出两株可以产生透明圈的菌株B4-1和B36-1。通过对两株菌株进行16S rRNA基因测序鉴定,并构建系统发育树,结合生理生化试验结果,最后确定两菌株均为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。单一碳源发酵试验表明,两株菌对葡萄糖、乳酸利用量均<5 g/L;葡萄糖-乳酸混合发酵试验结果表明,在葡萄糖存在的情况下菌株B4-1和B36-1的乳酸利用量分别为1.91g/L和1.26g/L,符合乳酸利用菌的筛选特征。所以,两株菌均可以作为清香型白酒的乳酸利用菌。
[1]徐 瑾,廖永红,徐嘉良,等.清香型白酒发酵过程中细菌PCR-DGGE条件优化及群落变化规律[J].中国食品学报,2017,17(5)224-231.
[2]熊君燕,李小东,谢圣凯,等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报,2017,44(8):1767-1776.
[3]唐取来,李晶晶,郭学武,等.清香型大曲酯化酶活力的研究[J].中国酿造,2017,36(1):35-38.
[4]于 勇.酱香型酒中的乳酸及乳酸乙酯[J].酿酒,2004,31(4):21-22.
[5]冯雅芳,张永利.凤型酒生产过程降乳措施探讨[J].酿酒,2015,42(6):89-93.
[6]王进明,刘忠军.清香型白酒乳酸乙酯偏高的原因及解决措施[J].酿酒,2012,39(4):81-84.
[7]张 浩,胡智慧,刑 爽,等.酸浓度和pH值对浓香型大曲酯化酶催化活力的影响[J].中国酿造,2017,36(5):41-45.
[8]栗连会.泸型酒酒醅中乳酸菌和乳酸降解菌的多样性和代谢特性[D].无锡:江南大学,2016.
[9]辛秀明.丙酸菌的筛选、分离及在特型酒生产中的应用[D].南昌:南昌大学,2011.
[10]曹云刚,胡永钢,马燕红,等.汾酒酒醅发酵过程中香气成分的变化规律[J].食品科学,2010,31(22):367-371.
[11]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:346-412.
[12]陈淑丽,陈丽莎.用制霉菌素抑制黄杆菌检验中霉菌干扰(简报)[J].微生物学杂志,1984(3):31-32.
[13]SEMIS R,POLACHECK I,SEGAL E.Nystatin-intralipid preparation:characterization andin vitroactivity against yeasts and molds[J].Mycopathologia,2010,169(5):333-341.
[14]凌 云,王 晶,王越菲,等.不同裂解方式对微生物DNA提取的影响[J].江苏农业科学,2016,44(12):61-64.
[15]丁 振,贾士儒,谭 宁.液体悬浮培养发状念珠蓝细菌生物量测定方法的条件确定及比较[J].中国酿造,2011,30(12):20-22.
[16]布坎南.伯杰细菌鉴定手册[M].北京:科学出版社,1984:729-759.
[17]LIU W,WANG X,WU L,et al.Isolation,identification and characterization ofBacillus amyloliquefaciens,BZ-6,a bacterial isolate for enhancing oil recovery from oily sludge[J].Chemosphere,2012,87(10):1105-1110.
[18]冉军舰,徐剑宏,胡晓丹,等.1株产脂肽类抗生素芽孢杆菌的鉴定及脂肽类抗生素相关基因克隆[J].食品科学,2016,37(17):127-132.
[19]栾素军,邢 焕,孙永波,等.解淀粉芽孢杆菌在畜禽养殖中的应用研究进展[J].中国畜牧兽医,2016,43(10):2615-2620.
[20]姜军坡,范会兰,王 伟,等.牛源肠道益生菌芽孢杆菌BN-9菌株的分离鉴定[J].湖北农业科学,2009,48(1):142-146.
Screening and identification of lactic acid-utilizing bacteria from Fen-flavorBaijiu
LI Wei,LI Jia,WANG Yupeng,YANG Fan,ZHAO Hua*
(College of Biotechnology,Tianjin University of Science&Technology,Tianjing 300457,China)
Two strains,named B4-1 and B36-1,were screened from Fen-flavorBaijiu(Chinese liquor)Daqu by transparent circle method.Both strains were identified by16S rRNA gene sequencing,and then phylogenetic tree was established.Combining with physiological and biochemical tests results,the strains were ultimately confirmed asBacillus amyloliquefaciens.Then single carbon source fermentation and mixed carbon sources fermentation with glucose and lactic acid were carried out,and results showed that lactic acid utilization of strains B4-1 and B36-1 were 1.91 g/L and 1.26 g/L,which meet the screening characteristic of lactic acid-utilizing bacteria.Therefore,both strains could be used as lactic acid-utilizing bacteria for Fen-flavorBaijiu.
transparent circle;lactate utilizing bacteria;strain identification;Bacillus amyloliquefaciens
TS262.3
0254-5071(2017)09-0087-05
10.11882/j.issn.0254-5071.2017.09.019
2017-06-26
李 伟(1992-),男,硕士研究生,研究方向为轻工技术与工程。
*通讯作者:赵 华(1963-),男,教授,博士,研究方向为发酵工程。
