白砂糖中出芽短梗霉的鉴定及溯源
2017-10-24黄结,覃思
黄 结,覃 思
(广西壮族自治区食品药品检验所,广西 南宁 530021)
白砂糖中出芽短梗霉的鉴定及溯源
黄 结,覃 思
(广西壮族自治区食品药品检验所,广西 南宁 530021)
在制糖干燥包装车间中找到白砂糖出芽短梗霉(Aureobasidium pullulans)的污染来源,建立白砂糖污染微生物的溯源方法。采用传统形态学、聚合酶链式反应(PCR)技术和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术结合的溯源方法,在制糖干燥包装车间的生产线上进行样品污染菌出芽短梗霉的溯源。在车间的白砂糖、通风口空气、排风口空气、鼓风机表面、干燥机表面等均分离出出芽短梗霉,这几株菌的特异性DNA序列和蛋白质指纹图谱相似度极高。白砂糖与车间环境之间存在交叉污染,需加强该车间的清洁及消毒灭菌工作,需在该车间的通风口和排放口配置高效过滤网。构建以传统形态学、PCR技术和MALDI-TOF MS技术结合的白砂糖微生物溯源方法,为制糖企业有针对性地采取有效控制措施提供实验基础和理论依据。
白砂糖;出芽短梗霉;PCR;MALDI-TOF MS;溯源
白砂糖的制糖工序是一种比较复杂的过程,其中蒸发、煮糖、分蜜和干燥等工序使微生物处于高温或高渗透压的条件下,多数微生物在其中难以生长繁殖。因此,白砂糖相比于其他加工食品,受微生物污染的数量较低,但在近几年的国家监督抽检结果报道中,也常报道有白砂糖微生物项目(菌落总数[1]、酵母菌[2])不合格情况,而且白砂糖是直接食用或作为其他食品加工原料,因此白砂糖的卫生安全尤为重要。
微生物溯源是通过采用某些微生物分析技术把样品与可疑污染源中的微生物比较出差异或有无生物标记来判断两者之间存在的联系,从而确定样品可能的污染来源[3-4]。HAGEDORN C等[5]用抗生素抗性分析技术对Viriginia流域的粪链球菌(Streptococcus faecalis)进行溯源,研究结果确认其主要污染来源为牛粪,然后采取限制牛接近水体的办法,使该流域的粪大肠菌群数量减少了94%。陈晓[6]利用聚合酶链式反应(polymerase chain reaction,PCR)技术研究双汇肘花和蒜蓉烤肠中腐败菌(枯草芽孢杆菌(Bacillus subtilis))的污染源,结果表明,在其配料淀粉、大豆蛋白、白砂糖以及其生产线上的灌肠机、熟区用的剪刀和二次灭菌后产品中均能检出该腐败菌,即进行了成功溯源。然而,溯源方法至今在食糖污染上应用较少。
目前,微生物溯源分型方法尚无统一标准,且各方法均存在有不同的局限性[7]。重复序列PCR(Rep-PCR)分型技术和脉冲场凝胶电泳脉冲场电泳(pulsed field gel electrophoresis,PFGE)分型技术早已被广泛应用于微生物溯源,但其操作复杂、耗时耗力、费用高。而基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization timeofflightmass spectrometry,MALDI-TOFMS)分型技术相比PFGE分型技术,则具有操作简单、快速、高通量、成本低[8]等优点,但其存在质谱数据库不足的缺陷[9]。MALDITOF MS技术是根据特异性指纹图谱分析独特的蛋白质图谱聚类分析对比分型,在食品微生物分型溯源方面已广泛应用[10]。郑秋月等[11]利用MALDI-TOF MS技术对74株食源性致病菌沙门氏菌(Salmonellasp.)进行鉴定研究,结果表明,MALDI-TOFMS技术可用作沙门氏菌检测和溯源分析。FIRACATIVE C等[12]利用MALDI-TOF MS技术在先建立新生隐球菌(Cryptococcus neoformans)/格特隐球菌(Cryptococcus gattii)的8个基因型的质谱数据库基础上,再进行164株临床菌株的检测,结果表明,MALDI-TOFMS技术可将其微生物鉴定到种,准确率达100%。本研究构建以传统形态学、PCR技术和MALDI-TOF MS技术结合的白砂糖微生物溯源方法,使企业能快速、准确地初步判断白砂糖的污染来源,为企业有针对性地采取有效控制措施提供实验基础和理论依据。
1 材料与方法
1.1 材料与试剂
在我国华南地区的一个制糖企业的制糖干燥包装车间中设置编号为1~22#的采样点。其中1#为四级振筛干燥机上的白砂糖样品;2~5#为车间各入门处的空气沉降菌采样;6~14#为车间各通风口的空气沉降菌采样;15~22#为车间仪器设备表面微生物的采样,各采样点的位置见图1所示。白砂糖的样品采用灭菌的小铲和三角瓶采集,低温保存。空气微生物采用空气沉降菌法采集,平皿沉降30 min收皿,低温保存。表面微生物采用灭菌棉签浸无菌生理盐水4支共涂抹100cm2的面积,装入10 mL无菌生理盐水的试管,低温保存。一起带回,在24h内进行微生物的检测和培养。
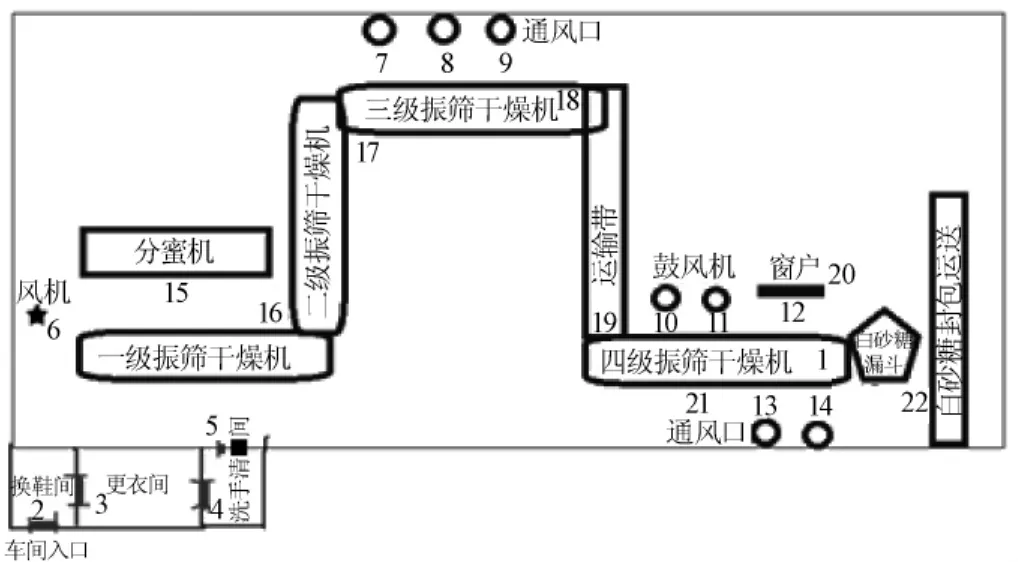
图1 样品采集位置示意图Fig.1 Sketch map showing sampling locations
沙氏葡萄糖琼脂(sabourauddextroseagar,SDA)培养基:北京三药科技开发公司;PCR引物、酵母菌DNA提取试剂盒(Dr.GenTLE High Recovery):大连TaKaRa公司;琼脂糖:香港基因有限公司;GelRed染色液:美国Biotium公司;MALDI-TOF MS基质、乙腈、三氟乙酸(色谱纯)、标准肽蛋白:德国Bruker Daltonik Gm bH公司。
1.2 仪器与设备
ESCO生物安全柜:新加坡ESCO公司;OLYMPUSBX51显微镜:奥林巴斯公司;BD(E2)240电热恒温培养箱:德国Binder公司;Mastercyler gradient PCR仪:Eppendorf(中国)有限公司;UNIVERSAL320R高速冷冻离心机:德国Hettich公司;BIO-RAD电泳槽、BIO-RAD凝胶成像系统:美国伯乐公司;MALDI-TOFMS基质辅助激光解吸电离-飞行时间质谱仪:德国Bruker Daltonik Gm bH公司。
1.3 方法
1.3.1 检测分离纯化
在车间采集的空气沉降菌按照GB 16292—2010《医药工业洁净室(区)悬浮粒子测试方法》采集检测,表面微生物按照《中国药典》四部9205擦拭法采集,采集的白砂糖和表面微生物样品按照GB4789—2010《食品微生物检验标准进行菌落总数与霉菌和酵母计数》的检测。平皿上生长的菌落进行分离纯化后,分别划线于相应的培养基斜面4℃保藏。
1.3.2 PCR技术鉴定
引物:根据待测菌株的显微观察结果,以酵母菌的26S rRNA基因D1/D2为保守区,选用酵母菌通用引物D1和D2。上游引物D1:5′-GCAT ATCA ATAA GCGG AGGA AAAC-3′;下游引物D2:5′-GGTC CGTG TTTC AAGA CGG-3′。
DNA提取:用无菌接种环挑取3~5个纯菌落在装有超纯水的专用试管中磨散,制成0.5麦氏单位的菌悬液(1×108CFU/mL),然后严格按照酵母菌DNA提取试剂盒的步骤进行DNA的提取。
PCR扩增:以提取好的DNA为模板,用对应的引物进行PCR扩增。PCR扩增采用50μL体系:DNA模板3μL,上游引物0.5 μL(20 pmol/μL),下游引物0.5 μL(20 pmol/μL),预混酶25 μL,双蒸水21 μL。扩增条件:94 ℃、5 min;94 ℃、1 min,55 ℃、1 min,72 ℃、1 min,30个循环;72 ℃、5 min。
电泳检测:采用琼脂糖凝胶电泳检测扩增结果,琼脂糖凝胶为1.0%,溴化乙锭1μL,PCR扩增产物上样量为5μL,6×LoadingBuffer 1 μL,DNA Marker 5 μL,电泳电压100 V,电流80 mA,电泳时间约45 min。
1.3.3 MALDI-TOF MS技术鉴定
MALDI-TOF MS技术是利用微生物具有特异性保守核糖体蛋白的原理进行对微生物的鉴定。用一次性接种针挑取少许纯菌落轻轻涂抹于MALDI靶板的靶点上,涂成一个薄层,然后在薄层上滴加1 μL 70%甲酸水溶液,室温下晾干,再滴加1 μLα-氰基-4-羟基肉桂酸基质溶液,室温晾干,样品和基质结合形成一薄层淡黄色晶体,立即可放入MALDI-TOF MS质谱仪进行菌株鉴定。
2 结果与分析
2.1 检测结果及分离纯化
为找出白砂糖中检出微生物与环境检出微生物之间存在的相关性,在我国华南地区的一个制糖干燥包装车间中设置了白砂糖样品、空气沉降菌、设备表面微生物等采样点,共计22个,在这22个采样点上分别检测得到的细菌总数和霉菌、酵母菌总数,结果见表1。
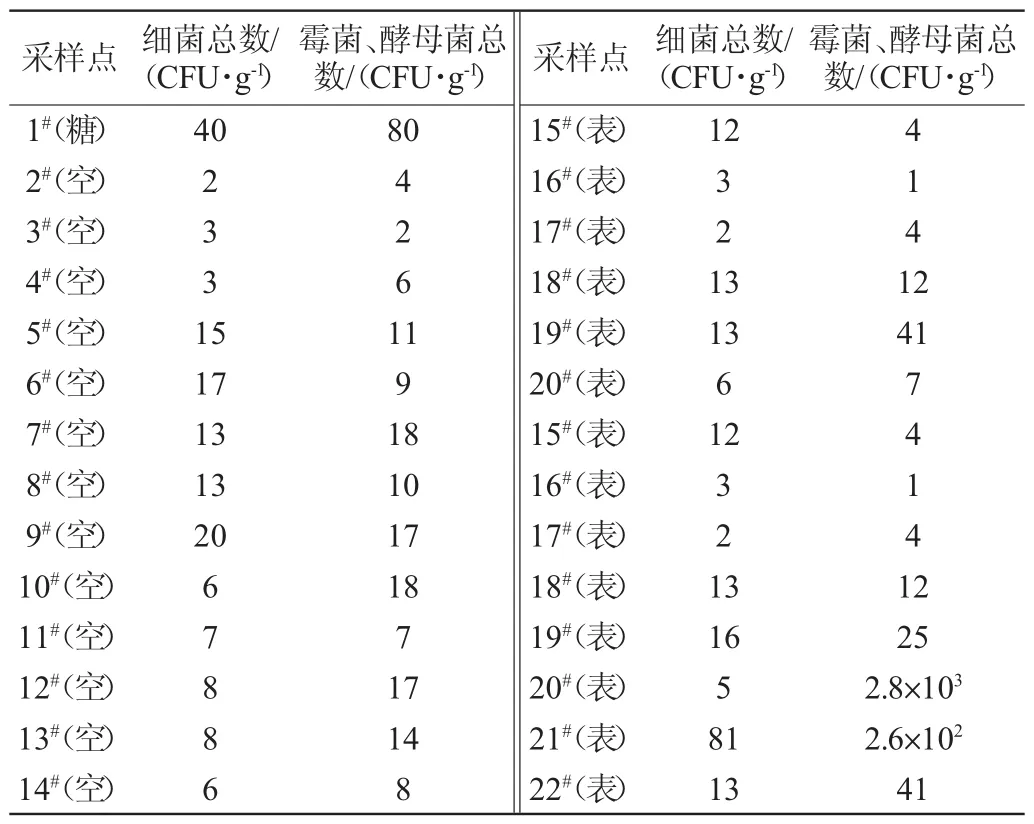
表1 各取样点的菌落数Table 1 Total plate count of sampling point
由表1可知,在制糖干燥包装车间中真菌的污染比较严重,尤其是在20和21号的采样点检测到的真菌数最多。
用一次性接种环挑取检测到的菌株,经过分离纯化,在沙氏葡萄糖琼脂培养基SDA平板28℃分离培养后,得出采样点1、7、11、14和20#均有一种相似真菌,结果见图2。

图2 分离菌株的菌落形态和细胞形态Fig.2 Colonies and morphology of isolated strains
由图2可知,在培养2 d的SDA平板上生长的菌落为乳白色中间带少许褐色,在培养5 d后菌落成灰色,周围产生黑色素。在水浸制片16×40倍显微镜下为椭圆形细胞的酵母菌形态。
2.2 PCR技术鉴定
按照显微形态观察结果,用酵母菌DNA提取试剂盒,对2.1分离得到的采样点(1、7、11、14、20)的这种相似真菌分别进行DNA的提取。用酵母菌的特异性引物扩增,用琼脂糖凝胶电泳检测扩增产物,结果见图3。

图3 分离菌株的凝胶电泳图Fig.3 Gel electrophoretogram of isolated strains
由图3可知,1、7、11、14和20#采样点分离的菌株在555bp处均有扩增,而且阳性对照有扩增,阴性对照没有扩增。表明使用的引物特异性强,使用的酵母菌DNA提取方法、酵母菌PCR反应体系、酵母菌PCR反应条件等实验合适,结果满意、可靠。
采用MEGA5.05生物学软件将GenBank基因库中搜索分析得到的相似序列结果进行系统发育树构建,得到系统发育树,结果见图4。

图4 分离菌株的系统发育树Fig.4 Phylogenetic tree of isolated strains
由图4可知,菌株1Y、7K、11K、14K、20B与Aureobasidium pullulansAY213639.1、AureobasidiumpullulansFJ515165.1、Aureobasidium pullulansKC253968.1同处于最小分支,表明以上菌株具有极高相似度的DNA序列片段,鉴定出菌株1Y、7K、11K、14K、20B为出芽短梗霉(Aureobasidiumpullulans)。
2.3 MALDI-TOF MS技术鉴定
采用MALDI-TOF MS质谱仪鉴定1、7、11、14和20号分离的菌株,以蛋白质离子质荷比(m/z)在2 000~20 000为横坐标,以蛋白质离子峰为纵坐标,列出各菌株的蛋白质指纹图谱,结果见图5。

图5 分离菌株的蛋白指纹图谱Fig.5 Protein fingerprint of isolated strains
由图5可知,菌株1Y、7K、11K、14K、20B的主要蛋白质组成基本相同,且与蛋白谱库中出芽短梗霉的蛋白图谱吻合,说明采样点1、7、11、14和20号存在相似度极高的出芽短梗霉。
2.4 讨论
本研究以PCR技术鉴定出芽短梗霉,采用酵母菌DNA的提取方法、酵母菌特异性引物、酵母菌PCR反应体系、酵母菌PCR反应条件等,实验结果表明实验条件选择正确,鉴定结果准确可靠。出芽短梗霉的鉴定可采用与酵母菌相同的处理方法[13-14]。
在对车间白砂糖和环境进行微生物检测时发现,其受真菌污染比较严重,特别是车间的窗户和通风口处,见图1和表1的20#和21#,霉菌、酵母菌总数分别为2.8×103CFU/g和2.6×102CFU/g,很可能的污染原因是窗户和通风口没安过滤网,使得车间外部不洁净空气进来,易污染了车间环境和车间样品。因此,建议加强车间的清洁及消毒灭菌工作,把紫外灯消毒换为臭氧发生器灭菌,因为臭氧杀灭真菌的效果比紫外线照射效果好[15];建议车间配置上温湿度控制系统,降低车间湿度,不易真菌生长;建议在车间的各送风口、通风口和窗户等装上高效过滤网,以有效去除空气中微生物和尘埃。这样可能会大大降低产品受微生物污染的程度。
3 结论
本研究以传统形态学、PCR技术和MALDI-TOF MS技术结合的溯源方法,对白砂糖检出的出芽短梗霉在制糖干燥包装车间中进行溯源。结果表明,四级振筛干燥机上的1#白砂糖,车间7#通风口、11#鼓风机口、14#通风口的空气沉降菌,20#窗户表面微生物均有出芽短梗霉检出,并且它们之间具有相一致的菌落形态和显微形态、相似度高的特异性DNA序列和相同的特异性蛋白质组成。对污染白砂糖的出芽短梗霉进行了成功溯源,为制糖企业有针对性地采取有效控制措施提供实验基础和理论依据。
[1]郭剑雄.食糖(国家监督抽查)[J].消费指南,2012(7):92-93.
[2]苏 林.3家企业食糖产品不合格[J].中国质量技术监督,2010(8):35.
[3]MEAYS C L,BROERSMA K,NORDIN R,et al.Source tracking fecal bacteria in water:a critical review of current methods[J].J Environ Manag,2004,73:71-79.
[4]SCOTT T M,ROSE J B,JENKINS T M,et al.Microbial source tracking:current methodology and future directions[J].Appl Environm Microbiol,2002,68:5796-5803.
[5]HAGEDORN C,ROBINSON S L,FILTZ J R,et al.Determining sources of fecal pollution in a rural Virginia watershed with antibiotic resistance patterns in fecal streptococci[J].Appl Environ Microbiol,1999,65:5522-5531.
[6]陈 晓.腐败肉制品中致腐微生物来源PCR分析方法研究[D].郑州:河南农业大学,2013.
[7]CLARRIDGE J E 3rd.Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J].Clin Microbiol Rev,2004,17(4):840-862.
[8]张 超,廖万清.基质辅助激光解析电离飞行时间质谱技术在病原真菌检验中的应用进展[J].中国真菌学杂志,2012,7(5):312-315.
[9]王 冲,占 萍,刘维达.MALDI-TOF MS技术在临床病原真菌鉴定中的应用进展[J].中国真菌学杂志,2013,8(6):369-373.
[10]饶名祯,顾晨荣,李云霞,等.MALDI-TOF MS技术在食品微生物领域的应用研究[J].上海师范大学学报:自然科学版,2015,44(6):681-686.
[11]郑秋月,战晓微,徐 杨,等.食源性致病菌沙门氏菌MALDI-TOF MS 溯源分析[J].食品安全与检测,2013,38(12):315-320.
[12]FIRACATIVE C,TRILLES L,MEYER W.MALDI-TOF-MS enables the rapid identification of the major molecular types within theCryptococcus neoformans/C.gattii species complex[J].Plos One,2012,7(5):e37566.
[13]ZHANG X,HUA M X,SONG C L,et a1.Occurrence and diversity of marineyeastsinAntarcticaenvironments[J].J Ocean Univ China,2012,11:70-74.
[14]王翠玲.普鲁兰短梗霉P10菌株产油脂的研究[D].青岛:中国海洋大学,2014.
[15]刘 骞,骆承庠,孔保华,等.臭氧杀菌在食品工业中的应用的广阔前景[J].肉类工业,2006(1):26-29.
Identification and tracing ofAureobasidium pullulansin white granulated sugar
HUANG Jie,QIN Si
(Guangxi Institute for Food and Drug Control,Nanning 530021,China)
The pollution source ofAureobasidium pullulansin white granulated sugar was found out in the dry packing workshop,and a tracing method of microorganism causing white granulated sugar pollution was established.Combining with traditional morphology,PCR technique and MALDI-TOFMS technique,the tracing ofA.pullulanson samples was conducted to the production line of dry packing workshop of sugar refinery.A.pullulanswas screened from the white granulated sugar in workshop,ventilation opening air,exhaust outlet air,surface of air blower and surface of drying machine,etc.The similarity of specific DNA sequence and protein finger-print of these strains was extremely high.There was cross contamination between white granulated sugar and workshop environment,so it needs to strengthen the cleaning and sterilization of the workshop.In addition,hepa filter should be set in the ventilation opening and discharge outlet of the workshop.In this paper,the microorganism tracing method of white granulated sugar combined with traditional morphology,PCR technique and MALDI-TOFMS technique was established,to provide experimental foundation and theoretical basis for taking effective control measures of sugar enterprises.
white granulated sugar;Aureobasidium pullulans;PCR;MALDI-TOF MS;tracing
TS207.3
0254-5071(2017)09-0078-04
10.11882/j.issn.0254-5071.2017.09.017
2017-03-29
广西食品药品检验所科研项目(KY201509);广西科学研究与技术开发计划项目(桂科重14122003-6)
黄 结(1978-),女,微生物检验技术中级,硕士,研究方向为化妆品、食品、药品等微生物学检验。
