基于PLFA分析不同窖龄窖泥微生物群落结构
2017-10-24李永博刘燕梅黄治国
李永博,邓 波,刘燕梅,黄治国,2*
(1.四川理工学院 生物工程学院,四川 自贡 643000;2.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;3.泸州老窖股份有限公司,四川 泸州 646000;4.宜宾市产品质量监督检验所,四川 宜宾 644002)
基于PLFA分析不同窖龄窖泥微生物群落结构
李永博1,邓 波3,刘燕梅4,黄治国1,2*
(1.四川理工学院 生物工程学院,四川 自贡 643000;2.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;3.泸州老窖股份有限公司,四川 泸州 646000;4.宜宾市产品质量监督检验所,四川 宜宾 644002)
该试验采用磷脂脂肪酸(PLFA)生物标记法对两种不同窖龄窖泥(30年、100年)微生物群落特征进行了研究。结果表明,100年窖龄窖泥微生物群落多样性高于30年的。对两种不同窖龄窖泥各类型的微生物结构研究发现,100年窖龄窖泥各类型的微生物含量均高于30年窖龄窖泥的,并且在两种不同窖龄窖泥中细菌的含量与丰度较其他类型微生物高,表明细菌是窖泥优势菌群。对两种不同窖龄窖泥磷脂脂肪酸含量进行主成分分析发现,30年窖龄窖泥的主要变异菌群是细菌,100年窖龄窖泥的主要变异菌群是细菌与真菌。
浓香型白酒;窖泥;微生物群落结构;磷脂脂肪酸
窖泥是浓香型白酒功能菌生长繁殖的载体,它直接影响着白酒中香味物质的生成,而且在发酵过程中赋予了浓香型白酒独特的芳香物质[1-3]。生产实践经验表明,窖池窖龄与酿酒质量有着紧密联系,只有老窖才能出好酒[4-5]。混蒸续糟、不间断发酵使窖泥长期处在高乙醇含量、低pH、微氧环境中,从而形成了独特的微生物群落[6]。因而解析窖泥微生物群落结构对浓香型白酒的生产有着重要的指导意义。
近年来,随着对窖池微生物群落研究的深入涌现出许多对窖池微生物群落研究的新方法[7-9]。罗惠波等[10-11]分别利用聚合酶链反应-单链构象多态性(polymerasechainreactionsingle strand conformation polymorphism,PCR-SSCP)技术和聚合酶链反应-变性梯度凝胶电泳(polymerasechainreactiondenaturing gradient gel electrophoresis,PCR-DGGE)技术对窖池的微生物群落结构进行研究,试图揭示其群落特征。但因受引物的特异性、DNA提取条件以及窖池微生物群落的复杂性,目前还很难对其微生物群落结构进行全面地描述[5]。
磷脂脂肪酸(phospholipid fatty acid,PLFA)是活体微生物细胞膜的重要组成成分,不同类群的微生物有着不同的生化途径来合成不同的PLFA,同类群微生物的PLFA具有高度的特异性[12-13],因此可以通过监测特征磷脂脂肪酸的组成和数量变化来揭示微生态环境中微生物群落的组成及变化规律,目前该方法已广泛的应用于土壤等环境微生物群落结构分析[14-15]。邓杰等[16]对浓香型白酒不同窖龄窖池窖泥中的古菌群落结构研究发现,100年窖龄窖池微生物群落相似性较高,30年窖龄窖池微生物群落差异性较大;陶勇等[4]对窖泥细菌群落结构研究表明,50年窖泥样品微生物多样性低于10年窖泥样品。本研究采用磷脂脂肪酸分析技术,对不同窖龄窖泥微生物群落结构进行分析,以期获得窖泥微生物群落结构及生物量信息,从而为更好地认识浓香型白酒窖泥中微生物群落结构奠定一定的理论基础,同时也为实时监测窖池微生物群落结构变化提供一种研究方法。
1 材料与方法
1.1 材料与试剂
30年窖龄、100年窖龄窖泥:采自泸州老窖股份有限公司白酒生产窖池(泸州地区),于窖壁上层(距窖口50 cm)、中层(距窖底50 cm)和下层(窖池底部)分别取样,迅速置于冰盒运回,4℃保藏,24 h内完成预处理。
K2HPO4、CHCl3、甲苯、醋酸、KOH(均为分析纯):成都科龙化工试剂厂;甲醇(色谱纯):德国Darmstadt公司。
1.2 仪器与设备
XMTD型水浴锅:余姚长丰仪器厂;ZHWY-103D型恒温培养振荡器:上海智城分析仪器制造有限公司;GC6890型气相色谱(gas chromatography,GC)仪、SampliqSilica硅胶萃取小柱:美国Agilent科技有限公司;Sherlock 6.0微生物鉴定系统:美国MIDI公司;BF2000型氮气吹干仪:北京八方世纪科技有限公司。
1.3 方法
1.3.1 PLFA的提取
称取8g窖泥样品置于50mL离心管中,加入5mL50mmol/L磷酸缓冲液(pH7.4)、6 mL三氯甲烷和12 mL甲醇,并加入5 μL 2.5 mmol/L 1,2-二酰基-sn-甘油-3-磷酰胆碱作为内标,振荡2 h,室温条件下3 500 r/min离心10 min。取上清液于分液漏斗,将沉淀加入5 mL磷酸缓冲液,6 mL三氯甲烷,12 mL甲醇,振荡30 min,室温条件下3 500 r/min离心10 min,将上清液与之前的上清液合并,加入分液漏斗后,加入12 mL三氯甲烷,12 mL磷酸缓冲液,振荡2 min,过夜静置分层,取下层溶液于试管中,32℃水浴,N2浓缩吹干,加入5份200 μL三氯甲烷溶解总脂肪酸后转移到硅胶萃取小柱中,分别加入5 mL氯仿、5 mL丙酮(2次)清洗小柱后,加入5 mL甲醇洗脱,收集洗脱液于玻璃试管中,32℃水浴,N2浓缩吹干即得到磷脂脂肪酸。
1.3.2 PLFA甲基化
将磷脂脂肪酸溶于1 mL甲苯与甲醇的混合液(V/V,1∶1),加入1mL0.2mmol/L氢氧化钾,摇匀,37℃水浴15min,加入0.3mL1mmol/L醋酸溶液,再加入2mL己烷,2mL超纯水,低速振荡10 min,将萃取得到上层清液于玻璃试管中,再加2mL己烷重复萃取1次,取上清液合并到刚才试管中N2浓缩吹干即得到甲基化的磷脂脂肪酸,4℃条件下保存待测。
1.3.3 PLFA气相色谱分析
将所得的磷脂脂肪酸样品用600 μL的己烷溶解,进行气相色谱分析。气相色谱仪配备分流进样口、氢火焰离子检测器(flameionizationdetector,FID)及Agilent气相色谱化学工作站。色谱条件:Ultra-2色谱柱(25mm×0.2mm×0.33μm);程序升温:起始温度170℃,5℃/min升至260℃,随后40℃/min升至310℃,维持1.5 min;进样口温度250℃,载气为氢气,流速0.5mL/min,分流进样模式,分流比100∶1,进样量2 μL;氢火焰离子检测器温度300℃,氢气流速30 mL/min,空气流速216 mL/min,氮气(N2)流速30 mL/min。
1.3.4 PLFA微生物群落的表征
通过对PLFA图谱中不同磷脂脂肪酸种类及其含量的分析,可以对样品的微生物种类及生物量进行分析。磷脂脂肪酸为i13:0、a14:0、i15:0、a15:0、a16:0和i16:0代表革兰氏阳性菌(G+);磷脂脂肪酸为16:1ω5、16:1ω7、16:1ω9、cy17:0和18:1ω6代表革兰氏阴性菌(G-);磷脂脂肪酸为18:2ω6,9、18:1ω9代表真菌;磷脂脂肪酸为cy17:0、cy19:0代表厌氧菌;磷脂脂肪酸15:0、i16:0、i17:0代表好氧细菌;磷脂脂肪酸10Me18:0代表放线菌[17-18]。
1.3.5 数据分析
磷脂脂肪酸(PLFA)的鉴定和分析采用美国MIDI公司开发的基于细菌细胞脂肪酸成分鉴定的SherlockMIS4.5系统。
2 结果与分析
2.1 不同窖龄窖泥微生物的PLFA组分分析
对两种不同窖龄窖泥中磷脂脂肪酸含量进行检测,结果见图1。

图1 两种窖龄窖泥磷脂脂肪酸含量检测结果Fig.1 Detection results of phospholipid fatty acid contents in pit mud with two kinds of pit ages
由图1可知,100年窖龄窖泥中共检测到32中脂肪酸,其中直链脂肪酸8种,支链脂肪酸11种,环状脂肪酸2种,单不饱和脂肪酸6种,多不饱和脂肪酸5种;30年窖龄窖泥中共检测到22种脂肪酸,包括直链脂肪酸6种,支链脂肪酸8种,环状脂肪酸1种,单不饱和脂肪酸3种,多不饱和脂肪酸4种。并且在100年窖龄窖泥中还检测到i13:0、a13:0、15:1ω6、15:4ω3、16:1ω9、16:2DMA、16:1ω7DMA、10Me16:0、cy17:0ω7、i18:0、18:2DMA、20:2ω6脂肪酸组分,表明100年窖龄窖泥中微生物的生物多样性高于30年的。这可能是由于随着窖龄的增长,窖池中的微生物菌群种类逐渐丰富并趋于稳定,使100年窖龄窖泥中微生物的生物多样性高于30年的。
2.2 不同窖龄窖泥中各类型微生物含量分析

表1 不同窖龄窖泥中各类型微生物含量Table 1 Contents of each type microbes in pit mud with different pit ages
由表1可知,100年窖龄窖泥中代表菌株革兰氏阳性菌、革兰氏阴性菌、真菌、放线菌、厌氧菌含量均高于30年窖龄窖泥。这可能是由于浓香型白酒采用混蒸续糟、不间断发酵生产工艺,使得生产过程中投入的发酵原料等同于向窖池微生态系统中输入碳、氮、磷、钾等营养物质。随着窖池使用时间的延长,大大提高了窖池窖泥中有机质的含量,改善了窖池的营养状况,使栖息在窖池中的功能微生物能够更好地生长繁殖。并且革兰氏阳性菌在两种不同窖龄窖泥中含量最高,表明革兰氏阳性菌为窖泥微生物群落结构的优势菌群。这可能是由于革兰氏阳性菌对于恶劣的环境具有较好的抵抗力,因此在高酸、低氧的条件下,革兰氏阳性菌的生长情况较其他菌群好。
2.3 不同窖龄窖泥中微生物群落结构特征分析
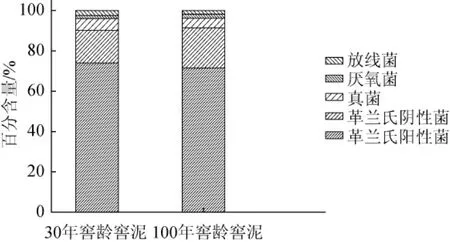
图2 不同窖龄窖泥中各类型微生物百分含量Fig.2 Percent contents of each type microbes in pit mud with different pit ages
由图2可知,100年窖龄窖泥中革兰氏阴性菌、厌氧菌的百分含量高于30年窖龄窖泥中的,而革兰氏阳性菌、真菌、放线菌的百分含量低于30年窖龄窖泥的。这可能是由于窖池在发酵过程中,微生物产生的有机酸和醇类等物质在滴窖过程中随黄水下渗至窖池底部,形成了高酸度、高乙醇及微氧的环境,使得窖池这种特殊的微环境对微生物进行了选择,那些不适合在高乙醇含量、低pH、微氧环境下生长的菌种被逐渐淘汰,而适合在这种极端环境下生长的微生物被不断的富集丰富。
2.4 不同窖龄窖泥不同位置中微生物群落结构特征分析

图3 不同窖龄不同位置各类型微生物百分含量Fig.3 Percent contents of each type microbes in pit mud with different pit ages and different positions

图4 30年(A)和100年(B)窖龄不同位置各类型微生物含量Fig.4 Content of each type microbes in different positions of 30 years old(A)and 100 years old(B)pit mud
由图3、图4可知,在30年窖龄窖池中,随着窖池由上至下,G-菌、厌氧菌、放线菌的百分含量与含量呈现先升后降趋势,真菌的百分含量与含量呈现持续下降的趋势,而G+菌的百分含量与含量呈现先降后升趋势并在底部达最大;在100年窖龄窖池中,随着窖池由上至下,G+菌、G-菌、真菌的百分含量呈现下降的趋势,其含量呈现先降后升趋势,厌氧菌、放线菌的百分含量与含量呈现上升的趋势,并且窖池底部的各类型微生物含量都较其他位置高。这可能是由于窖池在长期发酵过程中,微生物产生了大量的有机酸、腐殖质、菌体自溶物、矿物质等,它们随黄水下渗到窖池底部,使窖池底部营养物质较其他部位多,微生物能够更好地生长繁殖,加上不同位置的窖泥其含氧量不同,受氧胁迫存在差异,并且外部环境对不同位置的影响也不同,故导致了不同位置窖泥微生物群落的差异性。
2.5 不同窖龄窖池PLFA主成分分析
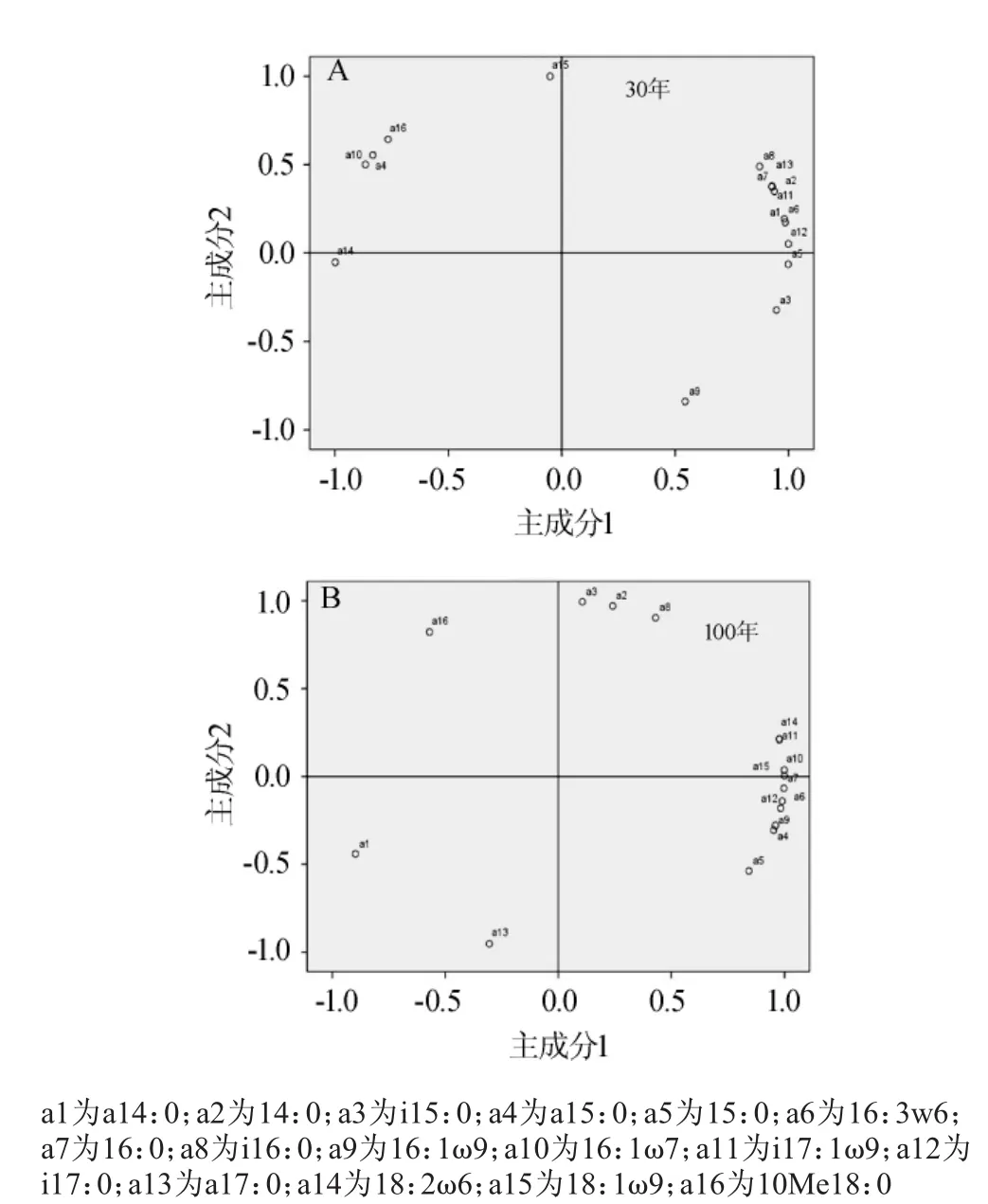
图5 30年(A)和100年(B)窖龄窖泥磷脂脂肪酸主成分分析Fig.5 PCA of PLFA in different positions of 30 years old(A)and 100 years old(B)pit mud
由图5可知,不同窖龄窖泥中PLFA可分为2种类型,主成分1(PC1)和主成分2(PC2)。PC1对30年与100年窖龄窖池微生态群落结构组成的贡献率分别为77.26%和67.91%,能够较好地反映数据所代表的信息,故用PC1来反映不同窖龄窖泥微生物群落结构的变异。由图5A可知,PC1主要集中了表征细菌PLFA组分a14:0、i15:0、15:0、i16:0、i17:0,表明细菌是30年窖龄窖池主要变异菌群;由图5B可知,PC1主要集中了表征细菌与真菌PLFA组分a15:0、15:0、16:1ω9、16:1ω7、i17:1ω9、18:2ω6、18:1ω9,表明细菌与真菌是100年窖龄窖池主要变异菌群。由各PLFA在PC1上的载荷值可知,a14:0、i15:0、a15:0、18:2ω6、18:1ω9的载荷值随着窖龄的增加而减少,表明革兰氏阳性菌与真菌对群落结构的影响减少;16:1ω9、16:1ω7、10Me18:0的载荷值随着窖龄的增加而增加,表明革兰氏阴性菌与放线菌对群落结构的影响在增加。
3 结论
窖泥微生物群落结构对白酒的香味和品质有着重要的影响,本试验通过对两种不同窖龄窖泥中微生物群落结构进行研究,结果发现100年窖龄窖泥中微生物多样性比30年的丰富,100年窖龄窖泥各类型的微生物含量高于30年窖龄窖泥的,而且细菌在两种不同窖龄窖泥中的含量与丰度较其他类型微生物高。基于PLFA组成的主成分分析结果,表明30年窖龄窖池主要变异菌群为细菌,100年窖龄窖池主要变异菌群为细菌与真菌。随着窖龄的增加,革兰氏阳性菌与真菌对群落结构的影响减少,革兰氏阴性菌与放线菌对群落结构的影响在增加。从而为全面了解窖泥微生物区系分布及主要功能微生物奠定了一定的基础,也为老窖环境的人工模拟及条件控制提供理论依据。
[1]黄治国,刘燕梅,卫春会,等.浓香型酒醅微生物群落与理化指标的相关性分析[J].现代食品科技,2014,30(11):38-42.
[2]廖永红,杨春霞,胡佳音,等.气相色谱-质谱法分析比较牛栏山牌清香型二锅头酒和浓香型白酒中的香味成分[J].食品科学,2012,33(6):181-185.
[3]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
[4]陶 勇,徐占成,李东迅,等.窖泥细菌群落结构演替及其与环境因子的相关性[J].酿酒科技,2011(9):42-46.
[5]黄治国,罗惠波,侯海波,等.浓香型白酒酒醅细菌群落结构及其变化规律[J].中国酿造,2012,31(3):100-104.
[6]郑 佳,张 良,沈才洪,等.浓香型白酒窖池微生物群落结构特征[J].应用生态学报,2011,22(4):1020-1026.
[7]YAN H,CAL Z C,ZHONG W H.PLFA analysis and its applications in the study of soil microbial diversity[J].Acta Pedologica Sinica,2006,43(5):851-859.
[8]EICKHORS T,TIPPKTTER R.Improved detection of soil microorganisms using fluorescencein situhybridization(FISH)and catalyzed reporter deposition(CARD-FISH)[J].Soil Biol Biochem,2008,40(7):1883-1891.
[9]MUYZER G,WAAL E C D,UITERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Appl Environ Microbiol,1993,59(3):695-700.
[10]罗惠波,甄 攀,黄治国.浓香型白酒窖池细菌群落[J].微生物学通报,2010,37(11):1621-1627.
[11]陕小虎,敖宗华,周 健,等.浓香型白酒窖泥原核微生物DGGE电泳条件的优化[J].酿酒科技,2011(1):37-40.
[12]颜 慧,蔡祖聪,钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].土壤学报,2006,43(5):851-859.
[13]SCHUTTER M E,DICK R P.Comparison of fatty acid methyl ester(FAME)methods for characterizing microbial communities[J].Soil Sci Soc Am J,2000,64(5):1659-1668.
[14]张会敏,束 莹,周庆伍,等.利用非培养技术研究古井贡酒大曲中的细菌群落结构[J].现代食品科技,2014,30(4):44-49.
[15]张秋芳,刘 波,林营志,等.土壤微生物群落磷脂脂肪酸(PLFA)生物标记多样性分析[J].生态学报,2009,29(8):4127-4137.
[16]邓 杰,黄治国,卫春会,等.浓香型白酒不同窖龄窖池窖泥中古菌群落结构分析[J].食品科学,2017,38(8):37-42.
[17]吴建军,蒋艳梅,吴愉萍,等.重金属复合污染对水稻土壤微生物生物量和群落结构的影响[J].土壤学报,2008,45(6):1102-1109.
[18]颜 慧,蔡祖聪,钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].土壤学报,2006,43(5):851-859.
Analysis of microbial community structure in pit mud with different pit ages based on PLFA
LI Yongbo1,DENG Bo3,LIU Yanmei4,HUANG Zhiguo1,2*
(1.College of Bioengineering,Sichuan University of Science&Engineering,Zigong 643000,China;2.Liquor Making Bio-Technology&Application of Key Laboratory of Sichuan Province,Zigong 643000,China;3.Luzhou Laojiao Co.,Ltd.,Luzhou 646000,China;4.Yibin Product Quality Supervision and Inspection Institute,Yibin 644002,China)
The microbial communitycharacteristics of two kinds of pit mud with different pit ages(30 years,100 years)were researched by phospholipid fattyacid(PLFA)biomarkermethod.Theresultsshowedthatthemicrobialcommunitydiversityinthe100yearsoldpitmudwashigherthanthatin30years,the each type microbes contents in 100 years old mud pit was more than that in 30 years.The contents and abundances of bacteria in two kinds of pit mud were higher than others types microbe,which indicated that bacteria was the dominant microbe in the pit mud.The results of phospholipid fatty acid contents analysis of two pit mud indicated that the main varied microbial community in 30 years old pit mud was bacteria,and in 100 years old pit mud was bacteria and fungi.
Luzhou flavorBaijiu;pit mud;microbial community structure;phospholipid fatty acid
TS262.3
0254-5071(2017)09-0074-04
10.11882/j.issn.0254-5071.2017.09.016
2017-03-20
国家固态酿造工程技术研究中心开放课题(2015K-246);固态发酵资源利用四川省重点实验室开放基金项目(2015GTY004);四川理工学院泸州老窖科研奖学金项目(13ljzk03);国家级大学生创新创业训练计划项目(201210622014)
李永博(1992-),男,硕士研究生,研究方向为发酵工程。
*通讯作者:黄治国(1978-),男,博士,教授,研究方向为发酵工程。
