组合处理对双菌种生物被膜的清除和杀灭效果
2017-10-24韩北忠陈晶瑜
石 靓,韩北忠,陈晶瑜*
(中国农业大学 食品科学与营养工程学院 食品质量与安全北京实验室,北京 100083)
组合处理对双菌种生物被膜的清除和杀灭效果
石 靓,韩北忠,陈晶瑜*
(中国农业大学 食品科学与营养工程学院 食品质量与安全北京实验室,北京 100083)
该研究建立了食源性病原菌(液化沙雷菌S1和腐生葡萄球菌S2)双菌种生物被膜研究模型,采用微孔板法和MTT法检测单一、组合处理方式对双菌种生物被膜的清除和杀灭效果。研究发现,采用24孔板37℃于TSB培养基中培养24 h可获得稳定的液化沙雷菌-腐生葡萄球菌双菌种生物被膜,组合处理方式优于单一处理效果,处理顺序的不同也会影响生物被膜的清除和杀灭效果,1%NaOH处理20 min再用0.3%NaClO处理20 min清除效果最好,双菌种生物被膜的量由1.11(OD595nm)减少至0.08(OD595nm),杀灭率达95.73%。
双菌种生物被膜;液化沙雷菌;腐生葡萄球菌;组合处理
生物被膜(biofilm)是自然条件下,微生物粘附于接触表面,分泌胞外多聚物(extracellular polymeric substance,EPS)等粘性基质,将其包裹其中而形成的大量细菌聚集膜样物,它是微生物的普遍生长方式之一[1]。其胞外多聚物主要由多糖、蛋白质、核酸、脂质等构成,这些物质使生物被膜具有复杂的形态、结构和物理化学性质[2]。相较于游离态的微生物,微生物能够稳定存在于环境中,大多数食源性病原菌污染的食品都是与被膜态存在的微生物有关[3]。目前生物被膜的研究多集中于单一菌种生物被膜,而在自然状态下生物被膜以多菌种状态生存[4],被膜菌种差异取决于不同环境[5],目前广泛接受的一种方式是建立双菌种被膜的模型来研究被膜的性状[6-8],从而对实际应用更具有指导意义。
单一菌种生物被膜对逆境条件和杀菌剂的抗性取决于微生物种类、接触面材质、温度、pH、营养状况等,而混合被膜中的菌间交互协同作用将改变生物被膜的生理状态、细胞间通信等,对增强生物被膜的抗性和耐受性起到一定作用[9-10]。环境中多以混合生物被膜形式存在,生物被膜的存在对肉品工业构成威胁,会造成产品交叉污染、货架期缩短以及食源性疾病的传播[11-12]。目前,对食品工业中生物被膜的清除和控制主要方式有:物理方法(高压喷射、紫外线、超声波处理)、化学方法(次氯酸钠、过氧乙酸、过氧化氢、臭氧)、生物方法(酶、噬菌体)[13-14]。FERNANDESMD等[15]用不同化学试剂处理从乳清干酪中分离出的粪肠球菌和屎肠球菌混合形成的生物被膜,发现组合使用化学试剂处理效果最佳,且清洁步骤和杀菌剂种类对被膜清除至关重要。MATHIEU L等[16]证明了用水冲洗可对被膜产生剪切作用,用消毒剂氯化作用产生氧化胁迫清除75%的被膜群落,结合用物理化学作用破坏生物被膜的物理和化学的平衡,不同处理方法对生物被膜根除机制和致死机理的不同,产生不同程度的清除效果,因而,不同方法的合理组合及操作顺序对控制生物被膜尤为关键[17]。
本研究通过建立液化沙雷菌、腐生葡萄球菌双菌种生物被膜模型,确定最佳培养条件,探讨各种单一、组合处理方式对双菌种生物被膜杀灭情况,为研究双菌种生物被膜的防治措施提供实验材料和理论依据。
1 材料与方法
1.1 材料与试剂
液化沙雷菌(Serratia liquefaciens)S1、腐生葡萄球菌(Staphylococcussaprophyticus)S2均分离自北京市通州区某肉品加工厂熟肉制品生产区;脑心浸出液肉汤(brain heart infusion,BHI)、营养肉汤(nutrient broth,NB)培养基、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基:北京奥博星生物技术有限责任公司;结晶紫:北京北化精细化学有限责任公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、NaOH(分析纯)、68%HNO3(分析纯)、苯扎氯铵(benzalkonium chloride,BC):北京北化精细化学有限责任公司;洗洁精:上海白猫(集团)有限公司;次氯酸钠(分析纯):济宁恒泰化工有限公司。
1.2 仪器与设备
DHP-9052电热恒温培养箱:上海一恒科学仪器有限公司;SKY-2102C振荡培养箱:上海苏坤实业有限公司;2800UV)紫外分光光度计:尤尼科(上海)仪器有限公司;Wellscan MK3酶标仪:美国热电有限公司;24孔细胞培养板(3524):美国COSTAR公司。
1.3 方法
1.3.1 菌种活化与菌悬液制备
将之前分离纯化得到的液化沙雷菌S1、腐生葡萄球菌S2接种于TSA培养基上,于37℃培养24 h,挑取单菌落接种于3%TSB中,于37℃、100 r/min分别培养12 h和14 h至对数中后期以备用。
1.3.2 生物被膜生物量的测定
结晶紫染色法[18],烘干培养有单、双菌株生物被膜的孔板,并用无水甲醇固定,每孔中加1 000 μL草酸铵结晶紫染色20 min,倾倒染色液后蒸馏水洗至不再褪色,晾干后每孔加1 000 μL 33%醋酸脱色,充分溶解后用酶标仪测定波长595 nm处的吸光度值。
1.3.3 生物被膜活菌量的测定
吸取无菌磷酸盐缓冲溶液(phosphate buffered saline,PBS)冲洗孔板3次,避光进行实验操作,先加入10%MTT溶液100μL,后加入3%TSB培养基900μL混合均匀[19]。37℃避光培养5 h后取出,无菌PBS清洗后,加入1 mL二甲基亚砜(dimethyl sulfoxide,DMSO)静置10 min,使结晶物甲瓒充分溶解。用酶标仪测定波长490 nm处的吸光度值[20]。
1.3.4 不同培养条件对单双菌种生物被膜形成的影响
按照2%的接种量将接种于孔板中的单、双菌株(混合比例1∶1)生物被膜分别于15℃、30℃和37℃条件下培养24 h,研究温度对单、双菌种生物被膜形成的影响;将接种有单、双菌株生物被膜的孔板于37℃条件下培养24h和48h,探究培养时间对生物被膜的影响;将单双菌株接种于BHI、NB、TSB培养基中培养,探究不同培养基对生物被膜的影响。重复试验3次,结晶紫染色法测定OD595nm,确定最佳培养条件。
1.3.5 单一处理条件对双菌种生物被膜的影响
为探究不同单一处理条件对双菌种生物被膜的影响,分别采用70℃、80℃、90℃恒温水浴处理20 min,1%NaOH(pH=13.40)和1%HNO3(pH=0.80)处理无菌PBS清洗过的生物被膜20 min,0.3%NaClO、0.3%洗洁精、0.3%苯扎氯铵处理无菌PBS清洗过的生物被膜20 min,考察不同培养温度、pH值、消毒洗涤剂对双菌种生物被膜的影响。用结晶紫染色法测定生物被膜的生物量,用MTT染色法测定生物被膜中微生物的杀灭率。杀灭率计算公式如下:

1.3.6 双重处理条件对双菌种生物被膜的影响
为探究不同温度和pH值交互处理对生物被膜的影响,采用不同温度(70℃、80℃或90℃)结合不同pH值条件(1%NaOH或者1%HNO3溶液)同时处理,条件设计如表1所示。

表1 不同温度和pH值处理方法Table 1 Treatments of different temperature and pH
为探究不同温度和消毒/洗涤剂交互处理对生物被膜的影响,采用不同温度(70℃、80℃或90℃)结合不同消毒/洗涤剂(0.3%NaClO、0.3%洗洁精或0.3%BC)同时处理,条件设计如表2所示。
为探究pH值和消毒/洗涤剂交互处理对生物被膜的影响,采用不同pH环境(1%NaOH或1%HNO3)结合不同消毒/洗涤剂(0.3%NaClO、0.3%BC或0.3%洗洁精)分别处理,处理方案如表3所示。

表2 不同温度和消毒/洗涤剂处理方法Table 2 Treatments of different temperature,disinfectants and detergents

表3 不同pH和消毒/洗涤剂处理方法Table 3 Treatments of different pH,disinfectants and detergents
2 结果与分析
2.1 培养条件对单、双菌株生物被膜生长情况的影响
不同培养时间、温度条件对单、双菌种生物被膜生物量的影响情况如图1、图2所示。

图1 培养时间对单、双菌株生物被膜形成的影响Fig.1 Effect of incubation time on the formation of single-and dual-species biofilms
由图1可知,液化沙雷菌和双菌种混合(1∶1)培养形成的生物被膜量随着时间的延长均呈现增长的情况,而腐生葡萄球菌情况相反,培养48 h后形成的生物被膜量比24 h的要少,且双菌种混合生物被膜的量在培养24h和48h后均多于相应时间下单菌株生物被膜的量。尽管双菌种混合培养48h形成的生物被膜的量多于24h的培养,但为了符合实际生产条件的情况以及避免腐生葡萄球菌培养48 h形成生物被膜量少于培养24 h这一情况对实验可能造成的影响,在后续的试验中选用培养24 h形成的单、双菌株生物被膜进行实验处理。
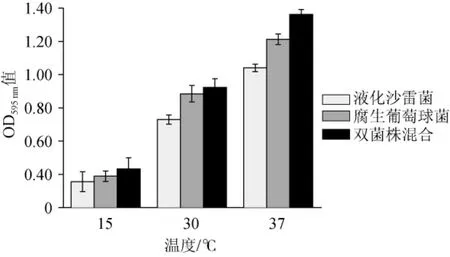
图2 温度对单、双菌株生物被膜形成的影响Fig.2 Effect of temperature on the formation of single-and dual-species biofilms
由图2可知,在15℃的培养条件下培养24 h后,两株单菌株分别培养以及混合菌株培养形成的生物被膜生物量相比较于30℃和37℃条件下形成的生物被膜量最少,说明低温是抑制生物被膜形成的因素,与文献结论一致[21]。37℃条件下形成的生物被膜量还是略高于30℃生物被膜量。此外,37℃是两种细菌的最适生长温度,说明在最适生长温度下利于这两种细菌更分泌胞外物质,从而导致被膜生物量的积累。在3种不同温度下混合生物被膜的形成量均多于单一菌种的生物被膜量。
2.2 单一处理方式对双菌株生物被膜清除和杀灭试验
在各种处理方式一次处理后对生物被膜生物量和杀灭率的影响情况如图3、图4所示。

图3 单一处理方式对双菌种生物被膜的清除作用Fig.3 Removal effects of different single treatments on dual-species biofilms
由图3可知,随着对双菌株生物被膜处理温度的升高,其生物量逐渐降低。对生物被膜用1%NaOH或1%HNO3处理20 min后,可发现用1%NaOH处理对生物被膜的清除效果比1%HNO3要好。在使用消毒/洗涤剂一次处理后,可发现对生物被膜的清除效果由强到弱排序为0.3%NaClO>0.3%BC>0.3%洗洁精。由图4可知,在不同温度处理中,随着温度的升高,对生物被膜中微生物的杀灭效果增强,与生物量清除效果的测定结果一致。对生物被膜用1%NaOH或1%HNO3处理20 min后,两者对生物被膜的杀灭效果差别不大,对生物被膜中的微生物并未完全杀死,说明生物被膜的胞外多聚物对其包裹的微生物有一定的保护作用。酸碱都能渗入到微生物胞内从而使其致死,而1%NaOH清除与杀灭作用都很明显,可能原因是NaOH能通过皂化反应清除构成生物被膜胞外多聚物的主要成分脂肪和蛋白等,有利于NaOH的渗入,HNO3通过化学反应去除钙盐和矿物油等,其所占胞外多聚物的比例并不大。消毒/洗涤剂一次处理对生物被膜中微生物的杀灭效果由强到弱排序为0.3%NaClO>0.3%BC>0.3%洗洁精。与图3比较发现,0.3%洗洁精对生物被膜有较强的去除效果但对微生物的杀灭作用极弱,这是由于洗洁精的主要成分是烷基磺酸钠、脂肪醇醚硫酸钠,两者都是阴离子表面活性剂,具有良好的去污和乳化力,对生物被膜具有一定的剥离效果,但难以渗入到细菌胞内产生致死效果。
2.3 组合处理方式对双菌株生物被膜清除和杀灭实验
组合处理方式(不同温度和pH值、不同温度和消毒/洗涤剂、pH值和消毒/洗涤剂)对单、双菌株生物被膜清除和杀灭情况的实验结果分别如图5~图7所示。
由图5可知,与单一处理方式相比较,组合处理方式能够显著提升对双菌株生物被膜的清除效果和对其中细菌的杀灭率(P<0.05)。在不同pH值或不同处理顺序下不同温度对生物被膜的清除效果随着温度的升高而逐渐增强,这与上述单一不同温度处理方式的结果一致,但不同温度与不同pH值组合处理时,温度的提升对杀灭率无显著提升。在热水协同处理有1%NaOH参与的处理A1、A3、A5中,无论是对生物被膜的清除效果还是对其中微生物的杀灭程度皆优于有1%HNO3参与的处理。这是由于NaOH能去除生物被膜上的蛋白质、脂质等主要构成物质,失去了胞外多聚物的保护使构成生物被膜的细菌更容易受到不同温度胁迫以及离子渗入而致死。图5中可见组合处理作用顺序的不同对生物被膜中微生物的清除杀灭效果也会不同,在1%NaOH与热水处理的组合中,对生物被膜清除杀灭效果由强到弱顺序为A5:先1%NaOH后热水处理>A1:1%NaOH与热水共同作用>A3:先热水后1%NaOH处理。可见相同的处理因素不同的处理顺序会有不同的效果,为优化实际生产中消毒/洗涤步骤提供了一定的理论依据。

图4 单一处理方式对双菌种生物被膜的杀灭效果Fig.4 Killing efficacy of different single treatments on dual-species biofilms

图5 组合处理方式(不同温度和pH值)对双菌株生物被膜清除和杀灭效果Fig.5 Removal effect and killing efficacy of combination treatments(different temperature and pH)on dual-species biofilms
由图6可知,在不同温度与消毒/洗涤剂共同处理情况下,生物被膜的清除杀灭效果并没有随着温度的升高而升高。采用0.3%NaClO与热水的组合方式相较于0.3%BC、0.3%洗洁精和热水的组合方式,对生物被膜的清除杀灭效果为最优,其中根据处理顺序不同处理效果由大到小排列为B1:0.3%NaClO共热水>B4:先热水后0.3%NaClO>B7:先0.3%NaClO后热水,可见0.3%NaClO与水共热能够使得NaClO发挥出最强的清除生物被膜杀灭其中细菌的效果。在本组试验中,当0.3%BC与不同温度热水同时作用于生物被膜时,对生物被膜的清除效果甚至不如单独采用不同温度处理,但对其中细菌的杀灭率很高,在80℃和90℃时与BC共同作用杀灭率甚至达100%,说明0.3%BC与不同温度热水同时作用仅仅是将生物被膜中的细菌杀死,而残存有死亡菌体与胞外多聚物在经处理过的表面仍然可被结晶紫所染色。在0.3%洗洁精与不同温度热水的组合B2、B5、B8中,可见洗洁精对生物被膜的清除效果较为显著而对其中细菌的杀灭效果较差,此现象与上述实验图3所示单一操作处理的结果相一致。

由图7可知,在pH与消毒/洗涤剂共同作用下,可以发现在先使用NaOH的操作中,对生物被膜具有最好的清除效果和杀灭率,其次是先使用0.3%NaClO再使用别的操作,尤其是先使用0.1%NaOH再使用0.3%NaClO处理生物被膜的时候清除与杀灭的效果最为良好。在本组试验中,可发现0.3%BC的杀灭效果甚至优于0.1%NaOH以及0.3%NaClO,但其对生物被膜的清除效果是这5种组合操作中最差的,此结果与上述图6结果相一致。在本组pH与消毒/洗涤剂共同作用的实验中,BC对生物被膜的清除能力以及洗洁精对生物被膜的杀灭能力都较弱,但联合使用其他处理方式弥补了以上两种对生物被膜的作用劣势,并且较大程度地发挥了优势。

图7 组合处理方式(pH值和消毒/洗涤剂)对双菌株生物被膜清除和杀灭效果Fig.7 Removal effect and killing efficacy of combination treatments(pH and disinfectant/detergent)on dual-species biofilm
3 结论
温度、营养条件、培养时间都能影响由液化沙雷菌和腐生葡萄球菌所构成的双菌种生物被膜的生长,选用TSB培养基和接近最适生长温度(37℃)最有利于双菌种生物被膜的大量生长,在双菌种生物被膜的培养过程中需要考虑浮游状态细菌和生物被膜状态的细菌的营养竞争以及两种细菌之间的相互作用,选取生长24 h的双菌种生物被膜进行下一步实验符合实际生产条件。
不同温度、pH值、消毒/洗涤剂对生物被膜处理皆具有显著的清除效果,组合处理方式相较单一处理方式有效提升了对双菌种生物被膜的清除和杀灭效果,采用1%NaOH和0.3%NaClO兼备了强力清除和高效杀灭的能力。两者联合使用处理顺序的不同也会影响到处理结果,双重处理先用1%NaOH处理20 min再用0.3%NaClO处理20 min清除效果最佳,双菌种生物被膜的量由1.11(OD595nm)减少至0.08(OD595nm),杀灭率可达95.73%。双菌种生物被膜研究模型的构建为研究自然状态下的生物被膜提供了理论依据,控制生物被膜处理方式的探究,为制定食品加工中控制生物被膜的有效措施提供了试验数据与理论参考。
[1]KAY M K,ERWIN T C,MCLEAN R J C,et al.Bacteriophage ecology inEscherichia coliandPseudomonas aeruginosamixed-biofilm communities[J].Appl Environ Microbiol,2011,77(3):821-829.
[2]FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nat Rev Microbiol,2010,8(9):623-633.
[3]BROOKS J D,FLINT S H.Biofilms in the food industry:problems and potential solutions[J].Int J Food Sci Technol,2008,43(12):2163-2176.
[4]COSTERTON J W,LEWANDOWSKI Z,DEBEER D,et al.Biofilms,the customized microniche[J].J Bacteriol,1994,176(8):2137-2142.
[5]YANG L A,LIU Y,WU H,et al.Current understanding of multi-species biofilms[J].Int J Oral Sci,2011,3(2):74-81.
[6]HABIMANA O,MORETRO T,LANGSRUD S,et al.Micro ecosystems from feed industry surfaces:a survival and biofilm study ofSalmonella versushost resident flora strains[J].Bmc Vet Res,2010,6:48-58.
[7]GIAOURIS E,CHORIANOPOULOS N,DOULGERAKI A,et al.Co-culture withListeria monocytogeneswithin a dual-species biofilm community strongly increases resistance ofPseudomonas putidato benzalkonium chloride[J].Plos One,2013,8(10):e77276.
[8]LIU N T,NOU X W,LEFCOURT A M,et al.Dual-species biofilm formation byEscherichia coliO157:H7 and environmental bacteria isolated from fresh-cut processing facilities[J].Int J Food Microbiol,2014,171:15-20.
[9]BEHNKE S,PARKER A E,WOODALL D,et al.Comparing the chlorine disinfection of detached biofilm clusters with those of sessile biofilms and planktonic cells in single-and dual-species cultures[J].Appl Environ Microbiol,2011,77(20):7176-7184.
[10]BRIDIER A,SANCHEZ-VIZUETE P,GUILBAUD M,et al.Biofilmassociated persistence of food-borne pathogens[J].Food Microbiol,2015,45(Pt B):167-178.
[11]GIAOURIS E,HEIR E,HEBRAUD M,et al.Attachment and biofilm formation by foodborne bacteria in meat processing environments:Causes,implications,role of bacterial interactions and control by alternative novel methods[J].Meat Sci,2014,97(3):298-309.
[12]KOSTAKI M,CHORIANOPOULOS N,BRAXOU E,et al.Differential biofilm formation and chemical disinfection resistance of sessile cells ofListeria monocytogenesstrains under monospecies and dual-species(withSalmonella enterica)conditions[J].Appl Environ Microbiol,2012,78(8):2586-2595.
[13]SREY S,JAHID I K,HA S D.Biofilm formation in food industries:A food safety concern[J].Food Control,2013,31(2):572-585.
[14]孙纪录,陈小雪,韩北忠.金黄色葡萄球菌生物被膜的控制方法研究进展[J].中国酿造,2011,30(6):1-3.
[15]FERNANDES M D,KABUKI D Y,KUAYE A Y.Biofilms ofEnterococcus faecalisandEnterococcus faeciumisolated from the processing of ricotta and the control of these pathogens through cleaning and sanitization procedures[J].Int J Food Microbiol,2015,200:97-103.
[16]MATHIEU L,BERTRAND I,ABE Y,et al.Drinking water biofilm cohesiveness changes under chlorination or hydrodynamic stress[J].Water Res,2014,55:175-184.
[17]HA J H,HA S D.Synergistic effects of sodium hypochlorite and ultraviolet radiation in reducing the levels of selected foodborne pathogenic bacteria[J].Foodborne Pathogen Dis,2011,8(5):587-591.
[18]DI BONAVENTURA G,PICCOLOMINI R,PALUDI D,et al.Influence of temperature on biofilm formation byListeria monocytogeneson various food-contact surfaces:relationship with motility and cell surface hydrophobicity[J].J Appl Microbiol,2008,104(6):1552-1561.
[19]方 蓉,李芳秋,武建国.MTT比色法的条件探讨[J].临床检验杂志,2003(1):34-35.
[20]边兴艳.MTT比色法及其应用[J].国外医学:临床生物化学与检验学分册,1998(2):83-85.
[21]MORIMATSU K,HAMANAKA D,TANAKA F,et al.Effect of temperature fluctuation on biofilm formation with bacterial interaction betweenSalmonellaentericaandPseudomonasputida[J].JFacAgrKyushu U,2013,58(1):125-129.
Removal effect and killing efficacy of combination treatments on dual-species biofilms
SHI Liang,HAN Beizhong,CHEN Jingyu*
(Beijing Laboratory for Food Quality and Safety,College of Food Science&Nutritional Engineering,China Agricultural University,Beijing 100083,China)
The study mainly focused on the establishment of a dual-species biofilm model formed by two foodborne pathogenic bacteriaSerratia liquefaciensS1 andStaphylococcus saprophyticusS2.Microtitor-plate method and MTT assay were used to measure the removal effect and killing efficacy of single or combination treatments on dual-species biofilm formation.The results showed that the stable dual-species biofilms,consisting of S.liquefaciensS1 andS.saprophyticusS2,could be obtained in tryptone soy broth(TSB)at 37℃for 24 h.The effects of combined treatments were better than single treatments.Moreover,in combined treatments,the removal effect and killing efficacy were also influenced by treatment orders.Resultsindicated that when the dual-species biofilms were treated with 1%NaOH for 20 min firstly and then disposed with 0.3%NaClO for another 20 min,the removal effects of biofilms were better than that under other conditions,while the dual-species biofilms quantity decreased from 1.11(OD595nm)to 0.08(OD595nm)and the killing efficacy reached to 95.73%.
dual-species biofilms;Serratia liquefaciens;Staphylococcus saprophyticus;combination treatment
TS201.3
0254-5071(2017)09-0019-06
10.11882/j.issn.0254-5071.2017.09.005
2017-04-12
国家自然科学基金资助项目(31371716)
石 靓(1991-),女,硕士研究生,研究方向为食品微生物学。
*通讯作者:陈晶瑜(1978-),女,副教授,博士,研究方向为食品微生物学与分子生物学。
