白细胞介素36的研究进展①
2017-10-24满忠松王博飞张海涛
王 飞 满忠松 翟 敏 王博飞 张海涛 赵 鑫
(苏州大学附属第一医院普外科,苏州 215006)
白细胞介素36的研究进展①
王 飞 满忠松 翟 敏 王博飞②张海涛 赵 鑫
(苏州大学附属第一医院普外科,苏州 215006)
白细胞介素1家族(Interleukin-1 family,IL-1F)是一组结构相似、功能相关的细胞因子,近年来的研究发现其在人类的很多疾病的发生发展中起着重要的作用。IL-1F主要有IL-1α、IL-1β、IL-1Ra、IL-18、IL-33、IL-36α、IL-36β、IL-36Ra、IL-33、IL-37和IL-38[1]。按照分子在体内发挥的免疫学作用进行分类,大体可分为:7 个激活型配体成员(如 IL-1α、IL-1β、IL-18、IL-33、IL-36α、IL-36β和IL-36γ),3 个受体拮抗性成员(如 IL-38、IL-1Ra和IL-36Ra)和 1 个抗炎症因子(IL-37)[2](图1)。最初,白细胞介素36 细胞因子(Interleukin-36,IL-36)亚家族是通过一系列对人类基因组序列编码IL-1的同系物的分析时发现的[3-7]。在2010年前分别被称为IL-1F6、IL-1F8、IL-1F9、IL-1F10和IL-1F5[8]。后来,通过多种构建的动物模型,体外细胞实验发现,IL-1F6、IL-1F8、IL-1F9、IL-1F5这四个细胞因子有着相同的受体IL-36R,因此将其分别重新命名为:IL-36α(IL-1F6)、IL-36β(IL-1F8)、IL-36γ(IL-1F9)和IL-36Ra(IL-1F5)[9],统称为IL-36。IL-1F10则命名为IL-38。IL-36中IL-36α、β、γ是受体激动剂,IL-36Ra是天然的受体拮抗剂。它们的共受体,由 IL-36受体(IL-36 receptor,IL-36R也被称为IL-1Rrp2或者IL-1RL2)和IL-1RAcP[10]组成。相关研究发现IL-36主要表达在角质形成细胞、支气管上皮细胞、单核-巨噬细胞和T淋巴细胞中。它们是一些具有多种生物活性的分子,主要在人体的炎症过程、免疫反应等生理或病理进程中发挥作用[4]。最近的多项研究显示,其与人类的某些肿瘤的发生、发展有着密切的联系。现就其生物学特点、受体与信号通路、与临床疾病的关系及应用前景进行综述。
1 IL-36的生物化学特点及表达
1.1IL-36亚家族的表达及生物学特点 研究认为编码人的IL-36基因定位于2号染色体的IL-1F基因簇上的一段约400 kb的区域上,其基因定位与多个IL-1家族成员相同[11]。因此,这也在决定了IL-36亚家族与IL-1家族的高度相似性。例如IL-36分子的空间结构与其他IL-1家族成员极为相似,它们都包含有一个β三叶草结构和疏水核心,并且都缺少了一个信号肽和胱天蛋白酶1(Caspases-1)切割位点[12,13]。另外,在IL-36亚家族成员之间或者与IL-1家族其他成员之间,其分子同源性有许多相似之处。例如,IL-36与IL-1家族其他成员的同源性约为13%~56%。Towne等[14]分别用人与小鼠的IL-36分子证实了IL-36与IL-1家族的另一个共同点,它们都需要其N端被切除才能成为具有最大生物活性的分子。该研究发现N端被移除的IL-36分子其生物学活性可提升1 000~10 000倍,这也证实了IL-36相比IL-1F其他成员有更强的免疫调理及免疫激活作用,是树突状细胞(Dendritic cells,DCs)和T细胞的强效调节剂,参与DC与Th1(Ⅰ辅助型T细胞)细胞的激活、抗原提呈和诱导促炎因子产生,在免疫反应中具有巨大的潜能。这些既往研究为进一步探究IL-36的免疫学功能及其机制打下了基础。

图1 IL-1F的成员及简介[2]Fig.1 IL-1 family′s members and profiles[2]Note:Proinflammatory cytokines on behalf of the round,triangle represents the anti-inflammatory factor;digital represent the number of amino acid residues;the left vertical line indicating the possible presence of Caspases-1 cleavage sites or the family of the shared A-X-D sequence upstream of 9 amino acid residues at intervals.
1.2IL-36的表达 IL-36亚家族在多种组织细胞中有表达,现已证实其在皮肤、食道、扁桃体、脑组织细胞、肺中都有低水平的表达[15,16]。并且,近年来的研究发现IL-36在支气管上皮细胞、滑膜成纤维细胞、软骨细胞、结肠黏膜细胞、单核/巨噬细胞和T淋巴细胞中表达并起到相关作用[17,18]。IL-36β在角质细胞、T淋巴细胞、人类胎儿的结肠和骨骼肌等细胞中表达[19,20]。IL-36γ在人类子宫、支气管上皮细胞,大鼠的多种组织和细胞中皆有表达。IL-36Ra为IL-36的天然受体拮抗剂,广泛存在于人类的多种组织细胞中。有研究发现,在皮肤组织中IL-36分子成员可以在某些细胞因子的影响下表达上调,继而引起银屑病皮肤损害加重[20];Turtoi等[21]发现人类的外周血淋巴细胞可以在α射线照射后分泌IL-36γ,而IL-36γ具有抗肿瘤的作用[22]。
2 IL-36的受体与信号通路及免疫学特点
2.1IL-36的受体 Debets等[23]和Towne等[24]先后证明了IL-36α、β、γ的共同受体为IL-1Rrp2即IL-36R。值得一提的是,IL-36R并不能简单地与IL-36家族分子结合,还需要一个重要的辅助蛋白IL-1RAcP[10],该蛋白是IL-36Ra分子参与调控IL-36信号负调节通路的重要结构。
2.2IL-36的作用信号通路 早在2001年Dunn等[11]就揭示了IL-36的信号通路,IL-36α、β、γ是通过结合IL-36R和IL-1RAcP,最终激活NF-κB通路和MAPKs通路起作用。
IL-36细胞因子与IL-1F细胞因子结构功能相似,IL-36α、β、γ的细胞因子信号都是通过结合异源二聚体受体起作用,该受体又由IL-36R和IL-1R/AcP(Acyl Carrier Protein,酰基-载体蛋白质)组成。根据其在细胞内外的位置,可分为三部分即胞外段,跨膜段和胞内段。胞外段也称为“配体结合域”,含有3个免疫球蛋白样的结构域,可特异性的与IL-36α、β、γ结合。因此主要的受体结合亚单位IL-36R对IL-36来说是独一无二的。相反,AcP则可与IL-1α、IL-1β和IL-33共享。IL-36α、IL-36β、IL-36γ与IL-36R特异性结合会引起IL-36R的结构变化,从而招募AcP相互作用形成异源二聚体,产生细胞内信号转导,进而产生跨膜受体胞内段TIR(Toll/IL-1 receptor domain,TIR)结构域的变化,招募接头蛋白MyD88(Myeloid differentiation factor 88),最终激活NF-κB通路和由JNK或者ERK1/2介导的MAPKs通路[24]。这个过程与其他IL-1家族成员的方式相似。类似IL-1F,自然界还有IL-36Ra存在,即IL-36的天然受体拮抗剂。其作用方式与IL-1Ra相似,IL-36Ra结合IL-36R后可以竞争性阻止IL-36α、IL-36β和IL-36γ与IL-36R相结合,IL-36Ra结合IL-36R后并不能招募AcP,因此,IL-36Ra与IL-36R结合并不启动上文提到的信号通路反应。综上,IL-36Ra是IL-36α、IL-36β和IL-36γ这三个细胞因子竞争IL-36R的天然拮抗剂(图2)[25,26]。
2.3IL-36的免疫作用特点 IL-36可以在多种免疫细胞或者实质细胞中表达,如单核/巨噬细胞、树突状细胞、T细胞亚群、朗格汉斯细胞等[15,16]。原代巨噬细胞可以表达IL-36β和IL36-Ra,接受TLR(Toll-like receptor,TLR)介导的信号转导刺激后还可以表达IL-36α和IL-36γ[27]。人和小鼠的DC细胞都可以表达IL-36R,可以特异性的与IL-36亚家族分子结合,从而启动信号通路,在固有免疫和适应性免疫反应中起到了关键作用[19]。人类的DC可以被诱导表达IL-36R,由角质细胞或者其他上皮细胞分泌的IL-36分子可以激活DC分泌IL-12和IL-18[28,29],其在DC对T细胞抗原提呈过程中,可以诱导Th1的分化与γ-干扰素(Interferon-γ,IFN-γ)的分泌(图3)。另外,不只是免疫细胞可以表达IL-36R,髓样树突状细胞(Myeloid dendritic cells,MDCs)也可以高表达IL-36、IL-36分子,且可以通过刺激MDCs产生多种细胞因子,包括IL-1、IL-6、IL-12、IL-23、IL-18,并且可以诱导MDCs的分化[26,28]。Th1细胞产生IL-2、IFN-γ、IL-12和TNF-α细胞因子,参与细胞的促炎症反应,通过激活CD8+细胞毒性T淋巴细胞(CTL),和NK细胞介导的细胞毒作用发挥有效的抗肿瘤作用[30]。 IFN-γ具有抗病毒、免疫调节及抗肿瘤特性。然而,最近有一项研究发现,IL-36α也可以加强小鼠Th2(Ⅱ辅助型T细胞)的功能,直接抑制Th17细胞的分化[31]。IL-36不仅对T细胞发挥作用,而且还有研究发现IL-36R在人类的CD19+B细胞亚群中表达[32],但是IL-36亚家族对B细胞介导的免疫反应机制还需要进一步探索。上述的各种细胞和细胞因子与人类的生命活动息息相关,所以,对IL-36分子的研究可以帮助我们更深入的了解许多生理或疾病现象。
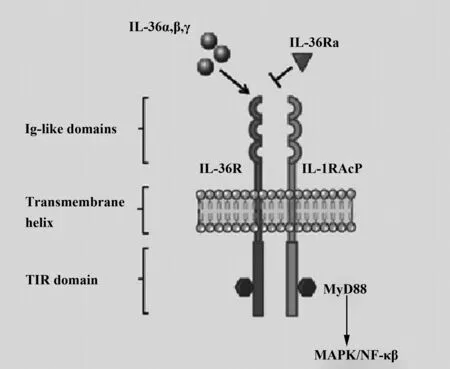
图2 IL-36作用的信号通路[10]Fig.2 IL-36 signaling pathway[10]
3 IL-36分子与多种疾病的关系
3.1IL-36与皮肤疾病的关系 IL-36分子在皮肤中相对高表达,所以近年来与皮肤疾病相关领域的研究较多。多项研究证明,IL-36分子与银屑病的发生发展有密切联系,在银屑病患者的皮损中发现了IL-36R和IL-36分子的表达[33-35]。调控IL-36α和IL-36γ表达的基因在银屑病的皮损中有明显的上调[35]。研究证实,IL-36α和IL-36γ在银屑病皮损中的高表达与IL-17、IL-23、TNF-α和IFN-γ的表达密切相关[36],说明可能存在一种正调控通路,促进皮损的发生和发展。这意味着,IL-36分子可能是多种分子的上游调控分子,参与多种疾病的分子调控机制。另外,对银屑病小鼠接种人类抗IL-36R的中和性单克隆抗体,可以使其皮肤病理学表现趋向正常化[20]。
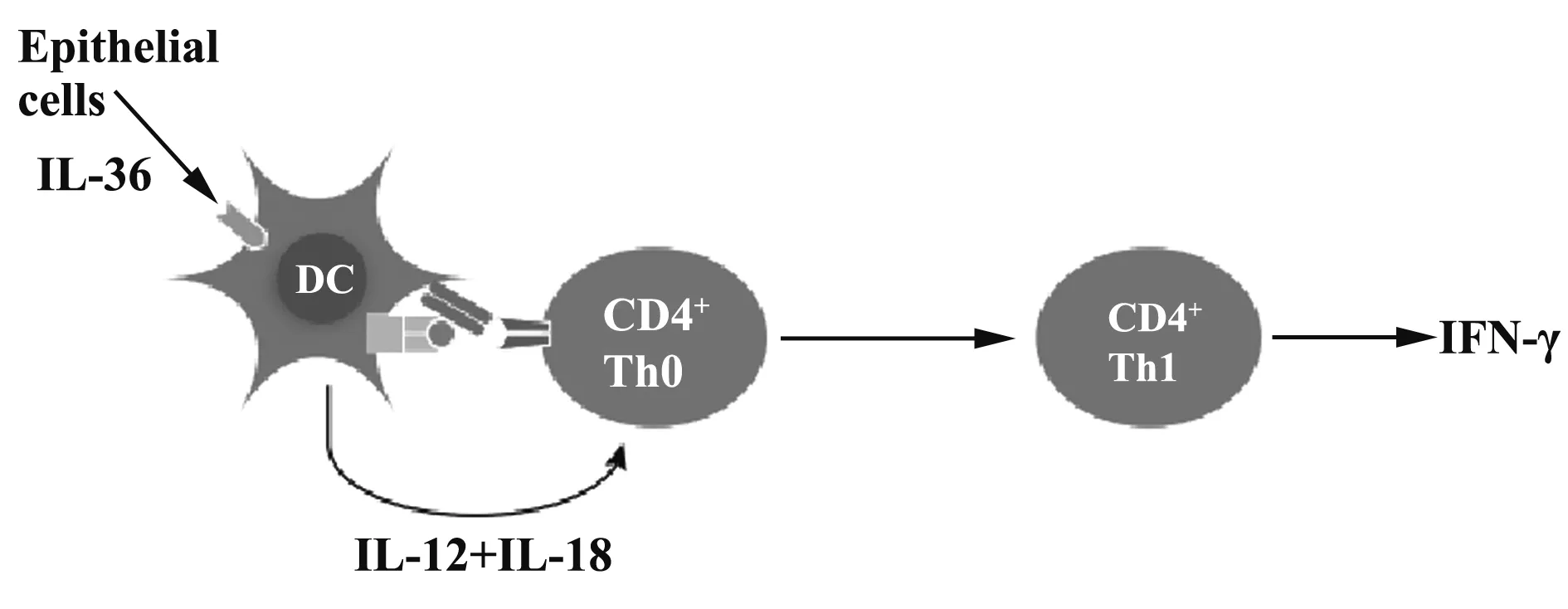
图3 IL-36分子的主要免疫作用示意图[17]Fig.3 Schematic diagram of major immune effect of IL-36[17]
弥漫型脓疱银屑病(Generalized pustular psoriasis,GPP)是一种严重的,甚至会对患者产生生命危险的银屑病。Marrakchi等[37]通过对13名GPP患者的研究发现,在这些患者的调控IL-36Ra的基因上发现了一种致病突变,这种突变会使翻译出的蛋白质失去应有的活性和稳定性,导致IL-36Ra的失活,IL-36Ra是IL-36R的受体拮抗剂,其在人体内失去活性可能会导致IL-36分子及其调控的信号通路失常。另外,舒丹等[38]发现GPP患者血清IL-36β、γ水平越高,患者的皮损面积越大,这意味着GPP病情严重度与血清IL-36β、γ的表达量呈正相关。所以IL-36分子参与的信号通路可能与GPP的发生和发展有重要的联系。
对小鼠的研究发现,IL-36γ通过与IL-36R受体结合,激活下游p38-AKt-β-catenin信号通路,诱导REG3A的表达,最终促进角质细胞的增殖。即IL-36γ有促进皮肤伤口愈合的能力。这意味着IL-36γ细胞因子的作用机制可能为治疗人类皮肤伤口提供了新的理论依据。
3.2IL-36与炎症性肠病(Inflammatory bowel disease,IBD)的关系 IBD为累及回肠、直肠、结肠的一种特发性肠道自身免疫性疾病。临床表现腹泻、腹痛,甚至可有血便。本病主要包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)。UC是结肠黏膜层和黏膜下层连续性炎症,疾病通常先累及直肠,逐渐向全结肠蔓延,CD可累及全消化道,为非连续性全层炎症,最常累及部位为末端回肠、结肠和肛周。IBD并发症多且严重,而它们的发病机制尚未明确。
研究发现,IL-36亚家族分子的作用可能是调控IBD发生和发展的潜在因素。在人类正常的结肠组织中IL-36α与IL-36γ可有少量的表达,但在IBD患者的结肠黏膜中,它们的表达量增加[27,31,39]。在人类IBD患者与构建的IBD模型小鼠的病变肠黏膜中,炎性巨噬细胞、树突状细胞、T淋巴细胞、浆细胞、血管内皮细胞和肠黏膜上皮细胞(Intestinal epithelial cells,IECs)都有不同程度的IL-36α、γ表达上调。通过构建剔除IL-36R表达的小鼠动物模型来模拟肠道的损伤和急性炎症,学者发现,阻断IL-36亚家族介导的信号通路可以减少中性粒细胞和巨噬细胞的渗透,明显降低某些疾病急性期的严重度[31]。此外,IL-36R的缺失还可以降低肠黏膜控制细菌感染的能力。这意味着,IL-36分子可以放大肠道的炎症反应。IL-36不仅在IBD的起始阶段起作用,在疾病的进展期同样有重要作用。Scheibe等[40]报道,在肠道中IL-36R介导的信号通路的靶向位点同样位于成纤维细胞,并且可以促进成纤维细胞的激活和分化,而成纤维细胞主要的作用在于细胞的再生和组织损伤的修复,因此IL-36亚家族分子可能有促进IBD肠道损伤修复的作用。
综上,IL-36亚家族分子在IBD中可能扮演着双面角色,即可以促进IBD的发生发展,又可以促进肠黏膜病损的恢复[10]。所以,IL-36亚家族分子在IBD中的作用及相关机制并不明确,需要更加深入的研究。
3.3IL-36与骨关节疾病的关系 IL-36也可能在骨关节相关疾病中发挥重要作用。骨性关节炎(Osteoarthritis,OA)是一种以关节软骨的变性、破坏及骨质增生为特征的慢性关节病。Conde等[41]研究发现,正常人类的关节软骨细胞可低表达IL-36α,但其在OA患者的关节软骨细胞中表达明显上调。OA患者的关节软骨细胞经过IL-36α刺激后,MMP-13、NOS2 和 COX-2等促炎因子分泌显著增加。Conde等[41]认为,IL-36α是通过激活NF-κB和p38 MAPK通路,最终调控软骨细胞分泌促炎因子和软骨细胞的代谢。这可能为OA的发生发展机制提供了新的理论依据。
IL-36β在小鼠和人类关节中都有表达,表达在人关节软骨细胞中的IL-36β,其诱导的促炎细胞因子的反应可刺激滑膜成纤维细胞和软骨细胞的增殖。在银屑病与类风湿关节炎患者的关节中都发现了IL-36α异常的高表达[42]。另外,IL-36β可以在健康人的血清中检测到,遗憾的是健康人血清IL-36β浓度与类风湿关节炎患者血清IL-36β浓度相比并无差异[43]。IL-36分子可能在某些关节疾病,如骨关节炎、类风湿性关节炎等疾病的发生和发展中充当重要的角色,但其具体机制还需要进一步的研究。
3.4IL-36与呼吸系统疾病的关系 IL-36亚家族可能在肺部炎症疾病中扮演重要角色。这可能与小鼠的编码IL-36分子的基因位于一个变应原诱导支气管气道高反应基因位点上有关。有学者发现IL-36γ在A/J(哮喘组)小鼠肺部的表达量要比C3H/HeJ小鼠(哮喘抵抗组)的高,这可能提示IL-36γ在过敏原诱导的小鼠肺部炎症反应中发挥作用[44]。Ramadas等[45]向小鼠气道内注射10 μg剂量的重组IL-36γ,结果发现小鼠肺有大量中性粒细胞浸润,这表明IL-36γ可能参与调节支气管气道炎症反应。另外,IL-36α也可以诱导中性粒细胞在呼吸道中的聚集[46]。这项研究结果验证了IL-36亚家族分子在呼吸道炎症反应中的作用。
IL-36可能与慢性阻塞性肺病(Chronic obstructive pulmonary disease,COPD)的发生发展有关。Chen等[47]发现COPD患者和慢性阻塞性肺病急性发作的患者,其血清中的IL-36α和IL-36Ra的含量要比正常人明显降低。此外,吸烟是COPD的一个重要致病因素,经过香烟烟雾刺激的支气管上皮细胞会高表达IL-36α、β、γ[48]。这可能为吸烟促进COPD的发生发展提供了新的证据。以上的研究表明,IL-36亚家族在肺部急慢性炎症中有重要作用。
3.5IL-36与恶性肿瘤的关系 IL-36属于IL-1F成员,不仅因为在结构组成上具有同源性,更重要的是它们对人体的功能也有很大的相似性。之前的许多研究发现IL-1F成员的表达高低与人类乳腺癌、头颈部鳞状细胞癌等恶性肿瘤恶性程度高低和患者预后有关[49-52]。这说明IL-36α、β、γ分子亦可能与人类的某些恶性肿瘤相关。通过对345例结肠癌患者和肿瘤标本的分析,Wang等[53]发现,IL-36α在结肠癌肿瘤组织中的表达量要比正常结肠组织中低;并且IL-36α表达高的患者,其肿瘤尺寸比IL-36α表达低者小,TNM分期更早,术后平均生存时间更长。Pan等[54]发现在163例原发性肝癌患者的肿瘤组织中,IL-36α的表达要比正常肝组织低;高分化的肝癌组织中IL-36α的表达比低分化的肝癌组织要高;肿瘤组织中IL-36α表达量越低,患者的总生存期(Overall survival,OS)越差。此外,Pan等[54]研究发现IL-36α与CD3+T和CD8+T细胞的分化成熟有关,而上述两种细胞高水平表达预示着肝癌患者有更高的OS。所以IL-36α可能通过调控CD3+T和CD8+T细胞的表达发挥抗肿瘤的作用。该反应与IL-1F家族的许多成员相似,主要通过调节某些免疫细胞进而改变肿瘤微环境,对肿瘤产生影响[55-57]。上述研究说明:IL-36分子可能在某些肿瘤微环境中发挥了重要的免疫调节作用,继而在肿瘤的发生发展中扮演了重要的角色,IL-36α可能是判断肿瘤预后的重要因素。
最近的研究发现,IL-36成员具有多种生物分子活性,人外周血淋巴细胞在接受α射线后表达IL-36γ,该特点可以用于肿瘤的免疫靶向治疗[21]。不仅如此,T淋巴细胞还可以分泌IL-36α和IL-36β,这都为肿瘤的免疫治疗带来了新思路[5-9]。
3.6IL-36与其他疾病的关系 近年来的许多研究还发现IL-36分子与肾脏疾病[58]、系统性红斑狼疮、脑组织病变、自身免疫性心肌炎、肥胖等疾病有关。
在动物模型中,模拟动物脑组织微动状态会极大地上调IL-36Ra的表达,IL-36Ra可以调节由动物脑组织周期性收缩引起的炎症反应中的细胞凋亡通路[59]。研究发现小鼠的心肌细胞中的IL-36α的表达与心肌受损程度呈正相关,也就是说,IL-36α表达上调可以加重自身免疫性心肌炎小鼠的心肌损伤程度。IL-36α在人类的脂肪组织中也有发现,主要表达于脂肪组织的血管,但脂肪细胞中亦有表达[60]。IL-36分子通过诱导IL-6、IL-8的分泌和过氧化物酶体增殖物激活受体γ的表达下调作用于脂肪细胞,进而促使脂肪细胞分化减少。
4 结语
综上所述,IL-36亚家族和多种疾病的发生和发展有着十分密切的关系,所以对于IL-36α、β、γ和IL-36Ra的研究,将会帮助人们从免疫学、分子生物学的角度去揭示多种疾病,特别是某些恶性肿瘤的发生机制,与此同时,人们也可以找到以IL-36亚家族为靶向的预防以及治疗癌症的新思路和新方法。随着研究的不断深入,从肿瘤微环境角度,进一步揭示IL-36亚家族在肿瘤发生发展机制中发挥的作用,将是未来研究的重点。
[1] 彭 笑,顾嘉杰,顾贤波,等.白细胞介素36及其在炎症性疾病中的作用[J].中国药理学与毒理学杂志,2015,29(2):317-322.
[2] Dinarello CA.Overview of the interleukin-1 family of ligands and receptors[J].Semin Immunol,2013,25(6):389-393.
[3] Mulero JJ,Pace AM,Nelken ST,etal.IL1HY1:A novel interleukin-1 receptor antagonist gene[J].Biochem Bioph Res Co,1999,263(3):702-706.
[4] Kumar S,Mcdonnell PC,Lehr R,etal.Identification and initial characterization of four novel members of the interleukin-1 family[J].J Biol Chem,2000,275(4):10308-10314.
[5] Smith DE,Renshaw BR,Ketchem RR,etal.Four new members expand the interleukin-1 superfamily[J].J Biol Chem,2000,275(2):1169-1175.
[6] Busfield SJ,Comrack CA,Yu G,etal.Identification and gene organization of three novel members of the IL-1 family on human chromosome 2[J].Genomics,2000,66(2):213-216.
[7] Barton J,Herbst R,Bosisio D,etal.A tissue specific IL-1 receptor antagonist homolog from the IL-1 cluster lacks IL-1,IL-1ra,IL-18 and IL-18 antagonist activities[J].EUR J Immunol,2000,30(11):3299-3308.
[8] FL VDV,Netea MG.New insights in the immunobiology of IL-1 family members[J].Front Immuno,2013,4(167):167.
[9] Dinarello C,Arend W,Sims J,etal.IL-1 family nomenclature[J].NAT Immunol,2010,11(11):973-973.
[10] Walsh PT,Fallon PG.The emergence of the IL-36 cytokine family as novel targets for inflammatory diseases[J].Ann NY Acad Sci,2016,doi:10.1111/nyas.13280.
[11] Dunn E,Sims JE,Nicklin MJH,etal.Annotating genes with potential roles in the immune system:six new members of the IL-1 family[J].Trends Immunol,2001,22(10):533-536.
[12] Mutamba S,Allison A,Mahida Y,etal.Expression of IL-1Rrp2 by human myelomonocytic cells is unique to DCs and facilitates DC maturation by IL-1F8 and IL-1F9[J].EUR J Immunol,2012,42(3):607-617.
[13] Lin H,Ho AS,Haley-Vicente D,etal.Cloning and characterization of IL-1HY2,a novel interleukin-1 family member[J].J Biol Chem,2001,276(23):20597-20602.
[14] Towne JE,Renshaw BR,Douangpanya J.Interleukin-36 (IL-36) ligands require processing for full agonist (IL-36α,IL-36β,and IL-36γ) or antagonist (IL-36Ra) activity[J].J Biol Chem,2011,286(49):42594-42602.
[15] Gresnigt MS,Veerdonk FLVD.Biology of IL-36 cytokines and their role in disease[J].Semin Immunol,2013,25(6):458-465.
[16] Gabay C,Towne JE.Regulation and function of interleukin-36 cytokines in homeostasis and pathological conditions[J].J Leukocyte Biol,2015,97(4):645-652.
[17] Frey S,Derer A,Messbacher ME,etal.Interleukin-36α is expressed by synovial plasma cells and induces cytokine production in human fibroblasts[J].Petrol Chem,2013,21(1):7-13.
[18] Li Y,Messina C,Bendaoud M,etal.Adaptive immune response in osteoclastic bone resorption induced by orally administered Aggregatibacter actinomycetemcomitans in a rat model of periodontal disease[J].Mol Oral Microbiol,2010,25(4):275-292.
[19] Vigne S,Palmer G,Lamacchia C,etal.IL-36R ligands are potent regulators of dendritic and T cells[J].Blood,2011,118(22):5813-5823.
[20] Blumberg H,Dinh H,Dean C Jr,etal.IL-1RL2 and its ligands contribute to the cytokine network in psoriasis[J].J Immunol,2010,185(7):4354-4362.
[21] Turtoi A,Brown I,Schläger M,etal.Gene expression profile of human lymphocytes exposed to (211)At α particles[J].Radiat Res,2010,174(2):125-136.
[22] Wang X,Zhao X,Feng C,etal.IL-36γ transforms the tumor microenvironment and promotes type 1 lymphocyte-mediated antitumor immune responses [J].Cancer Cell,2015,28(3):296-306.
[23] Debets R,Timans JC,Homey B,etal.Two novel IL-1 family members,IL-1 delta and IL-1 epsilon,function as an antagonist and agonist of NF-kappa B activation through the orphan IL-1 receptor-related protein 2[J].J Immunol,2001,167(3):1440-1446.
[24] Towne JE,Garka KE,Renshaw BR,etal.Interleukin (IL)-1F6,IL-1F8,and IL-1F9 signal through IL-1Rrp2 and IL-1RAcP to activate the pathway leading to NF-kappaB and MAPKs[J].J Biol Chem,2004,279(14):13677-13688.
[25] Günther S,Sundberg EJ.Molecular determinants of agonist and antagonist signaling through the IL-36 receptor[J].J Immunol,2014,193(2):921-930.
[26] Dunn EF,Gay NJ,Bristow AF,etal.High-resolution structure of murine interleukin 1 homologue IL-1F5 reveals unique loop conformations for receptor binding specificity[J].Biochemistry,2003,42(37):10938-10944.
[27] Boutet MA,Bart G,Penhoat M,etal.Distinct expression of interleukin (IL)-36 α,β,and γ,their antagonist IL-36Ra and IL-38 in psoriasis,rheumatoid arthritis and Crohn′s disease[J].Clin Exp Immunol,2016,184(2):159-173.
[28] Foster AM,Baliwag J,Chen CS,etal.IL-36 promotes myeloid cell infiltration,activation,and inflammatory activity in skin[J].J Immunol,2014,192(12):6053-6061.
[29] Mutamba S,Allison A,Mahida Y,etal.Expression of IL-1Rrp2 by human myelomonocytic cells is unique to DCs and facilitates DC maturation by IL-1F8 and IL-1F9[J].EUR J Immunol,2012,42(3):607-617.
[30] Chen X,Wang J,Rui W.Th1-,Th2-,and Th17-associated cytokine expression in hypopharyngeal carcinoma and clinical significance[J].EUR Arch Otorhinolaryngol,2016,273(2):1-8.
[31] Russell SE,Horan RM,Stefanska AM,etal.IL-36α expression is elevated in ulcerative colitis and promotes colonic inflammation[J].Mucosal Immunol,2016,9(5):1193-1204.
[32] Chu M,Wong C K,Cai Z,etal.Elevated Expression and Pro-Inflammatory Activity of IL-36 in Patients with Systemic Lupus Erythematosus[J].Molecules,2015,20(10):19588-19604.
[33] Johnston A,Xing X,Guzman A M,etal.IL-1F5,-F6,-F8,and -F9: a novel IL-1 family signaling system that is active in psoriasis and promotes keratinocyte antimicrobial peptide expression[J].J Immunol,2011,186(186):2613-2622.
[34] Blumberg H,Dinh H,Trueblood ES,etal.Opposing activities of two novel members of the IL-1 ligand family regulate skin inflammation[J].J Exp Med,2007,204(11):2603-2614.
[35] He Q,Chen H X,Li W,etal.IL-36 cytokine expression and its relationship with p38 MAPK and NF-κB pathways in psoriasis vulgaris skin lesions[J].J Huazhong U SCI-Med [Medical Sciences],2013,33(4):594-599.
[36] Vigne S,Palmer G,Martin P,etal.IL-36 signaling amplifies Th1 responses by enhancing proliferation and Th1 polarization of naive CD4+T cells[J].Blood,2012,120(17):3478-3487.
[37] Marrakchi S,Guigue P,Renshaw BR,etal.Interleukin-36-receptor antagonist deficiency and generalized pustular psoriasis[J].New Engl J Med,2011,365(7):620-628.
[38] 舒 丹,晋红中,王宝玺,等. 银屑病患者血清白介素36及其受体拮抗剂表达水平与病情严重度的相关性研究[J].中华皮肤科杂志,2014,47(7):469-472.
[39] Medinacontreras O,Harusato A,Nishio H,etal.Cutting edge:IL-36 receptor promotes resolution of intestinal damage[J].J Immunol,2015,196(1):34-38.
[40] Scheibe K,Backert I,Wirtz S,etal.IL-36R signalling activates intestinal epithelial cells and fibroblasts and promotes mucosal healing in vivo[J].Gut,2017,66(5):823-838.
[41] Conde J,Scotece M,Abella V,etal.IL-36α:a novel cytokine involved in the catabolic and inflammatory response in chondrocytes[J].Sci Rep,2015,5:16674.
[42] Frey S,Derer A,Messbacher ME,etal.The novel cytokine interleukin-36α is expressed in psoriatic and rheumatoid arthritis synovium[J].Ann Rheum Dis,2013,72(9):1569-1574.
[43] Magne D,Gaby Palmer,Jenny L Barton,etal.The new IL-1 family member IL-1F8 stimulates production of inflammatory mediators by synovial fibroblasts and articular chondrocytes[J].Arthritis Res Ther,2006,8(3):R80-R80.
[44] Ramadas RA,Li X,Shubitowski DM,etal.IL-1 Receptor antagonist as a positional candidate gene in a murine model of allergic asthma[J].Immunogenetics,2006,58(10):851-855.
[45] Ramadas RA,Ewart SL,Medoff BD,etal.Interleukin-1 family member 9 stimulates chemokine production and neutrophil influx in mouse lungs[J].AM J Resp Cell Mol,2011,44(2):134-145.
[46] Ramadas RA,Ewart SL,Iwakura Y,etal.IL-36α exerts pro-inflammatory effects in the lungs of mice[J].PLoS One,2012,7(9):e45784-e45784.
[47] Chen H,Wang Y,Bai C,etal.Alterations of plasma inflammatory biomarkers in the healthy and chronic obstructive pulmonary disease patients with or without acute exacerbation[J].J Proteomics,2012,75(10):2835-2843.
[48] Parsanejad R,Fields WR,Steichen TJ,etal.Distinct regulatory profiles of interleukins and chemokines in response to cigarette smoke condensate in normal human bronchial epithelial (NHBE) cells[J].J Interf Cytok Res,2008,28(12):703-712.
[49] Jin L,Yuan RQ,Fuchs A,etal.Expression of interleukin-1beta in human breast carcinoma[J].Cancer,1997,80(3):421-434.
[50] Wolf S,Chen Z,Dong G,etal.IL (interleukin)-1alpha promotes nuclear factor-kappaB and AP-1-induced IL-8 expression,cell survival,and proliferation in head and neck squamous cell carcinomas[J].Clin Cancer Res,2001,7(6):1812-1820.
[51] Chen Z,Malhotra PS,Thomas GR,etal.Expression of proinflammatory and proangiogenic cytokines in patients with head and neck cancer[J].Clin Cancer Res 1999,5(6):1369-1379.
[52] Apte RN,Voronov E.Interleukin-1--a major pleiotropic cytokine in tumor-host interactions[J].Semin Cancer Biol,2002,12(4):277-290.
[53] Wang ZS,Cong ZJ,Luo Y,etal.Decreased expression of interleukin-36α predicts poor prognosis in colorectal cancer patients[J].Int J Clin Exp Patho,2014,7(11):8077-8081.
[54] Pan QZ,Pan K,Zhao JJ,etal.Decreased expression of interleukin-36α correlates with poor prognosis in hepatocellular carcinoma[J].Cancer Immunol Immun,2013,62(11):1675-1685.
[55] Douvdevani A,Huleihel M,Zöller M,etal.Reduced tumorigenicity of fibrosarcomas which constitutively generate IL-1 alpha either spontaneously or following IL-1 alpha gene transfer[J].Int J Cancer,1992,51(5):822-830.
[56] Björkdahl O,Wingren AG,Hedhund G,etal.Gene transfer of a hybrid interleukin-1 beta gene to B16 mouse melanoma recruits leucocyte subsets and reduces tumour growth in vivo[J].Cancer Immunol Immun,1997,44(5):273-281.
[57] Srivastava S,Salim N,Robertson MJ.Interleukin-18:biology and role in the immunotherapy of cancer[J].Curr Med Chem,2010,17(29):3353-3357.
[58] Ichii O,Otsuka S,Sasaki N,etal.Local overexpression of interleukin-1 family,member 6 relates to the development of tubulointerstitial lesions[J].Lab Invest,2010,90(3):459-475.
[59] Karumbaiah L,Norman SE,Rajan NB,etal.The upregulation of specific interleukin (IL) receptor antagonists and paradoxical enhancement of neuronal apoptosis due to electrode induced strain and brain micromotion[J].Biomaterials,2012,33(26):5983-5996.
[60] van Asseldonk EJ,Stienstra R,Koenen TB,etal.The effect of the interleukin-1 cytokine family members IL-1F6 and IL-1F8 on adipocyte differentiation[J].Obesity,2010,18(11):2234-2236.
[收稿2017-01-20 修回2017-04-05]
(编辑 倪 鹏)
①本文为国家自然科学基金(NSFC,No.81302146)、江苏省自然科学基金(No.BK20161225)、江苏省高校自然科学基金 (No.13KJB320018)、中国博士后基金(No.2016M591913)和苏州市科技计划 (SYS201539)。
②潍坊市第二人民医院,潍坊 261041。
R392
A
1000-484X(2017)10-1592-06
10.3969/j.issn.1000-484X.2017.10.033
王 飞(1989年-),男,在读硕士,主要从事普通外科疾病的基础与临床研究,E-mail:wangfei123456082@126.com。
及指导教师:赵 鑫(1980年-),男,博士,副主任医师,副教授,主要从事消化系统肿瘤的基础与临床研究,E-mail:zhaox@suda.edu.cn。
