IL-37通过调控M-CSF和抑制IL-6-JAK2/STAT3信号通路抑制骨质疏松的机制研究
2017-10-24任汉强
马 铭 任汉强
(江汉大学附属医院(武汉市第六医院)内分泌科,武汉 430015)
IL-37通过调控M-CSF和抑制IL-6-JAK2/STAT3信号通路抑制骨质疏松的机制研究
马 铭 任汉强
(江汉大学附属医院(武汉市第六医院)内分泌科,武汉 430015)
目的探讨IL-37在抑制骨质疏松过程中的作用机制。方法选取本院2013年1月至2015年12月收治的97例骨质疏松患者及在本院行骨折手术的81例无骨质疏松患者(对照组)为研究对象,检测两组血清中IL-37及IL-6的水平。构建IL-37转基因小鼠,将C57BL/6J小鼠、IL-37转基因小鼠分别设置假手术(Sham)组,手术组(卵巢切除术,OVX组)。8周后,取小鼠血清,检测血清中雌激素水平、碱性磷酸酶水平(ALP)、血钙和血磷水平;同时取小鼠的双侧股骨、脊柱,病理切片分析股骨组织形态结构,骨密度仪检测脊柱骨密度变化。分离培养各组小鼠骨髓基质细胞(Bone marrow stromal cells,BMSCs),检测BMSCs的体外增殖能力,M-CSF及IL-6的表达及STAT3的激活。IL-37转染小鼠成骨细胞MC3T3-E1,转染后72 h,ELISA检测上清中M-CSF及IL-6,流式细胞术检测MC3T3-E1细胞的凋亡,Western blot检测STAT3的激活。结果骨质疏松患者血清中IL-37水平显著低于对照组(P<0.05),而IL-6则显著高于对照组;C57BL/6J小鼠、IL-37转基因小鼠OVX组血清中雌激素、血钙和血磷显著低于假手术组,而ALP水平显著高于假手术组(P<0.05),但IL-37转基因小鼠OVX组血钙和血磷则显著高于C57BL/6J小鼠OVX组(P<0.05)。股骨病理切片及脊柱骨密度结果显示,C57BL/6J小鼠、IL-37转基因小鼠OVX组均出现组织形态结构的破坏和骨密度下降,但IL-37转基因小鼠明显优于C57BL/6J小鼠(P<0.05)。IL-37转基因小鼠OVX组BMSCs增殖能力显著高于C57BL/6J小鼠OVX组,而STAT3的激活和M-CSF的表达则显著低于C57BL/6J小鼠OVX组(P<0.05)。MC3T3-E1细胞转染IL-37后能明显抑制M-CSF及IL-6的表达,而STAT3的激活也明显被抑制,流式细胞检测显示转染IL-37后能显著抑制MC3T3-E1细胞的凋亡。结论骨质疏松患者血清IL-37水平显著降低,IL-37可能是通过调控M-CSF及IL-6-JAK2/STAT3信号通路促进BMSCs增殖和抑制成骨细胞的凋亡从而抑制骨质疏松的进展。
IL-37;M-CSF;IL-6;STAT3;骨质疏松
近年来,伴随我国人口政策出现的人口老龄化给社会带来的公共卫生问题日益严重,老龄人口的健康问题广受关注。骨质疏松是老年人较为常见的一种疾病,特别是绝经后的老年妇女,其发病率呈逐年上升趋势。该疾病是以骨密度降低伴随骨折风险增加为主要特征的一种疾病。目前多数研究认为,在老年骨质疏松发病的机制中,主要是由于在绝经后骨质重塑的过程中,破骨细胞调控的骨吸收与成骨细胞调控的骨形成之间的竞争被打破,破骨细胞的调控占据了优势。老年骨质疏松患者,其骨髓基质细胞增殖能力及分化为成骨细胞的能力显著降低[1]。研究表明,在敲除STAT3的去卵巢小鼠模型中,其骨质疏松严重程度明显重于未敲除小鼠[2]。此外,有研究表明,M-CSF调控的失调,与骨质疏松之间存在显著的因果关系[3]。IL-37是近年来新发现的IL-1家族新成员,有研究表明,其在炎症过程中发挥负调节因子的作用,能够抑制炎症因子的表达,从而抑制过度的炎症反应,此外,它还能抑制STAT家族的表达和激活[4]。为此,本研究将探讨在骨质疏松患者血清中IL-37的表达水平,同时通过骨质疏松小鼠模型,探讨IL-37在骨质疏松过程中发挥作用的机制。
1 材料与方法
1.1材料
1.1.1患者及标本 选取本院2013年1月至2015年12月收治的97例骨质疏松患者为观察组,其中男性患者23例,女性74例,年龄56~74岁,平均(61.3±13.5)岁。同期选择在本院体检中心健康体检的81例志愿者为对照组,其中男性18例,女性63例,年龄45~60岁,平均年龄(48.8±10.9)岁。抽取两组患者的外周血并制备血清备用。
1.1.2纳入及排除标准 观察组所有患者均符合骨质疏松的诊断,诊断依据参照文献[1],即以下标准:① 临床表现:出现周身疼痛、身高降低、驼背、脆性骨折及呼吸系统受损等;②骨密度检查结果为骨峰值降低2个标准差或下降25%。排除标准:① 长期营养不良及低钙饮食患者;② 长期卧床患者;③ 伴有全身其他器官器质性疾病的患者;④ 恶性肿瘤患者;⑤ 近期及长期服用影响骨代谢药物患者;⑥ 并发其他代谢性疾病患者。
1.1.3材料与设备 主要试剂包括DMEM培养基、胎牛血清(FBS)(美国Gibco公司),青霉素、链霉素(美国Sigma公司),人IL-37 ELISA试剂(美国R&D Systems),小鼠M-CSF、IL-6 ELISA试剂盒(Elabscience iotechnology),ALP检测试剂盒(美国贝克曼公司),STAT3、p-STAT3、β-actin抗体(美国Abcam公司),Annexin V细胞凋亡检测试剂盒(美国BD公司),Lipofectamine®2000转染试剂盒(Thermo Fisher),MTT检测试剂盒(上海碧云天生物技术有限公司)。M-CSF及IL-6引物由上海生工合成。C57BL/6J小鼠、IL-37转基因小鼠购自武汉大学实验动物中心,MC3T3-E1细胞购自武汉大学典型培养物保藏中心。SDS-PAGE试剂购自Bio-Rad。主要设备包括CO2培养箱、超净工作台、Biotek酶标仪、流式细胞仪、Bio-Rad垂直电泳仪、Bio-Rad Western blot化学发光成像系统。
1.2方法
1.2.1骨质疏松小鼠动物模型 将健康C57BL/6J雌性小鼠30只、IL-37转基因雌性小鼠30只均随机分为2组,即卵巢切除术组(VOX)15只,假手术组(Sham组)15只。卵巢切除及假手术参照文献[5]进行。术后8周分离各组小鼠血清,测定血清雌激素、钙、ALP、磷水平;取VOX及Sham组小鼠的双侧股骨、脊柱,病理切片分析股骨组织形态结构,骨密度仪检测脊柱骨密度变化。
1.2.2BMSCs的体外培养、增殖、成骨分化能力及M-CSF表达和STAT3表达与激活检测 参照文献[6]的方法,采用全骨髓法培养BMSCs。细胞分离后置CO2培养箱中培养,3 d后首次换液,以后间隔3 d换液一次。当原代细胞集落处细胞密度达到密集状态时,以0.25%的胰酶进行消化传代。
当细胞传至第3代时,取各组BMSCs,计数后稀释至浓度为4×104个/ml,向96孔板中加入细胞悬液,每孔接种200 μl。根据实验需要设置复孔,每组各12孔。接种24 h后待细胞贴壁,给细胞换液,此后每48 h换液一次。在接种的第2、4、6天时以MTT法检测各组细胞在492 nm波长处吸光值,每组每次检测3孔,取均值。在细胞培养的第4天,吸弃培养基,参照文献[6]的方法,细胞裂解后全自动生化分析仪测定每组ALP,每组3孔,结果取平均值。
取第3代各组BMSCs,提取总RNA及总蛋白,Real time-PCR检测M-CSF的表达,Western blot检测STAT3蛋白表达及激活。
1.2.3MC3T3-E1细胞转染 采用脂质体转染法将构建好的pIL-37质粒及空质粒pcDNA3.1转染至MC3T3-E1细胞,转染后48 h ELISA检测细胞培养上清中M-CSF的含量,流式细胞术检测MC3T3-E1细胞的凋亡,Western blot检测STAT3的表达及激活。
1.3统计学分析 所有实验均单独重复3次,所有数据采用SPSS20.0进行分析,计量资料采用单因素方差,采用t检验进行两两比较,P<0.05为差异具有统计学意义。
2 结果
2.1骨质疏松患者与健康人血清IL-37及IL-6浓度比较 骨质疏松患者与对照组血清中IL-37及IL-6含量比较结果见图1。结果显示,骨质疏松患者血清IL-37浓度显著低于对照人群(P<0.001),而IL-6则显著高于对照组(P<0.001),差异具有统计学意义。
2.2骨质疏松模型的建立 术后8周血清学指标检测显示,C57BL/6J小鼠、IL-37转基因小鼠OVX组血清中血钙和血磷显著高于假手术组,而ALP水平显著低于假手术组(P<0.05),但IL-37转基因小鼠OVX组血钙和血磷显著低于C57BL/6J小鼠OVX组,ALP则高于C57BL/6J小鼠OVX组(P<0.05),见表1。

图1 骨质疏松患者与对照组血清IL-37及IL-6比较Fig.1 Comparison of serum IL-37 and IL-6 between osteoporosis patients and control groupNote:**.P<0.001.
股骨组织(图2A)病理切片及脊柱骨密度结果(图2B)显示,C57BL/6J小鼠、IL-37转基因小鼠OVX组均出现组织形态结构的破坏和骨密度下降,但IL-37转基因小鼠明显优于C57BL/6J小鼠(P<0.05)。
2.3BMSCs的增殖、ALP合成及M-CSF表达和STAT3激活检测 BMSCs细胞体外培养结果(见图3)。IL-37转基因小鼠OVX组第3代BMSCs增殖能力显著高于Sham组和C57BL/6J小鼠OVX组(P<0.05)(图3A);ALP检测结果显示,IL-37能促进ALP的合成(图3B);Real time-PCR结果显示,IL-37转基因小鼠OVX组BMSCs细胞M-CSF及IL-6表达显著低于C57BL/6J小鼠OVX组(P<0.05,图3C);Western blot结果显示,IL-37转基因小鼠OVX组BMSCs细胞STAT3的激活显著低于C57BL/6J小鼠OVX组(P<0.05,图3D)。
2.4IL-37对小鼠成骨细胞MC3T3-E1凋亡影响 MC3T3-E1转染pIL-37后,MC3T3-E1细胞凋亡明显减少(图4A),细胞培养上清中M-CSF及IL-6的浓度则显著降低(图4B),Western blot结果显示,STAT3的激活显著降低(图4C)。

表1 血清学指标检测(n=15)
Note:Compared with Sham group,1)P< 0.05;compared with C57BL/6J OVX group,2)P< 0.05.
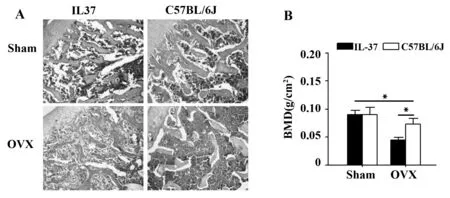
图2 股骨组织病理切片及脊柱骨密度比较Fig.2 Comparison of pathological sections of femur and spine bone densityNote:Representative results of three independent experiments,*.P<0.01.
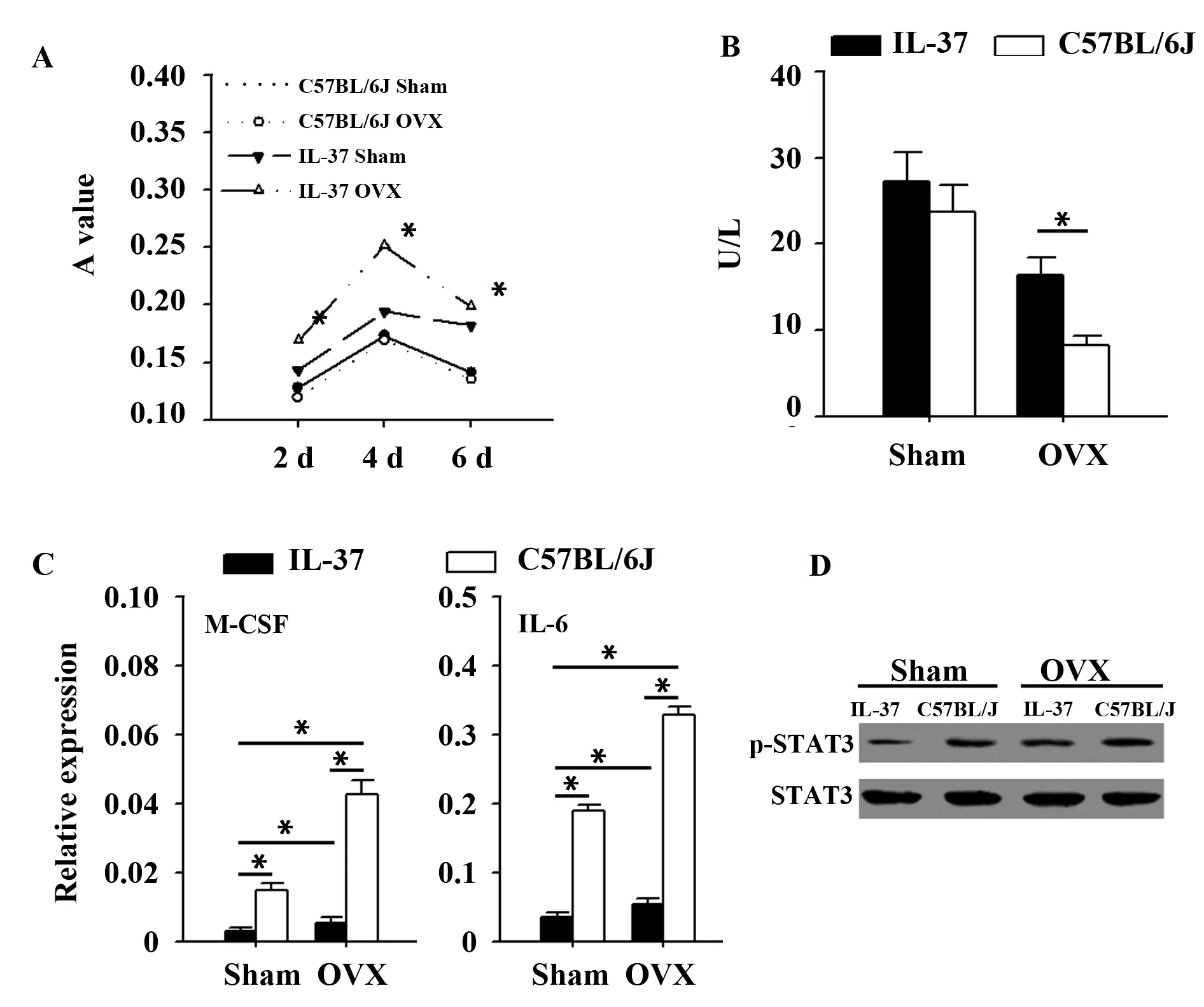
图3 BMSCs的增殖、ALP合成、M-CSF及IL-6表达和STAT3激活检测比较Fig.3 Comparison of proliferation,ALP synthesis,M-CSF and IL-6 expression and activation of STAT3 of BMSCsNote:Representative results of three independent experiments.*.P<0.01.
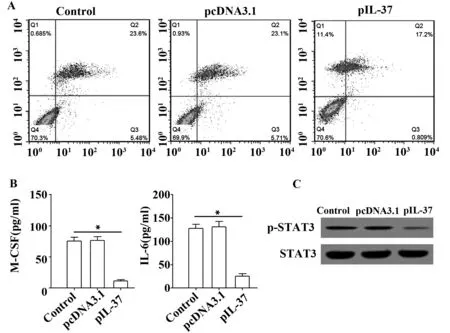
图4 IL-37对小鼠成骨细胞MC3T3-E1凋亡的影响Fig.4 Influence of IL-37 on apoptosis of mice osteoblast MC3T3-E1Note:Representative results of three independent experiments.*.P<0.01.
3 讨论
随着我国社会经济的发展,人口老龄化将带来一系列公共卫生问题。骨质疏松是其中困扰中老年妇女的一大难题,且该疾病在我国发病率呈逐年上升趋势。骨质疏松是一种全身性疾病,其特征是以骨量减少、骨密度降低、骨组织微结构破坏、骨脆性增加以及骨折敏感性增加为主[7]。研究表明,种族、遗传、身体、社会文化、经济及生活习惯的差异对发病的影响非常大[8]。该疾病在老年患者中具有发病率高、致残致死率高的特点,同时还会给社会和患者家庭带来沉重的经济负担。绝大多数骨质疏松引起的骨折会对患者生活质量造成严重的影响。以往研究骨质疏松发病机制主要以雌激素为中心,随着时间的推移和研究的不断深入,目前该疾病的发病机制开始以年龄相关因素和骨以及氧化应激为主要线索[9]。骨骼是一种具有高度重建性的器官组织,能持续性的重塑。在骨代谢过程中,骨形成和骨吸收是影响重建的一对最重要的耦联动态因素,这两个因素共同维持骨质及骨量的平衡,一旦平衡被打破,骨吸收量超过形成量,则会发生骨质疏松,即发生病理性的重塑,骨组织的微形态结构将发生改变[10,11]。研究表明,很多的炎症因子如M-CSF、TNF-α、IL-1家族成员、IL-6、IL-17等均能通过影响调节骨吸收的途径从而影响骨质疏松的发生[12-14]。我们的研究则表明,IL-37能够抑制M-CSF的表达,同时抑制STAT3的表达和激活,从而抑制骨质疏松的发生。IL-37是近年来发现的IL-1家族成员之一,其生物学作用目前仍知之甚少。目前的研究表明,其在炎症的过程中扮演着抑制炎症过度反应的角色,它能够广泛性的抑制促炎症因子的表达。在小鼠巨噬细胞内表达IL-37后,能够抑制LPS诱导的炎症,其机制主要是抑制了促炎性细胞因子IL-1α、TNF-α和IL-6等[15]。
研究表明,炎症和骨质疏松之间存在明显的关系,因为破骨细胞前体细胞位于骨髓中,而该前体细胞是单核细胞/巨噬细胞家族的成员[16]。由骨髓基质产生的M-CSF是巨噬细胞存活和增殖的必要条件。M-CSF结合到前体细胞的C-fms受体上,发挥激活RANKL的作用,从而增加前体细胞分化为破骨细胞的数量[17]。而体外纯化培养的人破骨细胞,是由骨髓巨噬细胞在M-CSF和RANKL共同存在下培养而获得的[14]。因此,M-CSF在破骨细胞的形成中扮演了非常重要的作用。我们的研究结果表明,IL-37转基因小鼠骨质疏松模型中BMSCs细胞的增殖明显低于普通骨质疏松小鼠,且其M-CSF的表达被明显下调;体外培养的成骨细胞MC3T3-E1转染表达IL-37后,其M-CSF的表达也被下调,这表明,IL-37在骨质疏松过程中可能是通过下调M-CSF的表达,从而抑制破骨细胞的形成抑制骨质疏松的进展,其机制尚需进一步的研究。
在骨质疏松患者体内,血清IL-6的表达明显上调,而IL-6对基质细胞、成骨细胞、破骨细胞及其前体细胞的产生调控具有重要的意义。研究表明,IL-6能通过多条途径对成骨细胞的凋亡和增殖分化进行调控,促进破骨细胞的形成,从而直接促进骨的吸收导致骨质疏松的发生[18]。值得注意的是,IL-37转基因小鼠骨质疏松模型中,BMSCs细胞IL-6表达水平显著低于普通野生型小鼠,成骨细胞MC3T3-E1转染表达IL-37后,IL-6表达水平显著低于未转染细胞,这与IL-37转基因小鼠骨质疏松严重程度明显轻于普通小鼠这一组织学结果相一致,这表明,IL-37能通过调控IL-6的表达,从而抑制骨质疏松的进展。研究表明,IL-6-JAK/STAT3信号途径是IL-6在骨质疏松中发挥作用的主要途径[19]。阻断IL-6特异性的信号通路JAK/STAT3后,IL-6的表达被显著抑制,骨质疏松模型动物骨密度明显增高,血清中ALP也显著升高,而ALP能促进成骨细胞的形成[19]。为此,本研究检测了STAT3信号通路的激活水平,结果发现,在IL-37转基因小鼠,其BMSCs中STAT3信号的激活显著低于普通骨质疏松小鼠。这表明,IL-37能通过阻断IL-6-JAK/STAT3信号途径从而抑制骨质疏松的进展。
综上所述,骨质疏松患者体内IL-37明显降低。在IL-37转基因小鼠的骨质疏松模型和体外细胞模型中,IL-37能够通过抑制M-CSF的表达和阻断IL-6-JAK/STAT3信号途径从而抑制骨质疏松的进展。但本研究仍然存在一定的局限性,在IL-37发挥作用机制的上下游,仍未探讨清楚,这需要进一步深入的研究。
[1] 王子江,向 川.骨质疏松症与骨关节炎的相关性研究新进展[J].中国骨质疏松杂志,2014,20(3):310-314.
[2] Zhang Z,Welte T,Troiano N,etal.Osteoporosis with increased osteoclastogenesis in hematopoietic cell-specific STAT3-deficient mice[J].Biochem Biophys Res Commun,2005,328(3):800-807.
[3] Tsubaki M,Satou T,Itoh T,etal.Bisphosphonate-and statin-induced enhancement of OPG expression and inhibition of CD9,M-CSF,and RANKL expressions via inhibition of the Ras/MEK/ERK pathway and activation of p38MAPK in mouse bone marrow stromal cell line ST2[J].Mol Cell Endocrinol,2012,361(1-2):219-231.
[4] Nold MF,Nold-Petry CA,Zepp JA,etal.IL-37 is a fundamental inhibitor of innate immunity[J].Nat Immunol,2010,11(11):1014-1122.
[5] 何 柳,王 然,王晓文,等.低强度脉冲超声对骨质疏松症小鼠模型的作用[J].中国骨质疏松杂志,2015,21(6):657-660.
[6] 张 哲,徐秀娟,刘 欣,等.老鹳草素对小鼠骨髓基质干细胞增殖及成骨分化的影响[J].中国临床药理学杂志,2016,32(7):633-636.
[7] Curate F.Osteoporosis and paleopathology:a review[J].J Anthropol Sci,2014,92(15):119-146.
[8] 王 涛,马信龙.骨质疏松发病机制研究进展[J].国际内分泌代谢杂志,2014,34(2):99-102.
[9] Manolagas SC.From estrogen-centric to aging and oxidative stress:a revised perspective of the pathogenesis of osteoporosis[J].Endocr Rev,2010,31(3):266-300.
[10] Curtis EM,Moon RJ,Dennison EM,etal.Recent advances in the pathogenesis and treatment of osteoporosis[J].Clin Med(Lond),2015,15(Suppl 6):s92-96.
[11] Khosla S.Pathogenesis of Osteoporosis[J].Transl Endocrinol Metab,2010,1(1):55-86.
[12] 谢翠柳,刘 珂,孟玉坤,等.活性氧影响骨重建在骨质疏松发病中的作用[J].中国骨质疏松杂志,2013,19(2):178-182.
[13] Qian H,Yuan H,Wang J,etal.A monoclonal antibody ameliorates local inflammation and osteoporosis by targeting TNF-α and RANKL[J].Int Immunopharmacol,2014,20(2):370-376.
[14] Lacativa PG,Farias ML.Osteoporosis and inflammation[J].Arq Bras Endocrinol Metabol,2010,54(2):123-132.
[15] Tete S,Tripodi D,Rosati M,etal.IL-37(IL-1F7)the newest anti-inflammatory cytokine which suppresses immune responses and inflammation[J].Int J Immunopathol Pharmacol,2012,25(1):31-38.
[16] Al-Daghri NM,Aziz I,Yakout S,etal.Inflammation as a contributing factor among postmenopausal Saudi women with osteoporosis[J].Medicine(Baltimore),2017,96(4):e5780.
[17] Tsubaki M,Komai M,Itoh T,etal.Nitrogen-containing bisphosphonates inhibit RANKL-and M-CSF-induced osteoclast formation through the inhibition of ERK1/2 and Akt activation[J].J Biomed Sci,2014,21(35):10-12.
[18] Yan L,Hu R,Tu S,etal.Meta-analysis of association between IL-6-634C/G polymorphism and osteoporosis[J].Genet Mol Res,2015,14(4):19225-19232.
[19] 吴景华,郭佳培,王志刚,等.IL-6-JAK2/STAT3信号途径在骨质疏松症的作用机制研究[J].现代预防医学,2016,43(14):2621-2623.
[收稿2017-02-14 修回2017-03-07]
(编辑 倪 鹏)
IL-37inhibitsosteoporosisviaregulatingM-CSFandinhibitingIL-6-JAK2/STAT3signalingpathway
MAMing,RENHan-Qiang.
EndocrineDepartment,AffiliatedHospitalofJianghanUniversity(SixthHospitalofWuhan),Wuhan430015,China
Objective:To investigate the mechanism of IL-37 in inhibiting osteoporosis.MethodsNinety-seven patients with osteoporosis and eighty-one fracture surgery patients without osteoporosis in our hospital from Jan 2013 to Dec 2015 were selected as study subjects.The serum level of IL-37 and IL-6 were detected.Construction of IL-37 transgenic mice,the C57BL/6J mice,IL-37 transgenic mice were set in sham operation group(Sham),operation group(ovariectomy,OVX) respectively.The serum level of estrogen,alkaline phosphatase(ALP),calcium and phosphorus were detected after 8 weeks.The bilateral femur and spine of mice were collect after sacrifice,the morphology and structure of the femur were analyzed,and the bone density was measured by bone density meter.The bone marrow stromal cells(BMSCs) were isolated and cultured in vitro.The proliferation ability of BMSCs,expression of M-CSF and IL-6,and the activation of STAT3 were detected.IL-37 was transfected into mouse osteoblast MC3T3-E1 cell,M-CSF and IL-6 in cultured supernatant were measured by ELISA.Apoptosis of MC3T3-E1 cells were detected by flow cytometry.The activation of STAT3 was detected by Western blot.ResultsThe serum level of IL-37 in patients with osteoporosis were significantly lower than control group(P<0.05),while IL-6 was significantly higher than control group(P<0.05).The serum level of estrogen,calcium and phosphorus in OVX group of C57BL/6J mice and IL-37 transgenic mice were significantly lower than the sham operation group(P<0.05),while the level of ALP was significantly higher than sham operation group(P<0.05),but the serum level of calcium and phosphorus in OVX group of IL-37 transgenic mice were significantly higher than C57BL/6J mice(P<0.05).The pathological section of femur and spine BMD showed that the bone tissue in C57BL/6J mice and IL-37 transgenic mice in OVX group were damaged and the bone density decreased significantly,but IL-37 transgenic mice was significantly better than C57BL/6J mice(P<0.05).The proliferation ability BMSCs in OVX group of IL-37 transgenic mice was significantly higher than C57BL/6J,while the activation of STAT3 and expression of M-CSF were significantly lower than C57BL/6J(P<0.05).The expression of M-CSF and IL-6 were inhibited after MC3T3-E1 cell was transfected with IL-37,and the activation of STAT3 were also inhibited after IL-37 transfection.The results of flow cytometry showed that IL-37 could significantly inhibit the apoptosis of MC3T3-E1 cells.ConclusionThe serum level of IL-37 in patients with osteoporosis decreased significantly.IL-37 may inhibit the proliferation of BMSCs and inhibit the apoptosis of osteoblasts by regulating the expression of M-CSF and the activation of IL-6-JAK2/STAT3 signaling pathway.
IL-37;M-CSF;IL-6;STAT3;Osteoporosis
R392.9
A
1000-484X(2017)10-1552-05
10.3969/j.issn.1000-484X.2017.10.023
马 铭(1979年-),男,主治医师,主要从事内分泌临床与基础医学方面研究,E-mail:maming1244@163.com。
及指导教师:任汉强(1963年-),男,副主任医师,主要从事内分泌临床与基础医学方面研究。
