过表达IDO大鼠骨髓间充质干细胞改善异位移植心脏存活①
2017-10-24贺继刚李贝贝韩金秀李宏远
贺继刚 李贝贝 韩金秀 李宏远 严 丹
(云南省第一人民医院心脏大血管外科,昆明 650032)
过表达IDO大鼠骨髓间充质干细胞改善异位移植心脏存活①
贺继刚 李贝贝 韩金秀 李宏远 严 丹②
(云南省第一人民医院心脏大血管外科,昆明 650032)
目的探讨过表达IDO大鼠骨髓间充质干细胞(BMSC)改善大鼠腹腔异位移植心脏的存活机制。方法通过慢病毒载体GV308携带IDO基因转染大鼠骨髓间充质干细胞构建过表达IDO大鼠骨髓间充质干细胞。建立大鼠腹腔异位移植心脏模型,经尾静脉给予相应细胞处理:①利用超声心动图检测移植心脏心功能变化。②采用小动物活体成像系统评估移植心脏局部荧光强度。③再取各组受体大鼠的脾脏,采用流式细胞技术检测CD40、CD86、CD80、MHCⅡ、CD274、CD45RA、CD45RA+CD45RB、Treg细胞的表达情况。④取各组移植心脏,采用HE染色评估炎性细胞浸润情况。⑤利用液相芯片检测各组血清IL-1ɑ、IL-4、IL-1β、IL-2、IL-10、IFN-γ、IL-18、TGFβ1、TGFβ2、TGFβ3因子的变化情况。结果①给予相应细胞处理,可见过表达IDO-BMSCs处理后2 d移植心脏的EF、FS较其余各组有提高。②采用小动物活体评估可见过表达IDO-BMSCs组移植心脏局部荧光强度最强。③给予干预措施后2 d可见过表达IDO-BMSCs组脾脏细胞CD40、CD86、CD80、MHCⅡ、CD45RA、CD45RA+CD45RB表达降低,而CD274、Treg细胞的表达增高。④采用液相芯片检测各组提取血清可见在2 d时,过表达IDO-BMSCs组血清中IL-1α、IL-4、IL-1β、IL-2、IFN-γ、IL-18是降低的;IL-10、TGFβ1、TGFβ2、TGFβ3表达量是升高的。HE染色证实过表达IDO-BMSCs组炎性细胞浸润少于其他组。结论过表达IDO的BMSCs可以通过有效调节免疫DC、T细胞及细胞因子,从多个免疫层面改善移植心脏存活。
IDO;大鼠骨髓间充质干细胞;免疫抑制
20世纪以来,由于器官移植技术、移植免疫基础研究以及各种免疫抑制剂的进展,器官移植已成为治疗器官功能衰竭的有效治疗手段。到2000年底,全球统计,共施行近80万例次各种器官移植。但不可否认目前器官移植已经进入了一个尴尬的境地。一方面是随着医疗生活水平改善,越来越多的器官终末期患者期盼器官移植。另一方面由于器官来源紧张及移植后的免疫排斥反应或免疫抑制药物严重副作用使患者得不到有效治疗、治疗效果不佳、生活质量无法改善。而供体来源的紧张短期内无法有效缓解。本研究正是基于上述社会背景下,结合骨髓间充质干细胞免疫抑制调节特性联合吲哚胺2,3-双加氧酶(IDO),试图寻找到一种有效改善心脏移植存活的生物免疫抑制方法。
1 材料与方法
1.1材料
1.1.1实验动物 健康4周龄SPF级SD大鼠及Wistar大鼠各60只,均为雄性,由成都达硕实验动物中心提供,动物许可证号为SCXK(川)2015-030。所有动物的喂养、观察均按照GLP(非临床研究管理规范)规定执行。
1.1.2主要试剂和仪器 TGFBMAG-64K-03试剂盒及RECYTMAG-65K-07试剂盒购自美国Merck millipore。 CD40-FITC、CD80-PE、CD86-PE、MH-CLASS Ⅱ-FITC、CD45RA-APC、CD3-FITC、CD4-APC、CD8a-PE、CD4-FITC、CD25-APC、FOXP3-PE、Foxp3 Staining Buffer 均购自eBioscience(美国);CD29、CD44、CD90、CD73、CD45、CD11b、CD34均购自BioLegend(美国);CD274-FITC购自Biorbyt(美国);CD45RA+CD45RB-FITC购自Thermo(美国);LS-C62680(ox62)FITC购自LSBio(美国);流式细胞仪BD Accuri C6 购自美国BD公司;MAGPIX检测仪购自美国Luminex公司;小动物活体成像仪购自美国Caliper IVIS Lumina LT公司;心脏彩超仪购自美国PHILIPS EPIQ 7C。
1.2方法
1.2.1大鼠BMSC的分离、培养及鉴定 全骨髓培养大鼠BMSC,胰酶消化传代至第7代。取生长至P7代BMSCs,待细胞融合达80%~90%时。制备单细胞悬液,采用流式细胞术检测CD29、CD44、CD90、CD73、CD45、CD11b、CD34( CD29单抗5 μl做1∶ 20稀释至100 μl,CD44单抗5 μl做1∶ 40稀释至100 μl,CD90 5 μl作 1∶ 20稀释至100 μl,CD73 5 μl 作1∶ 20稀释至100 μl,CD45、CD11b、CD34单抗5 μl做1∶40稀释至100 μl)。
1.2.2慢病毒载体及基因开启技术构建过表达IDO大鼠骨髓间充质干细胞 ①将已构建成功的IDO基因插入慢病毒包装质粒GV308中,构建GV308-IDO重组慢病毒包装质粒。②将构建成功的GV308-IDO重组慢病毒包装质粒转染入大鼠骨髓间充质干细胞并加入基因开启剂DOX(强力霉素)。③转染成功后利用Q-PCR方法检测转染48 h IDO基因量的表达。
1.2.3大鼠腹腔异位移植心脏模型建立 ①取供体(Wistar大鼠)心脏开腹后将50 U/L的4℃冰肝素盐水5 ml经下腔静脉注射,2 min后剪开腹主动脉及下腔静脉充分放血,剪开胸腔放入盐水冰削,结扎下腔、左右上腔后剪断升主动脉,游离肺动脉后剪断肺动脉,结扎心脏后的肺静脉。取下心脏。②供体心脏吻合到受体(SD大鼠)腹腔主动脉及下腔静脉,将受体开腹后,分离腹主动脉及下腔静脉,套3-0丝线,阻断下腔静脉及腹主动脉,剪开腹主动脉及下腔静脉,采用连续单点吻合方法将供体心脏的主动脉及肺动脉与受体心脏的腹主动脉及下腔静脉吻合。
1.2.4采用心脏彩超评估移植心脏心功能变化和采用小动物活体成像评估移植心脏荧光强度 收集过表达IDO-BMSCs、空载体-BMSCs、BMSCs细胞悬液。每106细胞中加入5 μl Dir(2.5 mmol/L)。在37℃培养40 min。利用PBS洗脱3次后应用。经尾静脉注射到大鼠腹腔异位移植心脏术后3 d的模型中,每只400 μl,106个细胞。并将建模未处理组及正常大鼠给予喂养DOX(0.25 mg/L)作为对照组1及对照组3。另外一组建模未处理的大鼠按40 mg/kg的标准喂养吗替麦考,作为对照组2。注射后分别喂养2 d,进行心脏彩超评估移植心脏心功能和小动物活体成像。
1.2.5体内流式检测 ①完成小动物活体成像后,取其大鼠脾脏组织,制备成单细胞悬液。取100 μl细胞悬液分装到1.5 ml EP管中,加相应抗体,避光孵育15 min。每支100 μl的细胞悬液加相应抗体量为CD40 0.5 mg/ml 1 μl、 CD86 0.2 mg/ml 0.8 μl、CD80 0.2 mg/ml 1.4 μl、 MHCⅡ 0.5 mg/ml 2 μl、CD274 0.5 mg/ml 1 μl、CD45RA 0.2 mg/ml 0.5 μl、CD45RA+CD45RB 0.1 mg/ml 1.4 μl、OX62 0.1 mg/ml 8 μl、CD3 0.5 mg/ml 0.5 μl、CD4 0.2 mg/ml 1 μl、CD8 0.2 mg/ml 0.5 μl。②Treg细胞染色步骤:取100 μl细胞悬液到离心管中,加细胞表面抗原CD4 0.5 mg/ml 0.5 μl和CD25 0.2 mg/ml 0.5 μl,避光孵育20 min。加1 ml Foxp3 Fixation/Permeabilization工作液,涡旋,室温避光孵育40 min。加2 ml 1×Permeabilization缓冲液,1 000 r/min离心5 min,弃上清。用100 μl Permeabilization缓冲液重悬细胞,1 000 r/min离心5 min弃上清使剩余体积约为100 μl。加3 μl细胞内染色抗体0.2 mg/ml Foxp3,室温避光孵育40 min。加 2 ml 1×Permeabilization缓冲液,1 000 r/min离心5 min,弃上清。加300 μl PBS重悬细胞后,采用BD Accuri C6流式细胞仪进行检测。
1.2.6液相检测 待小动物活体成像后,取其新鲜全血,制备成血清用于液相检测,按RECYTMAG-65K-07试剂盒及TGFBMAG-64K-03试剂盒检测说明书完成细胞因子浓度监测。
1.2.7心脏石蜡切片与HE染色 将心脏组织切成约1 cm×1 cm×1 cm放入包埋盒中,固定心脏组织并进行脱水,浸蜡,包埋,连续切片,贴片,烤片。切片进行常规脱蜡、水化;伊红染色15 s;中性树胶封片,显微镜下观察显色结果并拍照。

2 结果
2.1大鼠BMSC流式细胞仪鉴定结果 结果显示超过90%大鼠骨髓间充质干细胞表达CD29、CD44、CD90、CD73。但不表达CD45、CD11b、CD34。
2.2慢病毒转染大鼠骨髓间充质干细胞并加入DOX(强力霉素) 慢病毒转染大鼠骨髓间充质干细胞加入DOX后48 h RT-PCR结果可见过表达组IDO表达量为62 906.27±4.36;对照组的表达量为0.05±0.02,见图1。
2.3大鼠腹腔异位移植模型建立 异位心脏移植48 h,心脏彩超结果,见图2。
2.4采用心脏彩超评估移植心脏心功能改变 大鼠腹腔异位心脏移植模型建立3 d,经大鼠尾静脉给予各组BMSCs,采用心脏彩超评估移植心脏心功能改变,可见过表达IDO-BMSCs组其射血分数前后差值为18.367±1.32较其余各组高。环比收缩前后差值为14.5±1.26较其余各组仍有较大改善,见图3。
2.5采用小动物活体成像评估移植心脏荧光强度 大鼠心脏移植模型建立3 d后给予注射过表达IDO-BMSCs、空载体-BMSCs、BMSCs后2 d完成小动物活体成像,给予注射各组干细胞后,可见过表达IDO-BMSCs组平均荧光强度为8.224±1.56,较其余各组荧光强度高,见图4。
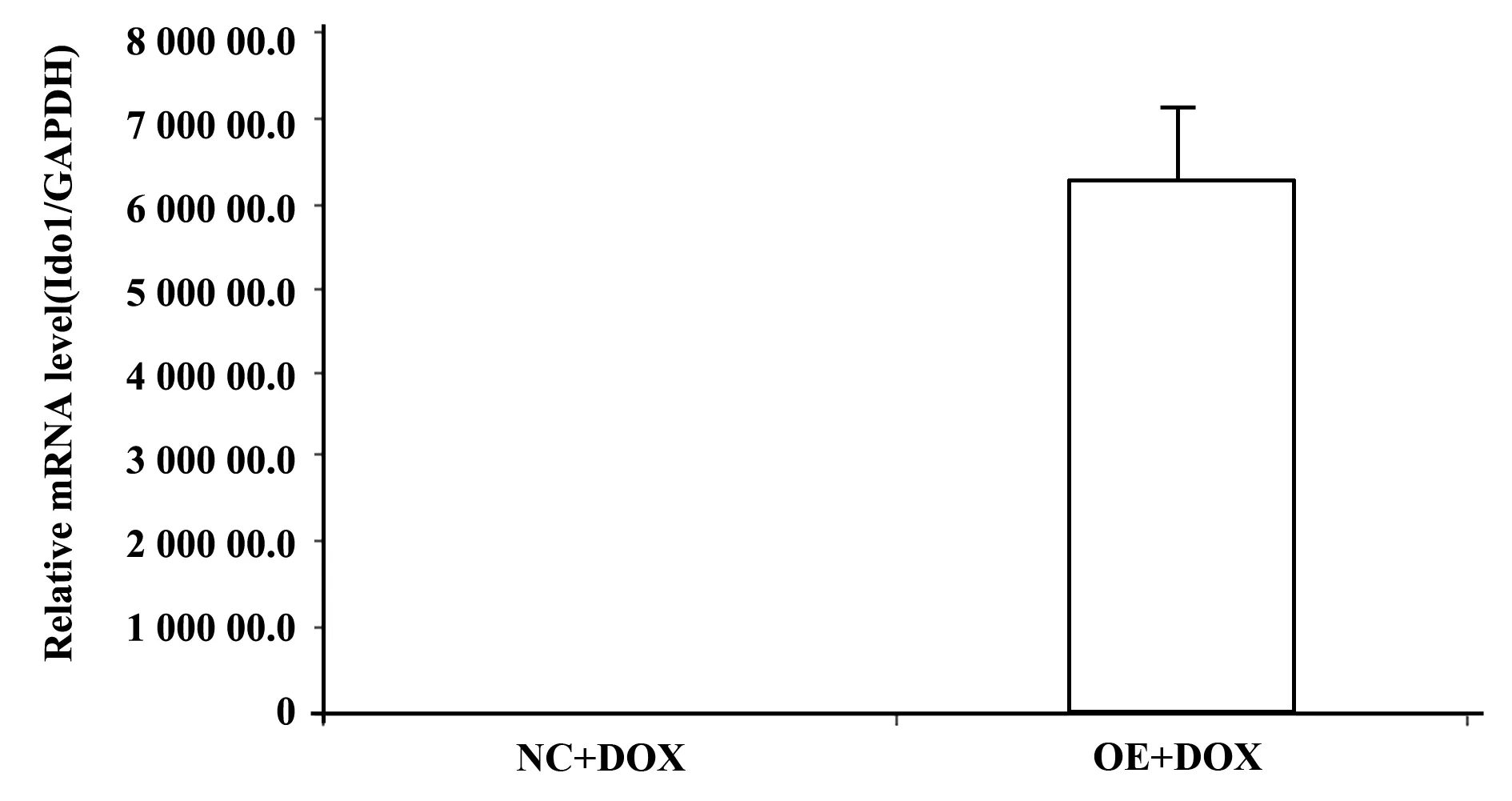
图1 慢病毒转染大鼠骨髓间充质干细胞后48 h IDO-PCRFig.1 Result of IDO-PCR that 48 hours after using lentiviral vector transfect rats bone marrow mesenchymal stem cellsNote:RT-PCR results showed that in the rats bone marrow mesenchymal stem cells and comparison of NC(Negative control group),OE(overexpressing IDO group) expression level of IDO gene was 62 906.27 times of NC (P<0.05).
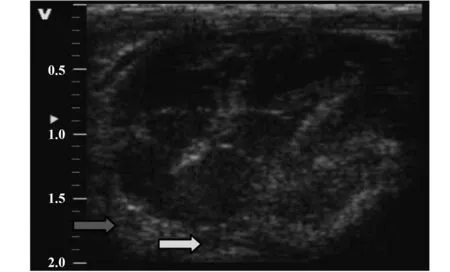
图2 腹腔异位移植心脏48 h后复查心脏彩超结果Fig.2 After rat abdominal heterotopic heart transplan-tation model established 48 h that color Doppler examination resultNote:The white arrow points to the formation of the thrombus;The black arrow points to the transplanted heart.

图3 大鼠移植模型建立3 d后给予IDO-BMSCs、空载体-BMSCs、BMSCs处理后2 d移植心脏心功能Fig.3 Using color Doppler examination assessment of transplanted cardiac function after intervention 2 daysNote:EF and FS were significantly improved in the transplant heart after 3 days of rat abdominal heterotopic heart transplantation model intervention by IDO-BMSCs 2 days, and there was significant difference between the other groups (P<0.05).
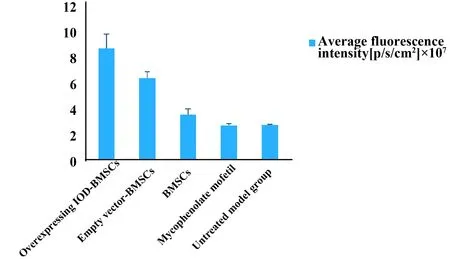
图4 给予干预措施2 d后完成移植心脏局部荧光强度评价Fig.4 Assessing cardiac local average fluorescence intensity after intervention 2 daysNote:The group of IDO-BMSCs the cardiac local average fluorescence intensity was the strongest,and there were significant difference between the other groups (P<0.05).
2.6采用流式细胞术检测受体大鼠脾脏细胞免疫抗原分子变化 提取给予干预措施(IDO-BMSCs、空载体-BMSCs、BMSCs、吗替麦考)2 d后受体大鼠脾脏细胞完成CD40、CD86、CD80、MHCⅡ、CD274、CD45RA、CD45RA+CD45RB、Treg表达检测,将未给予干预措施组(未处理组)及正常大鼠的脾脏细胞作为对照:可见过表达IDO-BMSCs组CD40表达为3.24±0.23;CD86表达为9.24±0.74;CD80表达为8.54±0.26;MHCⅡ表达为24.76±0.36;CD45RA表达为47.23±1.27;CD45RB+CD45RA表达为26.15±1.46其表达较其余组低。过表达IDO-BMSCs组CD247表达为10.37±1.42;Treg细胞表达为6.54±2.35,其表达较其余组高,如图5。
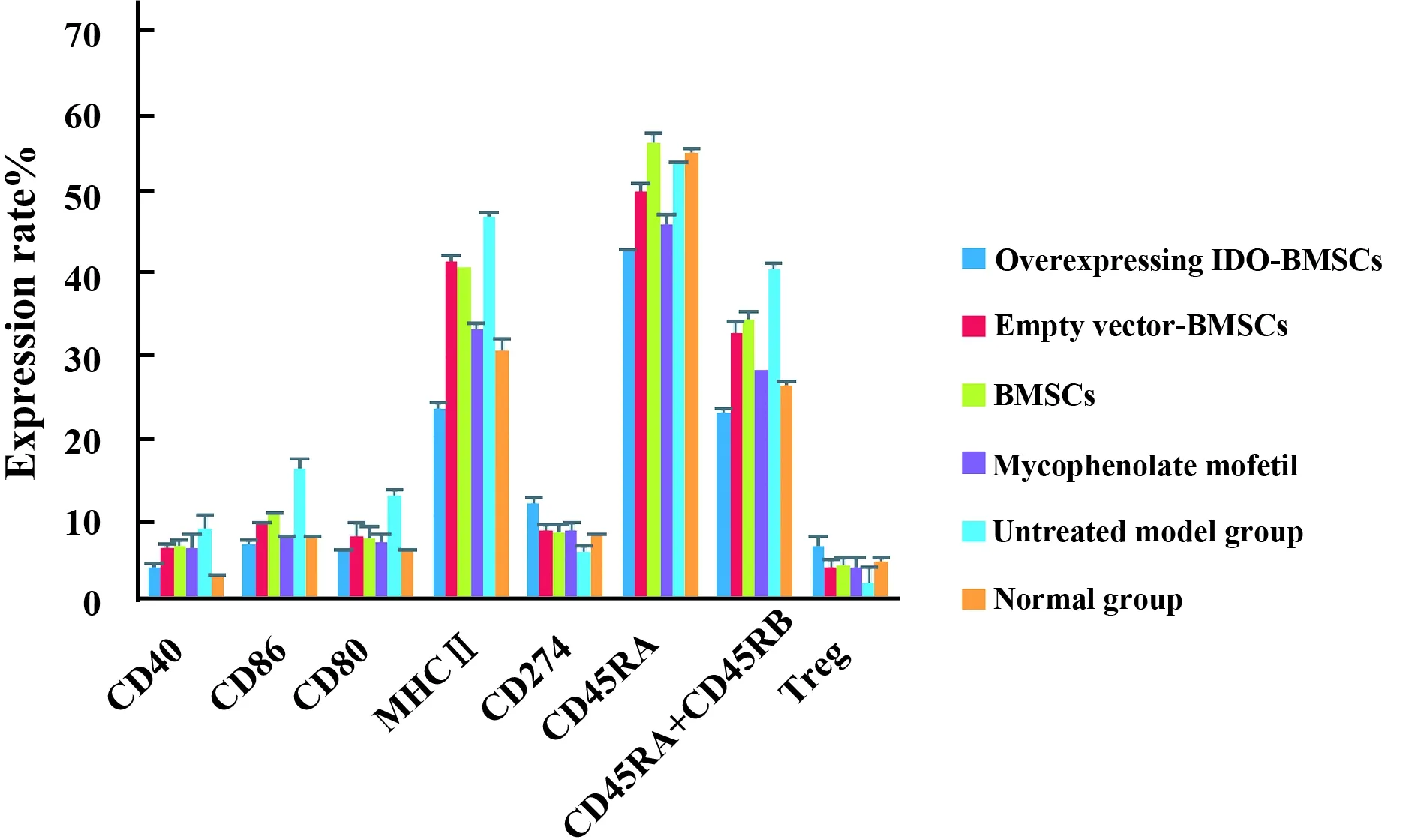
图5 给予干预措施2 d后流式检测脾脏细胞抗原分子表达Fig.5 Using flow cytometry detection of splenic cell antigen molecules expression after intervention 2 daysNote:Overexpression IDO-BMSCs group CD40,CD86,CD80,MHCⅡ,CD45RA,CD45RA+CD45RB expression are the lowest,and no significant difference compared with the normal group(P>0.05),and there was significant difference between the other groups (P<0.05).Overexpressing IDO-BMSCs group CD274 expression was the highest,and there was significant difference between the other groups (P<0.05).Overexpressing IDO-BMSCs group Treg expression was the highest,and there was significant difference between the other groups (P<0.05).

图6 给予干预措施后2 d提取受体大鼠血清检测细胞因子表达Fig.6 Detection of cytokine expression in serum of recipient rats after intervention 2 daysNote:Overexpress IDO-BMSCs group the expression of IL-1α,IL-4,IL-1β,IL-2,IFN-γ,IL-18 were reduced,and there was significant difference between the other groups (P<0.05),but IL-10 were rised and had significant difference between the other groups(P<0.05).
2.7采用液相芯片检测受体大鼠血清体液免疫分子变化 取腹腔异位移植术后2 d受体大鼠血清,使用RECYTMAG-65K-07试剂盒检测IL-1ɑ、IL-4、IL-1β、IL-2、IL-10、IFN-γ、IL-18及使用TGFBMAG-64K-03试剂盒检测TGFβ1、TGFβ2、TGFβ3,可见过表达IDO-BMSCs组IL-1ɑ、IL-4、IL-1β、IL-2、IFN-γ、IL-18表达分别为(78.341±2.45、3.455±0.24、134.563±7.21、45.761±4.81、38.273±1.67、178.346±2.34)较其余组低但较正常组对照组高。IL-10的表达为(1 003.245±3.56 )较其余组表达增高,见图6。
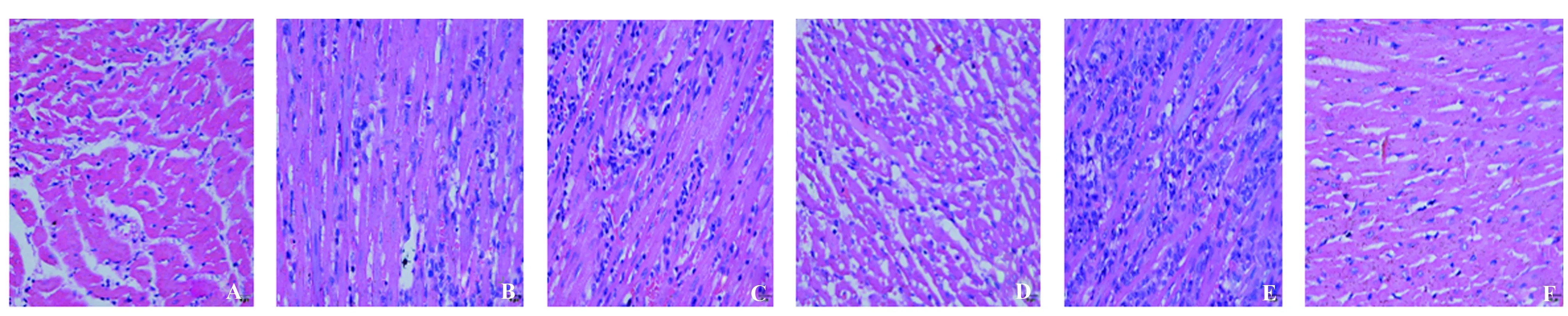
图8 大鼠心脏移植模型建立3 d后给予干预措施2 d后HE染色结果Fig.8 After 3 days of rat abdominal heterotopic heart transplantation model, and after intervention 2 days,result of HE stainingNote:A.Overexpressing IDO-BMSCs group;B.Empty vector-BMSCs group;C.BMSCs group;D.Mycophenolate mofetil;E.Untreated model group;F.Normal heart.Untreated model group the infiltration of inflammatory cells were higher than others, but overexpressing IDO-BMSCs the infiltration of inflammatory cells are lesser than others.
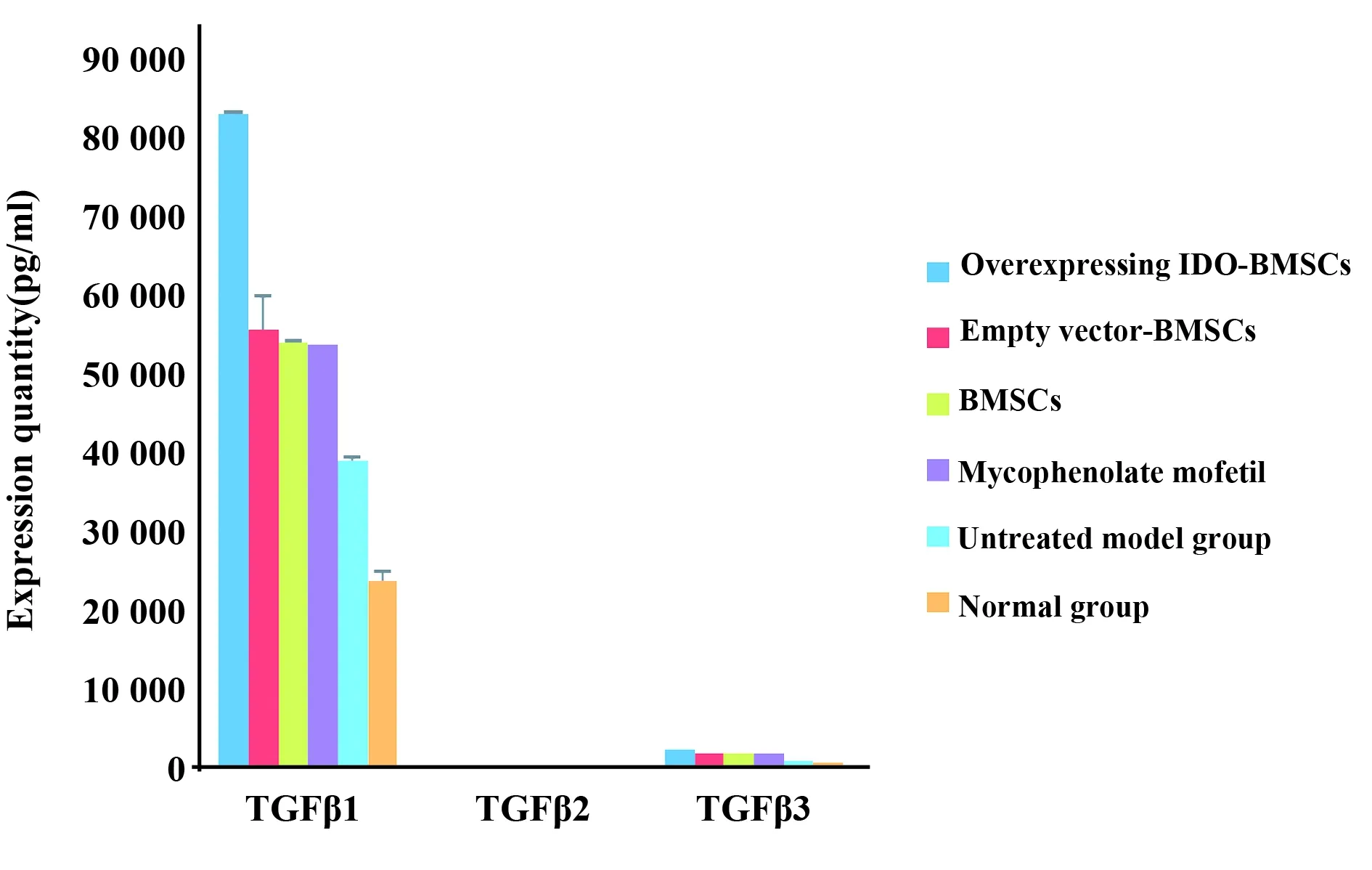
图7 给予干预措施后2 d提取受体大鼠血清检测细胞因子表达Fig.7 Detection of TGFβ1,TGFβ2,TGFβ3 expression in serum of recipoient rats after intervantion 2 daysNote:Overexpressing IDO-BMSCs group the expression of TGFβ1,TGFβ2,TGFβ3 were rised, and there was significant difference between the other groups (P<0.05).
2.8采用液相芯片检测受体大鼠血清TGFβ1、TGFβ2、TGFβ3的变化 给予干预措施后2 d提取受体大鼠血清,检测TGFβ1、TGFβ2、TGFβ3的量,可见过表达IDO-BMSCs组TGFβ1、TGFβ2、TGFβ3表达量为(80 006.982±4.23、0.321±0.12、7.346±1.12)较其余各组表达量高,见图7。
2.9HE染色结果 大鼠心脏移植模型建立3 d后,给予注射相应BMSCs细胞后2 d取其腹腔心脏,制备石蜡切片,完成HE染色(图8A~F)。可见过表达IDO-BMSCs组其炎症细胞浸润较正常组多但较其余组少。
3 讨论
20世纪以来,由于器官移植技术、移植免疫基础研究以及各种免疫抑制剂的进展,器官移植已成为临床治疗器官功能衰竭的有效治疗手段。但不可否认的是免疫排斥一直是阻碍器官移植进一步发展的瓶颈。本实验正是基于上述社会背景下,结合最新免疫调节研究结果,试图寻找到一种有效的生物免疫抑制方法。
MSCs具有免疫调节功能,目前认为其可能涉及以下途径:①MSCs持续不断表达低水平的MHCⅠ分子但不表达MHCⅡ及协同刺激分子,包括CD80、CD86或者CD40[1]。因此,MSCs将不会激活异种或异体淋巴细胞而其本身缺乏免疫原性。②MSCs能够抑制T、B淋巴细胞的激活和增生,部分是通过将细胞抑制于G0/G1细胞周期阶段[2,3]。MSCs也可能通过可溶性细胞因子(如:IL-6、M-CSF)干涉树突细胞的分化、成熟及功能[4]。③MSCs能够通过释放抗炎及抗凋亡分子修饰损伤组织的微环境并且保护损伤组织[5,6]。但目前MSCs临床应用免疫排斥仍不成熟,归根还是由于其调节免疫耐受的效果不确切。
IDO主要通过三条途径完成免疫调节:①通过产生犬尿氨酸(KYN)[其是芳基羟化物(AhR)受体的一个天然配体]。IDO催化分解色氨酸并产生毒性代谢产物犬尿氨酸,其被淋巴细胞摄取可以阻止细胞进入G1期,而凋亡[6]。犬尿氨酸途径,包括(犬尿氨酸、3OH-犬尿氨酸),可以诱导Tregs产生或抑制DCs[7,8]。治疗上,应用天然及合成的犬尿氨酸产物可以促进免疫耐受,保护移植器官,减少由于病原感染而引起的组织损伤[9]。②通过消耗色氨酸以触发细胞敏感转录信号途径。色氨酸的消耗可以经由分子应激反应途径,诸如:GCN2激酶和在哺乳动物中对色氨酸缺失反应的帕雷霉素样受体(mTOR)两者的激活可以发挥免疫调节作用。任何氨基酸的缺失都可以激活GCN2激酶而导致下游目标的磷酸化,真核细胞启动因子(eIF)-2α的磷酸化可以阻断大多数mRNA物种核糖体的转录,但是它可以选择性增强少量转录因子转录[10]。色氨酸的缺失也可影响到营养敏感性mTOR途径[11]。mTOR激活后可通过IDO、精氨酸酶、色氨酸羟化酶和其他酶抑制炎性位点色氨酸的分解代谢而影响Tregs细胞和效应性T细胞的功能[11]。③在DCs上表达的IDO可以直接作为细胞间信号分子[12]。IDO信号分子的功能是不依赖IDO酶的活性的。它主要是通过IDO和Src同族的第2域(SHP-1/SHP-2)与磷酸酯酶相接触,触发IDO的免疫调节域发挥作用。有研究表明,IDO-SHP复合体是维持TGF-β对老鼠血浆DCs发挥作用的关键因素[13]。
本实验正是在上述研究基础上通过建立大鼠异位心脏移植模型,采用心脏彩超、小动物活体成像、流式细胞、液相芯片、HE染色技术证实:①大鼠异位心脏移植模型建立后,给予相应细胞处理,可见过表达IDO-BMSCs处理后2 d移植心脏的EF、FS较其余各组有所提高。②进一步采用小动物活体评估也可见过表达IDO-BMSCs组移植心脏局部荧光强度最强。③给予干预措施后2 d可见过表达IDO-BMSCs组脾脏细胞CD40、CD86、CD80、MHCⅡ、CD45RA、CD45RA+CD45RB表达降低,而CD274、Treg细胞的表达增高。④采用液相芯片检测各组提取血清可见,2 d时过表达IDO-BMSCs组血清中IL-1ɑ、IL-4、IL-1β、IL-2、IFNγ、IL-18是降低的。IL-10、TGFβ1、TGFβ2、TGFβ3表达量是升高的。HE染色证实过表达IDO-BMSCs组炎性细胞浸润少于其他组。
综上所述,过表达IDO的BMSCs可以通过有效调节免疫DC、T细胞及细胞因子。从多个免疫层面改善移植心脏存活。
[1] Götherström C.Immunomodulation by mesenchymal stem cells and clinical experience [J].Placenta,2007,262(5):509.
[2] Jones S,Horwood N,Cope A,etal.The antiproliferative effect of mesenchymal stem cells is a fundamental property shared by all stromal cells [J].J Immunol,2007,179(5):2824.
[3] Corcione A,Benvenuto F,Ferretti E,etal.Human mesenchymal stem cells modulate B-cell functions [J].Blood,2006,107(1):367-372.
[4] Djouad F,Charbonnier LM,Bouffi C,etal.Mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin-6-dependent mechanism [J].Stem Cells,2007,25(8):2025-2032.
[5] Meirelles LS,Fontes AM,Covas DT,etal.Mechanisms involved in the therapeutic properties of mesenchymal stem cells [J].Cytokine Growth Factor Rev,2009,20(5-6):419-427.
[6] Terness P, Bauer TM, Rose L,etal.Inhibition of allogeneic T cell proliferation by indoleamine 2,3-dioxygenase-expressing dendritic cells: mediation of suppression by tryptophan metabolites[J].J Exp Med,2002,196(4):447-457.
[7] Belladonna ML,Grohmann U,Guidetti P,etal.Kynurenine pathway enzymes in dendritic cells initiate tolerogenesis in the absence of functional IDO[J].J Immunol,2006,177(1):130-137.
[8] Zaher SS,Germain C,Fu H .etal.3-hydroxykynurenine suppresses CD4+T-cell proliferation,induces T-regulatory-cell development,and prolongs corneal allograft survival[J].Invest J Vis Sci,2011,52(5):2640-2648.
[9] Kilberg MS,Shan J,Su N.ATF4-dependent transcription mediates signaling of amino acid limitation[J].J Metab,2009,20(9):436-443.
[10] Powell JD,Pollizzi KN,Heikamp EB.etal.Regulation of immune responses by mTOR[J].Annu J Rev Immunol,2012,30(5):39-68.
[11] Dalton DK,Noelle RJ.The roles of mast cells in anticancer immunity[J].Cancer Immunol J,2012,61(9):1511-1520.
[12] Cobbold SP,Adams E,Farquhar CA,etal.Infectious tolerance via the consumption of essential amino acids and mTOR signaling[J]. J Acad Sci USA,2009,106(29):12055-12060.
[13] Pallotta MT,Orabona C,Volpi C,etal.Indoleamine 2,3-dioxygenase is a signaling protein in long-term tolerance by dendritic cells[J].J Nat Immunol,2011,12(9):870-878.
[收稿2017-05-28]
(编辑 倪 鹏)
ImprovedsurvivalofheterotopichearttransplantoverexpressingIDOratbonemesenchymalstemcells
HEJi-Gang,LIBei-Bei,HANJin-Xiu,LIHong-Yuan,YANDan.
CardiovascularSurgery,theFirstPeople′sHospitalofYunnanProvince,Kunming650032,China
Objective:To explores the improvement in survival mechanism of a rat model of enterocoelia heterotopic heart transplant with rat bone marrow mesenchymal stem cells(BMSCs) IDO-overexpressing.MethodsIDO-overexpressing rat BMSCs were produced through transfection of rat BMSCs with IDO gene carried by the lentiviral vector GV308.A rat model of enterocoelia heterotopic heart transplantation was established.This rat model
a cell treatment via its tail veins,as follows:①Echocardiography was employed to detect the functional changes in the transplanted heart.②The fluorescence intensity of the different parts of the transplanted heart was evaluated using a body imaging system for small living animals.③Receptors rat spleens cells were obtained and used for a flow cytometric detection of the expression levels of CD40,CD86,CD80,MHCⅡ,CD274,CD45RA,CD45RA+CD45RB,and Treg cells.④A transplanted heart was obtained after injection to evaluate inflammatory cell infiltration through HE staining.⑤Liquid phase chips were used to detect changes in the serum factors IL-1ɑ,IL-4,IL-1β,IL-2,IL-10,IFN-γ,IL-18,TGFβ1,TGFβ2 and TGFβ3 in after injection cells.Results①After the rat heterotopic heart transplantation model and the corresponding cell treatment were established,after over-expressed IDO-BMSCs treatment 2 days the EF and FS were higher in the transplanted heart than other groups.②The fluorescence intensity of the parts of the transplanted heart was highest in the IDO-BMSC overexpression group as revealed by small animal living body evaluation.③Two days after the interventions,spleen cells in the over-expressed IDO-BMSCs group showed reduced expression levels of CD40,CD86,CD80,MHCⅡ,CD45RA,CD45RA+CD45RB and increased expression levels of CD274 and Treg cells as revealed by flow cytometry.④Liquid phase chips were used to examine the serum obtained from each group 2 days after the intervention,and the results showed that the expression levels of IL-1α,IL-4,IL-1β,IL-2,IFN-γ and IL-18 in the IDO-BMSC overexpression group decrease.By contrast,the expression levels of IL-10,TGFβ1,TGFβ2 and TGFβ3 increase.HE staining results demonstrate that inflammatory cell infiltration was lower in IDO-BMSC overexpression group than in other groups.ConclusionIDO-overexpressing BMSCs improve the survival of a transplanted heart through effective adjustment of immune DC and T cells,as well as cell factors.
IDO;Rat bone mesenchymal stem cell;Immunosuppression
①本文为国家自然科学基金(81460073)、云南省科技厅-昆明医科大学应用基础研究联合专项(2014FB089)、云南省教育厅科学研究基金(2015Z051)、中国博士后科学基金(2015M582764XB)、成都医学院2015年度科研项目(CYZ15-18)和云南省医学后备人才(H-201607)项目。
②通讯作者,E-mail:jiganghe999@163.com。
R392.4
A
1000-484X(2017)10-1447-06
10.3969/j.issn.1000-484X.2017.10.002
贺继刚(1980年-),男,副主任医师,硕士生导师,主要从事干细胞在终末重症心脏疾病中的应用研究。
