葡萄糖调节蛋白78调控乙型肝炎相关性肝细胞癌患者线粒体生成蛋白的表达及临床分析
2017-10-23李亚萍贾晓黎潘国英
李亚萍, 王 媛, 翟 嵩, 贾晓黎, 张 欣, 潘国英, 杨 颖
(西安交通大学第二附属医院 感染科, 西安 710004)
葡萄糖调节蛋白78调控乙型肝炎相关性肝细胞癌患者线粒体生成蛋白的表达及临床分析
李亚萍, 王 媛, 翟 嵩, 贾晓黎, 张 欣, 潘国英, 杨 颖
(西安交通大学第二附属医院 感染科, 西安 710004)
目的研究葡萄糖调节蛋白78(GRP78)在乙型肝炎相关性肝细胞癌组织中的表达及其与患者临床病理特征的关系,探索GRP78对肝癌细胞中线粒体生成相关蛋白分子的调控,为建立肝癌防治的新策略提供基础。方法收集乙型肝炎相关性肝细胞癌54例患者组织标本,用免疫组化和Western Blot检测肝癌及癌旁组织中GRP78、Lon、TFAM、COXⅣ的表达;用siRNA干涉肝癌细胞中GRP78的表达,检测细胞中GRP78、Lon、TFAM、COXⅣ的表达;用实时定量PCR (qRT-PCR)检测临床标本和干涉GRP78 表达后肝癌细胞中线粒体DNA(mtDNA)的水平;对临床资料和实验数据进行统计分析。计量资料2组间比较比较采用t检验,计数资料2组间比较采用Fisher精确检验,患者生存分析采用Kaplan-Meier法。结果GRP78及Lon在乙型肝炎相关性肝癌组织中的表达显著高于癌旁组织(t值分别为9.135、5.523,P值均<0.001),而线粒体生成相关蛋白TFAM、COXⅣ的表达及mtDNA水平显著低于癌旁组织(t值分别为2.765、4.260、12.280,P值分别为0.011、<0.001、<0.001)。干涉肝癌细胞中GRP78的表达,可显著提高线粒体生成相关蛋白TFAM、COXⅣ的表达及mtDNA水平(P值均<0.05)。GRP78在不同肿瘤数量、门静脉癌栓以及肿瘤分期的病例中,表达水平存在显著差异(P值分别为0.016、0.003、0.045);GRP78低表达患者术后总生存期及无复发生存期优于GRP78高表达的患者(χ2值分别为5.006、4.995,P值分别为0.025、0.026)。结论GRP78对线粒体维持与生成具有潜在的调控作用,对建立潜在的肝癌防治新策略具有重要的临床指导意义。
癌,肝细胞; 肝炎病毒, 乙型; 线粒体蛋白质类
全球癌症统计报告[1]显示,肝癌致死率位居癌症第二位,其中又以肝细胞癌(HCC) 为主,占总病例数的70%~90%。在全球每年新增的肝癌病例和死亡病例中,我国约占50%[2]。HCC是多因素共同作用的结果,其中主要的风险因素包括HBV感染、肝硬化、应激刺激和基因异常表达等。HCC易转移复发,预后极差,因此探索研究其发生发展机制具有重要的临床价值及意义。内质网应激是肿瘤细胞适应微环境变化的一种普遍性自我防御反应,在维持肿瘤细胞的生存中扮演了极其关键的角色。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是内质网应激发生的重要标志之一,参与肿瘤的发生发展及耐药过程[3-5]。GRP78在正常肝组织中几乎不表达[6],在肝癌组织中表达程度各异且其作用的分子机制尚不明确,在乙型肝炎相关性肝细胞癌中的作用尚未见报道。本研究检测了GRP78在乙型肝炎相关性肝细胞癌组织中的表达,并对其临床特征进行了初步分析,探索了GRP78对线粒体生成相关蛋白的分子调控,为阐明HCC发生发展和防治的新策略提供实验基础。
1 资料与方法
1.1 资料及试剂
1.1.1 一般资料 病例来源于2013年6月-2016年6月在本院接受肝癌切除手术的患者54例,均有石蜡和液氮冻存组织标本。病例选取依据:(1)经病理切片确诊为HCC; (2)血清常规检查HBsAg阳性;(3)手术前未进行过放化疗;(4)临床病历及后续随访资料完整。癌旁组织选取依据:(1)距离癌灶组织≥2 cm;(2)经病理切片检查未含癌细胞。本研究已获得患者或家属知情同意,并经本院伦理委员会批准。
1.1.2 主要试剂 兔抗人GRP78抗体(ab21685)、LON抗体(ab103809)、TFAM抗体(ab131607)、COXⅣ抗体(ab153709)、羊抗兔二抗(ab6721)均购自Abcam公司。两步法EnVision免疫组化试剂盒和DAB试剂盒购自Dako公司。Lipofectamine 2000、PVDF膜购自Invitrogen公司;蛋白质预染Marker(SM 0671)购自Thermo Scientific公司;Opti-MEM、高糖DMEM培养基和胎牛血清购自Gibco公司;基因组DNA提取试剂盒购自OMEGA BIO-TEK公司;蛋白提取试剂盒购自上海碧云天生物技术有限公司;引物由生工生物工程(上海)股份有限公司合成;GRP78 siRNA干涉引物5′-AUAACAUUUAGGCCAGCAAUAGUUC-3′和阴性对照引物5′-UUCUCCGAACGUGUCACGUUU-3′由上海吉玛公司设计合成;肝癌细胞系MHCC-97H、SMMC7721购自上海中科院细胞库,肝癌细胞系BEL7402、HepG2和正常肝细胞HL-7702由本室保存。
1.2 方法
1.2.1 免疫组化检测HCC组织中GRP78蛋白的表达 免疫组化操作过程按照试剂盒说明书进行。石蜡标本制成厚度均为3 μm切片。用柠檬酸缓冲液高压法进行抗原修复,兔抗人GRP78抗体(1∶200),4 ℃孵育过夜,生物素标记的羊抗兔二抗(1∶1000),37 ℃孵育1 h,HRP标记的链霉亲和素在湿盒中28 ℃孵育20 min,DAB显色后苏木精复染。阴性对照组用非免疫血清代替一抗。免疫组化评分标准:根据阳性细胞比率及显色深浅综合评分,最终得分用公式∑pi计算。p代表阳性细胞百分率分值,阳性细胞显色百分数<10%分数为0;10%~25%为1;26%~50%为2;51%~75%为3;76%以上为4。i代表细胞显色深浅:不显色或显色极淡为0分;浅黄色为1分;棕黄色为2分;黄褐色为3分。
1.2.2 Western Blot检测蛋白的表达 取液氮冻存的HCC癌组织及癌旁组织各约100 mg,加入4 ℃预冷的组织裂解液和PMSF混合液(99∶1),用匀浆器充分研磨,之后将匀浆组织移入EP管中,4 ℃、12 000 r/min离心15 min,取上清液。取4 μl上清液用BCA法测定其蛋白浓度,之后取部分上清液与还原型4×蛋白SDS-PAGE上样缓冲液混合并煮沸10 min,之后用SDS-PAGE电泳分离,经Western Blot转运至PVDF膜,用5%脱脂奶粉室温封闭1 h后,在膜上分别滴加兔抗人GRP78(1∶1000)、Lon(1∶2000)、TFAM(1∶1000)、COXⅣ (1∶2000)、β-actin抗体(1∶2000)等抗体,4 ℃孵育过夜,TBST洗膜3次,之后将HRP标记的二抗(1∶10 000)室温孵育1 h,TBST洗膜3次,采用ECL化学发光检测试剂盒检测蛋白表达情况,Gel Pro软件分析灰度值。细胞中相关蛋白的表达检测用全细胞裂解液,步骤同前。
1.2.3 细胞培养 所有肝癌细胞和正常肝细胞均以10%FBS的高糖DMEM培养基培养,细胞放置37 ℃、5%CO2的细胞培养箱中正常培养;细胞用0.25%的胰蛋白酶消化、传代。
1.2.4 siRNA干涉 转染前1天,将肝癌细胞和正常肝细胞按照每孔2×104个细胞接种于6孔板中,次日将400 pmol siRNA 用8 μl Lipofectamine 2000 转染每孔细胞(终浓度为200 nmol/L),实验设置空白对照组、阴性对照组(Scramble siRNA)和实验组(GRP78 siRNA),每组设置3个复孔,重复3次实验。48 h后提取细胞总DNA,72 h后裂解细胞,获取细胞总蛋白。
1.2.5 实时定量PCR(qRT-PCR)检测HCC组织和细胞线粒体DNA(mtDNA)水平 取54例HCC组织和癌旁组织以及瞬时转染GRP78 siRNA 48 h后的肝癌细胞及正常细胞,按照基因组DNA提取试剂盒步骤,提取全细胞DNA,并紫外定量。设计两套PCR引物(表1),分别扩增mtDNA和作为内参的核基因组中单拷贝的HGB基因。qRT-PCR反应体系为20 μl,包括1×SYBR Green PCR Master Mix、10 nmol/L引物、8 ng基因组DNA。扩增条件为94 ℃ 30 s,58 ℃ 30 s,72 ℃ 50 s,35个循环。所有样品均设置3个复孔,每实验批次均设置阳性对照和空白对照。实验需满足标准曲线,R2须大于0.99,重复样品Ct值的标准差须小于0.25,否则重复该样品实验。
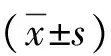
2 结果
2.1 GRP78在HCC和癌旁组织中的表达 本研究中用免疫组化检测了54例HCC组织及癌旁组织GRP78的表达情况,与癌旁组织相比,46例HCC组织中GRP78表达较癌旁组织高,占85.2 %,8例HCC组织中GRP78表达较癌旁组织低,占14.8 %。免疫组化最终评分显示,GRP78在HCC组织(7.481±0.294)和癌旁组织(4.322±0.291)中的表达差异具有统计学意义(t=7.626,P<0.001)(图1)。
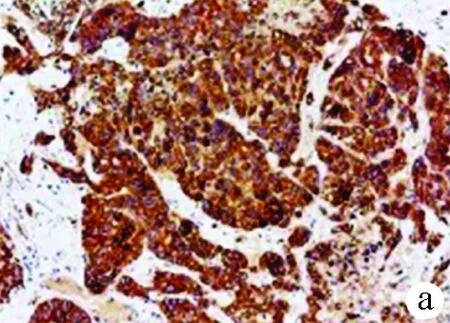
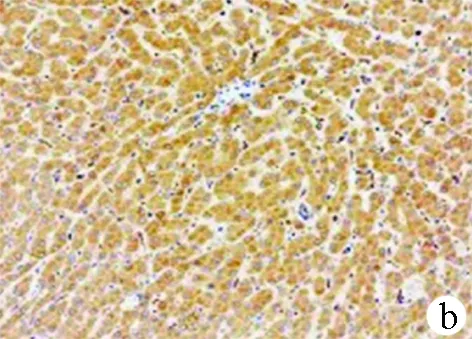
图1 GRP78在HCC组织及癌旁组织中的免疫组化染色结果
2.2 GRP78在HCC组织中的表达水平与临床特征
分析患者临床特征发现,GRP78在肿瘤单发或多发、是否存在门静脉癌栓以及不同肿瘤分期的乙型肝炎相关性肝细胞癌病例中,表达水平的差异均有统计学意义(P值均<0.05)(表2)。Kaplan-Meier生存分析显示,GRP78低表达患者术后总生存期及无复发生存期优于GRP78高表达的患者(χ2值分别为5.006、4.995,P值分别为0.025、0.026)(图2)。
2.3 GRP78与线粒体生成相关蛋白在HCC中的表达 GRP78是内质网应激的标志分子,本研究随机选取了12例HCC组织及其癌旁组织,用Western Blot法检测了组织中GRP78、Lon、TFAM、COXⅣ等内质网应激和线粒体生成相关蛋白的表达情况(图3),用Gel Pro软件测量其灰度值,进行半定量分析(表3)。结果显示,GRP78、Lon蛋白在癌组织中的表达显著高于癌旁组织,TFAM、COXⅣ的表达则显著低于癌旁组织,差异均有统计学意义(P值均<0.05)。

表1 用于mtDNA qRT-PCR的引物序列

表2 HCC患者临床特征与GRP78表达水平情况(例)
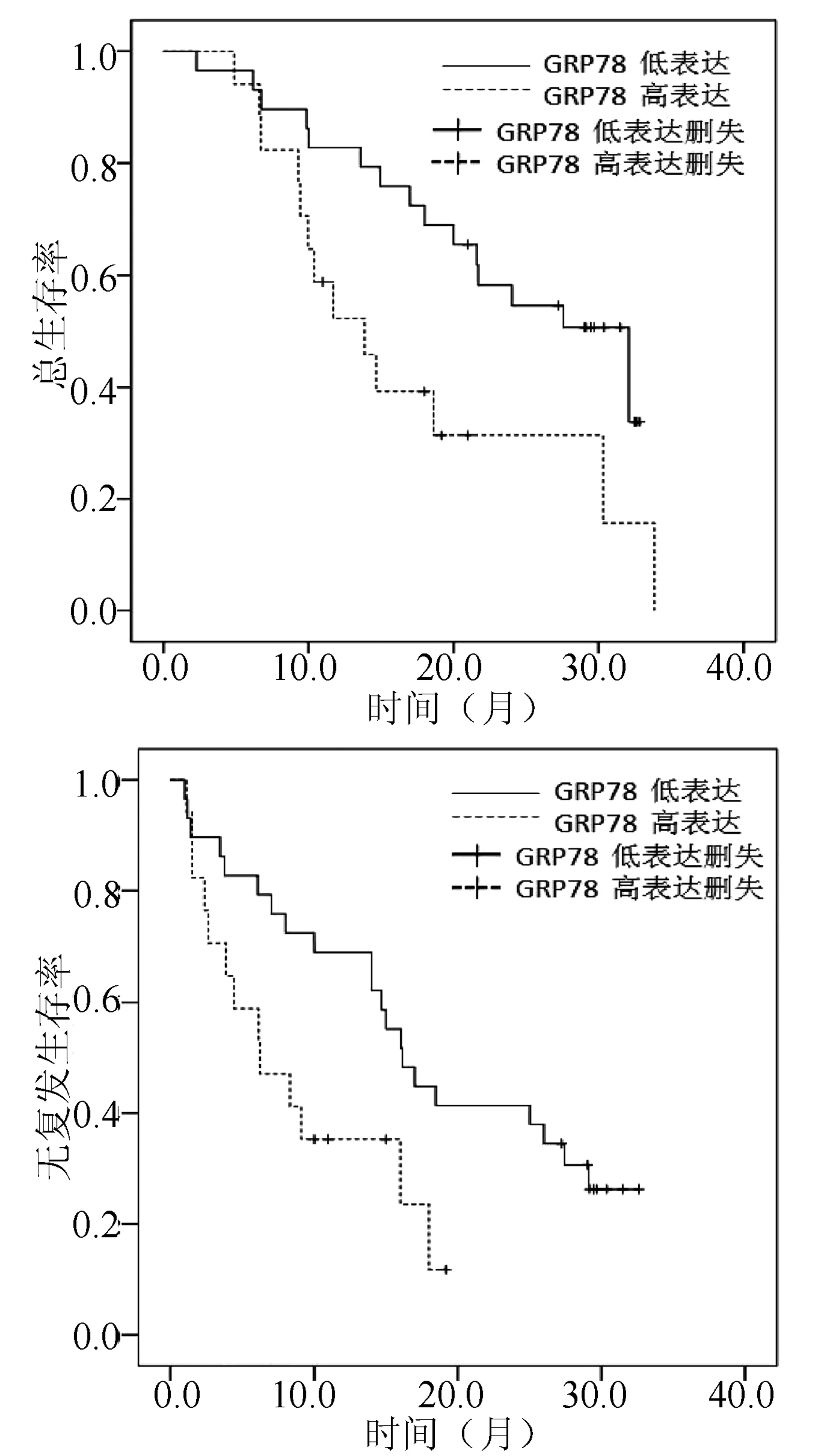
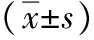
图2 GRP78表达水平与HCC患者术后总生存和无复发生存的关系
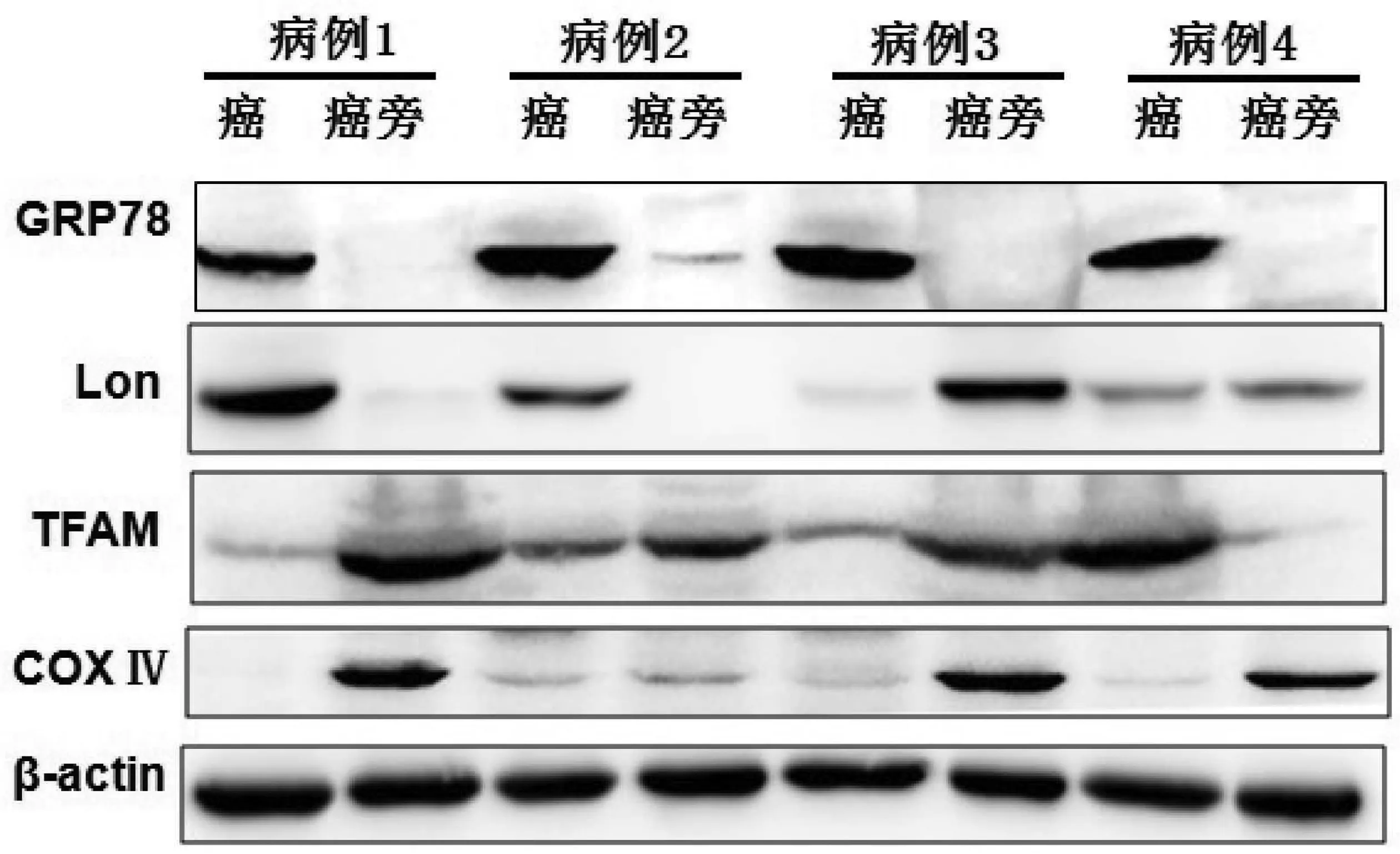
图3 Western Blot检测GRP78和线粒体生成相关蛋白在HCC中的表达
2.4 HCC和癌旁组织中mtDNA水平分析 本研究提取了54例HCC组织和癌旁组织中的基因组DNA和mtDNA,用qRT-PCR检测组织中mtDNA水平。结果显示,54例HCC组织中mtDNA水平(0.266±0.016)显著低于癌旁组织(0.677±0.029)(t=12.280,P<0.001)。
2.5 干涉肝癌细胞中的GRP78表达后线粒体生成蛋白和mtDNA水平分析 GRP78 siRNA转染肝癌细胞MHCC-97H、SMMC7721、BEL7402、HepG2和正常肝细胞HL-7702后,Western Blot检测结果显示,与阴性对照组相比,GRP78和Lon在肝癌细胞中表达显著降低(tGRP78值分别为191.300、59.570、311.000、84.940,tLon值分别为115.300、15.800、236.800、97.800,P值均<0.05),而TFAM、COXⅣ表达水平显著增高(tTFAM值分别为25.260、25.330、10.310、11.410,tCOXⅣ值分别为125.900、73.570、126.400、84.940,P值均<0.05);而在正常肝细胞中,GRP78、Lon、TFAM、COXⅣ与阴性对照组无显著差异(P值均>0.05) (图4)。mtDNA qRT-PCR检测结果显示,干涉GRP78后,与阴性对照组相比,mtDNA水平显著升高(P值均<0.05),而正常肝细胞差异无统计学意义(P>0.05) (表4)。
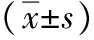
表4 干涉肝癌细胞和正常肝细胞中GRP78表达后mtDNA水平分析
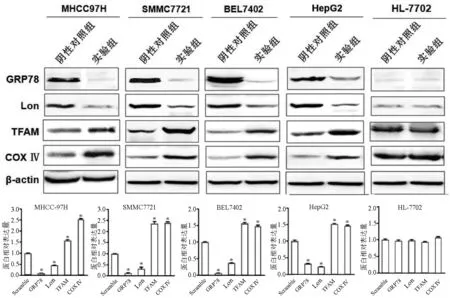
图4干涉肝癌细胞和正常肝细胞中GRP78表达后线粒体生成相关蛋白的表达情况*P<0.05
3 讨论
目前HCC的主要治疗手段包括手术切除、介入、射频消融等,早诊断早治疗对提高患者生存率具有非常重要的作用,充分利用临床标本研究HCC潜在诊治靶点和预后指标及其分子机制具有重要意义。内质网应激现象在肿瘤细胞中普遍存在[7],以应对缺氧、氧化应激、营养匮乏以及钙离子稳态失衡和生存微环境的变化。GRP78表达升高被看作是内质网应激发生的重要标志之一,其参与了肿瘤的发生发展及耐药过程,与以往在肝癌组织中的研究[8-9]基本一致。本研究结果显示,GRP78在乙型肝炎相关肝癌组织中的表达显著高于癌旁组织。但是与以往研究不同的是[6],GRP78在癌旁组织中表达也有所增高而非不表达,这可能与癌旁组织应对微环境改变,产生内质网应激有关。
HBV感染是引起肝细胞内质网应激的刺激因子之一,也是HCC发生发展的重要危险因素[10]。以往的细胞生物学研究[11-13]表明,HBV感染可以引起肝癌细胞中GRP78表达升高,进而引起肝癌细胞的凋亡、免疫逃逸、放化疗耐受,但其作用的分子机制尚不明确。本研究发现,在肿瘤是否多发、门静脉是否有癌栓和不同肿瘤分期的HCC组织中,GRP78的表达水平具有显著差异。同时发现,GRP78低表达的患者术后总生存率和无复发生存率优于GRP78高表达的患者,提示GRP78蛋白表达水平对判断乙型肝炎相关性肝癌的临床预后具有重要临床价值。
mtDNA的突变、拷贝数以及水平的变化与肿瘤的发生发展、肿瘤风险、肿瘤耐药性密切相关[14-16],文献[17]报道内质网应激介导了肿瘤中线粒体的凋亡。因此,本研究检测了HCC组织中线粒体相关蛋白的表达及mtDNA水平。结果发现,除了GRP78表达升高外,线粒体内关键的蛋白水解酶Lon也显著高于癌旁组织。Lon蛋白酶是一种存在于线粒体中的ATP依赖蛋白酶,可以选择性地降解TFAM,对保护线粒体、维持线粒体再生起着重要作用[18-20]。与此同时,线粒体生成标志分子COXⅣ、mtDNA合成的核心转录因子TFAM和mtDNA水平则显著低于癌旁组织。之后,课题组者通过细胞生物学实验发现,干涉肝癌细胞中GRP78的表达,蛋白水解酶Lon的表达水平也显著下降,而肝癌细胞中mtDNA水平及线粒体生成相关蛋白TFAM、COXⅣ的表达则显著提高,呈一种逆转现象。这些结果提示,在肿瘤微环境中,GRP78蛋白可能通过Lon和TFAM对线粒体维持与生成、mtDNA的水平产生潜在的调控作用,是潜在的干预靶点,这为进一步探索HCC发生发展及耐药机制提供了线索,对建立潜在的HCC防治新策略具有一定的临床指导意义。
[1] TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics 2012[J].CA Cancer J Clin, 2015, 65(2): 87-108.
[2] CHEN WQ, ZHENG RS, ZHANG SW, et al. Report of cancer incidence and mortality in China,2012[J]. China Cancer, 2016, 25(1): 1-8. (in Chinese)
陈万青, 郑荣寿, 张思维,等. 2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤, 2016, 25(1): 1-8.
[3] DICKS N, GUTIERREZ K, MICHALAK M, et al. Endoplasmic reticulum stress, genome damage, and cancer[J]. Front Oncol, 2015, 3(5): 11.
[4] YUAN XP, DONG M, LI X, et al. GRP78 promotes the invasion of pancreatic cancer cells by FAK and JNK[J]. Mol Cell Biochem, 2015, 398(1-2): 55-62.
[5] MALHI H, KAUFMAN RJ. Endoplasmic reticulum stress in liver disease role of endoplasmic reticulum stress and unfolded protein responsesin health and diseases[J]. J Hepatol, 2011, 54(4): 795-809.
[6] CHEN WT, ZHU G, PFAFFENBACH K, et al. GRP78 as a regulator of liver steatosis and cancer progression mediated by loss of the tumor suppressor PTEN[J]. Oncogene, 2014, 33(42): 4997-5005.
[7] XIAO B, LIU RR, LIU BT, et al. Induction effect of TTF1-NP on human hepatoma cell apoptosis through ERS-mediated pathway[J]. J Jilin Univ: Med Edit, 2015, 41(6): 1118-1123. (in Chinese)
肖斌, 刘荣荣, 刘炳彤, 等. TTF1-NP诱导人肝癌HepG-2细胞凋亡的内质网应激作用[J]. 吉林大学学报: 医学版, 2015, 41(6): 1118-1123.
[8] WANG WA, GROENENDYK J, MICHALAK M. Endoplasmic reticulum stress associated responses in cancer[J]. Biochim Biophys Acta, 2014, 1843(10): 2143-2149.
[9] SU R, LI Z, LI H, et al. Grp78 promotes the invasion of hepatocellular carcinoma[J]. BMC Cancer, 2010, 10: 20.
[10] LI YW, YANG FC, LU HQ, et al. Hepatocellular carcinoma and hepatitis B surface protein[J]. World J astroenterol, 2016, 22(6): 1943-1952.
[11] ZHUO CS, LIU LJ, XIE HH, et al. Endoplasmic reticulum stress in Huh7 cell induced by envelope proteins of hepatitis B virus[J/CD]. Chin J Exp Clin Infect Dis: Electronic Edition, 2016, 10(3): 375-379. (in Chinese)
卓传尚, 柳丽娟, 谢海花, 等. 乙型肝炎病毒包膜蛋白诱导肝癌细胞系内质网应激的研究[J/CD]. 中华实验和临床感染病杂志: 电子版, 2016, 10(3): 375-379.
[12] WANG HC, HUANG W, LAI MD, et al. Hepatitis B virus pre-S mutants,endoplasmic reticulum stress and hepatocarcinogenesis[J]. Cancer Sci, 2006, 97(8): 683-688.
[13] SUNAMI Y, RINGELHAN M, KOKAI E, et al. Canonical NF-κB signaling in hepatocytes acts as a tumor-suppressor in hepatitis B virus surface antigen-driven hepatocellular carcinoma by controlling the unfolded protein response[J]. Hepatology, 2016, 63(5): 1592-1607.
[14] LI L, HANN HW, WAN S, et al . Cell-free circulating mitochondrial DNA content and risk of hepatocellular carcinoma in patients with chronic HBV infection[J]. Sci Rep, 2016, 6: 23992.
[15] HSU CC, LEE HC, WEI YH. Mitochondrial DNA alterations and mitochondrial dysfunction in the progression of hepatocellular carcinoma[J]. World J Gastroenterol, 2013, 19(47): 8880-8886.
[16] WALLACE DC. Mitochondria and cancer[J]. Nat Rev Cancer, 2012, 12(10): 685-698.
[17] BHAT TA, CHAUDHARY AK, KUMAR S, et al. Endoplasmic reticulum-mediated unfolded protein response and mitochondrial apoptosis in cancer[J].Biochim Biophys Acta, 2017, 1867(1): 58-66
[18] GIBELLINI L, PINTI M, BARTOLOMEO R, et al. Inhibition of Lon protease by triterpenoids alters mitochondria and is associated to cell death in human cancer cells[J]. Oncotarget, 2015, 6(28): 25466-25483.
[19] LU B, LEE J, NIE X, et al. Phosphorylation of human TFAM in mitochondria impairs DNA binding and promotes degradation by the AAA+ Lon protease[J]. Mol Cell, 2013, 49(1): 121-132.
[20] MATSUSHIMA Y, GOTO Y, KAGUNI LS. Mitochondrial Lon protease regulates mitochondrial DNA copy number and transcription by selective degradation of mitochondrial transcription factor A (TFAM)[J]. PNAS, 2010, 107(43): 18410-18415.
Glucose-regulatedprotein78regulatestheexpressionofmitochondrialgenesisproteinsinHBV-relatedhepatocellularcarcinomaaclinicalanalysis
LIYaping,WANGYuan,ZHAISong,etal.
(DepartmentofInfectiousDiseases,TheSecondAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an710004,China)
ObjectiveTo investigate the expression of glucose-regulated protein 78 (GRP78) in HBV-related hepatocellular carcinoma (HBV-HCC) and its association with clinicopathological features, as well as its regulatory effect on mitochondrial genesis proteins in hepatoma cells, and to provide a basis for new strategies for the prevention and treatment of HCC.MethodsTissue samples were collected from 54 patients with HBV-HCC, and immunohistochemistry and Western blot were used to measure the expression of GRP78, Lon, TFAM, and cytochrome C oxidase Ⅳ (COXⅣ). The expression of GRP78 in hepatoma cells was interfered by siRNA, and then the expression of GRP78, Lon, mitochondrial transcription factor A (TFAM), and COX Ⅳ was measured. Quantitative real-time PCR was used to measure the level of mitochondrial DNA (mtDNA) in clinical specimens and HCC cells after GRP78 expression was interfered with. A statistical analysis was performed for clinical and experimental data. Thet-test was used for comparison of continuous data between groups, the Fisher′s exact test was used for comparison of categorical data between groups, and the Kaplan-Meier method was used for survival analysis.ResultsCompared with the adjacent tissues, HBV-HCC tissues had significantly higher expression of GRP78 and Lon (t=9.135 and 5.523, bothP<0.0001) and significantly lower expression of the mitochondrial genesis proteins TFAM and COX Ⅳ and mtDNA level (t=2.765, 4.260, and 12.280,P=0.011, <0.001, and <0.001). There were significant increases in the expression of the mitochondrial genesis proteins TFAM and COX Ⅳ and mtDNA level after the interference with GRP78 expression in hepatoma cells (allP<0.05). There were significant differences in the expression of GRP78 between patients with different numbers of tumors, patients with and without portal vein tumor thrombus, and patients with different tumor stages (P=0.016, 0.003, and 0.045). The patients with low GRP78 expression had significantly longer overall survival and recurrence-free survival after surgery than those with high GRP78 expression (χ2=5.006 and 4.995,P=0.025 and 0.026).ConclusionGRP78 has a potential regulatory effect on mitochondrial genesis and maintenance and has important clinical guiding significance in establishing new strategies for the prevention and treatment of HCC.
carcinoma, hepatocellular; hepatitis B virus; mitochondrial proteins
R512.62; R735.7
A
1001-5256(2017)10-1949-06
10.3969/j.issn.1001-5256.2017.10.020
2017-05-09;
2017-06-15。
国家自然科学基金资助(81500453)
李亚萍(1986-),女,助理研究员,博士,主要从事感染性疾病的防治研究。
翟嵩,电子信箱:zhaisongsong@189.cn。
引证本文:LI YP, WANG Y, ZHAI S, et al. Glucose-regulated protein 78 regulates the expression of mitochondrial genesis proteins in HBV-related hepatocellular carcinoma: a clinical analysis[J]. J Clin Hepatol, 2017, 33(10): 1949-1954. (in Chinese)
李亚萍, 王媛, 翟嵩, 等. 葡萄糖调节蛋白78调控乙型肝炎相关性肝细胞癌患者线粒体生成蛋白的表达及临床分析[J]. 临床肝胆病杂志, 2017, 33(10): 1949-1954.
(本文编辑:朱 晶)
