乌司他丁联合奥曲肽对重症急性胰腺炎HMGB1、TNF-α、IL-1β表达的影响及疗效观察
2017-10-21李娟娥
李娟娥
(定西市中医院,甘肃 定西 743000)
乌司他丁联合奥曲肽对重症急性胰腺炎HMGB1、TNF-α、IL-1β表达的影响及疗效观察
李娟娥
(定西市中医院,甘肃 定西 743000)
目的 探究乌司他丁联合奥曲肽对重症急性胰腺炎(SAP)高迁移率族蛋白B1(HMGB1)、肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)表达的影响及其疗效。方法 选取我院收治的SAP患者120例,按随机原则将其分为对照组和观察组,每组60例。两组均进行常规治疗,在此基础上对照组给予奥曲肽治疗,观察组给予乌司他丁联合奥曲肽治疗,两组均持续治疗15天。采用酶联免疫吸附法(ELISA)测定两组患者血清HMGB1、TNF-α、IL-1β的水平,观察两组治疗后的临床疗效。结果 治疗后两组患者血清HMGB1、TNF-α、IL-1β的水平均显著低于治疗前(P<0.01);治疗后观察组血清HMGB1、TNF-α、IL-1β的水平显著低于对照组(P<0.01);观察组的总有效率为90.00%,显著高于对照组的73.33%(P<0.01);观察组的腹痛腹胀缓解时间、血淀粉酶恢复正常时间均明显短于对照组(P<0.01)。结论 乌司他丁联合奥曲肽能够有效降低SAP患者HMGB1、TNF-α、IL-1β的表达水平,并提高临床疗效。
乌司他丁;奥曲肽;重症急性胰腺炎
重症急性胰腺炎(Severe Acute Pancreatitis,SAP)是一种常见的消化内科急腹症,发病急、并发症多、病情险恶、病死率高,临床表现为腹痛、腹胀、恶心、发热等典型症状,同时伴有血尿淀粉酶异常升高等。SAP可引发患者全身炎症反应,严重时将导致机体器官衰竭[1]。目前,临床治疗SAP主要采用药物治疗,乌司他丁、奥曲肽为临床常用药物。乌司他丁能够抑制炎症因子的产生、释放[2];奥曲肽能够有效减轻胰腺损伤,改善胰腺组织充血、水肿等情况[3]。关于乌司他丁与奥曲肽联合使用治疗SAP的研究较少,因此,本研究使用乌司他丁联合奥曲肽治疗SAP,观察分析其对SAP患者HMGB1、TNF-α、IL-1β表达的影响及临床疗效,现报告如下。
1 对象与方法
1.1 研究对象
选取我院于2015年9月至2017年2月期间收治的120例SAP患者作为研究对象,所有患者的诊断标准均符合《重症急性胰腺炎诊治草案》[4]。按随机原则将其分为对照组和观察组,每组60例。对照组中男性34例,女性26例,年龄25~58岁,平均(42.71±4.23)岁,病程 1~5天,平均(3.25±1.31)天;观察组中男性33例,女性 27例,年龄 26~57岁,平均(43.23±4.36)岁,病程 1~7天,平均(3.31±1.28)天。两组患者的性别、年龄、病程等一般资料比较,无显著性差异(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:(1)经CT或核磁共振检查,有急性胰腺炎的影像特征;(2)胰腺脓肿、胰腺坏死等;(3)血清淀粉酶水平升高3倍以上;(4)器官衰竭;(5)所有患者均签署知情同意书。排除标准:(1)心脑血管疾病患者;(2)肠胃疾病患者;(3)肝肾功能不全者;(4)对本次研究所用药物有过敏史者;(5)妊娠期、哺乳期妇女。
1.3 治疗方法
两组患者入院后均禁食,给予平衡水电解质、胃肠减压、抗生素预防感染及营养支持等常规综合治疗。在此基础上,对照组给予奥曲肽(国药准字H20061309,批号20110929,北京百奥药业有限责任公司生产)治疗,0.3 mg/天,皮下注射,2次/天,持续治疗15天;观察组在对照组的基础上给予乌司他丁(国药准字H20040506,批号20111108,广东天普生化医药股份有限公司生产)治疗,将10万U乌司他丁溶于250 ml 5.0%的葡萄糖溶液中静脉滴注,1次/天,30分钟滴完,持续治疗15天。
1.4 HMGB1、TNF-α、IL-1β 及血淀粉酶的水平测定
治疗前后,分别采集两组患者的肘前静脉血5 ml,注入不抗凝的玻璃试管中,室温静置60分钟,将低温离心机温度调至4℃,预冷后离心15分钟,转速为3 000 r/min,取上清液,置于-80℃冰箱保存。待样本收集完毕后,利用酶联免疫吸附法(ELISA),通过酶标仪同批次测定各样本的吸光值;依据说明书绘制标准曲线,计算出两组患者血清HMGB1、TNF-α、IL-1β的表达水平以及血淀粉酶的水平。
1.5 疗效判定
治疗过程中观察两组患者腹痛腹胀的缓解时间、血淀粉酶恢复正常的时间。在持续治疗15天后,若患者的临床症状全部消失,即为痊愈;若患者的临床症状有很大改善,即为显效;若患者的临床症状有所好转,即为有效;若患者的临床症状未消失,即为无效。总有效率=(痊愈例数+显效例数+有效例数)/总例数×100%。
1.6 统计学分析
运用SPSS17.0统计学软件对数据进行分析,计量资料用(±s)描述,采用t检验,计数资料用百分率表示,P<0.05为差异具有统计学意义。
2 结果
2.1 治疗前后两组患者血清HMGB1、TNF-α、IL-1β表达水平的变化(见表1)
两组患者治疗后的血清HMGB1、TNF-α、IL-1β表达水平均显著低于治疗前(P<0.01);治疗后观察组血清HMGB1、TNF-α、IL-1β表达水平显著低于对照组(P<0.01);治疗前两组患者血清HMGB1、TNF-α、IL-1β表达水平比较,无显著性差异(P>0.05)。
表1 治疗前后两组患者血清 HMGB1、TNF-α、IL-1β 表达水平的变化(±s,ng/ml)

表1 治疗前后两组患者血清 HMGB1、TNF-α、IL-1β 表达水平的变化(±s,ng/ml)
组别 H M G B 1例数I L-1 β治疗前T N F-α治疗后 P 治疗前治疗后 P 治疗前治疗后 P对照组观察组P 6 0 6 0-1 9.0 8±5.7 7 1 9.1 1±5.7 2>0.0 5 7.3 6±2.4 8 3.8 7±0.6 1<0.0 1<0.0 1<0.0 1-6.3 4±2.0 8 6.3 8±2.1 0>0.0 5 3.5 6±0.7 8 1.2 1±0.3 2<0.0 1<0.0 1<0.0 1-0.5 7±0.1 4 0.5 8±0.1 3>0.0 5 0.3 2±0.1 0 0.1 4±0.0 8<0.0 1<0.0 1<0.0 1-
2.2 两组临床疗效比较
观察组的总有效率为90.00%,显著高于对照组的73.33%(P<0.01),见表 2。
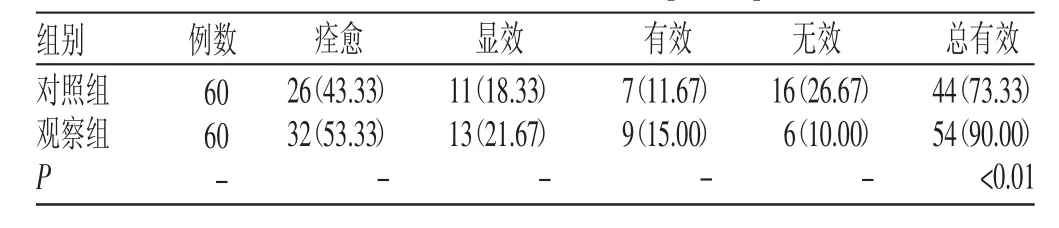
表2 两组临床疗效比较[n(%)]
2.3 两组患者症状缓解时间及血淀粉酶恢复正常时间比较
观察组的腹痛腹胀缓解时间、血淀粉酶恢复正常时间均明显短于对照组(P<0.01),见表 3。
表3 两组患者症状及指标恢复时间比较(±s,d)

表3 两组患者症状及指标恢复时间比较(±s,d)
组别对照组观察组P例数6 0 6 0-腹痛腹胀缓解时间3.8 6±0.9 4 3.2 5±0.8 2<0.0 1血淀粉酶恢复正常时间5.1 7±1.5 6 4.3 2±1.2 4<0.0 1
3 讨论
3.1 SAP与促炎细胞因子
SAP可由暴饮、暴食、酗酒等不良生活习惯引起,在短时间内胰腺外分泌异常增加,胰管内壁压力增大,使得胰泡破裂,胰液的大量外漏导致胰腺急性炎症,严重时可出现脏器损伤。SAP的发病机制十分复杂,细胞因子、炎性介质等多种因素参与其病理过程。细胞因子具有双重作用,可以增强机体的免疫能力,同时也可加重炎症反应。在SAP早期,机体产生大量炎性介质,引发炎症“瀑布效应”,继续连锁扩大反应,最终导致全身炎症性反应综合征(SIRS)[5]。促炎细胞因子 HMGB1、TNF-α、IL-1β是SAP产生炎症反应及其病情发展的重要调控介质。高迁移率族蛋白B1(HMGB1)是一种高度保守的核蛋白,在炎症因子如巨噬细胞、单核细胞、坏死细胞等的刺激下释放,参与调控机体炎症反应的发生、发展等[6]。HMGB1作为SAP晚期炎性介质,其分泌滞后、持续时间久,使得SAP患者血清HMGB1高表达[7];同时,HMGB1与急性胰腺炎的病程呈正相关(P<0.05)[8]。肿瘤坏死因子(TNF-α)是一种细胞毒性蛋白,能够激活多种促炎因子,如中性粒细胞、巨噬细胞等。TNF-α在胰腺组织中分泌早,与SAP病程及其预后呈正相关(P<0.05)[9],TNF-α可反映组织炎症、胰腺损伤程度[10]。白细胞介素-1(IL-1)是由活化的单核细胞产生的一种激素多肽,参与机体的免疫应答、炎症反应。白细胞介素-1β(IL-1β)是IL-1的一个亚型,可诱发细胞产生炎性介质、氧自由基、破坏性酶等,并激活中性粒细胞,加重SAP机体脏器功能的损伤[11]。IL-1β、TNF-α在SAP的发病、发展中均显著升高[12]。
3.2 乌司他丁、奥曲肽治疗SAP的作用机理
乌司他丁、奥曲肽为临床治疗SAP的常用药物,其治疗效果优于常规治疗。奥曲肽为生长抑素类似物,是一种生长抑素八肽,其半衰期长,可采取静脉注射、皮下注射的方式给药。奥曲肽能够缓解器官功能衰竭、坏死胰腺感染等,对SAP有很好的疗效;奥曲肽还可抑制胰腺病理性分泌,保护胰腺细胞膜,减轻SAP对胰腺组织的损伤[13];奥曲肽亦可减少SAP并发症的发生,降低致死率[14]。乌司他丁是一种糖蛋白,半衰期较短,为30~40分钟,需频繁静脉给药,进入血液后可参与调节炎性反应[15]。乌司他丁具有降低胰蛋白酶的活性、抑制炎性因子的释放、清除氧自由基等作用,可有效改善临床疗效[16];乌司他丁还可有效抑制炎症因子的释放,降低血清炎症因子水平,减少并发症[17]的发生。乌司他丁联合奥曲肽可明显提高治疗SAP的临床效果[18]。
本研究结果表明,治疗后两组患者血清HMGB1、TNF-α、IL-1β的水平均显著低于治疗前(P<0.01);治疗后观察组血清HMGB1、TNF-α、IL-1β 的水平显著低于对照组(P<0.01)。观察组的治疗总有效率为90.00%,显著高于对照组的73.33%(P<0.01)。观察组的腹痛腹胀缓解时间、血淀粉酶恢复正常时间均明显短于对照组(P<0.01)。以上结果与已有研究结果一致[19]。因此,在常规给药的基础上,采用乌司他丁联合奥曲肽治疗SAP,可明显缩短SAP患者血淀粉酶恢复正常的时间、腹痛腹胀缓解时间,能有效降低血清中促炎因子HMGB1、TNF-α、IL-1β的表达水平,二者联用的疗效明显优于单用奥曲肽的疗效,对临床治疗SAP可提供一定的理论依据。
[1]李科军,向正国,陈旭峰,等.早期大剂量乌司他丁联合奥曲肽治疗对重症急性胰腺炎患者炎症因子和T淋巴细胞的影响[J].海南医学院学报,2015,21(7):929-932.
[2]宋波.乌司他丁的药理作用和临床应用新进展[J].岭南急诊医学杂志,2016,21(3):314-315.
[3]张喜平.奥曲肽治疗急性胰腺炎研究概况[J].中国急救医学,2003,23(3):168-169.
[4]中华医学会外科学会胰腺外科学组.重症急性胰腺炎诊治草案[J].中华肝胆外科杂志,2002,8(2):257-258.
[5]Nieminen A,Maksimow M,Mentula P,et al.Circulating cytokines in predicting development of severe acute pancreatitis[J].Critical Care,2014,18(3):104.
[6]Harris HE,Andersson U,Pisetsky DS.HMGB1:a multifunctional alarmin driving autoimmune and inflammatory disease[J].Nature Reviews Rheumatology,2012,8(4):195-202.
[7]Yasuda T,Ueda T,Takeyama Y,et al.Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis[J].Pancreas,2006,33(4):359-363.
[8]Yasuda T,Ueda T,Takeyama Y,et al.Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis[J].Pancreas,2006,33(4):359-363.
[9]闫小梅,王希平,叶丽燕.TNF-α、IL-1β和IL-2在评估急性胰腺炎病情中的临床意义[J].中国医学工程,2012(2):94-95.
[10]Binker MG,Binker-Cosen AA,Richards D,et al.Chronic stress sensitizes rats to pancreatitis induced by cerulein:Role of TNF-α[J].World Journal of Gastroenterology,2010,16(44):5565-5581.
[11]杨智勇,王春友,陶京.早期血液滤过对重症急性胰腺炎家猪TNF-α及 IL-1β 水平的影响[J].中国普外基础与临床杂志,2004,11(5):433-434.
[12]Nishio A,Asada M,Uchida K,et al.The role of innate immunity in the pathogenesis of experimental autoimmune pancreatitis in mice[J].Pancreas,2011,40(2):95-102.
[13]潘登,孙跃女.乌司他丁联合血必净对重症急性胰腺炎患者血清白细胞介素8和干扰素γ的影响[J].中国综合临床,2015,31(5):443-445.
[14]汤耀卿,张臣烈,张圣道.奥典肽对重症急性胰腺炎的治疗价值[J].肝胆胰外科杂志,1996,8(3):99-100.
[15]邓国宝,刘志文.乌司他丁联合血必净注射液治疗外伤后多器官功能障碍综合征临床观察[J].中国实用内科学杂志,2012,23(6):357-358.
[16]宋斌.乌司他丁联合奥曲肽治疗重症急性胰腺炎的临床效果分析[J].中国医药指南,2017,15(1):121-122.
[17]张凌燕.乌司他丁的药理作用机制及对炎性因子的影响研究[J].中国医药指南,2016,14(8):29-30.
[18]马连顺.乌司他丁联合奥曲肽治疗重症急性胰腺炎疗效观察[J].医学信息:下旬刊,2010(10):94.
[19]江宗奇.乌司他丁与奥曲肽联合治疗急性重症胰腺炎的疗效观察[J].中国医院用药评价与分析,2016,16(1):26-28.
R195
B
1671-1246(2017)20-0148-03
