3种药用作物对烟草黑胫病菌的抑菌效果研究
2017-10-20何大敏陈阳杨水平张雪赵建莫静静张东艳赵新梅陈大霞丁伟
何大敏 陈阳 杨水平 张雪 赵建 莫静静 张东艳 赵新梅 陈大霞 丁伟


[摘要]煙草黑胫病是由疫霉菌侵染引起的最具危害的土传病害之一,为寻找该病的控制方法,该试验采用菌丝生长速率法,研究了玄参、川明参、半夏等作物茎叶根系提取物、根系分泌物以及提取物与分泌物组合对烟草黑胫病的抑菌效果,结果表明:①玄参、川明参、半夏的茎叶和根系提取物对烟草黑胫病菌有不同程度的抑制作用,且随提取物浓度增大而增强;其中,玄参抑菌活性最强,05 g·mL-1时茎叶、根系提取物抑菌率分别达7488%,6927%;川明参与半夏抑制效果相对较差;川明参茎叶和根系提取物组合后,有明显增益效应。②玄参、川明参、半夏根系分泌物对烟草黑胫病菌均表现出一定的抑菌性,随浓度增大而增强;抑菌强度为川明参>玄参>半夏。③提取物与根系分泌物组合的抑菌性,玄参、川明参相近而强于半夏,均介于各自提取物与根系分泌物之间。玄参、川明参具有防控烟草黑胫病的应用潜力。
[关键词]烟草黑胫病菌; 玄参; 川明参; 提取物; 根系分泌物; 抑菌性
Antifungal effects of three medicinal crops on Phytophthora nicotianae
HE Damin1,2, CHEN Yang1, YANG Shuiping1*, ZHANG Xue3,4*, ZHAO Jian2, MO Jingjing2,
ZHANG Dongyan1, ZHAO Xinmei1, CHEN Daxia4, DING Wei1
(1. College of Resources and Environment, Southwest University, Chongqing 400715, China;
2. Zunyi Subsidiary of Guizhou Tobacco Company, Zunyi 563000, China;
3. Chongqing Medical and Pharmaceutical College, Chongqing 401331, China;
4. Chongqing Academy of Chinese Material Medica, Chongqing 400065, China)
[Abstract]Tobacco black shank is one of the most harmful soilborne diseases infected by Phytophthora parasitica In order to probe the control method to this disease, in this study, the mycelial growth rate method was employed to investigate the antifungal effects of extracts from stemleaf and root, root exudates, and their combination of Scrophularia ningpoensis, Chuanmingshen violaceum and Pinellia ternata The results showed that: ①Stemleaf and root extracts of S ningpoensis, C violaceum and P ternata exhibited different antifungal activities, and the inhibition increased with the increase of extract concentration The antifungal effect of S ningpoensis extracts at 05 g·mL-1 was the strongest than other medicinal plants, the inhibition rate of steamleaf and root extracts reached 7488%, 6927%, respectively The inhibitory effect of C violaceum and P ternata was relatively lower, however, there is a significant gain effect after combination of steamleaf and root extracts of C violaceum ②The root exudates of S ningpoensis, C violaceum and P ternata showed fungistasis to Phytophthora nicotianae, and fungistasis was enhanced with the increase of root exudate concentration The antifungal effect in the order of C violaceum > S ningpoensis > P ternata ③The antifungal activity of combination of extract and root exudate from S ningpoensis was similar with the effect of C violaceum, they were both stronger than P ternata, and the antifungal activity for three combination were located between the antifungal activity of their extracts and root exudates S ningpoensis and C violaceum can be potentially applied to prevent and control the tobacco black shankendprint
[Key words]Phytophthora nicotianae; Scrophularia ningpoensis; Chuanmingshen violaceum; extract; root exudate; antifungal
药用作物和烟草Nicotiana tabacum L都是我国重要的经济作物,但是由于耕地的有限性及行业分割,连作在我国十分普遍[1]。大部分药用作物[2]和烟草具有严重的连作障碍,连作使土壤中的病原微生物大量繁殖,致使某些土传病害的发生危害程度增加[34],降低产量和品质[1,56]。轮(间/套)作可以有效缓解连作障碍[2,79]。
烟草黑胫病是由疫霉菌Phytophthora parasitica侵染引起的真菌性病害,疫霉菌危害茄科作物如茄、椒、番茄尤其烟草[10],是世界上种植业最具毁灭性土传病害之一[11],在我国各烟区都有发生和蔓延[12],连作加重该病的发生、流行及危害[4,13]。目前对烟草黑胫病菌P nicotianae的防治以化学防治为主[3,14],但长期使用化学品,容易使病菌产生抗药性,同时造成烟地污染,影响烟叶安全,也有报道用拮抗菌[1516]、轮作[1718]、植物提取物[1011,19]来防治的。筛选抗菌活性植物,利用其提取物加工制成植物源杀菌剂,或利用其与宿主作物轮(间/套)作而减轻病害,因对环境友好正广泛受关注和重视[2025]。研究表明,大蒜Allium sativum含有大量含硫化合物,具有广谱的抑菌活性,其提取物对烟草黑胫病菌和青枯病等具有明显抑菌效果,有希望用作防治烟草黑胫病等植物保护剂的原料[2526];大蒜根系分泌物也能抑制烟草黑胫病菌菌丝的生长,可利用其与烟草轮作降低烟草黑胫病在田间传播[17]。
自然界的植物资源中许多都具有抑菌性,其中,药用作物更具有开发潜力[2324]。药用作物玄参Scrophularia ningpoensis、川明参Chuanmingshen violaceum、半夏Pinellia ternata生境与烟草相近,在西南山地烟区广泛种植,它们的茎叶及根系都具有抗菌、抗炎的作用成分[2122,2728],但均只收获块根作药材,而茎叶等非药用部位大部分生物量枯落田间,产生不同程度的自毒连作障碍[7,19,29]。将玄参、川明参、半夏与烟草进行轮(间/套)作,形成特定的种植模式,不仅可以避免各自的连作障碍,其抑菌成分或许还可用于控制烟地土传病害。川明参轮作能显著改善烟地土壤微生物种群结构,降低烟草青枯病菌Ralstonia solanacearum等致病微生物数量[18]。但有关玄参、川明参、半夏对烟草黑胫病菌的抑菌性尤其药用作物根系分泌物抑菌性以及其轮(间/套)作控病利用均尚未见报道。本试验模拟田间条件下,研究玄参、川明参、半夏的不同部位提取物、根系分泌物及其组合,对烟草黑胫病菌的抑菌效应,为烟草黑胫病菌控制和药烟轮(间/套)作栽培以及药用作物资源充分利用提供借鉴。
1材料
供试菌株:烟草疫霉菌P parasitica var nicotianae,分离自遵义烟草黑胫病患病烟株,由西南大学资源环境学院微生物实验室提供。
供试植株:玄参、半夏、烤烟种子采自贵州道真县,川明参种子采自四川阆中市,将上述作物种子播于本单位实验苗圃,备用。
2方法
21培养基
燕麦培养基(OA),称取30 g燕麦置于1 000 mL蒸馏水中,煮沸20 min,过滤,加入20 g琼脂粉,融化后用蒸馏水补足至1 000 mL,分装灭菌(121 ℃,30 min),备用。
22提取物制备
取苗圃中4—6月龄供试植物苗,分成地上茎叶、地下根系两部分,除半夏鳞茎采用鲜样外,其余40 ℃恒温干燥箱中鼓风吹干至发脆,粉碎,过1 mm筛。各称取粉碎后的7个植物样品(玄参茎叶、玄参根系、川明参茎叶、川明参根系、半夏茎叶、烤烟茎叶、烤烟根系)50 g,每个样品称取3份,放入棕色广口瓶中,加入1 000 mL的蒸馏水作为提取剂,搅拌使植物材料完全浸没,置于常温的条件下采用超声波提取05 h,然后将广口瓶置于避光处静置24 h,再进行减压抽滤,残渣用同样方法重复处理3次。合并滤液,用旋转蒸发仪在40 ℃条件下减压浓缩至最小体积,于50 mL量瓶中定容,即得到1 g·mL-1提取物的原液(即每毫升原液含有1 g样品对应的提取物),密封,放入4 ℃冰箱中保存备用。
半夏鳞茎样品则采用50 g干样等量的鲜样,研磨,过滤,超声提取,其余步骤均相同。
23根系分泌物
取苗圃中2月龄供试植物健康均一幼苗,用蒸馏水将根系洗净,用01%的HgCl2灭菌10 min后,移栽到250 mL的航空杯中,以泡沫板固定,加入Hoagland营养液,至淹没幼苗根部,每杯3株,每种植物4个重复,每3 d更换营养液。3周后,取出幼苗,用蒸馏水冲洗根部,移栽到另一航空杯中,加蒸馏水至淹没根部。杯口用塑料薄膜遮挡,防止外来菌污染,同时也减少蒸发量。每2 d收集1次含有根系分泌物的蒸馏水,共收集3次,收集结束后称量植物鲜根重。合并收集的根系分泌物溶液,过滤,在35 ℃下旋转蒸发减压浓缩至最小体积,根据鲜根重,用蒸馏水定容成1 g·mL-1的原液(即每毫升原液含有1 g鲜根对应的根系分泌物)。
24浓度设置
将上述22项中的茎叶、根系提取物原液分别稀释至005,01,025,05 g·mL-1,将23中的根系分泌物原液分别稀释至01,02,04,06 g·mL-1。莖叶、根系提取物组合用025 g·mL-1质量浓度按体积比1∶1配制,2种提取物与根系分泌物组合用025 g·mL-1的提取物组合液和04 g·mL-1的根系分泌物按体积1∶1配制。endprint
25抑菌性测定
采用菌丝生长速率法[30]。将OA培养基倒入直径9 cm的培养皿,冷却凝固后,在无菌操作下取2 mL提取物、根系分泌物稀释液滴加至培养基表面,涂匀,以加2 mL灭菌水作为CK,每个处理重复3次。待稀释液浸入培养基表面后,在平板中央接入直径05 cm的黑胫病菌饼(用直径05 cm打孔器在培养的黑胫病菌菌落边缘同一圆周上打孔而得),每个皿1个菌饼,密封,随机摆放于恒温培养箱中,25 ℃暗黑培养6 d,期间每隔24 h用十字交叉法测定菌落直径。记录并计算生长抑制率:生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
26数据统计分析
试验数据用Microsoft Excel和DPS进行统计分析。
3结果与分析
31几种作物提取物对烟草黑胫病菌的抑菌效应
311提取物抑菌时间效应玄参、川明参、半夏及烟草的提取物在浓度01 g·mL-1时对烟草黑胫病菌的抑制效应见图1。玄参、川明参、半夏3种作物地上、地下部分提取物都有明显的程度不同的抑菌效应,随培养时间增加而下降,降幅不一,至第4~6天趋于稳定。不同作物存在较大差异,同种作物不同部位也存在一定差异。玄参在6 d期间内抑制率最高,茎叶略高于根系,玄参茎叶在第1天抑制率为5521%,最高,第6天为4141%,降幅249%。其次为川明参,茎叶高于根系,随时间缓慢降低,最后趋于稳定。半夏鳞茎初期有较高抑菌效果,抑菌率介于玄参根系与川明参茎叶之间,但迅速下降,降幅861%,至第4天有所回升并趋于稳定;半夏茎叶初期抑菌效果不明显,后期有所上升。
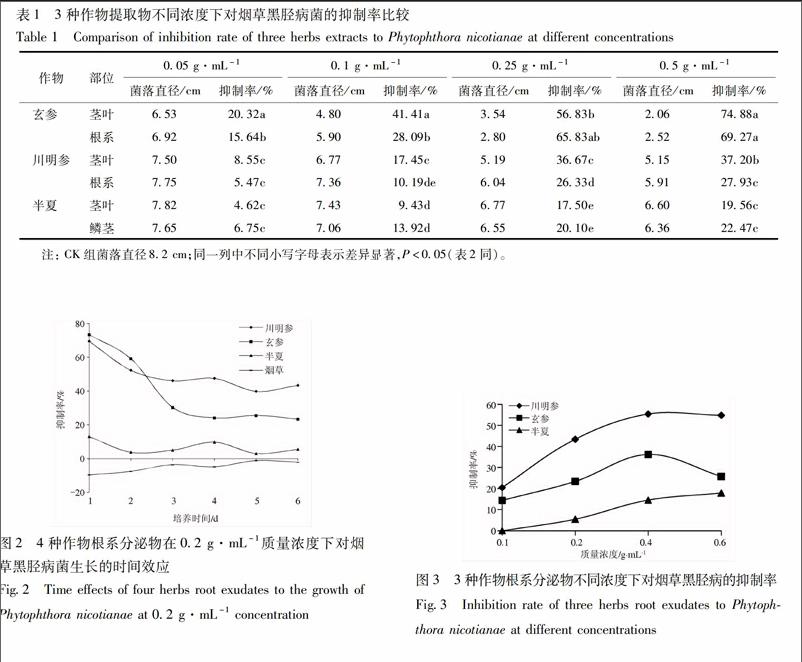
312提取物抑菌浓度效应玄参、川明参、半夏3种作物不同浓度提取物在培养6 d后的抑菌结果见表1,在试验浓度范围内(005 ~05 g·mL-1),各作物提取物对黑胫病菌的抑制率,随浓度增大而上升并逐渐趋于稳定。不同作物间存在较大差异,总体抑菌强度为玄参>川明参>半夏;在05 g·mL-1下,玄参茎叶、根系提取物的抑制率分别达7488%,6927%。各作物不同部位间差异相对较小,总体而言,玄参茎叶略高于根系且低浓度下显著,川明参高浓度下茎叶显著高于根系,半夏鳞茎略高于茎叶但都很低。
32几种作物根系分泌物对烟草黑胫病菌的抑菌效应
321根系分泌物抑菌时间效应玄参、川明参、半夏及烟草4种作物根系分泌物对烟草黑胫病菌的抑制率随时间变化情况见图2。玄参、川明参的根系分泌物有比较高的抑制效果,尤其在初期,但随时间增加抑制率下降,第3天开始趋于平缓;在前期,玄参抑菌效果强于川明参,后期川明参强于玄参。半夏分泌物也表现出一定抑制效果,但远低于玄参、川明参。烟草则相反,其根系分泌物表现出一定的促进效应,尤其在初期。
322根系分泌物抑菌浓度效应川明参、玄参、半夏3种作物根系分泌物对烟草黑胫病菌抑制的浓度效应见图3,在试验质量浓度范围内(01~06 g·mL-1),抑制作用随着浓度增大而增强。作物抑制作用强弱依次为川明参、玄参、半夏,川明参在04~06 g·mL-1时趋于稳定,而玄参在04 g·mL-1时达到最高,而后下降。
33提取物与分泌物组合的抑菌效应
331作物不同部位物提取物组合效应在025 g·mL-1质量浓度下,茎叶与根系提取物的组合对烟草黑胫病菌抑制效果见表2,玄参、川明参抑制率远高于半夏,三者相差显著。比较各作物组合部位发现,玄参、半夏的组合效果都介于其茎叶和根系之间,而川明参(5237%)远高于其茎叶(3667%)、根系(2633%)单剂抑菌率,具有明显的组合增益效应。
332提取物与根系分泌物组合效应提取物与根系分泌物组合效果,玄参、川明参差异不显著,但二者显著高于半夏,见表2。相较于提取物和根系分泌物,各作物组合抑制率介于各自提取物(含茎叶、根系及组合)和分泌物之间。
4讨论
利用植物的抗菌活性部分或提取其有效成分,以及分离纯化的单体物质加工而成的用于防治植物病害的植物源杀菌剂,被认为是化学合成杀菌剂最好的替代品,与化学合成杀菌剂相比,其来源于自然,對环境友好[23]。本研究中,玄参、川明参、半夏的茎叶和根系提取物对烟草黑胫病菌都有程度不同的抑制作用,玄参抑菌活性最强,在05 g·mL-1时茎叶和根系分别达7488%,6927%,具有开发杀黑胫病菌菌剂的潜力;川明参和半夏抑菌活性相对较低,开发潜力不大,但川明参茎叶和根系组合的抑菌率能达到5237%,远较茎叶和根系单剂高,组合增益效应显著。提取剂影响植物提取物抑菌性的效果,研究表明,五倍子Galla chinensis、金银花Lonicera japonica Thunb、大青叶Isatis indigotica、穿心莲Andrographis paniculata、蒲公英Taraxacum mongolicum等乙醇提取物对枯草芽孢杆菌Bacillus subtilis和大肠杆菌Escherichia coli的抑菌性要强于水提物[31],大蒜乙醇提取物对烟草黑胫病菌的抑制作用优于大蒜水提物[25],这提示,若采用乙醇等更有效的提取剂,3种药用植物抑菌活性或许更强。但它们起作用的活性成分,有待进一步研究。
利用提取物中抗菌活性成分的另一种方式是将抗菌植物与宿主作物(烟草)进行轮(间/套)作。相比开发植物源杀菌剂,轮(间/套)作更简便、直接、有效,成本更低,更能使抗菌植物资源得以充分利用。轮(间/套)作下,药用作物株体中抑菌活性成分通过雨雾淋溶直接进入土壤,而不需要提取、加工等制药环节。同时,轮(间/套)作下,本研究中3种药用作物仅块根或鳞茎收获带走,株体的大部分非药用部分(尤其玄参、川明参每亩以吨计的茎叶和根系)被留下,即使活性成分含量低不易加工提取,在生长过程中叶枯落田间时或茎叶还田后,都可经淋溶持续进入土壤而发挥抑菌效力,作用时间长,数量上远多于一般田间农药施用量而作用强度大。轮(间/套)作还增加田间土壤有机物的多样性和数量,调节和改善土壤微生物种群结构,增加微生物多样性,间接控制病原微生物[1719]。从这个意义看,3种作物轮(间/套)作配置控制烟草黑胫病的利用潜力,远优于开发植物源杀菌剂。endprint
根系分泌物为轮(间/套)作控制或减轻病害提供了另一物质来源。植物生长过程中通过根系向周围土壤环境分泌释放大量各种有机物质,其数量通常情况下可达到植物光合固定碳的20%左右,部分植物如禾谷类植物可可高达40%以上[32]。根系分泌物在土壤中发挥着复杂而独特的化学、生物、生态作用:分泌物中的化感物质会影响植物自身(自感)和其他植物(他感)的生长发育,而其中有机酸通过活化土壤养分而加强作物营养吸收,根系分泌物为土壤微生物增添有机碳源而影响微生物生长,通过促进或拮抗而深刻塑造土壤微生物种群结构[18,3337]。作物特异性根系分泌物具有其特异的生理活性,其种类和数量受自身遗传所主导[37]。小麦Triticum aestivum根系分泌物能抑制小麦全蚀病菌Gaeumannomyces gramini的菌丝发育[34],大蒜根系分泌物能抑制黄瓜枯萎病菌Fusarium oxysporum f sp cucumerinum和西瓜枯萎病菌F oxysporium f niveum的菌丝生长及孢子萌发[35],川明参根系分泌物能抑制烟草青枯病[18]。本研究中,玄参、川明参、半夏的根系分泌物对烟草黑胫病菌都有一定的抑制作用,其中,与提取物有所不同的是川明参抑菌性明显强于玄参和半夏。同提取物一样,川明参、玄参、半夏根系分泌物对烟草黑胫病菌的抑制作用也随浓度增大而增强,在质量浓度01 g·mL-1时就表现出比较强的抑菌性,当质量浓度04 g·mL-1时抑制率接近高点,抑菌率增加了3倍。综合考虑抑菌浓度和通常情况下作物根系分泌物的数量,可以推知,川明参、玄参、半夏与烟草轮(间/套)作利用它们的根系分泌物来控制烟草黑胫病是可行的,尤其是生物产量大的玄参和川明参。
提取物和根系分泌物的组合,可以模拟田间自然轮(间/套)作条件下,提取物和根系分泌物同时存在时的抑菌效果。玄参、川明参、半夏3种药用作物的组合,对烟草黑胫病菌都有明显的抑制效果,抑菌率分别为4502%,4752%,1933%,玄参与川明参相近而强于半夏。但3种作物的组合抑菌率介于其提取物与根系分泌物之间,并无明显增益效应出现,可能因为提取物、分泌物中抑菌活性成分并不相同,组合之后各成分因溶液体积相对增加而浓度被稀释一倍,也可能各抑菌成分相互影响导致抑菌性发生了不同程度的改变[38],实际情况尚待进一步研究。
5结论
玄参、川明参对烟草黑胫病菌都有较强的抑菌性,半夏抑菌性不佳。其中,玄参的茎叶、根系提取物及其组合的抑菌性要优于川明参和半夏,且茎叶强于根系;川明参根系分泌物的抑菌性要优于玄参和半夏;川明参茎叶、根系提取物组合效果要远高于单剂效果。玄参、川明参提取物有开发植物源杀菌剂的潜力;从提取物和根系分泌物两方面利用看,它们与烟草轮(间/套)作配置防控烟草黑胫病的应用前景会更好。但作物株体中对烟草黑胫病菌起作用的具体有效成分,以及轮(间/套)作配置的田间实际效果等需进一步研究。
[参考文献]
[1]石秋环,焦枫,耿伟,等. 烤烟连作土壤环境中的障碍因子研究综述[J]. 中国烟草学报,2009,15(6):81.
[2]张重义,林文雄. 药用植物的化感自毒作用与连作障碍[J]. 中国生态农业学报,2009,17(1):189.
[3]王志愿,姜清治,霍沁建. 烟草黑胫病的研究进展[J]. 中国农学通报,2010,26(21):250.
[4]刘晔,姜瑛,王国文,等. 不同连作年限对植烟土壤理化性状及微生物区系的影响[J]. 中国农学通报,2016,32(13):136.
[5]张仕祥,过伟民,李辉信,等. 烟草连作障碍研究进展[J]. 土壤,2015(5):823.
[6]李振方,杨燕秋,谢冬凤,等. 连作条件下地黄药用品质及土壤微生态特性分析[J]. 中国生态农业学报,2012,20(2):217.
[7]马小奇. 半夏的连作障碍效应研究及其缓解措施初探[D]. 杨凌:西北农林科技大学,2016.
[8]晋艳,杨宇虹,段玉琪,等. 烤煙轮作、连作对烟叶产量质量的影响[J]. 西南农业学报,2004,17(S1):267.
[9]陈丹梅,段玉琪,杨宇虹,等. 轮作模式对植烟土壤酶活性及真菌群落的影响[J]. 生态学报,2016,36(8):2373.
[10]Kroumova A B,Artiouchine I, Wagner G J. Use of several natural products from selected Nicotiana species to prevent black shank disease in tobacco[J]. Beitr Tabakforsch Int, 2016, 27(3):113.
[11]Bowers J H, Locke J C. Effect of formulated plant extracts and oils on population density of Phytophthora nicotianae in soil and control of Phytophthora blight in the greenhouse [J]. Plant Dis, 2004, 88(1):11.
[12]陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997,18(4):1.
[13]黄成江,李天福,卢向阳,等. 抗黑胫病烤烟品种资源筛选的研究初报[J]. 云南农业大学学报:自然科学版,2008,23(4):565.
[14]Han T, You C, Zhang L, et al. Biocontrol potential of antagonist Bacillus subtilis Tpb55 against tobacco black shank [J]. Bio Control, 2016, 61(2):1.endprint
[15]冯志珍,陈太春,段军娜,等. 烟草黑胫病拮抗根际芽胞杆菌FB16的筛选鉴定及其抑菌活性[J]. 植物保护学报,2012,39(3):224.
[16]Huang Y, Ma L, Fang D H, et al. Isolation and characterisation of rhizosphere bacteria active against Meloidogyne incognita, Phytophthora nicotianae and the root knotblack shank complex in tobacco[J]. Pest Manag Sci, 2015,71(3):415.
[17]钏有聪,张立猛,焦永鸽,等. 大蒜与烤烟轮作对烟草黑胫病的防治效果及作用机理初探[J]. 中国烟草学报,2016,22(5):55.
[18]张东艳,赵建,杨水平,等. 川明参轮作对烟地土壤微生物群落结构的影响[J]. 中国中药杂志,2016,41(24):4556.
[19]赵新梅,王军,莫静静,等. 三种作物茎叶枯落物水浸液对烟草幼苗生长的化感效应[J]. 草业学报,2016,25(9):37.
[20]Bhutia D D, Zhimo Y, Kole R, et al. Antifungal activity of plant extracts against colletotrichum musae, the post harvest anthracnose pathogen of Banana cv. martaman[J]. Nat Food Sci, 2015,46(1):2.
[21]Feng H, Fan J, Qiu H, et al. Chuanminshen violaceum polysaccharides improve the immune responses of footandmouth disease vaccine in mice[J]. Int J Biol Macromol, 2015, 78:405.
[22]Song X, Yin Z, Li L, et al. Antiviral activity of sulfated Chuanminshen violaceum polysaccharide against duck enteritis virus in vitro[J]. Antivir Res, 2013, 98(2):344.
[23]袁高庆,黎起秦,王静,等. 植物源杀菌剂研究进展Ⅰ:抑菌植物资源[J]. 南方农业学报,2010,41(1):30.
[24]喻大昭,杨小军,杨立军,等. 49种植物源粗提物对黄瓜灰霉菌的生物活性筛选[J]. 植物保护学报,2004,31(2):217.
[25]赖荣泉,姜林灿,陈志敏,等. 大蒜粗提物对烟草黑胫病菌的室内抑制作用[J]. 烟草科技,2009(9):62.
[26]张汉千,赖荣泉,陈志敏,等. 大蒜粗提物对烟草青枯病菌的室内抑制作用测定[J]. 烟草科技,2009(3):62.
[27]胡瑛瑛,黄真. 玄参的化学成分及药理作用研究进展[J]. 浙江中医药大学学报,2008,32(2):268.
[28]Li J, Huang X, Du X, et al. Study of chemical composition and antimicrobial activity of leaves and roots of Scrophularia ningpoensis[J]. Nat Prod Res, 2009,23(8):775.
[29]曾庆秋. 川明参连作障碍机理和防治的初步研究[D]. 成都:成都中医药大学,2007.
[30]袁善奎,周利娟,黄继光,等. 华蟹甲草对几种植物病原真菌的离体抗菌活性研究[J]. 天然产物研究与开发,2008(4):609.
[31]李军红,田胜尼,方晓光,等. 5种常见中草药的抑菌性研究[J]. 生物技术通报,2006(S1):395.
[32]Lynch J M, Whipps J M. Substrate flow in the rhizosphere[J]. Plant Soil, 1990, 129(1):1.
[33]罗永清,赵学勇,李美霞. 植物根系分泌物生态效应及其影响因素研究综述[J]. 应用生态学报,2012,23(12):3496.
[34]Smiley R W. Relationship between takeall of wheat and rhizosphere pH in soils fertilized with ammonium vs. nitratenitrogen [J]. Phytopathology, 1973, 63(7):882.
[35]周艳丽,王艳,李金英,等. 大蒜根系分泌物的化感作用[J]. 应用生态学报,2011,22(5):1368.
[36]Doornbos R F. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere. A review [J]. Agron Sustain Dev, 2012, 32(1):1.
[37]Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms [J]. Annu Rev Plant Biol, 2006, 57(1):233.
[38]曾令達,彭惠莲,宋冠华,等. 5种植物乙醇提取物及其复配物对荔枝霜疫霉菌的抑菌活性[J]. 南方农业学报,2016,47(8):1332.
[责任编辑吕冬梅]endprint
