硫代黄素T与溶菌酶淀粉样纤维结合的荧光停流动力学
2017-10-19马刚秦哲刘思阳商艳丽贾宝环
马刚,秦哲,刘思阳,商艳丽,贾宝环
(河北大学 化学与环境科学学院,药物化学与分子诊断教育部重点实验室,河北 保定 071002)
硫代黄素T与溶菌酶淀粉样纤维结合的荧光停流动力学
马刚,秦哲,刘思阳,商艳丽,贾宝环
(河北大学 化学与环境科学学院,药物化学与分子诊断教育部重点实验室,河北 保定 071002)
蛋白淀粉样纤维与多种疾病有关,如阿尔茨海默病、帕金森病、Ⅱ型糖尿病等.荧光染料硫代黄素T(ThT)广泛地应用于淀粉样纤维的定性和定量测定.但从目前的研究来看,ThT与淀粉样纤维结合的动力学机理研究尚非常少见.本研究应用荧光停流动力学技术对盐酸胍诱导的溶菌酶淀粉样纤维和ThT的结合动力学进行了研究,提出ThT与溶菌酶淀粉样纤维结合的动力学符合双位点平行反应机理模型.本研究对深入理解荧光染料分子与蛋白淀粉样纤维的作用有借鉴意义.
硫代黄素T;溶菌酶;淀粉样纤维;动力学
蛋白纤维化是一种独特的蛋白聚集行为.在纤维化过程中,单体蛋白通过自组装过程形成纤维状的蛋白聚集体[1-2],这种蛋白聚集体又被称为淀粉样纤维.研究表明,许多威胁人类健康的疾病都和某种特定蛋白在组织和细胞中的纤维化沉积有关.这些疾病包括熟知的阿尔兹海默病、帕金森病、Ⅱ型糖尿病等多种退形性疾病.这类疾病可以被统一归为淀粉样蛋白沉积疾病[3].蛋白淀粉样纤维与这些重大疾病的密切关联使相关研究近年来在国内外方兴未艾[2,4-9].蛋白淀粉样纤维的定性定量检测无疑是蛋白纤维化研究中的一个重要内容.其中,基于硫代黄素T(thioflavin T,简称ThT)荧光染料的荧光光谱技术广泛地应用于淀粉样纤维的定性和定量测定[10-11].ThT属于芳香族化合物,如图1所示,中间的C—C键连接了苯并噻唑和苯胺环,2个芳香环可以以C—C键为轴自由转动.当ThT被激发后由于该自由转动的存在而导致荧光淬灭.但当ThT与蛋白淀粉样纤维结合后,芳香环的转动受到了抑制,则会发出荧光.一般实验中,人们使用450 nm左右的光对ThT进行激发,如果ThT结合了蛋白淀粉样纤维,便会在480 nm左右发射很强的荧光;如果体系中不存在蛋白淀粉样纤维,ThT在480 nm处几乎不发荧光[11].一般而言,该荧光的强度和体系中蛋白淀粉样纤维的量成正比,因此,ThT荧光检测法常用于淀粉样纤维的定量分析,比如用于测量淀粉样纤维的S-型生成动力学曲线.
ThT在蛋白纤维化研究中的重要作用,使人们对其多种物理化学性质产生了极大兴趣.目前有许多研究报道致力于深刻理解ThT的光物理性质以及ThT和蛋白淀粉样纤维的作用位点和作用模式[12-13].相比这些研究,有关ThT和蛋白淀粉样纤维结合的动力学过程,文献中报道非常少见[14-15].在非常早期的荧光动力学研究中,LeVine[14]研究了ThT与Aβ1-40多肽形成的纤维的结合动力学,其倾向于认为ThT和纤维的结合过程是一个多步连续反应过程,包括1个类似双分子反应的结合过程和3个连续的复合物构型顺变过程.而近期的荧光动力学研究中,Sabate等[15]研究了ThT与HET-s多肽形成的纤维的结合动力学,他们倾向于认为ThT和纤维的结合就是一个简单的类似双分子一步结合的过程.这主要是因为淀粉样纤维的结合位点是一种不易发生构象变化的刚性β-折叠结构,而早期LeVine的假说中提出的淀粉样纤维结合ThT后会发生构象变化的情况与这一理论预期不符.笔者新近利用紫外吸收停流动力学技术的研究也支持Sabate的论点[16],即ThT与淀粉样纤维的结合动力学是一个多位点平行反应,每个位点上的结合过程都是简单的双分子一步反应.
为更加深入地理解ThT结合蛋白淀粉样纤维的动力学过程,本文将以鸡卵清溶菌酶形成的蛋白淀粉样纤维为模型体系,应用基于ThT荧光检测的停流动力学技术,研究ThT和纤维结合的动力学过程并提出和动力学实验结果相匹配的机理模型.

图1 ThT的分子结构Fig.1 Molecular structure of ThT
1 材料与方法
1.1 实验试剂
鸡卵清溶菌酶蛋白(以下简称溶菌酶)、刚果红(>85%)、盐酸胍(>99%)由美国Sigma-Aldrich公司购得.ThT(超纯级)由美国AnaSpec公式购得.磷酸氢二钾(>99%)、磷酸二氢钾(>99%)由阿拉丁购得.超纯水(电阻率18.2 MΩ·cm)由美国密理博公司的Millipore超纯水机制得.
1.2 溶菌酶淀粉样纤维的制备及预处理方法
溶菌酶纤维的制备条件参照文献[17].配制2 mg/mL溶菌酶、3 mol/L盐酸胍、20 mmol/L 磷酸盐缓冲溶液 (pH=6.3),经0.22 μm滤膜过滤.放入恒温混匀仪中孵育4 h,孵育温度为50 ℃,频率为900 r/min.经孵育后,上述溶液由澄清变为浑浊.用原子力显微镜、ThT荧光分析法、刚果红染色法、红外光谱对制备的纤维进行表征和确认.
在进行动力学研究前,需要对溶菌酶淀粉样纤维进行预处理.预处理的目的是获得分散良好的稳定胶体体系,从而提高动力学数据的稳定性.预处理过程中,先进行离心处理,以去除盐酸胍以及缓冲溶液对后续实验的影响.离心机转速为10 000 r/min,每次离心10 min,共离心3次.每次离心后弃去上清液,然后加入超纯水混匀再重悬.经3次离心处理后,将获得的蛋白淀粉样纤维在冰浴环境下进行超声,功率为130 W,超声时间1 s,间隔时间5 s,总时间5 min.经过预处理,溶菌酶纤维悬浊液变为稳定的在纯水中的胶体溶液.所获得的溶液可以进一步用纯水稀释以获得动力学实验所需浓度.
1.3 溶菌酶纤维的ThT荧光分析
采用日立F-7000荧光分光光度计对溶菌酶淀粉样纤维进行ThT荧光检测.激发波长450 nm,狭缝宽度5 nm;发射波长460~600 nm,狭缝宽度10 nm.检测器光电倍增管的电压为500 V.取新制备的2 mg/mL溶菌酶纤维10 μL加入到1 mL 10 μmol/L ThT的磷酸盐溶液中,混匀后用1 cm石英池进行荧光测量.单纯的10 μmol/L ThT磷酸盐溶液的荧光光谱做空白对照.
1.4 溶菌酶纤维的刚果红染色分析
刚果红染色分析实验在德国Implen紫外可见超微量分光光度计上进行.刚果红浓度为5 μmol/L,缓冲体系为10 mmol/L磷酸盐溶液,pH =7.4并含有体积分数0.5% 的乙醇.染色分析时,取新制备的2 mg/mL的溶菌酶纤维30 μL加入到1 mL刚果红溶液中,充分作用后测量紫外可见光谱.单纯的刚果红溶液做空白对照.
1.5 溶菌酶纤维的红外光谱分析
对溶菌酶纤维的固态样品进行红外测试.固态样品制备方式如下:将前述经离心水洗去除盐酸胍后的样品冷冻干燥,然后进行红外测试.红外光谱测试采用德国Bruker公司Vertex 70傅里叶变换红外光谱仪.光谱采集使用衰减全反射(ATR)模式.数据采集的分辨率为 4 cm-1,扫描次数32次.
1.6 溶菌酶纤维的原子力显微镜形貌表征
原子力图像通过俄罗斯的NT-MDT Solver P47 扫描探针显微镜,采用轻敲模式测得.测量时,将预处理前的溶菌酶纤维溶液用高纯水稀释2倍,然后滴在新鲜剥离的云母表面.静置5 min后,用去离子水冲洗云母表面,自然风干后测样.
1.7 动力学实验方法
动力学实验采用SFM-300停流动力学装置进行实验.实验时,1个样品室加入0.4 mmol/L ThT,另外2个样品室储存加入9.6 μmol/L预处理过的溶菌酶纤维.进行停流动力学实验时,3个样品室中的样品按ThT:淀粉样纤维:淀粉样纤维=1∶2∶2的体积比,同时打入到停流反应池内.混合后,ThT的浓度为80 μmol/L,溶菌酶纤维浓度为7.7 μmol/L.基于以往研究,盐酸胍诱导的溶菌酶纤维的位点数目基本上每3个溶菌酶单体构成一个结合位点[18],这样80 μmol/L 的ThT和7.7 μmol/L的溶菌酶纤维的浓度组合可以保证ThT的量相对于溶菌酶纤维上的位点而言是大大过量的,保证纤维上的所有结合位点均被结合.荧光激发波长为435 nm,PMT上加装450 nm的滤光片.数据采集间隔:0~2 s内每50 ms监测1次,2~10 s内每100 ms监测1次.
2 结果与讨论
2.1 溶菌酶淀粉样纤维的表征
首先对预处理前盐酸胍诱导的溶菌酶纤维采用原子力显微镜进行形貌表征,如图2所示,纤维高度大约为20 nm.这里需要指出的是,盐酸胍诱导法制备的淀粉样纤维的形貌与笔者之前研究的淀粉样纤维的形貌有较大的不同[19],这主要是由于纤维化具体条件的差异.之前笔者的研究中采用酸性和加热的条件,使溶菌酶先进行水解,生成一系列较小分子量的多肽,这些多肽再进一步进行纤维化,这样获得的纤维较为光滑和细长.但缺点是成分复杂,不适合进行定量动力学分析.在本研究中,使用盐酸胍诱导法获得的溶菌酶蛋白由纯的溶菌酶单体构成,成分单一,适合动力学研究,而且其结合位点大致数目在从前文献中也有报道.
对上述盐酸胍诱导法获得的溶菌酶纤维,笔者进行了ThT荧光表征、刚果红染色分析和红外光谱表征.ThT与溶菌酶纤维结合的荧光光谱如图3所示.通过和单纯ThT溶液在相同条件下测得的荧光光谱对比.发现当ThT与溶菌酶纤维结合后,当激发波长为450 nm时,荧光发射光谱在480 nm附近会产生明显的荧光增强,而单纯ThT溶液在这个区域基本无荧光.
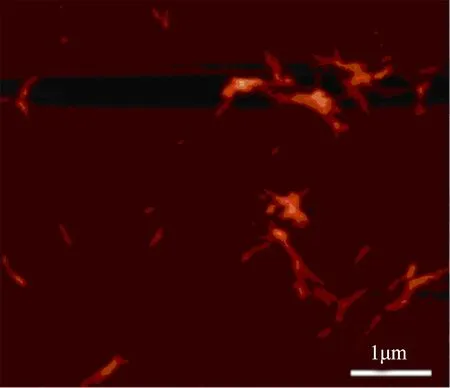
图2 溶菌酶纤维的原子力形貌表征Fig.2 AFM image of lysozyme fibrils
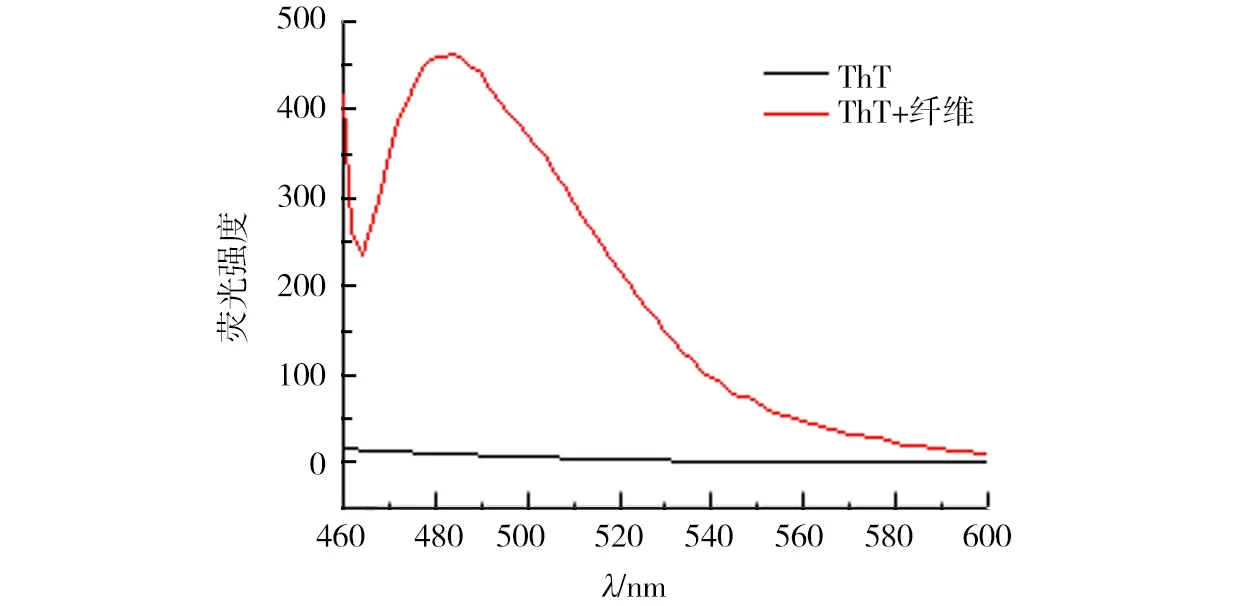
图3 ThT与溶菌酶纤维结合后的荧光光谱和单纯ThT荧光光谱对比Fig.3 Fluorescence spectrum of ThT bound onto lysozyme fibrils and ThT control
刚果红与溶菌酶纤维结合的紫外可见光谱如图4所示.通过和单纯刚果红溶液在相同条件下测得的光谱对比,发现当刚果红与溶菌酶纤维结合后,在540 nm处出现吸收峰增强.这是淀粉样纤维的一个特征光谱标志[20].图5中检测了溶菌酶纤维的红外光谱.淀粉样纤维的形成必然伴随β-折叠结构的产生.β-折叠结构在蛋白红外光谱的酰胺Ⅰ带1 640 cm-1以下区域有特征吸收峰[21].这个峰的存在可以作为蛋白淀粉样纤维成功制备的一个佐证.如图5所示,其在1 629 cm-1附近有明显的吸收峰,这个峰就来自淀粉样纤维中β-折叠结构.
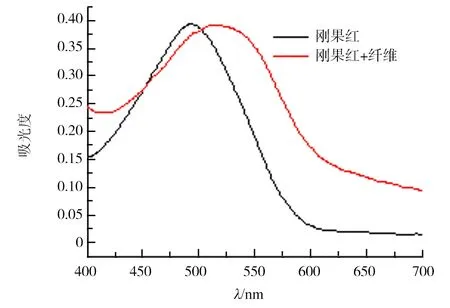
图4 刚果红与溶菌酶纤维结合后的紫外可见吸收光谱和单纯刚果红吸收谱的对比Fig.4 UV-Vis spectroscopy of Congo red bound onto lysozyme fibril and Congo red control
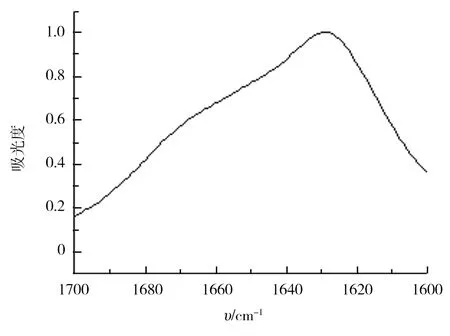
图5 溶菌酶纤维的红外光谱Fig.5 FTIR spectrum of lysozyme fibril
2.2 ThT结合溶菌酶纤维的荧光停流动力学研究
应用荧光检测的方法,结合停流技术研究了ThT结合溶菌酶纤维的动力学过程.实验中,为了确保动力学反应在ThT过量的条件下进行,使ThT大过量,即在ThT浓度为80 μmol/L、淀粉样纤维浓度为7.7 μmol/L的条件下进行荧光停流动力学实验.图6为荧光变化曲线,笔者看到随着反应时间的推移,ThT荧光先呈现一个快速上升的过程,这一过程大约持续2 s,之后呈现缓慢上升的过程,最后在10 s左右趋于平缓变化.
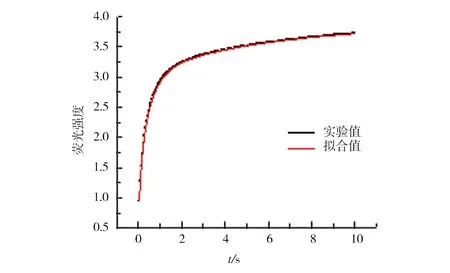
图6 ThT与淀粉样纤维结合的停流动力学曲线Fig.6 Stop-flow kinetic curve of ThT binding onto amyloid fibril
对这一动力学曲线,进行了数学拟合.发现单指数拟合效果不好.双指数可以获得非常好的拟合效果,(函数形式:y=A1e-k1t+A2e-k2t)相关系数R2为0.999,同时把相关拟合参数列于表1.
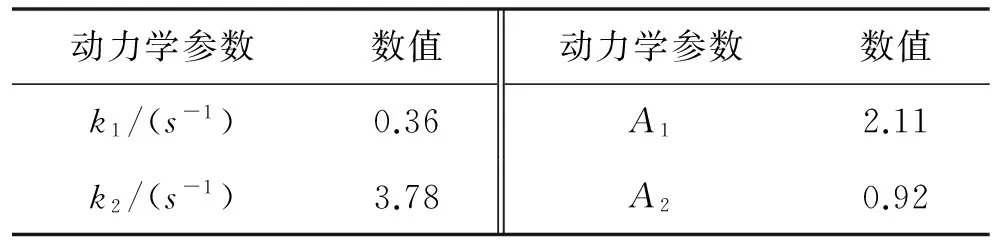
表1 ThT与溶菌酶纤维结合的动力学参数Tab.1 kinetic parameters of ThT binding onto amyloid fibril
2.3 平行反应动力学模型的建立和推导
笔者提出应用多位点平行反应模型来解释观察到的双指数拟合现象,具体推导如下.假设淀粉样纤维上存在多个可以与ThT进行结合的位点,如图7所示:
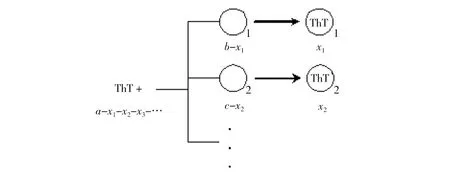
图7 ThT与淀粉样纤维结合的多位点平行反应模型Fig.7 Multi-site parallel mechanism of ThT binding onto amyloid fibril
其中a、b、c… 分别为0时刻ThT和纤维上各结合位点的浓度,x1、x2… 分别为t时刻纤维上各结合位点结合的ThT的浓度,也等同于各个位点在t时刻被消耗掉的浓度.则各平行反应的反应速率如下:

(1)
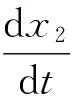
(2)
⋮
当a远大于b、c、时,对本研究而言也就是相当于ThT过量的情况,

(3)
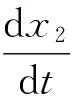
(4)
⋮
将上式积分可得:
x1=b-bexp(-k1at),
(5)
x2=c-cexp(-k2at),
(6)
⋮
因为在荧光条件下,所得信号为各结合位点上ThT的总和,所以
x=x1+x2+…=(b+c+…)-bexp(-k1at)-cexp(-k2at)-…
(7)
因为荧光强度与浓度成正比,所以体系实测的总荧光强度为
Ix=(Ib+Ic+…)-Ibexp(-k1at)-Icexp(k2at)-…
(8)
由以上(8)推导看出,荧光动力学曲线为双指数方程形式,符合多位点平行反应机理模型.具体到笔者的溶菌酶纤维体系,其双指数荧光动力学形式说明我们溶菌酶纤维上有2个结合位点,每个结合位点上ThT均以一个简单的一步结合的方式与纤维结合,2个位点上的结合动力学反应平行发生.
3 结论
本文应用停流动力学技术研究了ThT与溶菌酶淀粉样纤维结合的快速动力学过程,发现ThT和溶菌酶纤维结合的荧光增长曲线符合双指数增长模式,提出了一个双位点平行反应动力学模型.笔者希望本研究对进一步深入理解荧光染料分子与淀粉样纤维之间的相互作用提供有益借鉴.
[1] NELSON R,EISENBERG D.Structural models of amyloid‐like fibrils[J].Advances in Protein Chemistry,2006,73: 235-282.DOI:10.1016/S0065-3233(06)73008-X.
[2] SAWAYA M R,SAMBASHIVAN S,NELSON R,et al.Atomic structures of amyloid cross-beta spines reveal varied steric zippers[J].Nature,2007,447: 453-457.DOI:10.1038/nature05695.
[3] CHITI F,DOBSON C M.Protein misfolding,functional amyloid,and human disease[J].Annual Review of Biochemistry,2006,75: 333-366.DOI: 10.1146/annurev.biochem.75.101304.123901.
[4] LANSBURY P T,LASHUEL H A.A century-old debate on protein aggregation and neurodegeneration enters the clinic[J].Nature,2006,443: 774-779.DOI:10.1038/nature05290.
[5] SACHSE C,FAENDRICH M,GRIGORIEFF N.Paired beta-sheet structure of an a beta(1-40)amyloid fibril revealed by electron microscopy[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105: 7462-7466.DOI: 10.1073/pnas.0712290105.
[6] TYCKO R,WICKNER R B.Molecular structures of amyloid and prion fibrils: Consensus versus controversy[J].Accounts of Chemical Research,2013,46: 1487-1496.DOI: 10.1021/ar300282r.
[7] 张岚,杨延莲,王琛.调节分子对茁淀粉样蛋白的聚集调控及细胞毒性抑制效应[J].生物物理学报, 2010,26: 649-661.
ZHANG L,YANG Y L,WANG C.Regulation of aggregation and cytotoxicity of β-Amyloid by molecular modulators[J].ACTA Biophysica sinica,2010,26:649-661.
[8] 刘鹏,赵玉芬,李艳梅.Tau蛋白介导阿尔兹海默病的机理及相关药物[J].中国科学:化学, 2010,40: 906-913.
LIU P,ZHAO Y F,LI Y M.Advances in Tau-mediated neurodegeneration and Tau-focused drug for Alzhehimer’s disease[J].Scientia Sinica Chimica,2010,40:906-913.
[9] 刘夫锋,董晓燕,孙彦.海藻糖抑制淀粉质多肽42构象转变的分子动力学模拟[J].物理化学学报, 2010,26(6): 1643-1650.
LIU F F,DONG X Y,SUN Y.Molecular dynamics simulation of the conformational transition of amyloid peptide 42 inhibited by trehalose[J].Acta Physico-Chimica Sinica,2010,26(6): 1643-1650.
[10] NAIKI H,HIGUCHI K,HOSOKAWA M,et al.Fluorometric determination of amyloid fibrils in vitro using the fluorescent dye,thioflavin T1[J].Analytical Biochemistry,1989,177: 244-249.DOI: 10.1016/0003-2697(89)90046-8.
[11] LEVINE H,3RD.Quantification of beta-sheet amyloid fibril structures with thioflavin T[J].Methods in Enzymology,1999,309: 274-284.DOI: 10.1016/S0076-6879(99)09020-5.
[12] WOLFE L S,CALABRESE M F,NATH A,et al.Protein-induced photophysical changes to the amyloid indicator dye thioflavin T[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107: 16863-16868.DOI: 10.1073/pnas.1002867107.
[13] AMDURSKY N,EREZ Y,HUPPERT D.Molecular rotors: What lies behind the high sensitivity of the thioflavin-T fluorescent marker[J].Accounts of Chemical Research,2012,45: 1548-1557.DOI: 10.1021/ar300053p.
[14] LEVINE H,3RD.Stopped-flow kinetics reveal multiple phases of thioflavin T binding to alzheimer beta (1-40)amyloid fibrils[J].Archives of Biochemistry and Biophysics,1997,342: 306-316.DOI:10.1006/abbi.1997.0137.
[15] SABATE R,LASCU I,SAUPE S J.On the binding of thioflavin-T to HET-s amyloid fibrils assembled at pH 2[J].Journal of Structural Biology,2008,162: 387-396.DOI:10.1016/j.jsb.2008.02.002.
[16] QIN Z,SUN Y,JIA B H,et al.Kinetic mechanism of thioflavin T binding onto the amyloid fibril of hen egg white lysozyme[J].Langmuir,2017,33: 5398-5405.DOI: 10.1021/acs.langmuir.7b00221.
[17] VERNAGLIA B A,HUANG J,CLARK E D.Guanidine hydrochloride can induce amyloid fibril formation from hen egg-white lysozyme[J].Biomacromolecules,2004,5: 1362-1370.DOI: 10.1021/bm0498979.
[18] SULATSKAYA A I,KUZNETSOVA I M,TUROVEROV K K.Interaction of thioflavin T with amyloid fibrils: Stoichiometry and affinity of dye binding,absorption spectra of bound dye[J].Journal of Physical Chemistry B,2011,115: 11519-11524.DOI: 10.1021/jp207118x.
[19] ZOU Y,LI Y,HAO W,et al.Parallel beta-sheet fibril and antiparallel beta-sheet oligomer: New insights into amyloid formation of hen egg white lysozyme under heat and acidic condition from FTIR spectroscopy[J].Journal of Physical Chemistry B,2013,117: 4003-4013.DOI: 10.1021/jp4003559.
[20] KLUNK W E,JACOB R F,MASON R P.Quantifying amyloid by congo red spectral shift assay[J].Methods in Enzymology,1999,309: 285-305.DOI:10.1016/S0076-6879(99)09021-7.
[21] BARTH A,ZSCHERP C.What vibrations tell us about proteins[J].Quarterly Reviews of Biophysics,2002,35: 369-430.DOI: 10.1017/S0033583502003815.
(责任编辑:梁俊红)
Fluorescence-detectedstopped-flowkineticinvestigationofthioflavinTbindingontotheamyloidfibriloflysozyme
MAGang,QINZhe,LIUSiyang,SHANGYanli,JIABaohuan
(Key Laboratory of Medicinal Chemistry and Molecular Diagnosis of Ministry of Education,College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
Deposition of amyloid fibrils in tissues and organs is relevant to a wide range of devastating human diseases,including Alzheimer’s disease,Parkinson’s disease,and type Ⅱ diabetes.Thioflavin T (ThT)is widely used as a fluorescent probe for qualitative and quantitative detections of amyloid fibrils.Yet the exact kinetic mechanism of ThT binding onto amyloid fibril remains elusive.In this study,we used fluorescence-detected stopped-flow technique to study the binding mechanism of ThT onto the amyloid fibril of hen egg white lysozyme induced by guanidine hydrochloride.We proposed a kinetic binding mechanism to interpret our experimental observations.Our results showed that the binding of ThT onto lysozyme fibril follow a dual-site parallel binding mechanism.We believe our work is beneficial for better understanding of the interaction between fluorescent dye and amyloid fibril.
thioflavin T;lysozyme;amyloid fibril;kinetics
O643
A
1000-1565(2017)05-0476-07
10.3969/j.issn.1000-1565.2017.05.006
2017-03-26
国家自然科学基金资助项目(21075027);河北省自然科学基金资助项目(B2011201082;B2016201034)
马刚 (1971—),男,北京人,河北大学教授,博士,主要从事与蛋白纤维化聚集相关的研究.E-mail:gangma@hbu.edu.cn
马刚 (1971—),男,北京人,河北大学教授,博士,主要从事与蛋白纤维化聚集相关的研究.E-mail:gangma@hbu.edu.cn;商艳丽(1979—),女,河北保定人,河北大学副教授,博士,主要从事材料化学方面的研究.E-mail:ylshang@hbu.edu.cn
