化学氧化法制备季铵盐离子液体
2017-10-18李文秀张利月张志刚
李 冬, 李文秀, 张利月, 杜 悦, 张志刚, 张 弢
(沈阳化工大学 辽宁省化工分离技术重点实验室, 辽宁 沈阳 110142)
化学氧化法制备季铵盐离子液体
李 冬, 李文秀, 张利月, 杜 悦, 张志刚, 张 弢
(沈阳化工大学 辽宁省化工分离技术重点实验室, 辽宁 沈阳 110142)
首次以离子液体溴盐中间体和质子酸为原料、以双氧水为氧化剂、以二氯化碳为除溴剂、通过化学氧化反应合成8种季铵类离子液体.用核磁光谱对产物结构进行表征,用离子色谱、pH计和卡尔费休水份滴定仪分别测量产品中的溴杂质、残留酸和水的含量,用能斯特方程计算无法准确测量的溴离子的浓度.将化学氧化法和离子交换法的结果进行对比,结果表明与传统的离子交换法相比,化学氧化法具有反应时间短和产品收率高的优点.
离子液体; 合成; 化学氧化反应
离子液体(ILs),或称室温熔融盐,在室温下成液态,由有机阳离子和无机或有机阴离子组成.由于具有独特的物理化学性质,如低饱和蒸汽压、良好的溶解性、良好的导电性、高热稳定性和化学稳定性、结构可设计性等,离子液体不但在萃取分离[1-2]和有机合成[3-4]等物理化学过程中有着广泛的应用,还应用在电池材料[5]、纳米材料[6]等功能材料的研究中.近几年,国内外对离子液体的应用研究越来越多,相对而言对离子液体合成方法的研究较少.目前广泛使用的合成方法包括烷基化法[7-9]和离子交换法[10-15].烷基化法虽然可以得到高纯度的离子液体,但其阴阳离子的种类会受到有限的烷基化试剂的限制[7-9].离子交换法是向含有目标阳离子的卤素离子液体中间体中加入含有目标阴离子的酸或盐,然后根据溶解度的不同选择恰当的溶剂进行结晶分离,得到产品的方法.该方法存在收率低、合成时间长等缺点[10-15]. 本文首次采用了化学氧化法,以双氧水为氧化剂,用含有目标阴离子的强酸为酸性氧化条件,在水相中将离子液体中间体中的溴离子氧化为溴单质,生成的溴单质用二氯化碳为除溴剂从水相中萃取除去.提出了一种新的离子液体制备方法,与传统的离子交换法相比缩短了反应时间,提高了反应的收率.
1 实验部分
1.1 试剂及主要仪器
四甲基溴化铵(质量分数≥98 %),三乙胺(AR),溴代乙烷(AR),硝酸(质量分数>65 %),甲烷磺酸(AR),三氟乙酸(AR),双氧水(质量分数30 %水溶液),乙酸乙酯(AR),二氯甲烷(AR),试剂均为国药集团化学试剂有限公司产品.
旋转蒸发仪RE-52AA,上海亚荣生化仪器厂;电子天平JY502,上海浦春计量仪器有限公司;核磁共振波谱仪AV500Hz,Brucker公司;离子色谱仪IC-6200,安徽皖仪科技股份有限公司;自动水分滴定仪ZSD-2,上海市安亭电子仪器厂;PHSJ-5型pH计,上海仪电科学仪器股份有限公司.
1.2 合成方法及步骤
1.2.1 四乙基铵甲烷磺酸盐([N2222]CH3SO3)化学氧化法合成
以四乙基铵甲烷磺酸盐([N2222]CH3SO3)的合成为例对本实验采用的化学氧化法进行介绍.
1.2.1.1 季铵溴盐中间体四乙基溴化铵([N2222]Br)的合成
准确称取0.12 mol溴代乙烷原料和50 mL乙酸乙酯溶剂,加入装有搅拌转子的三口烧瓶中,并连续通入氮气制造无氧无水环境,搅拌下由恒压分液漏斗将三乙胺0.1 mol逐滴滴入三口烧瓶.滴加结束后在60 ℃恒温油浴中,搅拌转速为15 r/min条件下反应6 h,反应结束后得到无色黏稠液体,在25 ℃恒温水浴中自然降温静置,待其完全结晶后取出晶体即为目标产物[N2222]Br,该产物使用前需在真空干燥箱中70 ℃下干燥24 h.
1.2.1.2 四乙基铵甲烷磺酸盐([N2222]CH3SO3)化学氧化法合成
在250 mL三口瓶中,将0.1 mol四乙基溴化铵([N2222]Br)和0.1 mol甲烷磺酸溶于10 mL水中,然后向三口瓶中加入50 mL的CH2Cl2,CH2Cl2层在水溶液层下方.室温搅拌下滴加0.2 mol过氧化氢水溶液,滴加完毕后,在室温下反应3 h.用分液漏斗分离水相和CH2Cl2相,水相用CH2Cl2洗至无色透明,旋转蒸发除去水分和过量的H2O2得到无色透明液体即为目标产物[N2222]CH3SO3.得到的产品在真空干燥箱中70 ℃下干燥24 h后使用.
1.2.2 其他离子液体的合成
按上述方法,以双氧水为氧化剂,以含有目标阴离子的强酸为酸性环境,以二氯化碳为除溴剂合成四甲基铵甲烷磺酸盐([N1111]CH3SO3),四甲基铵硝酸盐([N1111]NO3),四甲基铵对甲苯磺酸盐([N1111]OTs),四甲基铵三氟甲基乙酸盐([N1111]CF3COO),四乙基铵硝酸盐([N2222]NO3),四乙基铵对甲苯磺酸盐([N2222]OTs),四乙基铵三氟甲基乙酸盐([N2222]CF3COO)七种季铵盐离子液体.为了与化学氧化法对照,按照文献报道的方法[10-15],用离子交换法合成这8种离子液体.
2 结果与讨论
2.1 结构表征
表1列出了通过上述化学氧化法合成的8种季铵盐离子液体的1H NMR和13C NMR测试结果,其化学位移与标准样品谱图的化学位移一致,表明化学氧化法适合上述离子液体的合成.上述8种季铵盐类离子液体的共同特点是:1.为保证反应过程在酸性条件下进行,实验中选用的质子酸均为强酸;2.合成原料中不含有化学稳定性差的双键等不饱和基团.

表1 离子液体核磁表征结果
2.2 杂质含量测量及计算
分别使用IC-6200型离子色谱仪、ZSD-2型卡尔费休自动水分滴定仪、PHSJ-5型pH计对产品中的溴杂质、残留酸和水3种杂质的质量含量进行定量测量,结果列于表2中.

表2 离子液体中的杂质含量
注:溴杂质为没有反应的溴盐中间体;残留酸为没有反应的原料酸;杂质含量均为质量分数.
从表2可以看出:8种离子液体中杂质质量分数的总和低于0.4 %,产品纯度较高.其中溴杂质的含量均低于离子色谱的检测下限,无法通过离子色谱进行定量分析.因此溴杂质的准确含量需结合残留酸含量的测试结果,通过能斯特方程(1)进行计算.

(1)
其中:E是电极电位(V),反应结束时为平衡点位0;Εθ是给定的氧化还原体系的电极电位差值(V),从式(2~4)可见其值为0.711 V;R为气体常数,8.314 J·mol-1·K-1;T为绝对温度(K),本文中的温度为298.15 K;F是法拉第常数96 500 C·mol-1;n是反应过程中转移的电子摩尔量,本文中的值为2; [O]是氧化态物质的活度; [R]是还原态物质的活度.在该反应中,电极反应如下:
2Br--2e-→Br2
-1.065 V 阳极反应
(2)
H2O2+2H++2e-→2H2O
1.776 V 阴极反应
(3)
Eθ=Eθ(H2O2〡H2O)+
Eθ(Br-〡Br2)=0.711 V
(4)
平衡时,能斯特方程可以写为:

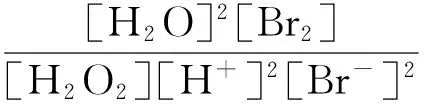
(5)
其中:[H2O]=1,[Br2]=1,[H2O2]=1,因此溴离子浓度可通过(6)式计算:
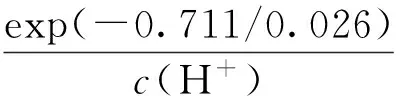
(6)
其中,c(H+)是体系中氢离子摩尔浓度,可通过下式计算:
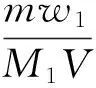
(7)
式中:m为目标产品的质量,每次试验后通过电子天平称量;w1是残留酸质量分数,通过pH剂测量,列于表2中;M1是残留酸相对分子质量;V是氧化反应中水相体积.溴杂质w2含量可由下式计算:
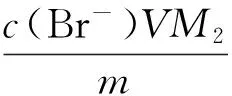
(8)
M2是溴盐中间体相对分子质量,得到的溴杂质含量列于表2,计算结果与测量结果一致.
2.3 化学氧化法和离子交换法的比较
表3列出了上述8种离子液体用化学氧化法和离子交换法合成时的反应时间和收率.

表3 离子交换法和化学氧化法的比较
从表3可见化学氧化法明显降低了反应时间并提高了反应收率.从前诉溴杂质计算和测试的结果可见,化学氧化法在第1次达到平衡时溴的转化率就极高,不必像传统的离子交换法一样通过多次平衡操作提高目标产物纯度,因此节省了总的反应时间.同样,由于节省了平衡操作次数,化学氧化法产物的损失较小,产品收率显著提高.
3 结 论
(1) 本文首次通过化学氧化法合成了四甲基铵甲烷磺酸盐([N1111]CH3SO3)等8种季铵类离子液体,并通过核磁共振对产物进行了表征,证明了该方法的可行性.
(2) 通过测试和计算确定了产物中水,原料溴杂质和残留酸的含量.
(3) 由于提高了目标产物在第1次反应平衡中的浓度,化学氧化法缩短了总反应时间,并提高了反应收率.
[1] EGOROV V M,DJIGAILO D I,MOMOTENKO D S,et al.Task-Specific Ionic Liquid Trioctylmethylammonium Salicylate as Extraction Solvent for Transition Metal Ions[J].Talanta,2010,80 (3):1177-1182.
[2] ABBOTT A P,CULLIS P M,GIBSON M J,et al.Extraction of Glycerol from Biodiesel into a Eutectic Based Ionic Liquid[J].Green Chemistry,2007,9 (8):868-872.
[3] WELTON T.Room-Temperature Ionic Liquids.Solvents for Synthesis and Catalysis[J].Chemical Reviews,1999,99 (8):2071-2084.
[4] PAN L,YU L T,WU Z Q,et al.Quaternary Ammonium Salt as Alkylation Agent in Three-Component Reactions for the Synthesis of Benzothiazoles in Water[J].RSC Advances,2014,4 (53):27775-27779.
[5] LIN M C,GONG M,LU B,et al.An Ultrafast Rechargeable Aluminium-Ion Battery[J].Nature,2015,520 (7547):324-328.
[6] KIM J Y,KIM J T,SONG E A,et al.Polypyrrole Nanostructures Self-Assembled in Magnetic Ionic Liquid as a Template[J].Macromolecules,2008,41 (8):2886-2889.
[7] HIMMLER S,HORMANN S,van HAL R,et al.Transesterification of Methylsulfate and Ethylsulfate Ionic Liquids——An Environmentally Benign Way to Synthesize Long-Chain and Functionalized Alkylsulfate Ionic Liquids[J].Green Chemistry,2006,8 (10):887-894.
[8] LECLERCQ L,SUISSE I,NOWOGROCKI G,et al.Halide-free Highly-Pure Imidazolium Triflate Ionic Liquids:Preparation and Use in Palladium-Catalysed Allylic Alkylation[J].Green Chemistry,2007,9(10):1097-1103.
[9] SACHNOV S J,SCHULZ P S,WASSERSCHEID P.A Convenient Method to Access Long-Chain and Functionalised Mixed Methylphosphonate Esters and Their Application in The Synthesis of Ionic Liquids[J].Chemical Communications(Camb),2011,47 (40):11234-11236.
[10] CASSOL C C,EBELING G,FERRERA B,et al.A Simple and Practical Method for the Preparation and Purity Determination of Halide-Free Imidazolium Ionic Liquids[J].Advanced Synthesis & Catalysis,2006,348 (1/2):243-248.
[11] SROUR H,ROUAULT H,SANTINI C C,et al.A Silver and Water Free Metathesis Reaction:A Route to Ionic Liquids[J].Green Chemistry,2013,15 (5):1341-1347.
[12] GAO J,LIU J G,LI B,et al.A Quick and Green Approach to Prepare [Rmim]OH and Its Application in Hydrophilic Ionic Liquid Synthesis[J].New Journal of Chemistry,2011,35(8):1661-1666.
[13] FERGUSON J L,HOLBREY J D,NG S,et al.A Greener,Halide-Free Approach to Ionic Liquid Synthesis[J].Pure and Applied Chemistry,2011,84 (3):723-744.
[14] WILKES J S,ZAWOROTKO M J.Air and Water Stable 1-ethyl-3-methylimidazolium Based Ionic Liquids[J].Journal of the Chemical Society,Chemical Communications,1992(13):965-967.
[15] PRINGLE J M,GOLDING J,FORSYTH C M,et al.Physical Trends and Structural Features in Organic Salts of the Thiocyanate Anion[J].Journal of Materials Chemistry,2002,12 (12):3475-3480.
Abstract: Eight kinds of quaternary ammonium ionic liquids were synthesized for the first time by using ionic liquid bromide salts intermediates and proton acids through chemical oxidation method with H2O2and CH2Cl2.The ionic liquids were characterized by using1H NMR and13C NMR.The content of water,residual bromine and acid in the ILs were measured by Karl Fischer water titration,ion chromatography and pH meter,respectively.The content of residual bromine was calculated by Nernst equation.Comparing to the traditional ion exchange method,the advantages of the chemical oxidation method are the shorter reaction time and higher yields.
Keywords: ionic liquids; synthesis; chemical oxidation reaction
SynthesisofQuaternaryAmmoniumIonicLiquidsThroughChemicalOxidationReaction
LI Dong, LI Wen-xiu, ZHANG Li-yue, DU Yue, ZHANG Zhi-gang, ZHANG Tao
( Shenyang University of Chemical Technology, Shenyang 110142, China)
10.3969/j.issn.2095-2198.2017.03.003
TQ203
A
2016-09-30
国家自然科学基金项目(21576166)
李冬(1992-),男,安徽宿州人,硕士研究生在读,主要从事化工传质与分离的研究.
张弢(1975-),男,黑龙江方正人,副教授,博士,主要从事传质与分离方面的研究
2095-2198(2017)03-0210-05
