氧化铁、氧化锰及其复合物对砷(Ⅴ)的吸附
2017-10-18姚淑华郑志慧石中亮
姚淑华, 郑志慧, 石中亮
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
氧化铁、氧化锰及其复合物对砷(Ⅴ)的吸附
姚淑华, 郑志慧, 石中亮
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
合成氧化铁、氧化锰及其复合物,采用SEM研究其结构特征.以氧化铁、氧化锰及其复合物为吸附剂研究投量、pH值、时间等因素对吸附As(Ⅴ)的影响,并讨论As(Ⅴ)的饱和吸附量及等温吸附实验.吸附过程中,增加矿物投量可以明显提高砷的吸附率,但单位吸附量却随投量的增加呈先增后减的趋势;吸附量随pH值的增大呈先增后减的趋势.吸附速率在反应前40 min较高,逐渐降低后在100 min左右达到平衡,动力学曲线符合准二级动力学模型.Langmuir方程可以很好地描述吸附过程,由Langmuir方程计算出氧化铁、氧化锰及其复合物(Ⅰ、Ⅱ)的饱和吸附量分别为:62.5、44.6、103.1和114.9 mg/g.
氧化铁; 氧化锰; 砷; 吸附
砷是一种重要的工业原料,却又是一种对人体及其他生物有毒害作用的致癌物质[1],砷对人体的危害缓慢持久,在世界不同地区的流行病学研究表明,除引起皮肤色素沉积、皮肤角质增厚外,还可能引起心血管疾病、神经毒性、糖尿病等病症[2].Morton等[3]在1976年曾发现饮用水中砷含量与皮肤癌的发病率具有相关性.在之后的学者研究也证实砷在生物体内代谢的过程中由于持续的去甲基化从而促进了基因表达的变异,导致机体癌症的产生.
自然环境和生物体中砷元素的存在形态可以包括无机砷和有机砷两种,其化学状态主要以3价和5价的两种形态为主.有研究表明,含砷离子的亚砷酸盐毒性极高,其毒性是普通砷酸盐毒性的25~60倍.在自然界中,砷主要存在类型包括砷酸盐、砷的氧化物、砷的硫化物等,如雄黄(AsS)、毒砂(FeAsS)、三氧化二砷(As2O3)、雌黄(As2S3)、臭葱石(FeAsO4·2H2O)等[4].毒性顺序依次是三氢化砷>无机砷(Ⅲ)>有机砷(Ⅲ)>无机砷(Ⅴ)>有机砷(Ⅴ)>元素砷[5].
现在,国内外对含砷废水的处理方法很多,其中包括混凝-沉淀法、吸附法、离子交换法、生物法、反渗透法、膜法等[6-11].对水中低浓度砷,吸附法有成本低和效率高的优点,是处理砷污染地下水比较理想的方法[12].目前,研究较多的吸附除砷的方法有活性铁、铝氧化物法[13],活性炭吸附法[14],负载和改性的离子交换树脂法[15]等.研究表明,铁、锰氧化物一方面能够大量专性吸附砷,另一方面可以形成难溶性沉淀物来增强其吸附能力[16].而且,铁氧化物是一种较高效且价廉的砷吸附剂,有对砷吸附速率高,吸附容量大,选择性强等优点[17].
综上所述,以往研究只是针对一种氧化物进行,并且很少有对吸附机理进行的探究.本文在总结了前人成果的基础上,合成氧化铁、氧化锰、以及共沉淀合成了不同比例的复合物,通过 SEM 手段对合成矿物进行表面形貌测定,比较不同的矿物对As(Ⅴ)的吸附行为,并通过实验,从氧化物的结构,溶液的酸度、组成,温度,投量,时间等方面探讨对砷的吸附作用.以期望能更好地掌握砷在自然界中的迁移、转变和富集的规律,这对掌握砷的环境效应及对砷污染的治理有着积极的意义.
1 实验部分
1.1 试剂
Fe(NO3)3,NaOH,MnSO4,KMnO4,NaNO3,HCL,硫脲,抗坏血酸,KBH4,Na3AsO4·12H2O等.所有试剂均为分析纯,实验用水为去离子水.
1.2 仪器
SHB-Ⅲ循环水式多用真空泵,CL-4型恒温加热磁力搅拌器,101A-3型电热鼓风干燥箱,HZQ-C双层气浴振荡箱,AR124CN电子天平,台式离心机,双道原子荧光分光光度计.
1.3 氧化铁、氧化锰及其不同比例复合物的合成
1.3.1 氧化铁的合成
取定量1 mol/L的Fe(NO3)3溶液,滴加2 mol/L的NaOH溶液至pH=7,悬浮液在60 ℃条件下老化1 d,过滤,去离子水洗涤,得到氢氧化铁凝胶,80 ℃烘干,研磨后过分子筛,备用.
1.3.2 氧化锰的合成
室温条件下,将0.7 mol/L的MnSO4溶液与0.5 mol/L的KMnO4溶液以6∶5的体积比混合,震荡条件生成棕黑色沉淀,静置10 min后过滤,用去离子水洗涤,80 ℃烘干,研磨后过分子筛,备用[18].
1.3.3 不同比例氧化铁和氧化锰复合物的合成
两组实验,分别取一定体积1 mol/L的Fe(NO3)3溶液,用2 mol/L的NaOH溶液滴加至pH=7,在室温搅拌充分的条件下,根据铁锰摩尔比分别为25∶3、25∶9的比例,将0.7 mol/L的MnSO4溶液与0.5 mol/L的KMnO4溶液以体积比6∶5比例依次缓慢滴加至铁溶液中,悬浮液于60 ℃老化1 d,过滤,用去离子水洗涤,得氢氧化铁凝胶,80 ℃烘干,研磨后过分子筛,备用.
1.4 样品表征
样品扫描电镜分析在JEOL场发射扫描电子显微镜(JSM6700F,日本)上进行.
1.5 吸附实验
在室温条件下,初始质量浓度为10 mg/L的As(Ⅴ)溶液,以0.08 mol/L的NaNO3溶液为背景,加入同等质量的氧化铁,氧化锰和其不同比例的复合物.在恒温气浴振荡器中反应180 min,2 000 r/min转速离心20 min,分别测定上清液中As(Ⅴ),计算其吸附率并进行比较.
改变反应条件,研究时间,酸度,产品投加量对As(Ⅴ)吸附效果的影响,并对其反应机理进行研究.
1.6 标准曲线绘制和样品测量
采用原子荧光光谱法测定上清液中As(Ⅴ)浓度,取吸附后液体,加入5 mL体积分数50 %的HCl,5 mL 50 g/L硫脲+50 g/L抗坏血酸,用高纯氩气做载气流,以20 g/L KBH+0.25 g/L NaOH为还原剂上机测定.为保证实验结果的准确度,各条件实验均进行重复实验.
2 结果与讨论
2.1 SEM分析
图1分别为氧化铁、氧化锰、铁锰氧化物Ⅰ和铁锰氧化物Ⅱ的SEM图.由图1可以看出:氧化铁是无固定形貌的絮状体,有些部分呈小颗粒状;氧化锰表面颗粒为串状或球状集合体,而且颗粒之间聚结比较严重,颗粒间缝隙较小,因此导致氧化锰的总空体积和比表面积较低;铁锰氧化物Ⅰ、铁锰氧化物Ⅱ与氧化铁相比较,表面出现了较明显的颗粒凸起和褶皱,且形状无规则,微小的细粒相互堆积,大小不均;吸附后的矿物电镜图与之前的对比可看出表面变得光滑.

图1 不同材料的扫描电镜
2.2 反应时间对砷吸附的影响及砷的吸附动力学曲线
图2为在室温下不同样品在pH=7条件下,投加量在0.02 g时对As(Ⅴ)的吸附动力曲线.
由图2可看出:前40 min吸附速率较快,在40~100 min吸附速率降低,并在100 min左右达到吸附平衡.在固-液吸附体系中,对砷的吸附动力学采用准一级、准二级动力学两种吸附动力学模型,对实验数据用这两种模型进行拟合.
准一级动力学模型:
lnQt/Qe=k1t+C
(1)
准二级动力学模型:
(2)
由不同样品对As(Ⅴ)的吸附动力学数据用上述两种模型进行拟合,拟合后发现,准一级动力学模型的R2分别为0.871 6、0.919 9、0.847 7、0.825 6,与准二级动力学模型的拟合系数相比说明准二级动力学模型对As(Ⅴ)在不同样品上的吸附动力学过程的拟合最为恰当,拟合结果见表1. 由表1可知:不同样品对As(Ⅴ)的吸附动力学曲线用准二级方程拟合的相关系数较好,说明该吸附过程是由化学作用支配的.

图2 不同氧化物对As(Ⅴ)的吸附动力曲线
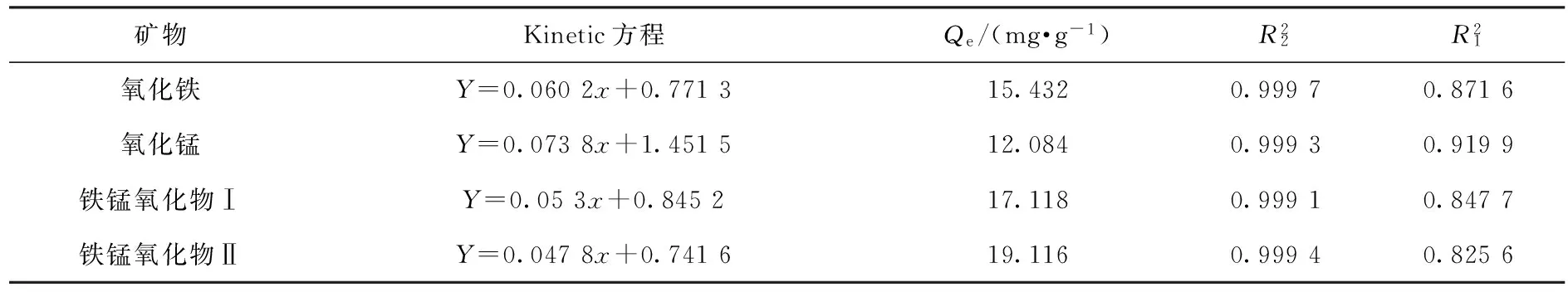
矿物Kinetic方程Qe/(mg·g-1)R22R21氧化铁Y=0.0602x+0.771315.4320.99970.8716氧化锰Y=0.0738x+1.451512.0840.99930.9199铁锰氧化物ⅠY=0.053x+0.845217.1180.99910.8477铁锰氧化物ⅡY=0.0478x+0.741619.1160.99940.8256
2.3 不同样品对砷的吸附等温线
室温下不同样品在pH=7,投加量为0.02 g时对As(Ⅴ)的等温吸附曲线如图3所示.
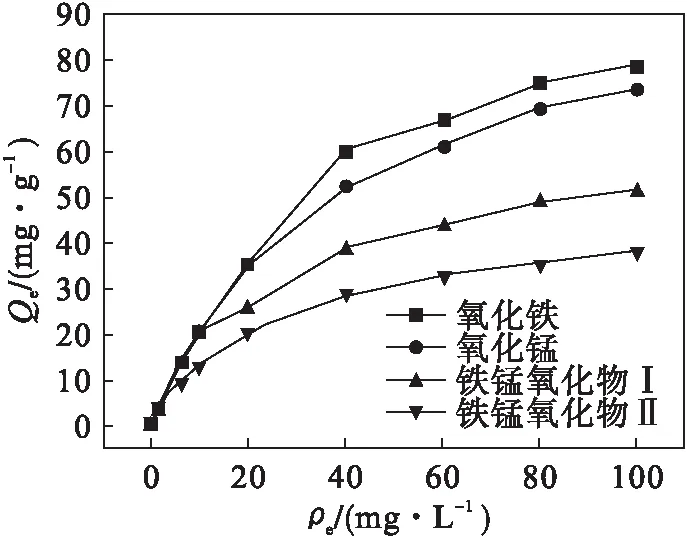
图3 不同氧化物对As(Ⅴ)的等温吸附曲线
常用的吸附等温线模型主要有Langmuir模型和Freundlich模型.
Langmuir等温方程为:
ρe/Qe=1/k3Qm+ρe/Qm
(3)
Freundlich等温方程为:
lgQe=lgk4+(1/n)lgρe
(4)
Langmuir和Freundlich方程进行拟合,结果见表2.由表2可以看出:Langmuir方程可以很好地表述样品对砷的吸附过程,其相关数R2分别达到了0.991、0.995、0.991、0.987.根据Langmuir方程求得最大吸附量分别为62.5、44.6、103.1、114.9 mg/g.
由表2还可知:随着砷离子质量浓度的增大,吸附率逐渐减小,这是因为随着吸附过程的进行,样品上的吸附位点不断减少,虽然吸附量会随着吸附质质量浓度的增加而增加,但由于吸附质质量浓度增幅更大,导致吸附率减小.
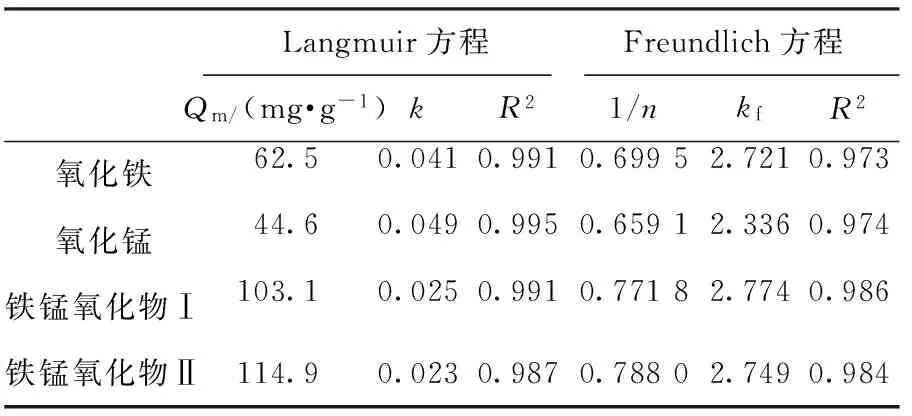
表2 等温吸附方程拟合结果
2.4 pH值对砷吸附的影响

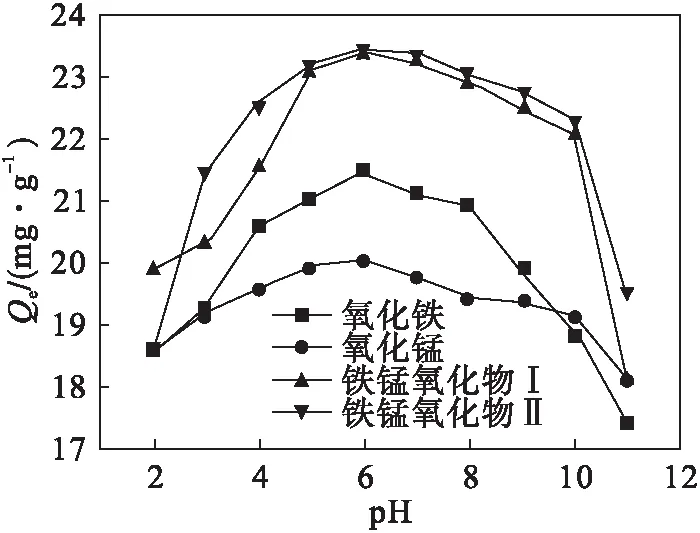
图4 pH对砷吸附的影响
2.5 不同投加量的铁、锰氧化物及不同比例的复合物对砷吸附的影响
由图5可以看出:随着样品投加量的增加可以明显提高砷的吸附率,最后趋于平稳.说明在投加量增加的过程中,吸附位点相应增加,但是单位吸附量却随着投加量的增加而呈现出先增加后减少的趋势,这是因为相对高剂量的样品可以提供相对较多但又不过量的吸附位点.
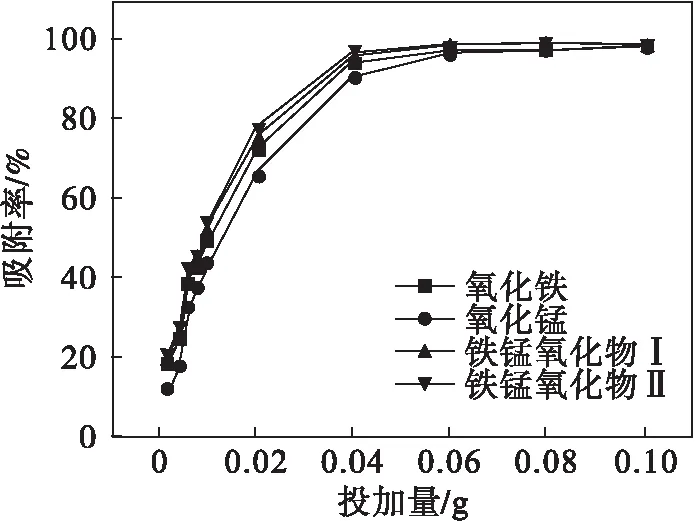
图5 投加量对砷吸附率的影响
3 结 论
不同样品对As(Ⅴ)的吸附量皆随pH值的增大呈先增后减的趋势,在中性及弱酸弱碱条件下,吸附效果较好.增加矿物的投加量可以显著提高砷的吸附率,但单位吸附量却随投加量的增加呈先增后减的趋势.吸附前期吸附量增长较快,100 min后达到平衡,吸附动力学曲线符合准二级动力学模型,说明吸附过程是由化学作用支配的.由Langmuir方程计算出铁、锰氧化物及不同比例的复合物(Ⅰ、Ⅱ)的饱和吸附量分别为:62.5、44.6、103.1、114.9 mg/g,可以看出在氧化铁中掺杂氧化锰对吸附量有较大提高,对处理环境中砷污染的处理有较好的改进.根据以往的研究,氧化铁具有较好的吸附性,而氧化锰氧化性相对较高,氧化铁中掺杂氧化锰对吸附As(Ⅲ) 预计会有较好的成果,有进一步研究的必要性.
[1] 徐键,胡国君,陈全庆.多组分碲卤基红外玻璃的研究[J].硅酸盐学报,1997,25(3):27-30.
[2] 赵艳芳,尚德荣,宁劲松,等.水产品中不同形态砷化合物的毒性研究进展[J].海洋科学,2009,33(9):92-96.
[3] MORTON W,STARR G,POHL D,et al.Skin Cancer and Water Arsenic in Lane County,Oregon[J].Cancer,1976,37(5):2523-2532.
[4] 谢正苗,黄昌勇,何振立.土壤中砷的化学平衡[J].环境科学进展,1998,6(1):23-25.
[5] VIRARGHAVAN T,SUBRAMANIAN K S,ARUL DOSS J A.Arsenic in Drinking Water—Problems and Solutions[J].Water Science Technology,1999,40(2):69-76.
[6] 刘志滨,韩宏大,吴维.混凝沉淀法对砷污染物的去除性能研究[J].供水技术,2011,5(5):8-11.
[7] PATTANAYAK J,MONDAL K,MATHEW S,et al.A Parametric Evaluation of the Removal of As(Ⅴ) and As(Ⅲ) by Carbon-based Adsorbents[J].Carbon,2000,38(4):589-596.
[8] 王鸣涛,李腾,朱迟,等.MIEX-DOC®离子交换树脂的饮用水除砷研究[J].化学与生物工程,2012,29(3):71-74.
[9] KIM J,BENJAMIN M M,KWAN P,et al.A Novel Ion Exchange Process as As Removal[J].American Water Works Association,2003,95(3):77-85.
[10] KATSOYIANNIS I A,ZOUBOULIS A I,JEKEL M.Kinetics of Bacterial As(Ⅲ) Oxidation and Subsequent As(Ⅴ) Removal by Sorption onto Biogenic Manganese Oxides during Groundwater Treatment[J].Ind Eng Chem Res,2004,43(2):486-493.
[11] 杨凡.关于膜技术在饮用水除砷处理中的研究与应用[J].科技资讯,2009(18):7.
[12] 常方方,曲久辉,刘锐平,等.铁锰复合氧化物的制备及其吸附除砷性能[J].环境科学学报,2006,26(11):1769-1774.
[13] HALTER W E,PFEIFER H R.Arsenic(Ⅴ) Adsorption ontoα-Al2O3between 25 and 70 ℃ [J].Applied Geochemistry,2001,16(7):793-802.
[14] CHUANG C L,FAN M,XU M,et al.Adsorption of Arsenic(Ⅴ) by Activated Carbon Prepared from Oat Hulls[J].Chemosphere,2005,61(4):478-483.
[15] 赵雅萍,王军锋,陈甫华.载铁(Ⅲ)—配位体交换棉纤维素吸附剂对饮用水中砷(Ⅴ)和氟联合去除的研究[J].高等学校化学学报,2003,24(4):643-647
[16] 李学垣.土壤化学[M].北京:高等教育出版社,2001:67-211.
[17] ZHANG G S,REN Z M,ZHANG X W,et al.Nanostructured Iron(Ⅲ)-copper(Ⅱ)Binary Oxide.:A Novel Adsorbent for Enhanced Arsenic Removal from Aqueous Solutions[J].Water Research,2013,47(12):4022-4031.
[18] 白德奎,朱霞萍,王艳艳,等.氧化锰、氧化铁、氧化铝对砷(Ⅲ)的吸附行为的研究[J].岩矿测试,2010,29(1):55-60.
Abstract: Iron oxide,manganese oxide and Fe-Mn bimetal oxide by different proportion were synthesized.The microstructures of the materials were characterized by using scanning electron microscopy (SEM).The effects of adsorbent dose,pH and equilibration time on the adsorption of As(Ⅴ) by oxides were studied.The saturated adsorption capacity and the isothermal adsorption of As(Ⅴ) by four minerals were also tested.In the process of adsorption,the dosage of oxides can significantly improve the arsenic adsorption rate,but the adsorption volume of unit was increased first and then decreases with increased dosage;the reaction equilibrium concentration of As(Ⅴ) increasing first and then decreasing with pH increasing.Adsorption rate is higher in forty minutes and gradually reduced,the adsorption equilibrium time was about 100 minutes,adsorption kinetic data correlated well with second kinetic equation.The adsorption mechanism of arsenic can be described by using Langmuir equation and Freundlich equation,the maximum adsorption amount of arsenic by using Langmuir equation were 62.5,44.6,103.1 and 114.9 mg/g,respectively.
Keywords: iron oxide; manganese oxide; arsenic; adsorption
AdsorptionBehaviorsofAs(Ⅴ)byIronOxide,ManganeseOxideandFe-MnBimetalOxide
YAO Shu-hua, ZHENG Zhi-hui, SHI Zhong-liang
(Shengyang University of Chemical Technology, Shenyang 110142, China)
10.3969/j.issn.2095-2198.2017.03.002
O647.32
A
2015-10-16
国家自然科学基金资助项目(41373127);辽宁省高等学校优秀科技人才支持计划资助项目(LR2015052)
姚淑华(1967-),女,辽宁阜新人,教授,博士,主要从事环境污染治理及资源综合利用的研究.
2095-2198(2017)03-0204-06
