壳聚糖磷酸酯糖用澄清剂的制备及结构表征
2017-10-18宋小荣任勤范松林张佳欣梁欣泉
宋小荣,任勤,范松林,张佳欣,梁欣泉
(广西大学轻工与食品工程学院,南宁 530004)
壳聚糖磷酸酯糖用澄清剂的制备及结构表征
宋小荣,任勤,范松林,张佳欣,梁欣泉*
(广西大学轻工与食品工程学院,南宁 530004)
壳聚糖具有较好的吸附性、成膜性、成纤性、吸湿性及生物相溶性等,对壳聚糖进行磷酸化改性,制备壳聚糖磷酸酯(PCTS),改善水溶性,并将其应用于甘蔗混合汁澄清,以清汁色值和纯度差为考核指标,采用单因素和正交试验探索壳聚糖磷酸酯制备的最佳工艺条件,利用扫描电镜(SEM)、傅立叶红外变换光谱仪(FT-IR)对其进行结构表征。实验表明:微波合成壳聚糖磷酸酯制备的最佳工艺条件为微波功率260 W,微波时间9 min,m(CH2O)∶m(壳聚糖)为1∶1,m(H3PO4)∶m(壳聚糖)为3.2∶1,处理混合汁后清汁纯度提高2.97%,色值为756.52 IU。与传统亚硫酸法澄清效果对比发现,PCTS澄清效果得到的清汁色值与纯度差均有所提高,认为PCTS能够代替SO2用于蔗汁无硫澄清生产。
壳聚糖磷酸酯;蔗汁;色值;纯度差
白砂糖是国家战略物资,制糖业作为广西的支柱性产业,其广西白砂糖产量约占全国总产量的60%以上。全国约90%以上的甘蔗糖厂采用亚硫酸法澄清工艺[1],但此法存在诸多问题,如白砂糖中残留的部分SO2,不能满足医药和高端食品的需求;随着储存时间的延长,白砂糖出现发黄、潮解现象等。因此,研究探索新的澄清剂及工艺对提高白砂糖质量,提高我国白砂糖国际竞争力至关重要。近年来,已有不少专利介绍了新型的澄清技术,包括磷酸上浮工艺、烟道气二氧化碳、复合酶制剂澄清剂等[2-4],相关文献也描述了多种澄清剂应用于制糖行业,均取得一定效果。目前,无硫澄清工艺极具吸引力,已成为我国制糖行业的研究热点,具有广阔的研究前景。
壳聚糖化学稳定性良好,吸湿性较强,遇水易分解;无毒无害,具有优良的生物相溶性,可被溶菌酶等溶解[5],可生物降解,其代谢产物无毒,且能被生物体完全吸收,但其溶解性能大大限制了其应用范围。壳聚糖分子中含有氨基、羟基,活性较高,可利用化学方法在这些基团上引入其他化学键,即通过改性,改善壳聚糖衍生物物理化学性质,提高水溶性和机械强度,使其在溶液中的构象发生改变,表现出利于吸附絮凝的构象,并伴随着吸附选择性的提高,吸附量增大,絮凝效果较好,进而扩大应用范围。
本文将壳聚糖进行磷酸化改性得到的壳聚糖磷酸酯(PCTS)属于水溶性壳聚糖,与壳聚糖相比,其溶解性能有所改善,且吸附性能、可降解性能均得到提高。该研究以其对甘蔗混合汁澄清后的清汁色值、纯度差为指标,通过条件优化,制备出适用于混合汁澄清的澄清剂壳聚糖磷酸酯。同时采用扫描电镜(SEM)、傅立叶红外变换光谱仪(FT-IR)对其进行结构表征及性能分析[6]。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料与试剂
甘蔗混合汁(采样于广西某糖厂);壳聚糖(工业级,实验室测定脱乙酰度78%,上海西宝生物科技有限公司);乙酸(AR)、甲醛(AR)、磷酸(AR)、乙醇(AR)、盐酸(AR)、NaOH(AR)。
1.1.2 主要仪器
101-2S型数显式电热恒温干燥箱 上海沪越实验仪器有限公司;WD900ATL23-2电脑型烧烤微波炉广东Ganlanz公司;501A型超级恒温器 上海实验仪器厂有限公司;PHSJ-4A型酸度计 上海雷磁仪器厂;HJ-J多功能搅拌器 常州国华电器有限公司;日立S-3400N型扫描电镜 日本日立电子有限公司;FT-IR傅立叶红外光谱仪 美国Perkin Elmer公司;喷雾干燥器(产地);精密天平 上海梅特勒-托利多仪器有限公司。
1.2 壳聚糖磷酸酯的主要制备过程
壳聚糖磷酸酯主要采用微波反应[7],主要过程为:将适量壳聚糖溶于1%乙酸溶液,按比例添加浓度为40%的甲醛溶液、50%的磷酸溶液,待溶液混合均匀后,放入微波反应器中,设置微波功率、微波时间,反应结束后,将反应液冷却至室温,加入乙醇溶液,充分搅拌后,转入离心瓶中,5000 r/min离心10 min,弃去上清液,将沉淀用蒸馏水溶解后再次加入乙醇溶液,待沉淀充分析出后,将含有析出物的混合液使用喷雾干燥法干燥,收集喷出物即得到产物壳聚糖磷酸酯,其主要工艺流程见图1。

图1 壳聚糖磷酸酯制备过程Fig.1 The preparation process of chitosan phosphate
1.3 壳聚糖磷酸酯的制备工艺实验
1.3.1 制备工艺单因素试验
通过单因素试验考察甲醛、磷酸添加比例、微波功率、微波时间对制备的壳聚糖磷酸酯澄清效果的影响,将所制备出的产物对甘蔗混合汁进行澄清处理,并以澄清后的清汁色值(ΔIU)和纯度差(ΔG.P.)为评定指标,以此来评定壳聚糖磷酸酯的最佳制备工艺条件。
1.3.2 制备工艺条件的优化
在单因素试验的基础上,采用L9(34)四因素三水平进行正交试验[8,9],并以壳聚糖磷酸酯对甘蔗混合汁澄清的清汁色值和纯度差为评价指标,优化壳聚糖磷酸酯的制备工艺条件,因素水平表见表1。

表1 四因素三水平正交试验设计表Table 1 Design table of four-factor three-level orthogonal test
1.3.3 壳聚糖磷酸酯对甘蔗混合汁的澄清实验
将1.2制备得到的产物溶于蒸馏水配制成适当浓度的溶液,采用图2的步骤处理混合汁,此过程主要考察甲醛、磷酸添加比例、微波功率、微波时间对制备的壳聚糖磷酸酯澄清效果的影响,主要考核指标为纯度差、清汁色值。

图2 壳聚糖磷酸酯澄清甘蔗混合汁工艺流程图Fig.2 The process flow diagram of chitosan phosphate clarifying sugarcane mixed juice
1.3.4 纯度、色值的测定与计算
甘蔗混合汁与清汁的纯度差、色值的测定与计算参照文献[10]。
纯度差的计算:
ΔG.P.=清汁的重力纯度-混合汁的重力纯度。
1.4 电镜扫描(SEM)分析
选取最佳工艺制备的壳聚糖磷酸酯糖用澄清剂,用扫描电子显微镜对其进行表面扫描,观察壳聚糖磷酸酯表面形貌情况,对原壳聚糖样品进行扫描电镜分析,以做对比分析。
1.5 傅里叶红外光谱分析
将壳聚糖磷酸酯和壳聚糖进行压片处理后,进行FT-IR扫描,分析其基团结构,得出制备的壳聚糖磷酸酯的基本结构。
2 结果与讨论
2.1 单因素试验结果
2.1.1 甲醛添加比例对澄清效果的影响
固定磷酸与壳聚糖m(H3PO4)∶m(壳聚糖)的添加比例为3.2∶1,微波功率130 W,微波时间9 min,考察甲醛与壳聚糖m(CH2O)∶m(壳聚糖)的添加比例为1∶1,3∶1,5∶1,7∶1,9∶1时,分别探究对试验产生的影响,试验结果见图3。
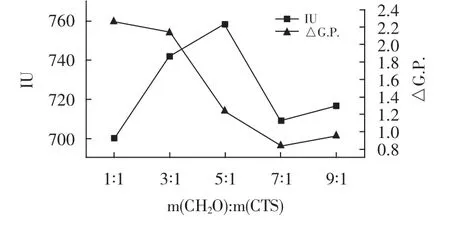
图3 甲醛添加比例对澄清效果的影响Fig.3 Effect of formaldehyde additive ratio on clarification effect
由图3可知,在不同甲醛配比下制备的壳聚糖磷酸酯澄清混合汁时,当甲醛量增加时,清汁纯度逐步降低,色值先增加后减小,当m(CH2O)∶m(壳聚糖)为1∶1时,制备的壳聚糖磷酸酯处理混合汁,色值最低为700 IU,纯度差最高为2.27%,澄清效果最佳,故选取最佳甲醛添加量为m(CH2O)∶m(壳聚糖)为1∶1。
2.1.2 磷酸添加量对澄清效果的影响
固定甲醛与壳聚糖m(CH2O)∶m(壳聚糖)的添加比例为1∶1,微波功率130 W,微波时间9 min,考察磷酸与壳聚糖m(CH2O)∶m(壳聚糖)的添加比例分别为1∶1,3∶1,5∶1,7∶1,9∶1时,探究5个磷酸比例各自对实验产生的影响,试验结果见图4。

图4 磷酸添加比例对澄清效果的影响Fig.4 Effect of phosphoric acid additive ratio on clarification effect
由图4可知,在不同磷酸配比下制备的壳聚糖磷酸酯处理甘蔗混合汁时,清汁纯度随着磷酸量的增加呈现先增加后减小的趋势,而清汁色值随着磷酸量的增加逐步增大,而在m(H3PO4)∶m(壳聚糖)为3.2∶1时,清汁纯度最高,纯度差为2.46%,色值较低为839.29 IU,综合考虑,选取磷酸与壳聚糖添加量:m(H3PO4)∶m(壳聚糖)为3.2∶1。
2.1.3 微波功率对澄清效果的影响
固定甲醛与壳聚糖m(CH2O)∶m(壳聚糖)的添加比例为1∶1,磷酸与壳聚糖m(H3PO4)∶m(壳聚糖)的添加比例为3.2∶1,微波时间9 min,考察微波功率为130,260,390,420,650 W时,对试验产生的影响,实验结果见图5。

图5 微波功率对澄清效果的影响Fig.5 Effect of microwave power on clarification effect
由图5可知,当控制微波功率制备的壳聚糖磷酸酯处理甘蔗混合汁时,澄清效果有所不同,无明显规律,在微波功率为260 W时,清汁色值最低为819.82 IU,纯度最高,纯度差为1.7%,故最佳微波功率为260 W。
2.1.4 微波时间对澄清效果的影响
固定甲醛与壳聚糖m(CH2O)∶m(壳聚糖)添加比例为1∶1,磷酸与壳聚糖m(H3PO4)∶m(壳聚糖)添加比例为3.2∶1,微波功率为260 W,考察微波时间为6,9,12,15,18 min时,对试验产生的影响,实验结果见图6。
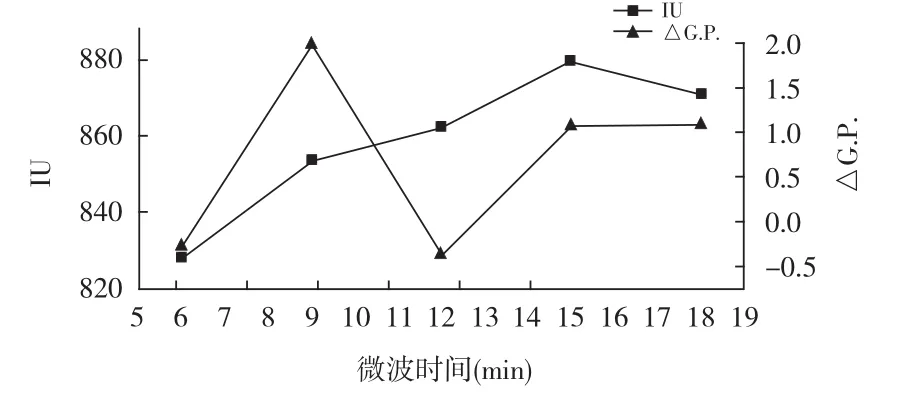
图6 微波时间对澄清效果的影响Fig.6 Effect of microwave time on clarification effect
由图6可知,控制微波时间制备的壳聚糖磷酸酯处理甘蔗混合汁效果存在显著差异,随着微波时间的延长,清汁色值逐步增加,清汁纯度无明显规律,当微波时间为9 min时,清汁纯度最高,纯度差为1.98%,而色值为827.59 IU,与6 min时相比,增加幅度不大,综合考虑,选取微波时间为9 min。
2.2 壳聚糖磷酸酯制备工艺条件的优化结果

表2 正交试验结果Table 2 The results of orthogonal test

表3 正交结果极差分析Table 3 The range analysis of orthogonal results
由表2和表3可知,以清汁色值为考核指标,得到最优试验方案:m(CH2O)∶m(壳聚糖)为1∶1,m(H3PO4)∶m(壳聚糖)为3.2∶1,微波功率260 W,微波时间9 min;以纯度差为考核指标,得到最优试验方案:m(CH2O)∶m(壳聚糖)为1∶1,m(H3PO4)∶m(壳聚糖)为1.6∶1,微波功率390 W,微波时间6 min。考虑到壳聚糖与磷酸的充分反应,将磷酸添加量定为m(H3PO4)∶m(壳聚糖)为1.6∶1,而考虑到反应耗能,将微波功率定为260 W,微波时间定为9 min。
将最佳制备条件下制备的壳聚糖磷酸酯用于混合汁的澄清,通过3次平行实验,得到最终实验结果,清汁纯度提高2.97%,清汁色值为756.52 IU。
2.3 壳聚糖和壳聚糖磷酸酯的电镜扫描(SEM)表征分析
壳聚糖和壳聚糖磷酸酯放大倍数(8000倍)的电镜扫描SEM图见图7。

图7 壳聚糖和壳聚糖磷酸酯的电镜扫描(SEM)图(×8000)Fig.7 SEM photograph of chitosan and chitosan phosphate(×8000)
由图7可知,壳聚糖改性后微观形态发生了较大变化。未改性的壳聚糖为无规则形态,表面粗糙,有较多褶皱,呈现凹凸状。改性后的壳聚糖磷酸酯呈较规则的圆球状,相同放大倍数下,可以看到单个壳聚糖磷酸酯颗粒体积变小,且大小不一,表面有褶皱凸起。规则的圆球状可能与干燥方法有关,本实验干燥方法采用的是喷雾干燥法,颗粒体积变小可能是微波反应使壳聚糖大分子结构发生断裂,颗粒表面凸起说明壳聚糖分子中引入了磷酸基团。
2.4 壳聚糖磷酸酯FT-IR图谱分析[11]

图8 壳聚糖(a)与壳聚糖磷酸酯(b)FT-IR曲线比较图Fig.8 Curve comparison diagram of chitosan(a)and chitosan phosphate(b)on FT-IR
由图8可知,在4000~500 cm-1范围内,壳聚糖磷酸酯的吸收峰与壳聚糖大致类似,同时也存在较多差异。
3437 cm-1处是形成氢键缔合的-OH伸缩振动吸收峰与-NH2的伸缩振动吸收峰重叠的多重吸收峰[12]。
在2875 cm-1处为C-H的伸缩振动吸收峰[13];
1654 cm-1是酰胺弯曲振动吸收峰,根据这2个峰的大小可以判定壳聚糖的脱乙酰化程度。因本实验所用壳聚糖脱乙酰度为78%,故1654 cm-1处的吸收峰相对较小;
1598 cm-1是氨基(-NH2)伸缩振动峰;
壳聚糖红外光谱中1384 cm-1是-CH2-的弯曲振动特征峰;
壳聚糖红外光谱中1076 cm-1是醇羟基特征峰;
壳聚糖红外光谱中616cm-1谱带处于指纹区,无法判断其结构;
壳聚糖磷酸酯的红外图谱与壳聚糖相比,变动较大:3437 cm-1,2875 cm-1处的C-H的伸缩振动吸收发生位移,出现了2950 cm-1新的吸收峰,说明在壳聚糖的羟基、氨基上发生了反应。1598 cm-1处的强氨基吸收峰消失,1634 cm-1处的振动峰明显增强,在1532 cm-1处出现了新的强吸收峰[14]。同时,1076 cm-1处的醇羟基特征峰消失,在941 cm-1,1083 cm-1处出现2个明显强吸收峰,这可能是因为-OH上的氢原子被P所取代,变成了P-O键的特殊伸缩振动和弯曲振动吸收峰,说明壳聚糖磷酸化反应中磷酸基团成功地引入了壳聚糖分子中。
3 结论
对壳聚糖进行磷酸化改性,制备壳聚糖磷酸酯(PCTS),以清汁色值和纯度差为考核指标,通过单因素实验及正交实验优化制备工艺,最终确立壳聚糖磷酸酯糖用澄清剂最佳制备工艺:m(CH2O)∶m(壳聚糖)为1∶1,m(H3PO4)∶m(壳聚糖)为3.2∶1,微波功率为260 W,微波时间为9 min,处理混合汁后清汁纯度提高2.97%,色值为756.52 IU。与亚法澄清生产工艺相比,认为壳聚糖磷酸酯可以取代SO2作为糖用澄清剂。
通过SEM和FT-IR分析,确定改性后的壳聚糖发生了磷酸化反应,反应产物为壳聚糖磷酸酯。改性后的壳聚糖磷酸酯改善了水溶性,将其应用于甘蔗混合汁的澄清,清汁的纯度差、色值等得到明显改善,澄清效果明显优于传统亚硫酸法。本研究为探索无硫工艺新澄清剂提供理论和实践依据[15]。
[1]梁欣泉,何惠欢,谢志荣,等.季铵化壳聚糖糖用澄清剂的制备及结构表征[J].广西大学学报(自然科学版),2014(3):544-551.
[2]钟伟,岑跃,王锐.磷酸上浮工艺技术的应用[J].广西轻工业,2001(1):48-51.
[3]凌国士,郭光海,余华,等.国内亚硫酸法蔗糖生产除杂澄清工艺中的酶制剂应用研究进展[J].轻工科技,2016(12):23-27.
[4]董毅宏,黄世钊,何华柱,等.糖厂锅炉烟道气二氧化碳的富集及其在亚硫酸法制糖澄清工艺的应用[J].广西大学学报(自然科学版),2009(5):631-634.
[5]马如,黄明智.壳聚糖的溶菌酶降解[J].北京化工大学学报(自然科学版),2002,29(6):40-43.
[6]Amaral I F,Granja P L,Barbosa M A.Chemical modification of chitosan by phosphorylation:an XPS,FT-IR and SEM study[J].Journal of Biomaterials Science Polymer Edition,2005,16(12):1575-1593.
[7]谢志荣.糖用改性壳聚糖澄清剂的制备及其应用工艺研究[D].南宁:广西大学,2011.
[8]李利华.正交试验法优化超声辅助提取大蒜多糖工艺[J].中国调味品,2014,39(7):70-73.
[9]王勇,赖伟勇,魏娜,等.单因素和正交试验法优选柠檬草油超临界CO2萃取条件[J].海南医学院学报,2012(3):305,307,309.
[10]李墉,郑长庚.甘蔗制糖化学管理分析方法[M].广州:中国轻工总会甘蔗糖业质量监督检测中心,1995:27-53.
[11]Vineet Bhardwaj,Vikesh Shukla,Narendra Goyal,et al.Formulation and evaluation of different concentration chitosan based periodontal film of ofloxacin[J].Journal of Pharmacy Research,2010,2(3):528-532.
[12]许海峰,周建,波曾.N-亚甲基磷酸壳聚糖有机锡酯的合成、表征及杀螺活性研究[J].精细化工中间体,2011(4):24-28.
[13]赵国骏,姜涌明,孙龙生,等.不同来源壳聚糖的基本特性及红外光谱研究[J].功能高分子学报,1998(3):403-407.
[14]Varma H K,Yokogawa Y,Espinosa F F,et al.Porous calcium phosphate coating over phosphorylated chitosan film by a biomimetic method[J].Biomaterials,1999,20(9):879-884.
[15]何惠欢,谢志荣,刘继栋,等.羧甲基壳聚糖糖用澄清剂的制备及结构表征[J].食品工业科技,2015(6):117-121.
Preparation and Structural Characterization of Chitosan Phosphate as Sugarcane Juice Clarifying Agent
SONG Xiao-rong,REN Qin,FAN Song-lin,ZHANG Jia-xin,LIANG Xin-quan*
(College of Light Industry and Food Engineering,Guangxi University,Nanning 530004,China)
Chitosan has good properties of adsorption,film-forming,fiber-forming,hygroscopicity and biocompatibility.Chitosan is phosphorylated to prepare chitosan phosphate(PCTS).PCTS can improve the water solubility,and it is applied for the clarification of sugarcane mixed juice.With the analysis of orthogonal test,the optimum conditions for the preparation of PCTS are explored by color value and purity difference.The structure is characterized by scanning electron microscope(SEM)and fourier transform infrared spectrum(FT-IR).The results show that under the treatment of microwave power of 260 W,treatment time of 9 min,m(CH2O)∶m(chitosan)of 1∶1 and m(H3PO4)∶m(chitosan)of 3.2∶1,the clarification effect of PCTS is better.The purity difference of clear juice is increased by 2.97%,and the color value is 756.52 IU.Compared with the traditional sulfuric acid method,the clarification effect of PCTS is higher than the traditional sulfuric acid method.The results indicate that PCTS could replace SO2in sugarcane juice clarification to explore the sulfur-free clarification process.
chitosan phosphate;sugarcane juice;color value;puritydifference
TS246.4
A
10.3969/j.issn.1000-9973.2017.10.006
1000-9973(2017)10-0023-06
2017-05-15 *通讯作者
糖蜜酒精精馏过程节能技术开发及应用示范(AE120094);广西区特色本科专业建设项目——食品科学与工程(制糖工程)
宋小荣(1994-),女,重庆人,硕士,研究方向:糖品过程强化理论与技术;梁欣泉(1966-),男,广西南宁人,教授,博士,研究方向:糖品过程强化理论与技术。
