马铃薯内生真菌E02发酵液的化学成分研究
2017-10-18艾洪莲杨会祥王文祥杨曼思郭华春
艾洪莲,杨会祥,王文祥,杨曼思,何 隽,郭华春,*
(1中南民族大学 药学院,武汉430074;2云南农业大学 农学与生物技术学院,昆明 650201)
马铃薯内生真菌E02发酵液的化学成分研究
艾洪莲1,2,杨会祥1,王文祥2,杨曼思2,何 隽1,郭华春2,*
(1中南民族大学 药学院,武汉430074;2云南农业大学 农学与生物技术学院,昆明 650201)
采用硅胶柱色谱、Sephadex LH-20凝胶柱色谱、(半)制备型HPLC等方法从马铃薯内生真菌E02发酵液中分离纯化得到了13个化合物,其结构通过波谱学数据分析分别鉴定为:大黄素-8-单甲醚 (1)、6-羟基芦荟大黄素-8-单甲醚 (2)、1,6-二羟基-3-甲基氧杂蒽酮-8-羧酸酯 (3)、硫赭曲菌素(4)、neuchromenin(5)、柠檬霉素(6)、8-去甲基杜鹃素 (7)、5-羟甲基-2-呋喃甲酸(8)、原儿茶酸(9)、尿嘧啶 (10)、麦角固醇(11)、 (2S,3S,4R,2′R)-2-(2′-羟基二十四碳酰胺)十八烷-1,3,4-三醇(12)和甘露醇(13). 以上化合物均首次从该菌中分离得到.
内生真菌;发酵液;化学成分;结构鉴定
AbstractUsing gel column chromatography, Sephadex LH-20 and (semi-)preparative HPLC,13 compounds were isolated from the fermentation broth of endophytic fungi E02.Their structures were determined to be questin(1), Questinol (2), 1,6-didroxy-3-methylxanthone-8-carboxylate(3), Sulochrin (4), neuchromenin (5), Citromycin (6), 8-demethylfarrerol(7), 5-hydroxymethyl-2-furoic acid(8), protocatechuic acid (9), uracil (10), ergosterol (11), (2S,3S,4R,2′R)-2-(2′-hydroxytetracosanoylamino)octadecane-1,3,4-triol(12), Mannitol (13) on the basis of spectroscopic analysis and comparison with literatures, respectively. All the compounds were isolated from this fungi for the first time.
Keywordsendophytic fungi;fermentation broth;chemical constituents;structural identification
马铃薯(SolanumtuberosumL.)是茄科茄属多年生草本块茎植物,是继水稻、小麦、玉米之后的第四大主粮作物,但在马铃薯栽培过程中各种真菌性病害严重影响了马铃薯产量. 本文选取健康马铃薯植株为材料,分离内生真菌,并采用平板对峙拮抗实验法筛选到一株具有抑制马铃薯枯萎病病原真菌(Fusariumoxysporum)、马铃薯黑痣病病原真菌(Rhizoctoniasolani)和马铃薯早疫病病原真菌(Alternariasolani)的内生真菌E02,通过测序获得的18S rDNA ITS序列进行BLAST(http:// blast. ncbi. nlm. nih. gov/)同源性序列比对分析,将其鉴定为茎点霉属真菌(Phomasp.). 利用反复柱层析及高效液相分析制备后,从该菌的次生代谢产物中分离13个单体化合物,经波谱学(EI-MS,ESI-MS,1D-NMR,2D-NMR等)分析鉴定为大黄素-8-单甲醚 (1)、6-羟基芦荟大黄素-8-单甲醚 (2)、1,6-二羟基-3-甲基氧杂蒽酮-8-羧酸酯 (3)、硫赭曲菌素(4)、neuchromenin(5)、柠檬霉素(6)、8-去甲基杜鹃素 (7)、5-羟甲基-2-呋喃甲酸(8)、原儿茶酸(9)、尿嘧啶 (10)、麦角固醇(11)、 (2S,3S,4R,2′R)-2-(2′-羟基二十四碳酰胺)十八烷-1,3,4-三醇(12)和甘露醇(13)(图1). 所有化合物均为首次从该真菌中分离得到. 本文为研究茎点霉属真菌次生代谢产物抑制马铃薯真菌性病害的作用机制奠定了化学基础.
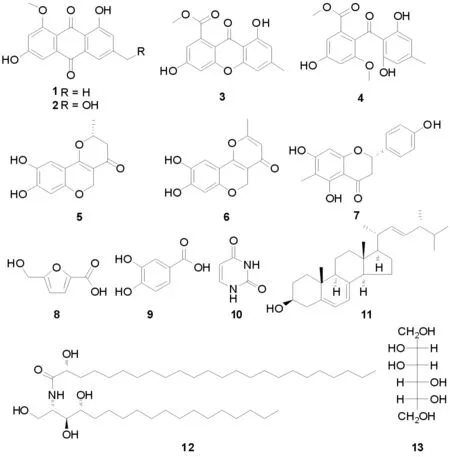
图1 化合物1~13的结构式Fig. 1 Chemical structure of compounds 1-13
1 实验部分
1.1仪器与材料
核磁共振波谱仪(Bruker公司,AM 600型), 其中,1HNMR在500 MHz,400 MHz下测定,13CNMR在125 MHz,100 MHz下测定;Waters Autospec Premier P776质谱仪;API QSTAR Pulsar;Jasco-P-1020旋光仪; Bruker Tensor 27 FT-IR型红外光谱仪;Shimadzu UV-2401PC型分光光度计.
柱色谱材料:柱色谱用硅胶(80~100目和200~300目)与GF254 TLC板(青岛海洋化工厂);Sephadex LH-20(瑞典Amersham Biosciences公司);反相材料Chromatorex (40~75 μm)(日本Fuji Silysia公司);分析型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(4.6 mm×150 mm),粒径5 μm;制备型HPLC为Agilent 1260,色谱柱为Agilent Zorbax SB-C18柱(9.4 mm×150 mm),粒径5 μm. 显色方法为紫外灯下波长254 nm和365 nm处观察荧光,碘蒸气显色及10%硫酸乙醇溶液显色剂加热显色.
1.2真菌发酵培养
采用平皿转摇瓶液体培养的方法. 培养基:葡萄糖5%、猪肉蛋白胨0.15%、KH2PO4和MgSO4各0.05%;培养条件:温度24 ℃,摇床转速160 r/min,暗培养21 d. 过滤后得发酵液21 L.
1.3提取和分离
发酵液浓缩至2 L后,经乙酸乙酯萃取6次,将萃取层合并浓缩;菌丝体经丙酮浸泡3次,过滤合并后浓缩;共得浸膏100 g. 浸膏经反复硅胶柱层析(石油醚→石油醚-乙酸乙酯→氯仿→氯仿-甲醇→甲醇)和Sephadex LH-20凝胶柱层析(氯仿-甲醇1:1和甲醇)分离得化合物(1)~(13).
2 结构鉴定
化合物1分子式C16H12O5,棕褐色针状结晶.1HNMR(DMSO-d6, 500 MHz)δH7.74(1H,d,J=2 Hz),7.20(1H,d,J=3 Hz),7.13(1H,d,J=2 Hz),6.84(1H,d,J=3 Hz),3.89(3H,s),2.49(3H,s). 化合物被确证为大黄素-8-单甲醚.
化合物2分子式C16H12O6,黄色针状结晶.1HNMR(Pyr-d5,500 MHz)δH3.87(3H,s, OCH3),4.56(2H,d,J=5.7 Hz,CH2-OH),6.83(1H,d,J=2.1 Hz,H-7),7.20(2H,d,J=2.1 Hz,H-2和H-5),7.56(1H,s, H-4),11.24(1H,s, ω-OH),13.26(1H,s,α-OH). 以上数据与文献数据基本一致[1]. 通过结合HMBC等其他波谱解析确切结构为6-羟基芦荟大黄素-8-单甲醚.
化合物3分子式C16H12O6,ESI-MS m/z:323(M+Na)+,淡黄色针状结晶.1HNMR(DMSO-d6,500 MHz)δH2.35(3H,s),3.83(3H,s),6.60(2H,s),6.77(1H,d,J=2 Hz),6.84(1H,d,J=2 Hz). 以上氢信号与文献报道基本一致[2].13C和DEPT谱显示有2个甲基,其中一个为典型的甲氧基信号,4个苯环上的次甲基信号,以及10个季碳信号,其中有在低场的两个羰基信号. 结合1H和13C以及HMBC谱可以确定化合物3为1,6-二羟基-3-甲基氧杂蒽酮-8-羧酸酯.
化合物4分子式C17H16O7,成棱形晶体.1HNMR(DMSO-d6,500 MHz)δH11.43(1H, br s, OH),9.98 (1H, br s, OH), 6.88 (1H, d,J=2.0 Hz,H-5),6.66(1H, d,J=2.0 Hz, H-3),6.07 (2H, q,J=0.6 Hz,H-3′, 5′),3.63和3.62(each 3H, s, H3-7, -8), 2.13 (3H, s, H3-7′). 以上数据与文献数据基本一致[3]. 故化合物4的结构确定为硫赭曲菌素.
化合物5分子式C13H12O5,1HNMR(DMSO-d6,500 MHz)δH6.90(1H,s),6.31(1H,s),4.91(2H,d,J=12.0 Hz),4.67(2H,d,J=12.0 Hz),4.64(m),2.55(2H,dd,J=17.0,13.0 Hz),2.49(2H,dd,J=17.0,4.0 Hz),1.45(3H,d,J=6.0 Hz). 以上数据与文献报道数据基本相符[4]. 故化合物5被鉴定为neuchromenin.
化合物6分子式C13H10O5,绿色针状结晶.1HNMR(DMSO-d6,500 MHz)δH6.98(1H,s,H-13),6.36(1H,s,H-10),6.13(1H,s,H-3),4.94(2H,s,H-63),2.30(3H,s,H-1).13C和DEPT谱显示C-1为甲基,C-6为亚甲基,C-3,10,13为次甲基,其余为季碳.13CNMR(125 HMz)δC174.93(C-4),164.55(C-2),155.51(C-7),150.84(C-9),150.49(C-11),140.92(C-12),113.34(C-3),110.27(C-5),108.66(C-13),106.21(C-8),103.97(C-10),62.34(C-6),19.21(C-1). 以上数据与文献数据对比基本一致[5]. 故化合物6为柠檬霉素.
化合物7分子式C16H14O5,白色无定形粉末.1HNMR(Acetone-d6,400 MHz)δ H 7.39(2H,d,J=8.4 Hz,H-2′,6′),6.90(2H,d,J=8.4 Hz,H-3′,5′),6.02(1H,s,H-8),5.42(1H,dd,J=12.8,2.8 Hz,H-2′,3′),3.19(1H,dd,J=17.2,12.8 Hz,H-3a),2.72(1H,dd,J=17.2,2.8 Hz,H-3b),2.08(3H,s,6-CH3). 以上数据与文献报道数据基本一致[6]. 故化合物7被确定为8-去甲杜鹃素.
化合物8分子式C6H6O4.1HNMR (Acetone-d6,500 MHz)δH7.15(1H,d,J=3.4 Hz,H-3),6.46(1H,d,J=3.4 Hz,H-3),4.58(2H,CH2OH). 以上数据与文献报道数据基本一致[7]. 故化合物8为 5-羟甲基-2-呋喃甲酸.
化合物9分子式C7H6O4,白色粉末.1HNMR (CD3OD,500 MHz)δH7.43(1H,d,J=2 Hz,H-2),7.40(1H,dd,J=2,8.5 Hz,H-6),6.79(1H,d,J=8.5 Hz,H-5). 以上数据与文献报道数据基本相同[8]. 故化合物9为原儿茶酸.
化合物10分子式C4H4N2O2.1HNMR(DMSO-d6,500 MHz)δ H 11.01(1H,s,brs,NH-3),10.81(1H,s,brs,NH-1),7.38(1H,d,J=5.9 Hz),5.43(1H,d,J=5.9 Hz). 以上数据与文献报道数据基本一致[9]. 故化合物10为尿嘧啶.
化合物11分子式C28H44O,无色针状结晶. mp.175 ℃,[α]D20-135°(c=1.2,CDCl3),13CNMR(CDCl3,125 MHz)δC141.31(C-8),139.71(C-5),135.54(C-22),132.00(C-23),119.59(C-6),116.30(C-7),70.40(C-3),55.78(C-17),54.55(C-14),46.27(C-9),42.82(C-13和C-24),40.81(C-4),40.35(C-20),39.09(C-12),38.37(C-1),37.04(C-10),33.08(C-25),32.00(C-2),28.20(C-16),22.07(C-15),21.09(C-11和 C-21),19.96(C-26和C-27),17.58(C-28),16.25(C-19),12.03(C-18). 以上数据与文献报道的ergosterol相符合[10]. 故化合物11确定为麦角固醇.
化合物12分子式C42H85NO5,白色无定形粉末(丙酮), m.p.139~141 ℃(文献值 140~142 ℃). 在1HNMR和13CNMR谱中,出现了两个末端甲基信号δH0.87(t,J=6. 7 Hz,6H)和δH1.26~1.31强质子信号推测有两个脂肪烃烷基单链,出现δH8.59(1H, d,J=8.8 Hz,NH)和δC175.42(C-1′,CONH),出现δH5.15(1H, m,H-2)和δC53.12 (CHNH,C-2)及连氧碳信号δC62.12(C-1),76.92(C-3),73.12(C-4),72.62(C-2′)显示有酰胺键和多羟基存在. 通过以上波谱数据与文献[11]的数据比较,化合物12的结构确定为(2S,3S,4R,2′R)-2-(2′-羟基二十四碳酰氨基)十八碳-1,3,4-三醇.
化合物13分子式C6H16O,白色粉末,m.p.130~132 ℃.1HNMR (DMSO-d6,500 MHz)δH3.59(2H,dd,J=10.8,3.6 Hz),3.58(2H,d,J=8.0 Hz),3.54(1H,dd,J=6.0,3.6 Hz)3.52(1H,dd,J=8.0,3.6 Hz)3.50(2H,dd,J=10.8,6.0 Hz).13CNMR(DMSO-d6,125 MHz)δC70.71(C-3,4),69.15(C-2,5),63.14(C-1,6),DEPT谱显示C-2,3,4,5为CH,C-1,6为CH2. 以上数据与文献报道数据基本相同[12]. 故化合物13确定为甘露醇.
3 结语
内生真菌(Endophytic Fungi) 普遍存在于植物中,是生活在植物组织内的一类微生物,具有分布广、种类多的特点. 内生菌在植物微生态系统中,与宿主建立了长期和谐的共生关系. 其次生代谢产物十分丰富(如萜类、生物碱类、酯类、黄酮类、醌类和蒽衍生物、甾体类等),并且具有抗菌、抗肿瘤、抗病毒、杀虫、调节免疫及促进植物生长等生物活性,是筛选生物活性成分或先导化合物的有效途径之一. 在医药领域和农药领域植物内生菌是目前研究的热点. 本文采用多种柱层析手段对内生真菌E02发酵液的次生代谢产物进行分离,并利用多种现代波谱手段确定了13个化合物,为后续研究内生真菌E02次生代谢产物抑制马铃薯枯萎病、马铃薯黑痣病和马铃薯早疫病的作用机制奠定了化学基础.
[1] 刘振丽, 李林福, 巢志茂, 等. 何首乌炮制后化学成分的研究[J]. 天然产物研究与开发, 2009, 21(2): 239-241, 248.
[2] Hamasaki T, Kimur Y. Isolation and structures of four new metabolites fromAspergilluswentii[J]. Agric Biol Chem, 1983, 47 (1), 163-165.
[3] Hargreaves J, Park J O, Ghisalberti E L, et al. New chlorinated diphenyl ethers from anAspergillusspecies[J]. J Nat Prod, 2002, 65(1):7-10.
[4] Gao J M, Dong Z J, Liu J K. A new ceramide from the basidiomyceteRussulacyanoxanthan[J]. Lipids, 2001, 36(2):175-180.
[5] 元 超, 李 刚, 吴长生, 等. 地衣内生菌Myxotrichumsp.的代谢产物的研究[J]. 天然产物研究与开发, 2014, 26(4):513-516,560.
[6] 李干鹏, 罗 阳, 李尚秀, 等. 小叶杜鹃花的化学成分研究[J].中草药,2014,45(12):1668-1672.
[7] Matsui T, Kudo A, Tokuda S, et al. Identification of a new natural vasorelaxatant compound,(+)-Osbeckic acid, from rutin-free tartary buckwheat extract[J]. J Agric Food Chem, 2010, 58(20):10876-10879.
[8] Miyazawa M, Oshima T, Tokura M, et al. Suppression of chemical mutagens-induced SOS response by phenolic acids from black rice bran usingSalmonellatyphimuriumTA1535/pSK1002 umu test[J]. J Oleo Sci, 2003, 52(9):471-481.
[9] Ding Z G, Zhao J Y, Yang P W, et al.1H and13C NMR assignments of eight nitrogen containing compounds fromNocardiaalbasp. nov (YIM 30243T)[J]. Magn Reson Chem, 2011, 47(4): 366-370.
[10] Smith W B. The carbon-13 spectra of steroids on the way to ecdysone[J]. Organic Magnetic Resonance, 1977, 9(11):644-648.
[11] Hayakawa Y, Yamamoto H, Tsuge N, et al. Structure of a new microbial metabolite, neuchromenin[J]. Tetrahedron Letters, 1996, (37)35:6363-6364.
[12] 汤海峰, 易杨华, 姚新生, 等. 褐藻果叶马尾藻化学成分的研究[J]. 中国海洋药物杂志, 2002, 21(6):11-15.
StudiesontheChemicalConstituentsfromEndophyticFungifromSolanumtuberosum
AiHonglian1,2,YangHuixiang1,WangWenxiang2,YangMansi2,HeJuan1,GuoHuachun2
(1College of Pharmacy, South-Central University for Nationalities, Wuhan 430074, China; 2 College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China)
O692.3;Q946.88
A
1672-4321(2017)03-0039-04
2017-05-24 *
陈雪娇,研究方向:心血管药物的筛选及其作用机制,E-mail: chenxuejiao@mail.kib.ac.cn
收稿日期2017-07-18 *通讯作者郭华春,研究方向:马铃薯栽培与推广应用,E-mail:ynghc@126.com
艾洪莲(1981-),女,讲师,博士,研究方向:民族药用植物学,E-mail:2015050@mail.scuec.edu.cn
国家自然科学基金地区科学基金资助项目(31560010),中南民族大学基本科研业务费专项资金项目(CZY16010,CZW17094,CSP17067)
