箬竹叶氯仿部提取物对小鼠气管平滑肌的舒张作用及其机理
2017-10-18沈金花谭鸿浩
沈金花,谭鸿浩,雷 骏
(中南民族大学 生命科学学院,医学生物研究所,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
箬竹叶氯仿部提取物对小鼠气管平滑肌的舒张作用及其机理
沈金花,谭鸿浩,雷 骏
(中南民族大学 生命科学学院,医学生物研究所,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
使用高钾溶液(80 mmol/L KCl)和乙酰胆碱(100 μmol/L ACh)对小鼠离体气管环进行了预处理诱导气道异常收缩,进而研究了箬竹叶氯仿部提取物(CEIT)对气管的舒张作用及其机理.结果表明:CEIT能够抑制高钾和ACh诱导的预收缩,且呈剂量依赖性. 此外,CEIT阻断了VDCCs电流,抑制了细胞外Ca2+内流. 在ACh诱导的收缩反应中,不仅VDCCs通道参与其中,还有其他离子通道的参与. CEIT能够抑制NSCCs通道,从而抑制内钙释放.CEIT能够通过阻断VDCCs通道和NSCCs通道抑制外钙内流和细胞内钙释放,从而舒张小鼠气管平滑肌.提示CEIT中的活性成分可以作为一种治疗气道异常收缩的药物.
箬竹叶氯仿部提取物;气管平滑肌;电压依赖型钙离子通道;非选择性阳离子通道
AbstractTo investigate whether chloroform extracts from leaves ofIndocalamustessellatus(CEIT) could relax precontracted airway smooth muscle and its mechanism, 80 mmol/L KCl and 100 μmol/LACH were used to induce abnormal contraction of airway smooth muscle. Results: The precontracted mouse ASM could be relaxed by CEIT in a concentration-dependent manner. Besides, CEIT could block VDCCs to restrain Ca2+influx. In the precontraction induced by ACh, there might be other channels involved except VDCCs.CEIT could block NSCCs to restrain the release of intracellular calcium. Conclusions: CEIT can relax the precontracted airway smooth muscle by blocking the VDCCs and NSCCs, which suppressed the cytoplasm Ca2+increase. These data suggested that CEIT might be potential drugs for the treatment of abnormal airway smooth muscle contraction.
KeywordsChloroform extracts from leaves ofIndocalamustessellatus;airway smooth muscle;voltage-dependent calcium channel; non-selective cation channel
哮喘是严重威胁人类健康的慢性疾病之一,其主要特征为气道平滑肌收缩性增强、气道高反应以及气道重塑[1].当哮喘发作时,气道会异常收缩,导致气道狭窄,引起呼吸不适,威胁人类生命安全[2, 3].缓解哮喘发作症状,常常要吸入β2肾上腺素激动剂[4],但是由于副作用较大,长期使用会影响心血管功能. 亟待寻找一种有效且毒副作用小的药物,用于治疗气道的异常收缩.
箬竹(Indocalamustessellatus)是禾本科竹亚科箬竹属植物. 箬竹叶中所含化学成分主要为黄酮、茶多酚和可溶性糖类[5].目前,还尚未有相关文献报道箬竹叶或箬竹叶活性成分用于气管平滑肌上的研究.本文拟提取箬竹叶氯仿部提取物,检测其中是否有活性物质可以舒张异常收缩的气管平滑肌.
1 实验材料与方法
1. 1实验材料
1.1.1 试剂和仪器
箬竹叶(采于湖北利川县),经中南民族大学生命科学学院刘虹副教授鉴定为箬竹(Indocalamustessellatus)的叶子.
高钙溶液(2 Ca2+PSS):NaCl 135 mmol/L、KCl 5 mmol/L、CaCl22 mmol/L、Glucose 10 mmol/L、HEPES 10 mmol/L、MgCl2·6H2O 1 mmol/L,调pH值至7.42.无钙溶液(0 Ca2+PSS):NaCl 135 mmol/L、KCl 5 mmol/L、EGTA 0.5 mmol/L、Glucose 10 mmol/L、HEPES 10 mmol/L、MgCl2·6H2O 1 mmol/L,NaOH调pH值至7.42.Ca2+母液:CaCl2120 mmol/L.高钾溶液:KCl 4 mol/L.ACh:100 mmol/L.rTASM解离液:NaCl 120 mmol/L、KCl 5.2 mmol/L、MgCl21.2 mmol/L、NaHCO325 mmol/L、KH2PO40.6 mmol/L、CaCl20.1 mmol/L、D-glucose 11 mmol/L、HEPES 10 mmol/L,调pH值至7.40.细胞外液:NaCl 105 mmol/L、CsCl 6 mmol/L、BaCl227.5 mmol/L、Glucose 11 mmol/L、HEPES 10 mmol/L、TEA-Cl 10 mmol/L,调pH值至7.40.电极内液:CsCl 130 mmol/L、EGTA 10 mmol/L、MgCl24 mmol/L、MgATP 4 mmol/L、HEPES 10 mmol/L,调pH值至7.20.
酶溶液I:木瓜蛋白酶 3 mg/mL,DTT 0.15 mg/ mL,BSA 1 mg/mL;酶溶液II:胶原蛋白酶H 1 mg/mL,BSA 1 mg/mL.
离体组织器官恒温灌流系统(HV-4,成都泰盟科技有限公司),生物机能实验系统(BL-420S,成都泰盟科技有限公司),张力换能器(JH-2,航天医学工程研究所),膜片钳放大器(HEKA,EPC-10,德国Lambrecht),玻璃微电极(外径1.4 mm,南京泉水教学实验器材厂),中草药粉碎机(天津市秦斯特仪器有限公司).
1.1.2 实验动物
雄性BALB/C小鼠,SPF级,平均年龄6~8周,购自湖北省疾病预防控制中心.在控温、控湿的条件下,自由饮水进食.动物实验和处理均遵照《中南民族大学实验动物使用与福利指导手册》.
1.2箬竹叶氯仿部提取物的制备
新鲜叶片晒干,粉碎成粉末.称取250 g室温下浸泡于85%的乙醇溶液5000 mL中.浸泡液加热至85 ℃,回流3 h,过滤取上清液,重复上述步骤,直至将所有的浸泡液提取完.合并上清液,减压蒸干,得到乙醇浸膏.
将乙醇浸膏用1000 mL超纯水溶解完全,加石油醚萃取,每次300 mL,总共3次,弃掉石油醚部,留下水部加入氯仿萃取3次,每次300 mL.合并氯仿部溶液,旋转蒸发仪蒸干,获得箬竹叶氯仿部提取物.真空干燥,干重约为原材料的0.32 %.将箬竹叶氯仿部提取物(Chloroform extracts from leaves ofIndocalamustessellatus,CEIT)溶解于10% DMSO中,调pH值至7.40.
1.3小鼠离体气管环的处理与上样
断颈法处死小鼠.取出主气管及肺组织,于预冷的PSS溶液中去除食管,结缔组织和脂肪组织,最后靠近气管三角区取5 mm左右的气管.将气管环挂到张力换能系统上,置于含有6 mL PSS液并持续通氧的水温37 ℃的恒温水浴槽内.气管环前负荷设置为300 mg,每15 min更换一次PSS溶液,连续4次.平衡60 min后,用80 mmol/L KCl或100 μmol/L ACh预刺激3次,使气管环处于最佳收缩状态,洗脱后恢复至基线,让组织休息30 min后开始实验[6, 7].
1.4小鼠气管平滑肌细胞的制备
颈部脱臼处死小鼠后,迅速取出小鼠气管,置于含rTASM解离液的解剖皿中,分离出主气管及支气管后,沿肌条与软骨环的连接处剪开,去除软骨组织.将呈“Y”型的肌条放入35 ℃预热10 min的酶Ⅰ中消化22 min,然后转入35 ℃预热10 min的酶Ⅱ中消化8 min,用BSA清洗2次,转入含300 μL BSA的EPP管,打散后置于冰上备用[7, 8].
1.5全细胞电流记录
通过EPC-10膜片钳放大器检测全细胞VDCC电流.钳制电压为-70 mV,维持50 ms,给予细胞去极化阶刺激1000 ms,刺激电压从-70 mV逐渐增加至+40 mV,每10 s增加10 mV,拾取步阶脉冲电流信号.
使用EPC-10膜片钳放大器测得NSCCs电流.采用全细胞记录方式来记录乙酰胆碱诱导的NSCCs电流.溶液中游离的Ca2+浓度约为70 nmol/L,通过WEBMAX计算符合标准.溶液中预先加入了硝苯地平(Nifedipine),尼氟酸(Niflumic acid)和四乙胺(TEA),用来排除VDCCs电流、K+电流和Cl-电流的影响.细胞钳制电压为-60 mV,在ramp条件下,从-80 mV到+60 mV用时500 ms.
数据用Patchmaster软件导出,Origin8分析作图.
2 结果与分析
2.1 CEIT对高钾诱导的预收缩的气管平滑肌的舒张作用
CEIT可以剂量依赖性地抑制高K+诱导的气管收缩,收缩被抑制一半时的浓度(IC 50)为1.99 mg/mL,最大舒张值为98.61±3.62%.硝苯地平是一种VDCCs的选择性阻断剂,10 μmol/L硝苯地平可以完全阻断80 mmol/L的高K+诱导的气管收缩.CEIT抑制气管收缩的同时对静止张力无影响.
2.2 CEIT抑制高K+引起的Ca2+内流
细胞外无Ca2+时,高K+无法引起气管环收缩,当胞外存在Ca2+时,能引起气管环收缩,3 mg/mL CEIT可抑制此收缩.当用3 mg/mL CEIT孵育气管时,高K+引起的收缩并没有被观察到(图1).故CEIT舒张高K+诱导预收缩的气管平滑肌是通过抑制VDCCs介导的Ca2+内流引起的.
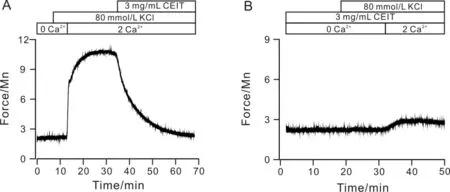
图1 CEIT抑制高K+引起的Ca2+内流Fig.1 CEIT blocks high K+-evoked Ca2+ influx
2.3 CEIT阻断VDCCs电流
在没有硝苯地平或者CEIT存在的情况下,单个气管平滑肌细胞在不同电压梯度刺激下的VDCCs电流(Ba2+作为载体电荷),电流呈先增大后减小趋势;当加入10 μmol/L硝苯地平或者3 mg/mL CEIT后,电流被抑制(图2).提示CEIT可能与硝苯地平作用类似,CEIT能够阻断VDCCs的电流.
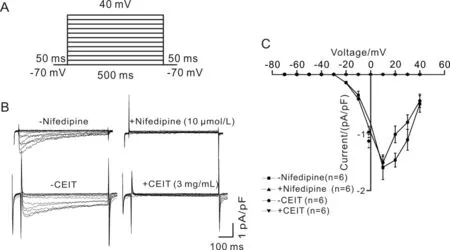
图2 CEIT阻断VDCCs电流Fig.2 CEIT blocks VDCCs currents
2.4 CEIT对ACh诱导的预收缩的气管平滑肌的舒张作用
乙酰胆碱(ACh)可以激活电压依赖型钙离子通道(VDCCs)和非选择性阳离子通道(NSCCs),调控细胞外Ca2+进入胞质中和肌浆网中Ca2+释放到胞质中,使得胞质中Ca2+浓度增加[9].CEIT呈剂量依赖性地抑制ACh诱导的气管收缩,收缩被抑制一半时的浓度(IC50)为2.13 mg/mL,最大舒张值为97.51 %±3.97%(图3).
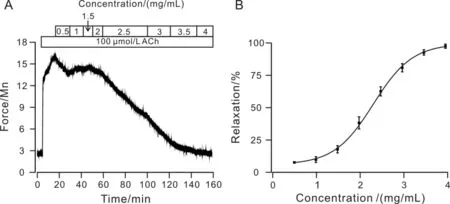
图3 CEIT舒张ACh诱导的预收缩的气管平滑肌Fig.3 CEIT inhibits ACh-induced precontraction
用硝苯地平抑制VDCCs通道,使胞质中Ca2+浓度有所下降,因此出现部分舒张(23.26%±2.17%),再加入4 mg/mL CEIT后,基本能完全舒张气管(97.57%±2.86%)(图4 A).当硝苯地平存在的条件下,ACh仍然能引起气管环的收缩,说明ACh能激活其他通道使胞内Ca2+浓度升高,这种收缩能被CEIT抑制,舒张百分比达到95.07%±6.48%(图4 B).故CEIT还抑制其他的通道参与气管环的舒张.
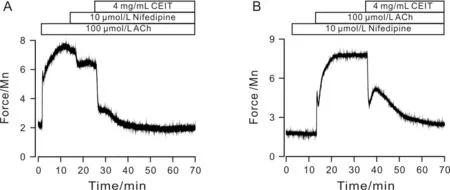
图4 排除VDCCs通道后,CEIT仍能舒张气管平滑肌Fig.4 CEIT can also relax precontracted airway smooth muscle even without VDCCs
2.5 CEIT抑制ACh引起的内钙释放
在零钙条件下,加入ACh,由于细胞外无Ca2+进入,但会引起肌浆网中Ca2+的瞬时释放,引起一个瞬时的收缩(图5).当细胞外Ca2+浓度恢复后,胞外Ca2+和肌浆网中Ca2+共同作用使胞质中Ca2+浓度增加,因而气管会出现一个持续而稳定的收缩,而该收缩能被4 mg/mL CEIT抑制,最大舒张达到91.15%±10.49%.
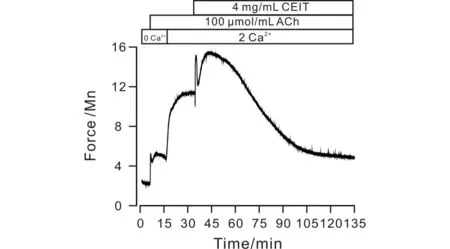
图5 CEIT抑制ACh引起的内钙释放Fig.5 CEIT inhibits release of intracellular calcium induced by ACh.
2.6 CEIT抑制NSCCs电流
用膜片钳技术测量单个气管平滑肌细胞的NSCCs电流.预先加入硝苯地平、尼氟酸和四乙胺以排除VDCCs电流、K+电流、Cl-电流的影响.在-80 mV~ +60 mV的ramp条件下记录ACh引起的NSCCs电流(图6),发现在-70 mV的条件下,4 mg/mL CEIT可以阻断NSCCs电流.
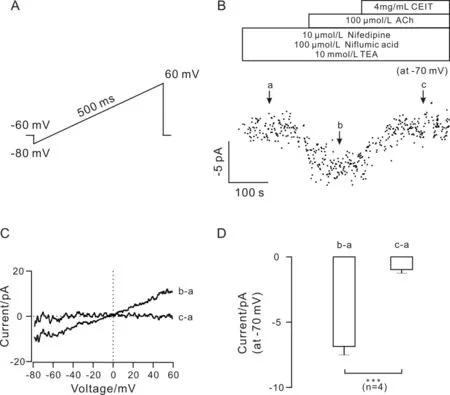
图6 CEIT抑制NSCCs电流Fig.6 CEIT blocks NSCCs currents
3 结语
箬竹叶氯仿部提取物能引起预收缩的小鼠气管平滑肌舒张是通过阻断VDCCs通道和NSCCs通道使胞质中Ca2+浓度下降来实现的.首先,用激动剂高K+模拟哮喘患者发病时异常收缩的气管,结果发现CEIT可以完全舒张预收缩的气管.进一步研究发现CEIT是通过抑制Ca2+内流来舒张气管平滑肌.单细胞离子通道验证发现CEIT可以完全阻断VDCCs电流.ACh可以同时激活VDCCs和NSCCs两种离子通道,综合作用使得细胞胞质内Ca2+浓度升高,使气管平滑肌收缩.研究发现CEIT可以完全舒张由ACh预收缩的气管平滑肌.用VDCCs通道的特异性阻断剂硝苯地平来排除VDCCs通道的影响,发现CEIT仍然能舒张余下部分的收缩.此外,CEIT可以阻断NSCCs电流.综上所述,CEIT可以阻断VDCCs通道和NSCCs通道来舒张预收缩的气管平滑肌.因此,箬竹叶中的活性成分将来有望作为一种潜在的气管扩张剂用于治疗气道异常收缩相关疾病.
[1] Katsumoto T R, Kudo M, Chen C, et al.The phosphatase CD148 promotes airway hyperresponsiveness through SRC family kinases[J].Journal of Clinical Investigation, 2013, 123:2037-2048.
[2] Postma D S,Kerstjens H A.Characteristics of airway hyper- responsiveness in asthma and chronic obstructive pulmonary disease[J].American Journal of Respiratory and Critical Care Medicine,1998,158:S187-192.
[3] West A R, Syyong H T, Siddiqui S, et al.Airway contrac- tility and remodeling: links to asthma symptoms[J].Pulmonary Pharmacology & Therapeutics.2013, 26:3-12.
[4] Han M K, Martinez F J.Pharmacotherapeutic approaches to preventing acute exacerbations of chronic obstructive pulmonary disease[J].Proceedings of the American Thoracic Society,2011, 8:356-362.
[5] 苏春花, 刘国华, 王福升,等.箬竹叶片活性成分的季节变化[J].应用生态学报, 2011, 22( 9) : 2471-2476.
[6] Liu Q H, Zheng Y M, Korde A S,et al.Protein kinase C-epsilon regulates local calcium signaling in airway smooth muscle cells[J].American Journal of Respiratory Cell and Molecular Biology.2009, 40:663-671.
[7] Zhang T, Luo X J, Sai W B,et al.Non-selective cation channels mediate chloroquine-induced relaxation in precontracted mouse airway smooth muscle[J].PLoS One,2014, 9:E101578.
[8] Liu Q H, Zheng Y M, Korde A S,et al.Membrane depolarization causes a direct activation of G protein-coupled receptors leading to local Ca2+release in smooth muscle[J].Proc Natl Acad Sci USA,2009, 106:11418-11423.
[9] Fleischmann B K, Wang Y X, Kotlikoff M I.Muscarinic activation and calcium permeation of nonselective cation currents in airway myocytes[J].American Journal of Physiology Cell,1997, 272:C341-349.
RelaxantActionofChloroformExtractsfromLeavesofIndocalamustessellatusonMouseAirwaySmoothMuscle
ShenJinhua,TanHonghao,LeiJun
(Institute for Medical Biology & Hubei Provincial Key Laboratory for Protection and Application of Special Plant Germplasm in Wuling Area of China, College of Life Sciences, South-Central University for Nationalities,Wuhan 430074, China)
Q474;R734.2
A
1672-4321(2017)03-0027-04
2017-03-31
沈金花(1975-), 女, 教授, 研究方向:疾病相关基因的功能, E-mail:shenjinhua2013@163.com
国家自然科学基金资助项目(81170227);湖北省自然科学基金重点资助项目(2012FFA028)
