miRNA-155的免疫调控功能及其在水产动物中的研究进展
2017-10-16谭旭恺李玉琴付京花唐雪莲徐民俊
谭旭恺, 姚 亚, 李玉琴, 付京花, 唐雪莲, 徐民俊
(华南农业大学 海洋学院, 广州 510642)
miRNA-155的免疫调控功能及其在水产动物中的研究进展
谭旭恺, 姚 亚, 李玉琴, 付京花, 唐雪莲, 徐民俊
(华南农业大学 海洋学院, 广州 510642)
microRNA(miRNA)是一类具有调控功能的非编码RNA,通常靶向mRNA的3′非编码区(3′-UTR),形成诱导沉默复合体而发挥调节靶基因的作用。miR-155的功能与免疫调控密切相关,其对免疫细胞包括树突状细胞、巨噬细胞、B细胞与T细胞的分化及功能均有着不可替代的调控作用。在miRBase中收录的miR-155物种有25种,从腔肠动物到人类等高等动物都有分布,其中水产动物就有6种,包括大西洋鲑、斑马鱼、斑点叉尾鮰、大宗鲇、锦鲤等。就miR-155免疫调控功能、靶基因研究及其在水产领域的研究进展进行综述,以期为miR-155功能研究提供参考。
靶基因;miR-155;免疫调控; 水产动物
AbstractmicroRNA (miRNA) is a class of non-coding RNA, which usually regulates target genes by bonding with the 3′noncoding region (3′UTR) of mRNA and forms an induced silence complex. There is an intimate connection between miR-155 and immunity. Also, miR-155 plays irreplaceable role in differentiation and function of immune cells, including dendritic cells, macrophages, B cells and T cell. There are collected 25 kinds of miR-155 species in miRBase datebase, ranging from coelenterate to human being and other higher animals. Among them there are six kinds of aquatic animals, including the Atlantic salmon, zebrafish, spot fork tail madtoms, catfish, and brocade carp, etc. For providing references for the study of the function of miR-155, we reviewed the immune function of miR-155, the progress of its target genes and the researches in aquatic animals.
Keywordstarget genes; miR-155;immune regulation; aquatic animals
miRNA是一类种子区高度保守的非编码核糖核酸,长度约为22~24个核苷酸,其作用方式是在转录后水平通过碱基互补配对来识别靶基因mRNA,并通过mRNA降解或者抑制其翻译来调节靶基因的表达。miRNA是基因表达的重要因子,它们在动物、植物及病毒中大量存在,是基因表达、转录和翻译的调节者,在细胞增殖、细胞分化、细胞凋亡及新陈代谢等过程中扮演着重要的角色,而宿主免疫反应调节是其中一项重要内容[1]。根据miRBase数据库研究表明,约30%的真核生物基因受到miRNA的调控,它们在组织器官发育、细胞分化凋亡及免疫功能调控等各种生命活动过程中发挥着重要作用[2]。miRNA形成起始于细胞核中,由RNA聚合酶II(poly II)的加工形成初级转录产物。接着初级转录产物被核酸酶Drosha-DGCR8复合物剪切修饰成70~90 nt大小的前体miRNA(pre-miRNA),然后在Exportin5的作用下从细胞核中转运出来,接着在Dicer酶的进一步加工包装后形成成熟miRNA,长度约为20~22 nt。成熟miRNA在形成RNA沉默复合体(RISC)之后,与目标mRNA碱基完全或不完全互补配对而发挥作用[3]。Lee等[4]在线虫研究中遗传发育第一次发现miRNA(lin-4),此后,miRNA的功能研究逐渐成为热点。
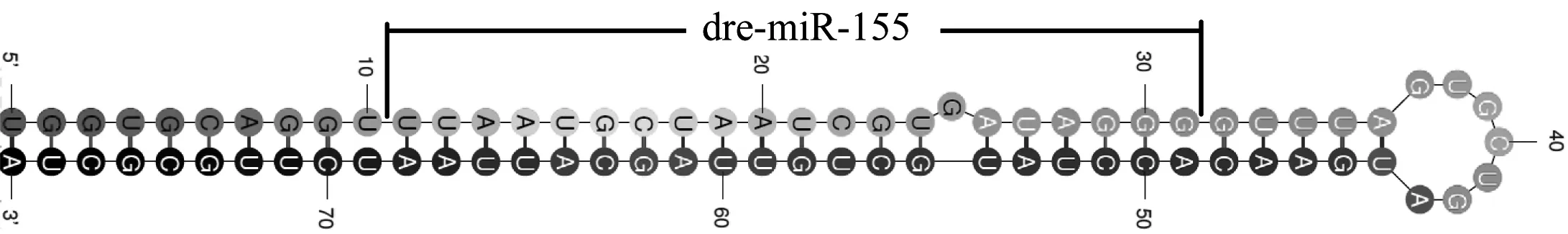
图1模式生物斑马鱼miR-155前体的二级结构
Fig 1 Secondary structure of miR-155 in model organism of zebrafish
1 miR-155的基本特征
人类的 miR-155一般处于B 细胞非编码集合基因簇(B cell integration clustor,BIC)中,BIC 是一个不含开放读码框的基因,专门对非翻译区RNA进行编码。成熟的 miR-155 单链序列为5′-UUAAUGCUAAUCGUGAUAGGGG-3′,可以调节上百种潜在的靶基因(图1)。鉴于其不可替代的重要性,miR-155在生物进化中极其保守,其序列在水产动物、两栖动物和哺乳动物等序列基本没有大的变化,种子区(2~8碱基)呈现非常一致的保守性,只在第12位出现 C-U 颠换,及末尾处出现U碱基的添加或减少,而这些位置的变化并不影响 miRNA 的调控功能(表1)。同其它miRNA一样,miR-155 也是通过作用于靶基因 mRNA 的3′非翻译区降解靶基因或阻止其翻译[5]。迄今为止,越来越多的证据揭示miR-155 涉及的大量生理和病理过程中,主要包括炎症反应、抗原呈递、T 细胞分化、细胞因子产生等免疫过程[6]。

表1 miR-155在不同物种中的遗传变异比对分析
2 miR-155与免疫调控
2.1 miR-155与非特异性免疫
非特异性免疫可以对有害物质的入侵立即产生反应,成为抵抗外来病原体感染的首次防御措施。非特异性免疫防线通过各种通路能及时激活并有效地消除威胁和修复组织损伤。模式识别受体(PPRs)控制的先天免疫反应具有准确、有效的特点。PPR激活后的转录开关受细胞外环境中输入信号的触发,一旦触发,信号将被转换成一组基因表达的变化,可将细胞充分调整为对待危险信号的特定“危险”状态。除了这种免疫反应方式之外,miRNA结合靶基因调节方式也是一种重要的免疫反应[7]。
Li等[8]在研究唐氏综合征中发现miR-155上调的时候,先天免疫调节蛋白补体因子(complementfactorH,Cfh)下调,而Cfh是先天免疫系统的一个重要抑制剂,抑制因子的下调意味着相关基因表达量的提高。在此研究中,21号染色体上编码的miR-155显著上调,这有可能归因于21号染色体基因的剂量效应,而Cfh的表达明显下调。因此,唐氏综合征中miR-155的表达上调会降低机体的先天性免疫。Schulte等[9]研究发现人体巨噬细胞被(Lipopolysaccharides,LPS)刺激后, Toll样受体4(TLR4)首先被激活,TLR4的激活导致激活核转录因子(NF-κB),再导致NF-κB靶向不同的炎症调节因子,包括细胞因子,急性蛋白和诱导酶等。随后发现miR-155靶向TLR4下游信号通路并和NF-κB共同加强固有免疫。Pareek等[10]在研究miR-155对日本脑炎病毒(JEV)的影响时发现,人类胶质细胞的miR-155会负性调节JEV诱导的固有免疫基因表达,而且miR-155在抑制胶质细胞JEV方面会起到有利的作用。综合在此方面的研究可以看出,miR-155确实在非特异性免疫中以多种途径发挥着重要作用。
2.2 miR-155与树突状细胞
miR-155与树突状细胞(DC)的分化、凋亡及代谢有着密切的联系。在成熟的DC中,一旦受到抗原刺激,DC就开始了成熟过程且形成具有功能特色的细胞,比如产生细胞因子或者结合抗原并呈递的能力上调[11]。其激活原理主要包括两条途径:第一条途径是通过MyD88-IRAK-TRAF6通路导致IKK、JNK和p38MAPK等因子兴奋。第二种途径则涉及Toll样受体1,主要包含诱导因子IFN-β(TRIF)和IRF3,这将导致干扰素IFN的表达和刺激分子的上调[12]。两条通路都需要一定量的NF-κB刺激并涉及细胞因子如IL-12或IL-1β的产生。研究表明,miRNA在人类DCs调节IL-1信号通路过程中扮演着重要的角色,作为可以直接通过靶向TLR/IL-1信号的承接分子。这种现象与在人类单核细胞中所观察的结果一样[13]。Ceppi[14]在用LPS刺激人类原始DC,发现在LPS刺激后miR-155表达量上调。并且证明miR-155直接靶向调节Tab2的 mRNA,Tab2作为一个多功能信号分子,促进IL-1独立和TRAF6等因子的泛素化,集合IL-1的信号及JNK,P38和NF-κB的激活。实验结果阐明miR-155在人类DCs的炎症微调反应中起重要作用。同样,也有研究表明miR-155的过表达会引起人类DC的凋亡反应[15]。
2.3 miR-155与B淋巴细胞
在B细胞中,miR-155通过作用于不同靶基因(如Aid、Pu.1)的方式影响其分化及功能。在miR-155缺失的小鼠中淋巴母细胞和B细胞在数量上明显减少,产生抗体的能力下降且记忆B细胞减少[16]。Pu.1是Ets(E26 transformation-specific)转录因子之一,miR-155通过靶向Pu.1的3′UTR区来抑制该基因表达,以防Pu.1作用于IgG1以致抗体数量减少。Aid是参与抗体类型转换和高位突变的重要酶类之一,也是miR-155的靶基因之一,会导致B细胞产生多种类型抗体。同时,B细胞在AID作用下发生渐进式突变,产生编码不同抗体的B细胞,从而完成抗体种类转换重组过程,最后产生出不容易对自身产生免疫对抗但具有高亲和力的B细胞[17]。
研究表明,在即将坏死的B细胞中miR-155和BIC中会累积过多,而miR-155过量表达会引发肿瘤。Ship1是miR-155的靶基因,且在B细胞活化中扮演着重要角色。Ship1缺陷会导致小鼠B细胞的数量大大地减少,以致抗体类型转换和生发中心形成均受到影响。且研究者对白血病细胞(Chronic lymphocytic leukemia,CLL)进行miR-155过表达后,Ship1表达量下调,B细胞抗原受体(BCR)结合的反应性及敏感性则明显增强[18]。总而言之,由于miR-155对B淋巴细胞的调控机制非常复杂,目前研究者们也在不断努力阐明其作用方式。
2.4 miR-155与T淋巴细胞
T 细胞主要有辅助性 T 细胞(CD4+T细胞)和杀伤性 T 细胞(CD8+T细胞)之分。CD4+T 细胞主要可分化为 Th1 细胞与Th2细胞两种,由 Th1 细胞分泌的大部分是炎症因子,如 IFN-γ、IL-2、TNF-β 等因子。然而Th2细胞功能主要是对体液免疫反应进行辅助,且分泌 IL-4、IL-5和IL-10 等因子。有研究表明在敲除miR-155 的小鼠中,Th0 型淋巴细胞趋向于向 Th2 型分化,其原理可能是 IL-4 启动子区可以被C-maf调控,而miR-155 调控转录因子C-maf 的表达。因此 miR-155 可通过调控C-maf 进而达到调控 IL-4 的表达。miR-155 缺失导致 IL-4 增多从而导致 Th2 型细胞增多[19]。然而有研究者[20]通过实验发现 miR-155 在作用于靶基因Socs1后,进而激活JAK/STAT信号通路,且大大提高炎症因子的释放机会,最终导致 Th1 细胞型反应明显增强。又有研究者称,miR-155 可作用于CD4+T 细胞而引起对 IFN-γ的信号阻断,使 Th0 细胞更多的分化为Th1细胞[21]。
调节性T 细胞(Treg)是 CD4+T 细胞的另一个亚群,它们的功能是维持免疫耐受能力。Kohlhaas 等[22]通过敲除基因的方法认为 miR-155 能促进 Treg 的增殖和分化,且对Treg 的免疫功能没有影响。Foxp3作为一个转录因子,能够与miR-155 的mRNA结合来调节Treg 的表达。另外,miR-155 还可以通过作用于Socs1来调控 Treg 的增殖和分化。当病原体刺激机体且结合TLR 信号通路后,体内miR-155表达量迅速上升来调节炎症反应并增强免疫反应。对 CD8+T 细胞而言,miR-155 的缺失会导致在小鼠受到病原体刺激时,CD8+T细胞迅速减少且抗病力减弱[23]。而且 miR-155 缺失会损害 CD8+T 细胞的各种调节功能。然而,miR-155 的过量表达又会累积 CD8+T 的细胞效应[24]。此外,通过miR-155 缺失实验发现miR-155 可以通过对干扰素调节来影响体内CD8+T 细胞积累效应。以上研究证明 miR-155 在T淋巴细胞中扮演着重要的作用。
3 miR-155与靶基因
miR-155靶基因数量和种类都非常丰富。在小鼠髓样细胞中,许多基因包括Bach1,Sla,Cutl1,Csf1r,Jarid2,Cebpβ,Arntl,Hif1α和Picalm等均已经被证明是miR-155的靶基因[25]。并且Cutl1和Cebpβ同时被证明在人类树突状细胞中也是miR-155的靶基因。在小鼠B淋巴细胞中,Pu.1和Aid被证明是miR-155的靶基因,对激活的B细胞进行基因表达分析,结果显示miR-155调节着一系列不同功能的基因[26]。Dorsetty[27]等研究者实验发现miR-155可以通过作用于靶基因AID作为一个肿瘤抑制因子来减少潜在的肿瘤异位。另外有研究表明, miR-155通过作用于靶基因C-maf来激活CD4+T细胞。如前文所述,C-maf是IL-4启动子强有力的反式激活因子,并导致减弱Th2细胞体内的反应[28]。
Socs1 已被实验证实是 miR-155的靶基因。在 CD8+T 细胞中,miR-155的缺失会造成Socs1 的积累,并通过信号通路 STAT5 引起细胞因子的缺失。SOCS-1 作为 CD8+T 的一个关键调节因子可以被用于加强调制免疫疗法,以应对传染性疾病和癌症[29]。Yang[30]等研究者证实Esat-6 会通过靶向miR-155-Socs1 的一个交互作用来促进巨噬细胞的凋亡。另外有研究发现Ship-1基因在 MDSC(髓源性抑制细胞)中作为 miR-155 的一个靶基因,尤其在 MDSC 复制增多的时候更加明显[31]。有趣的是,miR-155被报道有通过靶向一些特定基因(Ikkε,Myd88,Tab2,Traf6和Irak1)减弱NF-κB通路的活性,且这些基因基本被证实都是 miR-155 的靶基因[10]。总之,越来越多的基因被发现并被证实是 miR-155 的靶基因,且很多靶基因在免疫方面发挥着巨大作用。
4 miR-155与水产动物
4.1 miR-155在水产动物中的表达鉴定
在水产动物中对于 miR-155的功能研究总体还未太深入,相关报道较少。但关于miR-155在水产动物中表达鉴定等研究也是常见的,且报道的常见物种包括斑马鱼、对虾、青鳉鱼、大西洋庸鲽、鲤鱼、鲶鱼、牙鲆和石斑鱼和罗非鱼[32]。有研究对鲤鱼脾脏中保守miRNA 预测靶基因的GO富集分析显示,发现鲤鱼中miR-155相对于其他动物高度保守,且在许多动物中已证实miR-155与免疫功能相关[33]。刘欣等[34]利用第二代测序技术对日本七鳃鳗(Lampetrajaponica)白细胞的小RNA进行了高通量测序,鉴定miR-155在水产动物物种间具有保守性且其表达丰度高于1000个拷贝数,推测miR-155在日本七鳃鳗免疫系统中起重要作用。Zhang等[35]用高通量测序技术分析在日本比目鱼宿主和病毒中miRNA,发现miR-155在病毒感染14 d后明显上调,且认为miR-155在比目鱼的免疫方向,细胞凋亡中发挥作用。在对大黄鱼的全基因组鉴定及miRNA与其靶基因认证时,miR-155 序列被认定在各物种及鱼类中高度保守且具有系统发生性,并且认为miR-155与miR-223和miR-460家族在大黄鱼生理功能方面有着相似的作用[36]。Zhou等[37]为探究杂交鲤的杂交优势对进行转录组测序,发现miR-155作为非叠加表达基因与杂家鲤免疫调节和生长息息相关。
4.2 miR-155在水产动物中的功能研究
Dang 等[38]发现 miR-155 在鱼类细胞系中能很好地协助细胞抑制真鲷虹彩病毒的复制,且通过抗病毒因子IFN 及相关通路来效诱导抗病毒反应。Huang 等[39]在研究 miRNA-155 对氟虫腈作用下斑马鱼 ZF4 细胞存活的影响时,证实cyb561d2 是 miR-155 的一个靶基因。且 miR-155 参与由氟虫腈产生的毒理学反应,其表达程度能够检测出ZF4死亡率,因此可能成为研究致癌物质对生物体作用方式的新方法。同时,相似研究表明,在氟虫腈的作用下 miR-155 表达上调,靶基因Uhrf1表达下调;UHRF1蛋白表达量随miR-155 表达的增加而减少,miR-155 可能对Uhrf1 的表达有负调控作用。miR-155 对Uhrf1 的调控作用的研究对毒理学、生物医学等领域具有重要意义[40]。
近年来,高通量测序被广泛应用,Wang 等[32]对用感染乳链球菌尼罗罗非鱼进行测序,发现罗非鱼在感染 0~12 h 后脾脏中 miR-155 表达下调;而在48 h和72 h后,miR-155 在脾脏中又显著上调。GO 分析显示 miR-155 与信号转导和免疫反应有着密切的联系,且其靶基因如Tlr4、Tnf相关蛋白都被富集在免疫 GO 条目,与 miR-146及miR-125 等 miRNA 都参与到由细菌感染引起的机体免疫保护反应,和炎症反应。Najib 等[41]用出血性病毒感染牙鲆,且对感染后不同时间段进行转录组测序。结果发现与未感染病毒牙鲆相比,感染组 miR-155 在感染24 h后表达量上调 14.4 倍,在72 h后表达量上调36.1倍。而且预测miR-155在牙鲆中的靶基因有补体C9、Hsp90-α和Hsp90-β。由此可以得知,miR-55 在鱼类有细菌及病毒引起的免疫反应中都能扮演重要的角色。
另外,研究者用聚肌胞苷酸刺激鮸鱼并对其转录组进行测序分析,结果发现刺激后的鮸鱼体内 miR-155 表达量显著升高,其靶基因Nlrx1 表达量下降。然而,Nlrx1 是一条病毒免疫反应信号通路(RLR)上的抑制因子,所以 miR-155 间接激活了 RLR 信号通路[42]。Gan 等[43]用草鱼幼鱼口服苯乙烷 56 d后对其转录组进行测序分析,结果显示在服用56 d苯乙烷后 miR-155 表达量显著上调,并且有研究者证实鱼类暴露于苯乙烷会引起氧化应激[44]。有趣的是,Tang 等[45]在鲫鱼中也发现 miR-155 由于氧化应激反应而显著变化,而且在肝脏中 miR-155 上调导致羟基数量减少和过氧化氢酶活性升高。这些研究足以证实miR-155 在鱼类免疫反应、氧化应激反应及监测毒理反应中有着积极调节作用。然而,Jiang 等[46]在用 LPS 刺激团头鲂并对其测序研究免疫相关 miRNA 时,发现有许多与免疫相关的miRNA 上调,例如miR-217, miR-181c, miR-138, miR-148, miR-125b和miR-152。但是miR-155在刺激组与对照组中并没有显著的变化,研究者认为还需对其深入研究。总之,miR-155 在水产动物研究虽然较少,但也有证据证明它与水产动物的免疫功能存在着紧密的联系。
5 小结与展望
综上所述,miR-155 在免疫细胞的免疫应答等调控中扮演着重要角色,并且越来越多的靶基因被证明参与到由 miR-155 引导的免疫调控,而大量的靶基因与机体免疫功能密切相关。然而 miR-155 作为免疫应答反应的一个重要因子,其功能并未得到全面的诠释,尤其是在免疫性调控的作用途径及机制尚未完全清楚。随着对人类和其他高等动物的 miR-155 功能研究的深入,水产动物 miRNA 研究必将成为研究热点。因此,miR-155 在免疫研究方面有着巨大的发展空间,很可能为免疫领域的相关研究带来巨大突破。
[1]GRACHOW B, KIRIAKIDOU M. MicroRNA-21 deficiency protects from lupus-like autoimmunity in the chronic graft-versus-host disease model of systemic lupus erythematosus [J]. Clinical Immunology, 2016, 162: 100-106.
[2]CHEN X, XIA J, XIA Z, et al. Potential functions of microRNAs in starch metabolism and development revealed by miRNA transcriptome profiling of cassava cultivars and their wild progenitor [J]. BMC Plant Biology, 2015, 15 (1): l-33.
[3]SZABO G, CSAK T. Role of microRNAs in NAFLD/NASH [J]. Digestive Diseases and Sciences, 2016 , 61 (5): 1314-1324.
[4]LEE R C, FEINBAUM R L, AMBROS V. TheC.elegansheterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14 [J]. Cell, 1993, 75 (5): 843-854.
[5]BARTEL D P. MicroRNAs: target recognition and regulatory functions [J]. Cell, 2009, 136 (2): 215-233.
[6]VIGORITO E, KOHLHAAS S, LU D, et al. miR‐155: an ancient regulator of the immune system [J]. Immunological Reviews, 2013, 253 (1): 146-157.
[7]CARDOSO A L, GUEDES J R, DE LIMA M C. Role of microRNAs in the regulation of innate immune cells under neuroinflammatory conditions [J]. Current Opinion in Pharmacology, 2016, 26: 1-9.
[8]Ll Y Y, ALEXANDROV P N, POGUE A I, et al. miRNA-155 upregulation and complement factor H deficits in Down′s syndrome [J]. Neuroreport, 2012, 23 (3): 168-173.
[9]SCHULTE L N, WESTERMANN A J, VOGEL J. Differential activation and functional specialization of miR-146 and miR-155 in innate immune sensing [J]. Nucleic Acids Research, 2013,41(1): 542-553.
[10]PAREEK S, ROY S, KUMARI B, et al. MiR-155 induction in microglial cells suppresses Japanese encephalitis virus replication and negatively modulates innate immune responses [J]. Journal of Neuroinflammation, 2014, 11: 90-97.
[11]LIND E F, MILLAR D G, DISSANAYAKE D, et al. miR-155 upregulation in dendritic cells is sufficient to break tolerance in vivo by negatively regulating SHIP1 [J]. The Immunology, 2015, 195(10): 4632-4640.
[12]KUPPERS R. IRAK4 inhibition to shut down TLR signaling in autoimmunity and MyD88-dependent lymphomas [J]. The Journal of Experimental Medicine, 2015, 212 (13): 2184.
[13]JIA S, ZHAI H, ZHAO M. MicroRNAs regulate immune system via multiple targets [J]. Discovery Medicine, 2014 , 18 (100): 237-247.
[14]CEPPI M, PEREIRA P M, DUNAND-SAUTHIER I, et al. MicroRNA-155 modulates the interleukin-1 signaling pathway in activated human monocyte-derived dendritic cells [J]. Proceedings of the National Academy of Sciences, 2009, 106 (8): 2735-2740.
[15]LENG R X, PAN H F, QIN W Z, et al. Role of microRNA-155 in autoimmunity [J]. Cytokine & Growth Factor Reviews, 2011, 22 (3): 141-147.
[16]CREPEAU R, USHERWOOD E. MicroRNA-155 plays a critical role in the establishment of latency in murine γ-herpesvirus infection (VIR1P. 1148) [J]. The Journal of Immunology, 2015, 194(s1): 25.
[17]TENG G, HAKIMPOUR P, LANDGRAF P, et al. MicroRNA-155 is a negative regulator of activation-induced cytidine deaminase [J]. Immunity, 2008, 28 (5): 621-629.
[18]CUI B, CHEN L, ZHANG S, et al. MicroRNA-155 influences B-cell receptor signaling and associates with aggressive disease in chronic lymphocytic leukemia [J]. Blood, 2014, 124 (4): 546-554.
[19]ROUQUETTE-JAZDANIAN A K, KORYUM R L, LI W, et al. miR-155 controls lymphoproliferation in lat mutant mice by restraining t-cell apoptosis via SHIP-1/mTOR and PAK1/FOXO3/BIM pathways [J]. PloS One, 2015, 10 (6): e0131823.
[20]TAMIYA T, KASHIWAGI I, TAKAHASHI R, et al. Suppressors of cytokine signaling (SOCS) proteins and JAK/STAT pathways regulation of T-cell inflammation by SOCS1 and SOCS3 [J]. Arteriosclerosis Thrombosis and Vascular Biology, 2011, 31(5): 980-985.
[21]BANERJEE A, SCHAMBACH F, DEJONG C S, et al. Micro-RNA-155 inhibits IFN-γ signaling in CD4+T cells [J]. European Journal of Immunology, 2010, 40: 225-231.
[22]LU L F, THAI T H, CALADO D P, et al. Foxp3-dependent microRNA155 confers competitive fitness to regulatory T cells by targeting SOCS1 protein [J]. Immunity, 2009, 30 (1): 80-91.
[23]LIND E F, ELFORDA R, OHASHI P S. Micro-RNA 155 is required for optimal CD8+T cell responses to acute viral and intracellular bacterial challenges [J]. The Journal of Immunology, 2013, 190 (3): 1210-1216.
[24]GRACIAS D T, STELEKATI E, HOPE J L, et al. The microRNA miR-155 controls CD8+T cell responses by regulating interferon signaling [J]. Nature Immunology, 2013, 14 (6): 593-602.
[25]O′CONNELL R M, RAO D S, CHAUDHURI A A, et al. Sustained expression of microRNA-155 in hematopoietic stem cells causes a myeloproliferative disorder [J]. The Journal of Experimental Medicine, 2008, 205 (3): 585-594.
[26]HUFFAKER T B, O′CONNELL R M. miR-155-SOCS1 as a functional axis: satisfying the burden of proof [J]. Immunity, 2015, 43 (1): 3-4.
[27]DORSETT Y, MCBRIDE K M, JANKOVIC M, et al. MicroRNA-155 suppresses activation-induced cytidine deaminase-mediated Myc-Igh translocation [J]. Immunity, 2008, 28 (5): 630-638.
[28]CORTINAS-ELIZONDO F, VON GUNTEN S. MicroRNA‐155: microtuning the allergic concert [J]. Allergy, 2015, 70 (9): 1035-1036.
[29]JI Y, GATTINONI L. miR-155 releases the brakes on antitumor T cells [J]. OncoImmunology, 2015, 4 (8):e1026533.
[30]YANG S, LI F, JIA S, et al. Early secreted antigen ESAT-6 ofMycobacteriumtuberculosispromotes apoptosis of macrophages via targeting the MicroRNA155-SOCS1 interaction [J]. Cellular Physiology and Biochemistry, 2015, 35 (4): 1276-1288.
[31]CHEN S, ZHANG Y, ZHANG B. MicroRNA-155 regulates tumor myeloid-derived suppressive cells[J]. Oncoscience, 2015, 2(11):910-911.
[32]WANG B, GAN Z, CAI S, et al. Comprehensive identification and profiling of Nile tilapia (Oreochromisniloticus) microRNAs response toStreptococcusagalactiaeinfection through high-throughput sequencing [J]. Fish & Shellfish Immunology, 2016, 54: 93-106.
[33]陈功义, 赵银丽, 李国喜, 等. 鲤鱼脾脏中保守 miRNA 的鉴定 [J]. 中国生物化学与分子生物学报, 2015,31 (6): 636-644.
[34]刘 欣, 张 洁, 赵春晖, 等. 日本七鳃鳗物种特异性 microRNAs及其前体识别与验证 [J]. 遗传, 2015, 37 (3): 283-291.
[35]ZHANG B C, ZHANG J, SUN L. In-depth profiling and analysis of host and viral microRNAs in Japanese flounder (Paralichthysolivaceus) infected with megalocytivirus reveal involvement of microRNAs in host-virus interaction in teleost fish [J]. BMC Genomics, 2014 ,15 (1):878.
[36]HUANG Y, CHENG J H, LUO F N, et al. Genome-wide identification and characterization of microRNA genes and their targets in large yellow croaker (Larimichthyscrocea)[J]. Gene, 2016, 576(1): 261-267.
[37]ZHOU Y, REN L, XIAO J, et al. Global transcriptional and miRNA insights into bases of heterosis in hybridization of Cyprinidae [J]. Scientific Reports, 2015, 5: 13847.
[38]DANG L T, KONDO H, AOKI T, et al. Engineered virus-encoded pre-microRNA (pre-miRNA) induces sequence-specific antiviral response in addition to nonspecific immunity in a fish cell line: convergence of RNAi-related pathways and IFN-related pathways in antiviral response [J]. Antiviral Research, 2008, 80 (3): 316-323.
[39]HUANG H, ZHANG K, ZHOU Y, et al. MicroRNA‐155 targets cyb561d2 in zebrafish in response to fipronil exposure [J]. Environmental Toxicology, 2014, 31 (7): 877-886.
[40]张 杰, 张 凯, 李鹿丰, 等. 农药氟虫腈作用下斑马鱼miR-155对 UHRF1 的调控作用 [J]. 浙江理工大学学报, 2013, 30 (6): 891-895.
[41]NAJIB A, KIM M S, CHOI S H, et al. Changes in microRNAs expression profile of olive flounder (Paralichthysolivaceus) in response to viral hemorrhagic septicemia virus (VHSV) infection[J]. Fish & Shellfish Immunology, 2016, 51: 384-391.
[42]HAN J, XU G, XU T. The miiuy croaker microRNA transcriptome and microRNA regulation of RIG-I like receptor signaling pathway after poly (I: C) stimulation [J]. Fish & Shellfish Immunology, 2016, 54: 419-426.
[43]GAN L, XIONG Y, DONG F, et al. Profiling kidney microRNAs from juvenile grass carp (Ctenopharyngodonidella) after 56 days of oral exposure to decabromodiphenyl ethane [J]. Journal of Environmental Sciences, 2016, 44:69-75.
[44]FENG M, LI Y, QU R, et al. Oxidative stress biomarkers in freshwater fishCarassiusauratusexposed to decabromodiphenyl ether and ethane, or their mixture[J]. Ecotoxicology, 2013, 22(7): 1101-1110.
[45]TANG X L, FU J H, LI Z H, et al. Effects of a dietary administration of purple coneflower (Echinaceapurpurea) on growth, antioxidant activities and 8 miRNAs expressions in crucian carp (Carassiusauratus) [J]. Aquaculture Research, 2016, 47(5): 1631-1638.
[46]JIANG Y H, TANG L L, ZHANG F Y, et al. Identification and characterization of immune-related microRNAs in blunt snout bream,Megalobramaamblycephala[J]. Fish & Shellfish Immunology, 2016 , 49: 470-492.
The progress of miRNA-155 immune regulation function and its application in aquatic animals
TAN Xu-kai, YAO Ya, LI Yu-qin, FU Jing-hua, TANG Xue-lian, XU Min-jun
(College of Marine Sciences, South China Agricultural University, Guangzhou 510642, China)
Q52
A
2095-1736(2017)05-0083-06
2016-09-09;
2016-09-22
国家自然科学基金(31302213);广东省科技计划项目(2015A020209103)
谭旭恺,硕士,研究方向为水产动物营养与饲料,E-mail:xukaitan@163.com
徐民俊,副教授,研究方向为水产动物功能基因组学,E-mail:xuminjun@scau.edu.cn
doi∶10.3969/j.issn.2095-1736.2017.05.083
