藏北高寒草地土壤磷脂脂肪酸指纹特征及其与土壤化学性质的关系
2017-10-16马书琴王小丹王荷张蓓蓓陈有超鲁旭阳
马书琴,王小丹,王荷,张蓓蓓,陈有超,鲁旭阳
藏北高寒草地土壤磷脂脂肪酸指纹特征及其与土壤化学性质的关系
马书琴1,2,王小丹1*,王荷3,张蓓蓓3,陈有超1,2,鲁旭阳1
1. 中国科学院水利部成都山地灾害与环境研究所山地表生过程与生态调控重点实验室,四川 成都 610041;2. 中国科学院大学,北京 100049;3. 陕西省灾害监测与机理模拟重点实验室//宝鸡文理学院地理与环境学院,陕西 宝鸡 721013
微生物是土壤的重要组成部分,反映了土壤的生物活性,同时也是土壤有机质和养分转化与循环的动力。高寒草地是藏北高原分布面积最大的生态系统类型,不仅是亚洲中部高寒环境中最为典型的自然生态系统之一,而且在世界高寒地区亦具有代表性。为了解藏北不同类型高寒草地土壤微生物群落结构特征,比较了藏北5种高寒草地(高寒草甸、高寒草原、高寒草甸草原、高寒荒漠草原和高寒荒漠)的土壤磷脂脂肪酸(PLFA)指纹特征,并进一步分析其与土壤有机碳、总氮等土壤化学性质的关系。藏北5种高寒草地土壤PLFA中16:0和18:1w9c含量高,土壤PLFA主要包括直链饱和脂肪酸、直链单不饱和脂肪酸、支链饱和脂肪酸和环丙烷脂肪酸,其中直链单不饱和脂肪酸(27.77%~36.66%)和支链饱和脂肪酸(30.15%~36.61%)占比较高,环丙烷脂肪酸(3.48%~10.16%)仅占较少部分。高寒草甸土壤总 PLFA含量、细菌、真菌、放线菌、革兰氏阴性菌和革兰氏阳性菌 PLFA 含量最高,其含量分别是其他 4种草地类型土壤的 2.00~6.45,2.01~8.88,1.82~3.52,1.61~5.37,2.01~9.17和2.06~10.94倍。大部分PLFA分子集中于高寒草甸、高寒草原和高寒草甸草原土壤中,另外两种高寒草地土壤仅含少量微生物;土壤微生物在5种类型草地中的样点基本分散,而在每种类型草地样点中基本集中,表明微生物群落结构在不同草地类型土壤中存在明显差异,而在同一类型草地土壤中相近。土壤总PLFA,细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌PLFA含量与土壤有机碳、总氮、铵态氮和硝态氮之间存在极显著相关性(P<0.01),表明土壤碳、氮含量与土壤微生物间存在极为显著的相互刺激关系。该研究通过量化藏北不同类型高寒草地土壤的PLFA指纹特征,并分析其与土壤化学性质的关系,为进一步研究高寒草地生态系统土壤微生物群落结构特征提供理论依据。
土壤微生物;磷脂脂肪酸;高寒草地;土壤有机碳;硝态氮;铵态氮
土壤微生物是土壤生态系统的重要组成部分(文都日乐等,2010),反映了土壤的生物活性,同时也是土壤有机质和养分转化与循环的动力(Creamer et al.,2015),在草地的物质循环和能量转化中起重要作用(Fang et al.,2010)。土壤微生物是土壤有机质中最活跃的生命体,其数量和种类都十分丰富,主要包括细菌、放线菌、真菌、藻类和原生动物等(Garcia-Pausas et al.,2011)。土壤微生物只占总有机碳的一小部分,但是在全球碳氮循环中起关键作用(Phillips et al.,2012),主要负责有机质分解、控制氮吸收和释放(Coleman et al.,2005;Yanardağ et al.,2017)。土壤微生物在土壤生物活性、土壤结构形成、有机质周转、营养循环、土壤可持续发展过程中具有重要作用(Smith et al.,2014),因此,土壤微生物群落结构组成与活性是衡量土壤肥力的重要指标(Chu et al.,2007)。土壤微生物对环境变化敏感(张莉等,2012),可以较早地反映生态系统功能变化,可以用于评价草地土壤质量等(赵帅等,2011)。
土壤微生物物种多样性的研究方法主要有磷脂脂肪酸(PLFA)(王鸽等,2006;Frostegård et al.,2011)、DNA(李超等,2015)、Biolog(汤朋先等,2016)、平板培养法(黄祖新等,2011)等。PLFA是活体微生物细胞膜的恒定组分(姚晓东等,2016),具有结构多样性和生物学特异性,对环境因素敏感,可在生物体外迅速降解(Yannikos et al.,2014),因此特定菌群PLFA数量变化可反映出原位土壤真菌、细菌等活体生物量与菌群结构(李俊等,2016)。PLFA法由于具有对试验条件要求低、测试功能多和稳定性好等优点而被广泛应用于微生物群落结构研究(方圆等,2017)。
青藏高原是全球变化的敏感区域(姚檀栋,2010),过去几十年以来,在全球气候变暖的背景下,藏北高原增温明显(杨春艳等,2014)。藏北地区位于青藏高原腹地(熊定鹏等,2016),是全球中低纬度冰冻圈最发育的地区,其环境极其脆弱,对全球变化和人类活动的响应高度敏感(王建林等,2014)。藏北高原生态系统与环境关系以其自身的临界性和生物独特的适应机理为基本特征,在严酷的气候条件下,生态系统处于脆弱平衡的临界状态(赵玉红等,2016),环境变化的微小波动都可能打破这种平衡,从而导致地表生态系统格局及其对环境适应方式的改变。藏北高原特殊的环境造就了适应寒冷的多年生草本植物群落,主要包括以矮嵩草(Kobresia humilis)、紫花针茅(Stipa purpurea)、藏沙蒿(Artemisia wellbyi)等为主要建群种的不同高寒草地植被类型(顾振宽等,2012)。本研究通过应用PLFA法研究藏北5种高寒草地生态系统(高寒草甸、高寒草原、高寒草甸草原、高寒荒漠草原和高寒荒漠)土壤微生物群落结构特征及其与土壤有机碳、总氮等土壤性质的关系,为进一步研究高寒草地生态系统特征提供理论依据。
1 研究地区与研究方法
1.1 研究区概况及试验设计
青藏高原是全球高寒地区生物多样性研究中心,其中藏北地区位于冈底斯山与念青唐古拉山之间,平均海拔超过4500 m(Hong et al.,2014),是长江、怒江等江河的发源地(武建双等,2009)。研究区属亚寒带气候,气候寒冷干燥(高清竹等,2005),大部分地区年平均气温低于 0 ℃,最暖月均温不及 14 ℃,最冷月均温-10 ℃以下(熊定鹏等,2016)。65%~85%的年降水量集中在植物生长旺盛的6—8月(武建双等,2012)。高寒草地是该区域面积最大和最重要的生态系统类型,主要包括高寒草甸、高寒草原、高寒草甸草原、高寒荒漠、高寒荒漠草原5种地带性高寒草地生态系统类型。
2016年8月,选择典型高寒草地分布区域,在面积较大的高寒草甸、高寒草原和高寒荒漠草原各布设5个样点,在面积较小的高寒草甸草原和高寒荒漠各布设3个样点,共布设21样点(图1)。在每个样点选取3个1 m×1 m样方,用铁铲挖取具有完整根系的土体(土体体积以根系范围而定),先轻轻抖落不含根系的土壤,然后用力将根表面附着的土壤全部抖落下来,并装入塑封袋内。土壤样品分为2份,一份过0.25 mm筛后风干,用于测土壤基本理化性质;另一个土壤混匀并过 2 mm筛后4 ℃冷藏,用于测定磷脂脂肪酸。
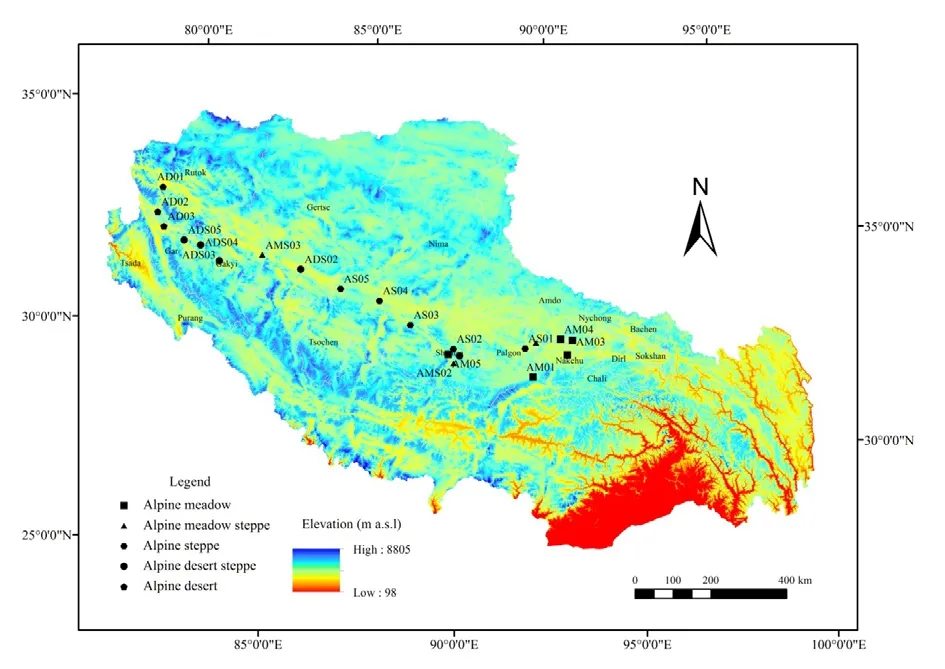
图1 藏北高寒草地21个采样点分布图Fig. 1 21 sampling points of grassland in North Tibet
1.2 土壤化学性质和PLFA测定
土壤化学性质的测定:采用常规分析法测定(鲍士旦,2000)。土壤铵态氮(NH4+-N)以及硝态氮(NO3--N)采用离子色谱仪测定;土壤总有机碳(TOC)采用重铬酸钾氧化-外加热法测定;土壤全氮(TN)采用元素分析仪测定;pH值采用酸度计法。
PLFA分析方法如下:称取相当于8.0 g干土的新鲜土样,采用 Bligh-Dyer法通过氯仿-甲醇-柠檬酸缓冲液振荡提取总脂,经硅胶柱层析分离得到磷脂脂肪酸,将得到的磷脂脂肪酸甲酯化,然后采用HP6890—HP5973型气相色谱质谱联用仪(GC-MS)进行磷脂脂肪酸的组成分析(牛磊等,2015;王曙光等,2004)。检测中升温程序:进样后在50 ℃持续1 min,之后以12 ℃∙min-1的速率升至180 ℃,停留2 min后以6 ℃∙min-1的速率升至220 ℃,保持2 min后以15 ℃∙min-1的速率升至240 ℃,停留1 min后以 15 ℃∙min-1的速率升至最终的温度260 ℃,并停留15 min。气相色谱-质谱的连接温度是280 ℃,以高纯氦气(1 mL∙min-1)作为载气。质谱仪分析采用电子电离的方式,电子能量是 70 eV。PLFA的定性分析依据质谱标准图谱和已有相关方面的报道,以正十九烷脂肪酸甲酯为内标物进行定量计算。
1.3 数据分析
采用以下原则命名PLFA(张莉等,2012):(1)用X:YwZ(c/t)表示脂肪酸分子式(X表示脂肪酸分子的碳原子总数,Y表示不饱和烯键的数目,w表示烯键距离羧基的位置,Z表示烯键或环丙烷链的位置);(2)前缀i(iso)和a(anteiso)分别表示异构甲基支链(距甲基端的第 2个碳原子)和前异构甲基支链(距甲基端的第3个碳原子);(3)后缀c和t分别表示顺式和反式同分异构体,cy表示环丙基支链。PLFA可以作为微生物生物量和群落结构变化的生物标记分子,从而构建土壤微生物PLFA指纹特征。如细菌的标记物:14:0、i15:0、16:1w9、i17:0、cy17:0等;真菌的标记物:18:2w6, 9t、18:1w9t、18:2w9, 12等;放线菌的标记物:10Me18:0、9Me15:0、14Me18:0等;革兰氏阳性细菌标记物:i15:0、a15:0、i16:0等;革兰氏阴性细菌标记物:16:1w9、18:1w12、cy17:0 等(Moore-Kucera et al.,2007);以14:0、15:0、16:0等之和计为一般饱和脂肪酸;以 16:1w9c、18:1w9c、17:1w8c等之和计为单链不饱和脂肪酸;以 i13、i14、i15、a15、a17等之和计为支链不饱和脂肪酸;以cy17:0、cy19:0w8c等之和计为环丙烷脂肪酸;各PLFA含量的加和表示微生物总量(Kramer et al.,2008)。
运用 PCORD 5(MjMSoftware,Gleneden Beach,Ore.)软件对微生物群落结构进行非线性多维度分析(non-meric multidimensional scaling,NMDS)。采用单因素方差分析(One-way ANOVA)检验不同草地类型土壤化学性质和PLFA含量的差异,并采用Duncan法进行多重比较。采用Pearson相关系数分析土壤化学指标和 PLFA含量的相关性。以上统计分析在 SPSS 20.0(International Business Machines Corporation,Unite States)中进行,并运用Sigmaplot 10.0(Systat Software,Inc.,Germany)作图。
2 结果与分析
2.1 不同高寒草地生态系统土壤化学性质
不同高寒草地类型土壤基本化学性质呈现一定的规律性,其中,高寒草甸土壤总有机碳、总氮、铵态氮和硝态氮含量最高,分别是(34.97±2.89)g∙kg-1、(1.18±0.24) g∙kg-1、(0.87±0.10) mg∙kg-1和(38.77±6.66) mg∙kg-1;高寒草原次之,分别是(17.26±2.48) g∙kg-1、(0.75±0.14) g∙kg-1、(0.48±0.07)mg∙kg-1和(14.04±2.32) mg∙kg-1;高寒草甸草原、高寒荒漠草原和高寒荒漠土壤碳、氮含量较低,并且土壤化学性质在这3种草地类型间的差异均未达到显著水平(表1)。土壤pH在高寒草甸草原中最高(9.52±0.21),而高寒草甸(8.24±0.27)、高寒荒漠草原(8.46±0.13)和高寒荒漠(8.17±0.11)之间差异性不显著,高寒草原(7.57±0.03)最低。
2.2 不同高寒草地生态系统土壤PLFA指纹特征
不同草地类型土壤中共检测出18种土壤PLFA标记的磷脂脂肪酸(图2)。5种不同类型高寒草地PLFA图谱相似,均表现为细菌PLFA标记物16:0和真菌 PLFA标记物 18:1w9c含量较高,分别占PLFA总量的16.98%~23.67%和14.50%~29.15%。5种不同类型高寒草地革兰氏阳性细菌PLFA标记物也较为丰富,包括14:0、i14:0、a15:0、i15:0、i16:0、i17:0、a17:0;而放线菌和革兰氏阴性细菌PLFA标记物相对较少(图2)。
土壤PLFA主要由直链饱和脂肪酸、直链单不饱和脂肪酸、支链饱和脂肪酸和环丙烷脂肪酸组成(表 2)。检测出的直链饱和脂肪酸包括 14:0、16:0和 18:0;直链单不饱和脂肪酸包括 14:1w5c、18:1w9c、16:1w5、17:1w8c、18:1w5c 和 16:1w9c;支链饱和脂肪酸包括 i13:0、a14:0、a15:0、i15:0、i16:0、a17:0和i17:0;环丙烷脂肪酸包括cy17:0和cy19:0w8c。土壤PLFA主要由直链饱和脂肪酸、直链单不饱和脂肪酸和支链饱和脂肪酸组成,相对含量分别占总 PLFA 的 22.33%~29.71%,30.15%~37.47%和27.77%~36.66%;而环丙烷脂肪酸只占很小部分,相对含量占总PLFA的3.48%~10.16%。
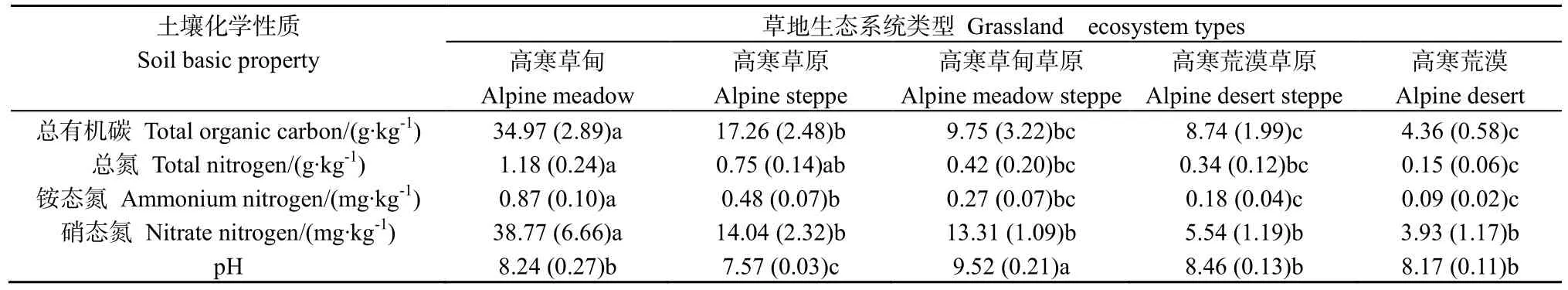
表1 高草草地不同生态系统土壤化学性质Table 1 The soil chemistry of different ecosystems

表2 高寒草地不同生态系统土壤PLFA类型及比例Table 2 The proportion of different PLFAs in different ecosystems in grassland in North Tibet %
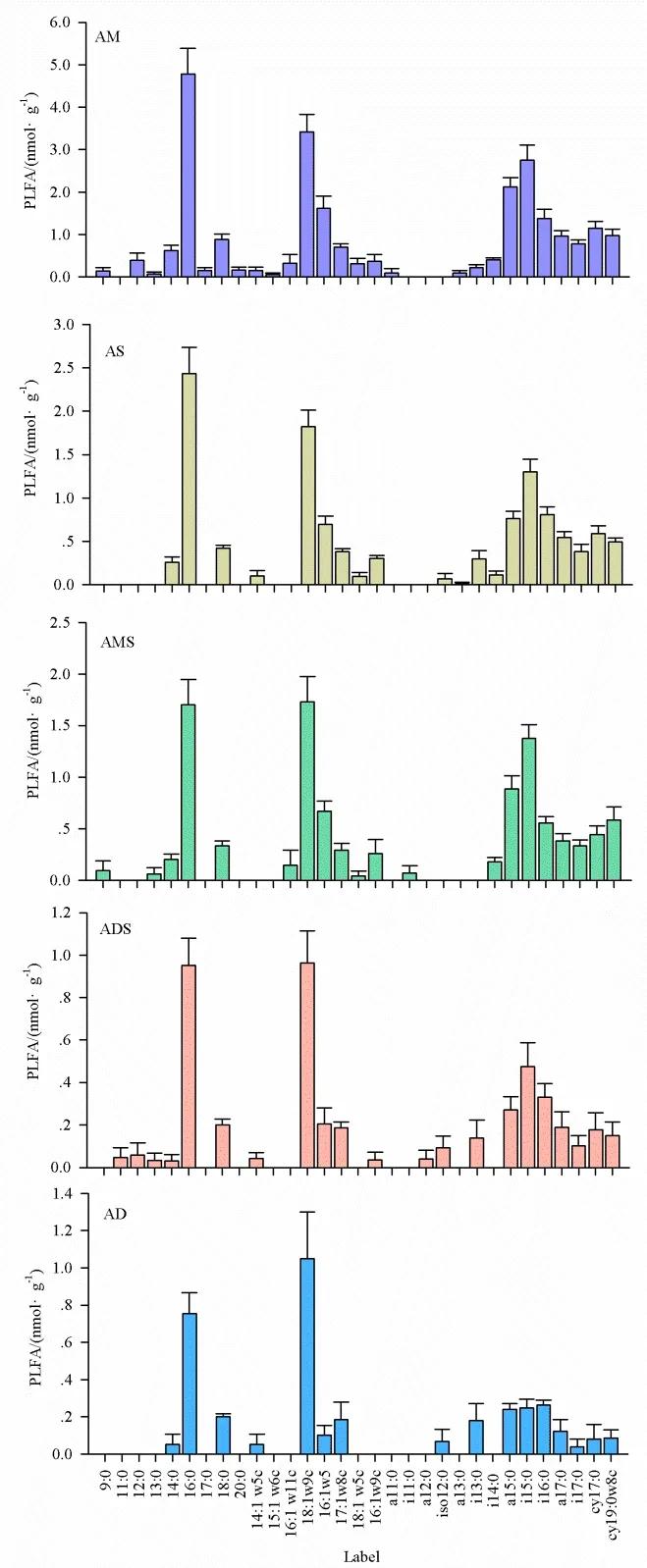
图2 高寒草地不同生态系统土壤微生物PLFA图谱Fig. 2 The content of each PLFA in different grassland types in North TibetAM:高寒草甸;AS:高寒草原;AMS:高寒草甸草原;ADS:高寒荒漠草原;AD:高寒荒漠AM: Alpine meadow; AS: Alpine steppe; AMS: Alpine meadow steppe; ADS:Alpine desert steppe; AD: Alpine desert
对藏北5种不同类型高寒草地土壤PLFA进行对比发现,土壤中总PLFA含量,细菌、真菌、放线菌、革兰氏阳性细菌和革兰氏阳性细菌PLFA含量总体上表现为高寒草甸>高寒草原>高寒草甸草原>高寒荒漠草原>高寒荒漠(图3)。藏北高寒草地土壤总PLFA含量范围为3.66~23.58 nmol∙g-1,其中,高寒草甸土壤总PLFA含量分别是高寒草原、高寒草甸草原、高寒荒漠草原和高寒荒漠的2.00、2.37、5.30和6.45倍。因此,高寒草甸土壤微生物含量最丰富,高寒草原,高寒草甸草原、高寒荒漠草原和高寒荒漠依次降低。比较不同高寒草地类型土壤微生物的PLFA含量,真菌PLFA含量和放线菌PLFA含量均低于细菌PLFA含量,革兰氏阴性细菌PLAF含量低于革兰氏阳性细菌PLFA含量(图3)。
2.3 不同草地生态系统土壤化学性质与 PLFA含量的相关性
对藏北5种高寒草地生态系统类型土壤PLFA含量与土壤化学性质进行相关分析(表3),土壤总PLFA含量,细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌PLFA含量与总有机碳、总氮、铵态氮和硝态氮4个指标之间均存在极显著相关关系(P<0.01);而土壤总PLFA含量,细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌 PLFA含量与与土壤pH值之间的相关性均未达到显著水平(P>0.05)。
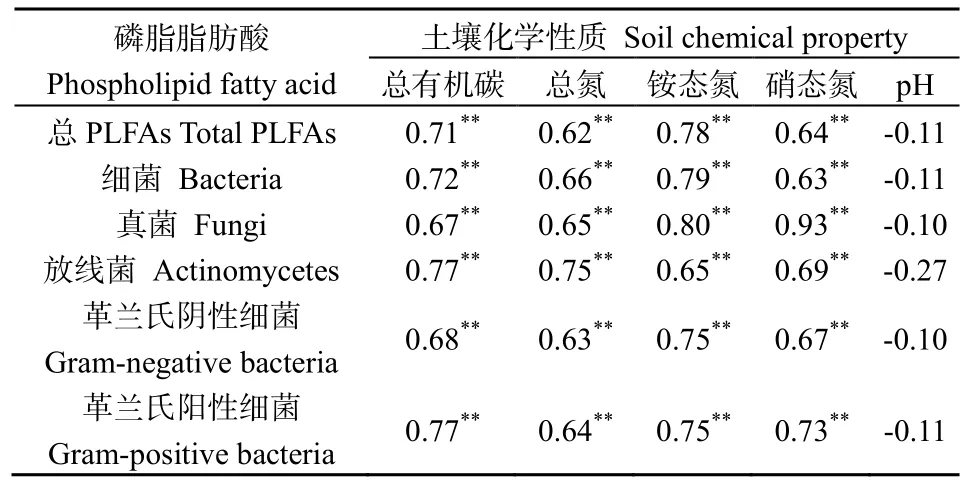
表3 土壤基本性质与PLFAs含量相关分析Table 3 The soil basic property and the contents of PLFAs correlation analysis
3 讨论
3.1 高寒草地土壤微生物PLFA特征
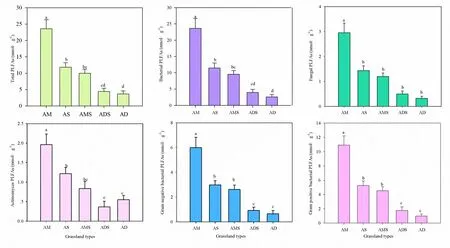
图3 高寒草地不同生态系统土壤微生物PLFA指标Fig. 3 The content of each PLFA biomarkers in different grassland types in North TibetAM:高寒草甸;AS:高寒草原;AMS:高寒草甸草原;ADS:高寒荒漠草原;AD:高寒荒漠AM: Alpine meadow; AS: Alpine steppe; AMS: Alpine meadow steppe; ADS: Alpine desert steppe; AD: Alpine desert
土壤微生物仅占土壤有机质的很小部分,但是作为土壤中最为活跃的部分,其在土壤碳、氮循环中扮演着重要角色(Matejek et al.,2010)。土壤微生物是土壤有机质中最活跃的组分之一(Powlson et al.,2001),植被类型数量和结构组成显著影响土壤微生物多样性(Zhang et al.,2013),因为植物为土壤微生物提供营养和能量。已有研究表明,在不同草地类型,土壤微生物总量和群落结构存在一定的差异性(韩玉竹等,2007;戴国华等,2006;Santonja et al.,2017)。本研究对藏北高原5种不同类型高寒草地土壤PLFA指纹特征进行分析,结果表明,高寒草甸土壤各PLFA生物指标含量最高,高寒荒漠含量最低,高寒草甸草原和高寒草原含量基本相似。植被主要通过植物生理生态过程为土壤微生物提供能源物质,高生产力的植被类型的土壤微生物多样性较高(蒋婧等,2010),植被类型的变化也会引起微生物活性和多样性的快速响应,从而决定了草地土壤微生物结构组成及其多样性(Loranger-Merciris et al.,2006)。因此,藏北不同高寒草地土壤PLFA指纹特征的差异,其主要原因可能是不同草地类型中植被结构类型,其土壤表面的覆盖程度和植物的生长发育、植物残体降解物质总量不同,导致土壤中能量和物质来源不同,从而影响了土壤中微生物数量及其活动状况(黄兴然等,2016;朱桂丽等,2017)。
藏北5种不同类型高寒草地细菌PLFA标记物16:0和真菌PLFA标记物18:1w9c含量较高,革兰氏阳性细菌PLFA标记物也较为丰富,而放线菌和革兰氏阴性细菌PLFA标记物相对较少。戴国华等(2016)研究表明,脂肪酸在青藏高原不同土层中的分布是相似的,均以C16、C18和偶碳长链脂肪酸(C22~C32)为主,本研究在藏北高原高寒草地发现土壤中脂肪酸以 C14~C18为主。C14~C18短链脂肪酸主要来源于微生物,最大浓度为C16(Feng et al.,2007),藏北高寒草地土壤细菌PLFA标记物16:0含量较高,表明藏北高原高寒草地土壤有机质微生物输入的重要地位。另外,真菌PLFA标记物18:1w9c含量也较高,由于非饱和脂肪酸主要源于新鲜植物和微生物,且在土壤中易于降解,因此其存在反映了新鲜有机质来源的贡献,以及藏北高原高寒草地土壤有机质处于较低的降解程度(戴国华等,2016;Wiesenberg et al.,2010)。
5种不同类型高寒草地PLFA生物指标中细菌含量最高,真菌和放线菌的含量很少,革兰氏阳性细菌含量高于革兰氏阴形细菌,土壤微生物群落组成的变化规律基本相似。然而,非线性多维度分析(NMDS)排序结果显示(图4),5种高寒草地类型样点基本分散,说明不同高寒草地类型间的微生物群落组成存在差异,而高寒荒漠草原和高寒荒漠的特殊点可能是由于土壤异质性高造成的,因此,在探讨不同草地类型土壤微生物群落时需考虑单个样点的环境因素(方圆等,2017)。藏北高寒草地PLFA标记物主要集中于高寒草甸和高寒草原,而高寒荒漠草原和高寒荒漠土壤中较少(图4),说明土壤微生物群落受地上植被类型的限制,在生产力水平相对高的高寒草地类型中,土壤微生物也相对丰富(王长庭等,2010)。同时,气温、降水、土壤理化性质等环境因子也可能是控制土壤微生物组成和分布的重要因素,例如,青藏高原土壤中PLFA含量会随年均气温的升高而降低,这是由于温暖气候条件下脂肪酸的降解增加导致的;降水增加有助于PLFA的累积,可能是降水增加导致植物生产力增加,从而使来源于新鲜有机质的脂肪酸获得较多的累积(戴国华等,2016)。
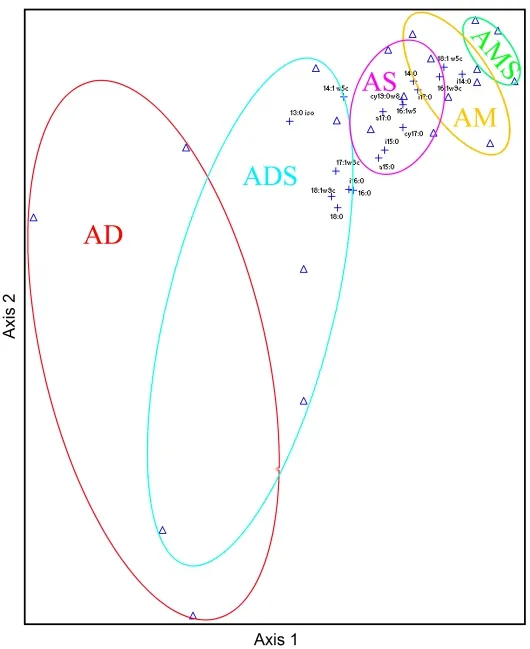
图4 高寒草地不同生态系统类型土壤微生物PLFA结构NMDS分析Fig. 4 The NMDS analysis PLFA in different grassland types in North TibetAM:高寒草甸;AS:高寒草原;AMS:高寒草甸草原;ADS:高寒荒漠草原;AD:高寒荒漠AM: Alpine meadow; AS: Alpine steppe; AMS: Alpine meadow steppe; ADS: Alpine desert steppe; AD: Alpine desert
3.2 高寒草地土壤 PLFA特征与土壤化学性质的关系
藏北高原高寒草甸土壤中含有大量的有机碳,高寒草原和高寒草甸草原次之,荒漠草原和荒漠中有机碳含量相对低,这与顾振宽等(2012)和艾丽等(2010)研究结果基本一致。土壤有机碳主要来源于植物残体的凋落物分解(Chen et al.,2017),不同植被下土壤有机碳含量存在差异性(Jackson et al.,2000),高寒草甸植被生产力相对较高,可产生较多植物残体,土壤有机质输入多,但是分解速率缓慢,而高寒荒漠草原和高寒荒漠植被生产力相对低,土壤有机质的输入量较少(孟凡栋等,2013)。不同高寒草地类型土壤中氮元素含量也不同,可能是不同草地类型下土壤淋溶过程、根系和地表凋落物中碳氮比和微生物结构差异导致土壤氮元素含量不同(王常慧等,2004)。高寒草甸土壤的总氮、铵态氮和硝态氮的含量较高,因为土壤温度低,水分含量高,且植被种类丰富,高寒荒漠草原和高寒荒漠土壤比较干燥,植物种类少且植被相对稀疏,所以含氮量低。
土壤是土壤微生物的C源和N源,如土壤有机质包含大量的植物营养元素,可提供营养物质和能量(Biswas,2014)。通过相关分析发现,藏北不同高寒草地类型的土壤化学性质和微生物群落结构分布具有明显的相关性(表3)。土壤细菌、真菌、放线菌、革兰氏阴性细菌和革兰氏阳性细菌 PLFA含量均与土壤有机碳、总氮、铵态氮和硝态氮呈极显著正相关关系,这是因为养分含量高的土壤有利于微生物的繁殖(Gude et al.,2012;Jirout et al.,2011),同时土壤微生物又对土壤条件改善、养分积累和循环起调节作用(Grandy et al.,2009)。土壤是草地生态系统的基础环境,土壤的稳定性是支持草地生态系统结构和功能稳定性、生态系统恢复的重要因素(李学斌等,2014)。草地土壤微生物作为草地生态系统的重要组成部分,在草地生态系统物质循环和能量流动过程中起主导作用,草地土壤微生物多样性可体现群落结构的稳定性,而土壤微生物多样性空间变异性又作用于土壤性质及地上植被(杜玮超等,2011;孙良杰等,2012)。藏北高寒草地不同植被类型微生物PLFA生物指标含量与土壤有机碳等养分之间的极显著相关性表明土壤碳、氮含量与土壤微生物间具有极为显著的相互刺激机制。一方面,土壤碳、氮含量的提高为土壤微生物提供了相对充足的碳源和能源物质,促进了土壤微生物的生长,从而使土壤微生物数量不断增加;另一方面,土壤微生物的增加进一步促进了土壤有机物质的分解和养分的释放,而当土壤碳、氮含量下降到一定程度时又可能成为土壤微生物生长的限制因子(彭岳林等,2007)。
4 结论
土壤微生物是土壤生态系统中养分来源的原动力,在动植物残体的降解和转化、养分的释放和循环及改善土壤理化性质中起着重要作用。本研究采用磷脂脂肪酸(PLFA)法研究了藏北高原5种类型高寒草地微生物群落结构组成和分布,构建了土壤微生物PLFA指纹特征,并进一步探讨了其与土壤总有机碳、总氮等化学性质的关系。藏北不同类型的高寒草地,植被类型差异明显,而草地土壤微生物结构组成和分布也不同,其中高寒草甸土壤各PLFA生物指标含量最高,高寒荒漠含量最低,高寒草甸草原和高寒草原含量基本相似。土壤中细菌PLFA标记物16:0和真菌PLFA标记物18:1w9c含量较高,证明了藏北高原高寒草地土壤有机质中微生物输入的重要地位以及土壤有机质较低的降解程度。土壤微生物PLFA标记分子在5种类型草地的样点基本分散,而在每种类型草地样点基本集中,说明微生物群落结构在不同草地类型土壤中存在明显差异,而在同一类型草地土壤中相近。另外,藏北高寒草地不同植被类型微生物PLFA生物指标含量与土壤化学性质之间的极显著相关性,揭示了土壤碳、氮含量与土壤微生物间具有极为显著的相互刺激机制。高寒地区特殊环境中土壤微生物群落结构复杂、功能特殊,对外界环境条件的变化响应敏感,本研究仅测定了生长季高寒草地土壤微生物群落结构组成,未研究土壤微生物的季节变化动态,也未研究不同类型高寒草地土壤微生物对气候变化和人类活动的响应,要揭示藏北高寒草地微生物群落组成和分布格局及其对环境变化的响应机理,还需要开展长期野外定位试验和多因子综合控制试验。
BISWAS S. 2014. Evaluation of growth, yield and nutrient content with microbial conssortia combined with different organic manures in Rumex acetosella L [J]. Journal of Environmental Science, 8: 1-5.
CHEN Y, MA S, SUN J, et al. 2017. Chemical diversity and incubation time affect non-additive responses of soil carbon and nitrogen cycling to litter mixtures from an alpine steppe soil [J]. Soil Biology and Biochemistry, 109: 124-134.
CHU H, LIN X, FUJII T, et al. 2007. Soil microbial biomass,dehydrogenase activity, bacterial community structure in response to long-term fertilizer management [J]. Soil Biology and Biochemistry,39(11): 2971-2976.
COLEMAN D C, WHITMAN W B. 2005. Linking species richness,biodiversity and ecosystem function in soil systems [J]. Pedobiologia,49(6): 479-497.
CREAMER C A, DE MENEZES A B, KRULL E S, et al. 2015. Microbial community structure mediates response of soil C decomposition to litter addition and warming [J]. Soil Biology and Biochemistry, 80: 175-188.
FANG J, YANG Y, MA W, et al. 2010. Ecosystem carbon stocks and their changes in China’s grasslands [J]. Science China Life Sciences, 53(7):757-765.
FENG X J, SIMPSON M J. 2007. The distribution and degradation of biomarkers in Alberta grassland soil profiles [J]. Organic Geochemistry, 38:1558-1570.
FROSTEGÅRD ÅSA, TUNLID A, BÅÅTH E. 2011. Use and misuse of PLFA measurements in soils [J]. Soil Biology Biochemistry, 43(8): 1621-1625.
GARCIA-PAUSAS J, PATERSON E. 2011. Microbial community abundance and structure are determinants of soil organic matter mineralisation in the presence of labile carbon [J]. Soil Biology and Biochemistry, 43(8): 1705-1713.
GRANDY A S, STRICKLAND M S, LAUBER C L, et al. 2009. The influence of microbial communities, management, and soil texture on soil organic matter chemistry [J]. Geoderma, 150(3-4): 278-286.
GUDE A, KANDELER E, GLEIXNER G. 2012. Input related microbial carbon dynamic of soil organic matter in particle size fractions [J]. Soil Biology and Biochemistry, 47: 209-219.
HONG J T, WANG X D, WU J B. 2014. Stoichiometry of root and leaf nitrogen and phosphorus in a dry alpine steppe on the Northern Tibetan Plateau [J]. Plos one, 9: 1-8.
JACKSON R B, SCHENK H J, JOBBAGY E G, et al. 2000. Belowground consequences of vegetation change and their treatment in models [J].Ecological Applications, 10(2): 470-483.
JIROUT J, ŠIMEK M, ELHOTTOV D. 2011. Inputs of nitrogen and organic matter govern the composition of fungal communities in soil disturbed by overwintering cattle [J]. Soil Biology and Biochemistry, 43(3): 647-656.
KRAMER C, GLEIXNER G. 2008. Soil organic matter in soil depth profiles: Distinct carbon preferences of microbial groups during carbon transformation [J]. Soil Biology and Biochemistry, 40(2): 425-433.
LORANGER-MERCIRIS G, BARTHES L, GASTINE A, et al. 2006. Rapid effects of plant species diversity and identity on soil microbial communities in experimental grassland ecosystems [J]. Soil Biology and Biochemistry, 38(8): 2336-2343.
MATEJEK B, HUBER C, DANNENMANN M, et al. 2010. Microbial nitrogen-turnover processes within the soil profile of a nitrogen-saturated spruce forest and their relation to the small-scale pattern of seepage-water nitrate [J]. Journal of Plant Nutrition and Soil Science, 173(2): 224-236.
MOORE-KUCERA J, DICK R P. 2007. PLFA Profiling of Microbial Community Structure and Seasonal Shifts in Soils of a Douglas-fir Chronosequence [J]. Microbial Ecology, 55(3): 500-511.
PHILLIPS R P, MEIER I C, BERNHARDT E S, et al. 2012. Roots and fungi accelerate carbon and nitrogen cycling in forests exposed to elevated CO2[J]. Ecology Letters, 15(9): 1042-1049.
POWLSON D S, HIRSCH P R, BROOKES P C. 2001. The role of soil microorganisms in soil organic matter conservation in the tropics [J].Nutrient Cycling in Agroecosystems, 61(1-2): 41-51.
SANTONJA M, RANCON A, FROMIN N, et al. 2017. Plant litter diversity increases microbial abundance, fungal diversity, and carbon and nitrogen cycling in a Mediterranean shrubland [J]. Soil Biology and Biochemistry, 111: 124-134.
SMITH A P, MAR N-SPIOTTA E, DE GRAAFF M A, et al. 2014.Microbial community structure varies across soil organic matter aggregate pools during tropical land cover change [J]. Soil Biology and Biochemistry, 77: 292-303.
WIESENBERG G L B, DORODNIKOV M,KUZYAKOV Y. 2010. Source determination of lipids in bulk soil and soil density fractions after four years of wheat cropping [J]. Geoderma, 156(3-4): 267-277.
YANARDAĞ I H, ZORNOZA R, BASTIDA F, et al. 2017. Native soil organic matter conditions the response of microbial communities to organic inputs with different stability [J]. Geoderma, 295: 1-9.
YANNIKOS N, LEINWEBER P, HELGASON B L, et al. 2014. Impact of Populus trees on the composition of organic matter and the soil microbial community in Orthic Gray Luvisols in Saskatchewan(Canada) [J]. Soil Biology and Biochemistry, 70: 5-11.
ZHANG C, LIU G-B, XUE S, et al. 2013. Effect of Different Vegetation Types on the Rhizosphere Soil Microbial Community Structure in the Loess Plateau of China [J]. Journal of Integrative Agriculture, 12(11): 2103-2113.
艾丽, 吴建国, 刘建泉, 等. 2010. 土壤有机碳和全氮含量及其与海拔、植被和气候要素的关系——以祁连山中段北坡为研究对象[J]. 中国园艺文摘, (3): 27-34.
鲍士旦. 2000. 土壤农化分析[M]. 第三版. 北京: 农业出版社: 30-83.
戴国华, 朱珊珊, 刘宗广, 等. 2016. 青藏高原高寒草地土壤中脂肪酸的分布特征[J]. 中国科学:地球科学, 46(6):756-766.
杜玮超, 袁霞, 曲同宝. 2011. 土壤微生物多样性与地上植被类型关系的研究进展[J]. 当代生态农业, 1-2: 14-18.
方圆, 王娓, 姚晓东, 等. 2017. 我国北方温带草地土壤微生物群落组成及其环境影响因素[J]. 北京大学学报, 53(1): 142-150.
高清竹, 李玉娥, 林而达, 等. 2005. 藏北地区草地退化的时空分布特征[J]. 地理学报, 60(6): 965-973.
顾振宽, 杜国祯, 朱炜歆, 等. 2012. 青藏高原东部不同草地类型土壤养分的分布规律[J]. 草业科学, 29(4): 507-512.
韩玉竹, 陈秀蓉, 王国荣, 等. 2007. 东祁连山高寒草地土壤微生物分布特征初探[J]. 草业科学, 24(4): 14-18.
黄兴然, 郭萍萍, 吴旺旺, 等. 2016. 模拟氮沉降增加对不同树种土壤微生物群落结构的影响[J]. 生态学杂志, 35(6): 1420-1426.
黄祖新, 黄镇, 叶冰莹, 等. 2011. 宿根甘蔗根际土壤细菌多样性分析中培养法与非培养法比较研究[J]. 应用与环境生物学报, 17(5): 742-746.
蒋婧, 宋明华. 2010. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 34(8): 979-988.
李超, 梁俊峰. 2015. 土壤微生物总DNA提取及其PCR优化[J]. 桉树科技, 32(2): 17-21.
李俊, 吴福忠, 杨万勤, 等. 2016. 高山草甸冬季凋落物分解过程中土壤动物对微生物群落结构的影响[J]. 应用与环境生物学报, 22(1): 27-34.
李学斌, 樊瑞霞, 刘学东. 2014. 中国草地生态系统碳储量及碳过程研究进展[J]. 生态环境学报, 23(11): 1845-1851.
孟凡栋, 王常顺, 张振华, 等. 2013. 西藏高原高寒草地群落植物多样性和地上生物量监测方法的比较研究[J]. 西北植物学报, 33(9): 1923-1929.
牛磊, 刘颖慧, 李悦, 等. 2015. 西藏那曲地区高寒草甸不同放牧方式下土壤微生物群落结构特征[J]. 应用生态学报, 26(8): 2298-2306.
彭岳林, 蔡晓布, 薛会英. 2007. 退化高寒草原土壤微生物变化特性研究[J]. 西北农业学报, 16(4): 112-115.
孙良杰, 齐玉春, 董云社, 等. 2012. 全球变化对草地土壤微生物群落多样性的影响研究进展[J]. 地理科学进展, 31(12): 1715-1723.
汤朋先, 荆英, 徐志英. 2016. BIOLOG在土壤微生物群落功能多样性研究中的应用[J]. 南方农业, 10(21): 242-243.
王常慧, 邢雪荣, 韩兴国. 2004. 草地生态系统中土壤氮素矿化影响因素的研究进展[J]. 应用生态学报, 15(11): 2184-2188.
王鸽, 白震, 何红波, 等. 2006. 磷脂脂肪酸技术及其在土壤微生物研究中的应用[J]. 生态学报, 26(7): 2387-2394.
王建林, 钟志明, 王忠红, 等. 2014. 青藏高原高寒草原生态系统土壤碳磷比的分布特征[J]. 草业学报, 23(2): 9-19.
王曙光, 侯彦林. 2004. 磷脂脂肪酸方法在土壤微生物分析种的应用[J].微生物学通报, 31(1): 114-117.
王长庭, 龙瑞军, 王根绪, 等. 2010. 高寒草甸群落地表植被特征与土壤理化形状、土壤微生物之间的相关性研究[J]. 草业学报, 19(6): 25-34.
文都日乐, 李刚, 张静妮, 等. 2010. 呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究[J]. 草业学报, 19(5): 94-102.
武建双, 李晓佳, 沈振西, 等. 2012. 藏北高寒草地样带物种多样性沿降水梯度的分布格局[J]. 草业学报, 21(3): 17-25.
武建双, 沈振西, 张宪洲. 2009. 藏北高原草地生态系统研究进展[J]. 安徽农业科学, 37(14): 6556-6558.
熊定鹏, 赵广帅, 武建双, 等. 2016. 羌塘高寒草地物种多样性与生态系统多功能关系格局[J]. 生态学报, 36(11): 3362-3371.
杨春艳, 沈渭寿, 林乃峰. 2014. 西藏高原气候变化及其差异性[J]. 干旱区地理, 37(2): 291-299.
姚檀栋 2010. 敏感脆弱、影响深远的青藏高原环境[J]. 大自然,(2): 1.
姚晓东, 王娓, 曾辉. 2016. 磷脂脂肪酸法在土壤微生物群落分析中的应用[J]. 微生物学通报, 43(9): 2086-2095.
张莉, 党军, 刘伟, 等. 2012. 高寒草甸连续围封与施肥对土壤微生物群落结构的影响[J]. 应用生态学报, 23(11): 3072-3078.
赵帅, 张静妮, 赖欣, 等. 2011. 放牧与围栏内蒙古针茅草原土壤微生物生物量碳、氮变化及微生物群落结构PLFA分析[J]. 农业环境科学学报, 30(6): 1126-1134.
赵玉红, 张卫红, 王向涛, 等. 2016. 藏北草原生态文明评价与发展趋势预测[J]. 草原与草坪, 36(5): 82-88.
朱桂丽, 李杰, 魏学红, 等. 2017. 青藏高寒草地植被生产力与生物多样性的经度格局[J]. 自然资源学报, 32(7): 210-222.
Abstract: Soil microorganism, which is an important component of the soil, reflects the biological activity in soil, and also acts as the driver of soil organic matter and nutrient transformation and cycling. Alpine grassland, which is one of the most typical natural ecological system in the central Asia and representative alpine region in the world, is the largest area in northern Tibet plateau. In this study, we investigated five types of alpine grassland soils across Northern Tibet, including alpine meadow, alpine steppe, alpine meadow steppe, alpine desert steppe and alpine desert, to examine the fingerprint of soil phospholipid fatty acid (PLFA), and analyze the their relationship with soil chemical properties. The results showed, the soil chemical properties (total organic carbon, total nitrogen, nitrate nitrogen and ammonium nitrogen) generally followed a similar pattern, with the highest level in the alpine meadow soil and the lowest content in alpine desert soil and alpine desert grassland soil. The contents of 16:0 and 18:1w9c were highest in PLFA for all the five soils. The PLFAs mainly constitute with straight chain saturated fatty acid, linear single unsaturated fatty acid,branched chain saturated fatty acid and cyclopropane fatty acid. Linear monounsaturated fatty acid (27.77%~36.66%) and branched chain saturated fat percentage (30.15%~36.61%) was higher, and cyclopropane fatty acids (3.48%~10.16%) was lower. The total PLFA, bacteria, fungi, actinomycetes, gram negative bacteria and gram positive bacteria contents were highest in Alpine meadow soil(P<0.05), with 2.00~6.45, 2.01~8.88, 1.82~3.52, 1.61~5.37, 2.01~9.17 and 2.06~10.94 times as large as those of the other four types grassland soils. Most PLFAs molecular concentrated on alpine meadow, alpine steppe and alpine meadow steppe soil, the other two types of grassland soil only contained a small amount of microbes; Soil microorganisms were largely dispersed among the five types of soil while centralized within each soil type, indicating that microbial community structures were different among the five soil types while similar within each type. The contents of total PLFA, bacteria, fungi, actinomycetes, gram negative bacteria and gram positive bacteria PLFA were significantly correlated (P<0.01) with soil organic carbon, total nitrogen, ammonium nitrogen and nitrate nitrogen. This study examines the PLFA fingerprint of different alpine grassland soils in North Tibet as well as their relationship with soil chemical properties, and may improve our understanding on soil microbial community structure characteristics in alpine grassland soil.
Key words: soil microorganism; phospholipid fatty acid; alpine grassland; soil organic carbon; nitrate nitrogen; ammonium nitrogen
Phospholipid Fatty Acids Fingerprint of Different Grassland Soils in North Tibet and Their Relationship with Chemical Properties
MA Shuqin1,2, WANG Xiaodan1*, WANG He3, ZHANG Beibei3, CHEN Youchao1,2, LU Xuyang1
1. Key Laboratory of Mountain Surface Processes and Ecological Regulation, Institute of Mountain Hazards and Environment, Chinese Academy of Sciences,Chengdu 610014,China;2. University of Chinese Academy of Sciences, Beijing 100049, China;3. Shaanxi Key Laboratory of Disaster Monitoring and Mechanism Simulating, Baoji University of Arts and Sciences, Baoji 721013, China
10.16258/j.cnki.1674-5906.2017.09.004
S154.2; X144
A
1674-5906(2017)09-1480-08
马书琴, 王小丹, 王荷, 张蓓蓓, 陈有超, 鲁旭阳. 2017. 藏北高寒草地土壤磷脂脂肪酸指纹特征及其与土壤化学性质的关系[J]. 生态环境学报, 26(9): 1480-1487.
MA Shuqin, WANG Xiaodan, WANG He, ZHANG Beibei, CHEN Youchao, LU Xuyang. 2017. Phospholipid fatty acids fingerprint of different grassland soils in North Tibet and their relationship with chemical properties [J]. Ecology and Environmental Sciences,26(9): 1480-1487.
国家自然科学基金项目(41671262;41371267)
马书琴(1990年生),女,博士研究生,研究方向为草地土壤生态。E-mail: shuqinq@163.com*通信作者:王小丹(1973年生),男,研究员,博士生导师,主要从事高山环境与高寒生态研究。E-mail: wxd@imde.ac.cn
2017-08-02
