藜麦麸皮总皂苷的提取纯化工艺研究
2017-10-16,,,,2,*
,,,,2,*
(1.山西农业大学食品科学与工程学院,山西晋中 030801;2.山西农业大学动物科技学院,山西晋中 030801)
藜麦麸皮总皂苷的提取纯化工艺研究
许效群1,赵文婷1,苗玲香1,霍乃蕊1,2,*
(1.山西农业大学食品科学与工程学院,山西晋中030801;2.山西农业大学动物科技学院,山西晋中030801)
采用溶剂回流提取法对藜麦麸皮中的总皂苷进行提取,以响应面实验对提取工艺进行优化。以吸附率和解析率为指标,筛选适合用于藜麦麸皮总皂苷纯化的大孔吸附树脂,并对纯化工艺进行优化。优化获得的提取工艺为:料液比1∶20.8,以72%乙醇在72 ℃提取147 min,皂苷得率可达到1.685%。经过比较,D101大孔吸附树脂的吸附率和解析率都高于HPD600、S-8和AB-8,故选其用作纯化研究,结果表明上样浓度为4 mg/mL,上样液pH6,上样流速为2 BV/h时吸附率最大;用90%乙醇,以2 BV/h的流速洗脱时,解析率最大,经浓缩和冻干所得的皂苷,其纯度达到43.6%。该研究结果为藜麦麸皮的高值利用及藜麦总皂苷生物活性研究和开发利用奠定了基础。
藜麦麸皮,总皂苷,大孔吸附树脂,溶剂回流提取
Abstract:Solvent reflux method was used for saponins extraction and the responsive surface methodology was used to optimize the related parameters. Adsorption rate and desorption rate were used as indicators for screening of proper resin for saponins purification and determining of purification techniques. The obtained optimal extraction technique with a ratio(bran to 72% ethanol)of 1∶20.8,carried out at 72 ℃ for 147 min,and the obtaining rate of saponins reached 1.685%. Compared with HPD600,S-8 and AB-8,the resin D101 showed the highest absorption rate and the highest desorption rate,so it was used for later purification studies. The results suggested that the highest absorption rate for D101 was obtained with a sample concentration of 4 mg/mL,the loading sample was adjusted to pH6 and loading at a velocity of 2 BV/h. The highest desorption rate was obtained when elute with 90% ethanol at a speed of 2 BV/h. The desorption fraction was condensed and freezing dried,the purity of resulted saponins powder reached 43.6%. The above results will facilitate the high-value application of quinoa bran and the related research work of quinoa saponins.
Keywords:quinoa bran;total saponins;macroporous adsorption resin;solvent reflux extraction
藜麦(ChenopodiumquinoaWilld.)原产南美洲安第斯山区,是藜科的一种双子叶植物,距今已有5000~7000年的种植历史[1]。我国首先在西藏引种成功[2],2010年山西静乐县推广种植获得成功,目前藜麦种植也主要集中在这两个地区。藜麦营养丰富全面[3-4]含有几乎完美的蛋白质氨基酸组合,特别是赖氨酸Lys和Met含量较高[4],Ca(874 mg/kg)、Fe(81 mg/kg)、Zn、Mn、Cu等矿质营养以及不饱和脂肪酸、纤维素、维生素、类黄酮等多种有益成分的含量也远高于其他谷物,享有 “营养黄金”、“超级谷物”以及“未来食品”的美称[5]。国外尤其是欧美国家对藜麦的营养价值、功能成分的提取及功效研究已很丰富[6-8],国内对藜麦的研究起步很晚,CNKI以藜麦为关键词检索,2011~2016年相关文献仅有38篇,2015年居多(26篇),且主要集中在藜麦引种、栽培、品种选育、种植等方面,仅有个别研究者对藜麦中的营养成分、矿物元素进行了测定[9],功能性成分方面,主要集中在藜麦总黄酮的提取、纯化和抗氧化活性研究[10-12],关于藜麦皂苷也仅见于测定方法的报道[13]。目前国产藜麦主要被加工成藜麦米或藜麦粉,副产品麸皮含有较高的皂苷,藜麦皂苷具有抗菌[6]、抗氧化[7]、抗病毒、抗癌等多种生物活性[8],为了有效利用藜麦麸皮这一宝贵资源,挖掘藜麦的特殊功能价值,本文探讨对藜麦麸皮总皂苷的提取纯化工艺,为藜麦麸皮开发利用和藜麦麸皮总皂苷深入研究奠定基础。
1 材料与方法
1.1 材料与仪器
藜麦麸皮 由山西稼祺农业科技有限公司山西静乐藜麦种植基地提供(白藜麦采用干法脱皮抛光工艺加工获得麸皮);齐墩果酸标准品(HPLC>98%) 北京索莱宝科技有限公司;无水乙醇、甲醇、石油醚、冰乙酸、高氯酸、香草醛等 均为分析纯;D101、AB-8、S-8、HPD600大孔吸附树脂 为天津欧瑞生物科技有限公司产品。
RE-5203旋转蒸发器、SHZ-Ⅲ型循环水式真空泵 上海亚荣生化仪器厂;723可见分光光度计 上海菁华科技仪器有限公司;HL-1恒流泵、HL-2BS数显恒流泵 上海青浦沪西仪器厂;层析柱 上海华美实验仪器厂;JDG-0.2真空冻干实验机 北京化玻联医疗器械有限公司。
1.2 实验方法
1.2.1 工艺流程 藜麦麸皮→烘干(60 ℃)→粉碎(过60目筛)→石油醚索氏提取器回流脱脂2 h→60 ℃烘干→取3.000 g置于250 mL圆底烧瓶→按实验设计加入乙醇→水浴锅加热回流(考察乙醇浓度、料液比、温度、时间对总皂苷提取得率的影响)→过滤→滤液经旋转蒸发浓缩成浸膏(转速80 r/min,温度60 ℃,真空度0.08 MPa)→真空冷冻干燥(冷阱温度-45 ℃,干燥温度50 ℃,真空度80 Pa)→总皂苷粗提物。
1.2.2 总皂苷测定 香草醛-高氯酸法:将待测液(0~1 mL)在10 mL试管中70 ℃水浴挥干,依次加入5%的香草醛-冰醋酸溶液0.2 mL和高氯酸0.8 mL,试管加塞摇匀后60 ℃水浴加热15 min,显色后冰水冷却5 min,加5 mL冰乙酸稀释摇匀、静置30 min,546 nm处测吸光值,测定时以甲醇等量替代待测液作空白[14]。
分别取0、0.2、0.4、0.6、0.8、1.0 mL齐墩果酸标准溶液(0.1 mg/mL,甲醇为溶剂)作为待测液,每组3个平行,按上述步骤进行操作,以吸光度(A)为纵坐标,齐墩果酸浓度为横坐标,绘制标准曲线并建立如下回归方程A=52.746c-0.0077(R2=0.9996)。据此方程,可求出样品吸光值A所对应的浓度c(mg/mL),从而求出总皂苷含量。
1.2.3 提取得率测定 将粗提物用20 mL蒸馏水溶解,加等体积的水饱和正丁醇萃取3次,合并正丁醇相并旋转蒸干,用甲醇溶解并定容于50 mL容量瓶中即得样品液。取0.05 mL样品溶液作为待测液,按照1.2.2的方法测定吸光值,计算皂苷浓度,利用以下公式计算藜麦麸皮总皂苷提取得率。
总皂苷提取得率(%)=c×V×120/(M×1000)×100
式中,c表示样品液中皂苷的浓度(mg/mL);V为样品液总体积;120为样品液测定时的稀释倍数;M为藜麦麸皮的质量(3.000 g)。
1.2.4 提取条件优化
1.2.4.1 单因素实验 取6份3.000 g脱脂处理后的藜麦麸皮,按照1.2.1方法提取粗提物并计算提取得率,研究各个提取条件对藜麦麸皮总皂苷提取得率的影响。各因素取值分别为:乙醇浓度40%、50%、60%、70%、80%、90%;提取温度40、50、60、70、80、90 ℃;提取时间0.5、1.0、1.5、2.0、2.5、3;料液比1∶5、1∶10、1∶15、1∶20、1∶25、1∶30。除变量外,其他各因素的固定条件分别为:乙醇浓度70%、料液比为1∶15(即45 mL)、提取温度为60 ℃、回流提取2 h。
1.2.4.2 响应面实验设计 在单因素实验结果的基础上,应用Box-Behnken模型的中心组合实验设计原理,进行四因素三水平的实验设计,因素水平见表1。

表1 因素水平表Table 1 Factors and levels table
1.2.5 纯化方法优化
1.2.5.1 大孔吸附树脂的选择 称取D101、AB-8、S-8、HPD600大孔吸附树脂各2 g,分别加入50 mL上样液(2.92 mg/mL),于25 ℃、120 r/min的恒温振荡水浴锅中振荡24 h,使其充分吸附饱和,过滤,用少量蒸馏水冲洗树脂滤饼。洗液与滤液混匀计量其体积,并测定计算其中的总皂苷质量M1(mg)和各种树脂的吸附率。
吸附率(%)=(M0-M1)/M0×100
式中,M0为吸附前溶液中总皂苷的质量(mg);M1为吸附后溶液中总皂苷的质量(mg)。
将吸附了总皂苷的大孔吸附树脂再装入250 mL的具塞三角烧瓶中,加入70%乙醇,在25 ℃、120 r/min的恒温振荡水浴锅中振荡6 h,使其充分解吸达到平衡,过滤,用少量70%乙醇冲洗树脂滤饼,与滤液混匀得解吸后溶液,记录其体积,测定并计算解吸后溶液中总皂苷质量M2(mg),计算各树脂的解吸率,解吸率(%)=M2/(M0-M1)×100。
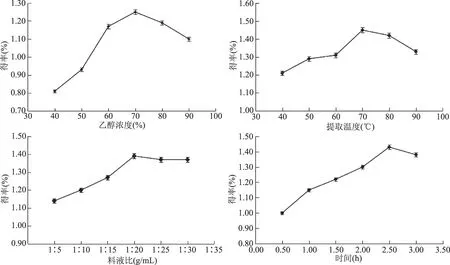
图1 乙醇浓度、提取温度、料液比以及提取时间对总皂苷得率的影响Fig.1 Effect of ethanol concentration,tratio of solid to liquid,temperature and time on the acquiring rate of total saponins
1.2.5.2 各因素对吸附率的影响 将预处理好的D101大孔树脂装入洗净的层析柱中(φ1.7 cm×20 cm),柱床体积约为30 mL,取2.92 mg/mL浓度的上样液100 mL,调节pH分别至4、5、6、7、8,通过恒流泵将上样流速控制在1.0 mL/min,收集过柱后样液,测定其中皂苷的含量并计算吸附率,获得较适上样液pH。其他条件不变,上样液pH7,确定上样流速0.5、1.0、1.5、2.0、2.5 mL/min(即为:1、2、3、4、5 BV/h)对吸附率的影响。同理配制浓度分别为2、3、4、5、6、7 mg/mL的上样液(pH7.0),以1.0 mL/min的流速上柱,计算吸附率,得到较适上样浓度。
1.2.5.3 洗脱流速和洗脱液浓度对解吸率的影响 按1.2.5.2获得的较适上样条件上样90 mL,以90 mL 70%的乙醇洗脱,洗脱流速分别为0.5、1.0、1.5、2.0、2.5 mL/min,收集并测定解析液中的皂苷浓度,计算解吸率,获得较适洗脱流速。以1.0 mL/min(2 BV/h)洗脱流速洗脱,乙醇浓度分别为40%、50%、60%、70%、80%、90%,计算解吸率,获得较适洗脱液浓度。
1.2.5.4 纯度测定 按照优化的纯化工艺进行纯化,收集解析液,浓缩成浸膏并干燥为粉末,用甲醇溶解并定容,测定皂苷的含量,并计算纯度,K(%)=(c×V)/m×100,式中,c皂苷浓度(mg/mL);V为样品液体积(mL);m为皂苷粉质量(mg)。
1.3 数据处理
采用Design Expert 8.0和SigmaPlot 10.0进行响应面实验设计、分析、制图。所有实验三个平行,取平均值。
2 结果与分析
2.1 提取条件优化
2.1.1 单因素实验 由图1可以看出,藜麦麸皮总皂苷得率在实验因素水平范围内随着乙醇浓度、提取温度的增高出现先增后减的变化规律。这可能与藜麦麸皮总皂苷的极性有关,提取剂的极性由乙醇浓度决定,根据相似相容原理二者极性相似时提取效果最好;提取温度的影响可从热力学角度分析,增加反应体系温度,可加快皂苷分子向溶剂扩散的速度,有利于浸出,但温度过高时造成皂苷的氧化和热敏性破坏。图1显示,料液比和提取时间对总皂苷得率的影响是先增高后维持在一定水平,这可能是由于增加溶剂可增大物料与溶剂接触面,降低物料结构内外皂苷浓度差,当料液比加大到一定程度时,这种效应逐渐消失;随着时间的增加,皂苷不断溶出,一段时间后已基本溶出,物料结构内外达到平衡。结果表明,达到相应峰值时对应的乙醇浓度为70%,料液比为1∶20、提取温度为70 ℃、提取时间2.5 h。
2.1.2 Box-Behnken响应面实验 通过软件Design Expert 8.05b对表2中的数据进行多元回归拟合分析,得到藜麦麸皮总皂苷得率(Y)与X1、X2、X3、X4之间的二次多元回归模型方程:Y=1.662+0.18417X1+0.0475X2+0.11X3+0.00166667X4-0.0675X1X2+0.02X1X3+0.075X1X4-0.0225X2X3-0.0025X2X4-0.0075X3X4-0.23475X12-0.03725X22-0.161X32-0.106X42。
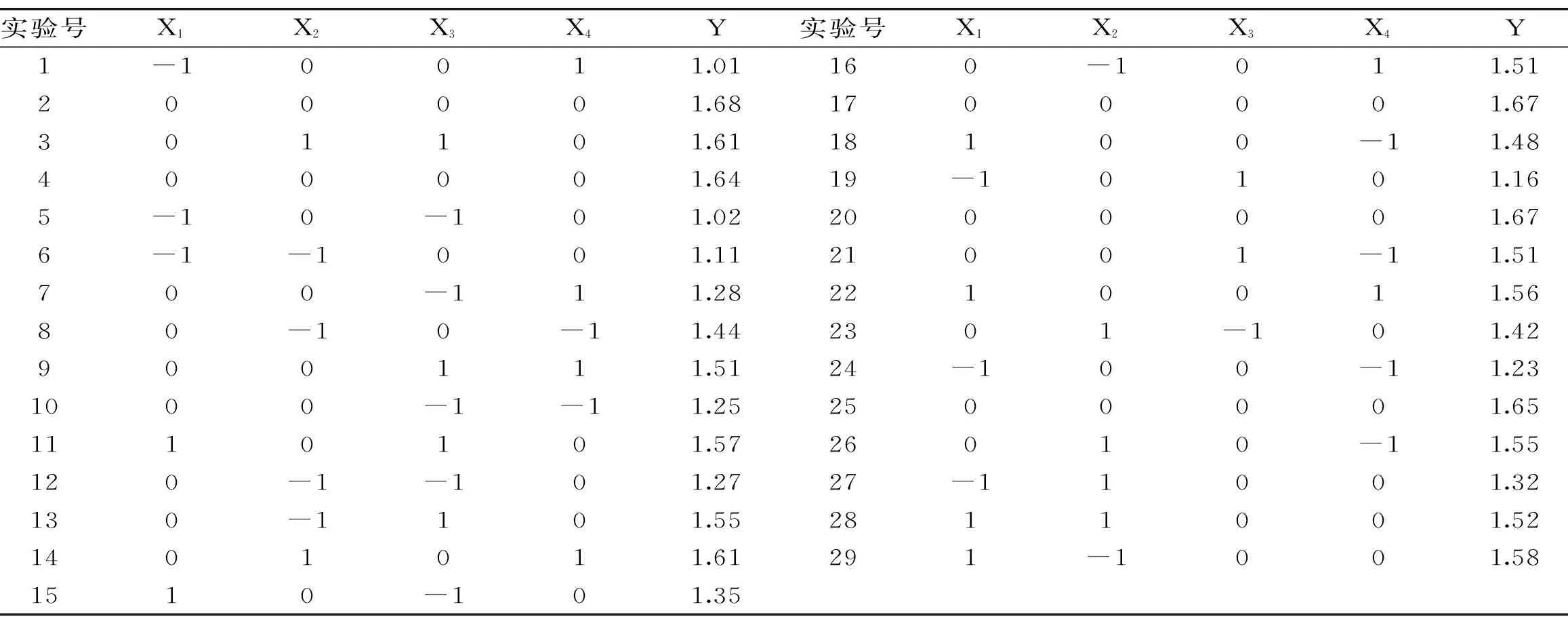
表2 Box-Behnken 实验设计及结果Table 2 Box-Behnken experimental design and results
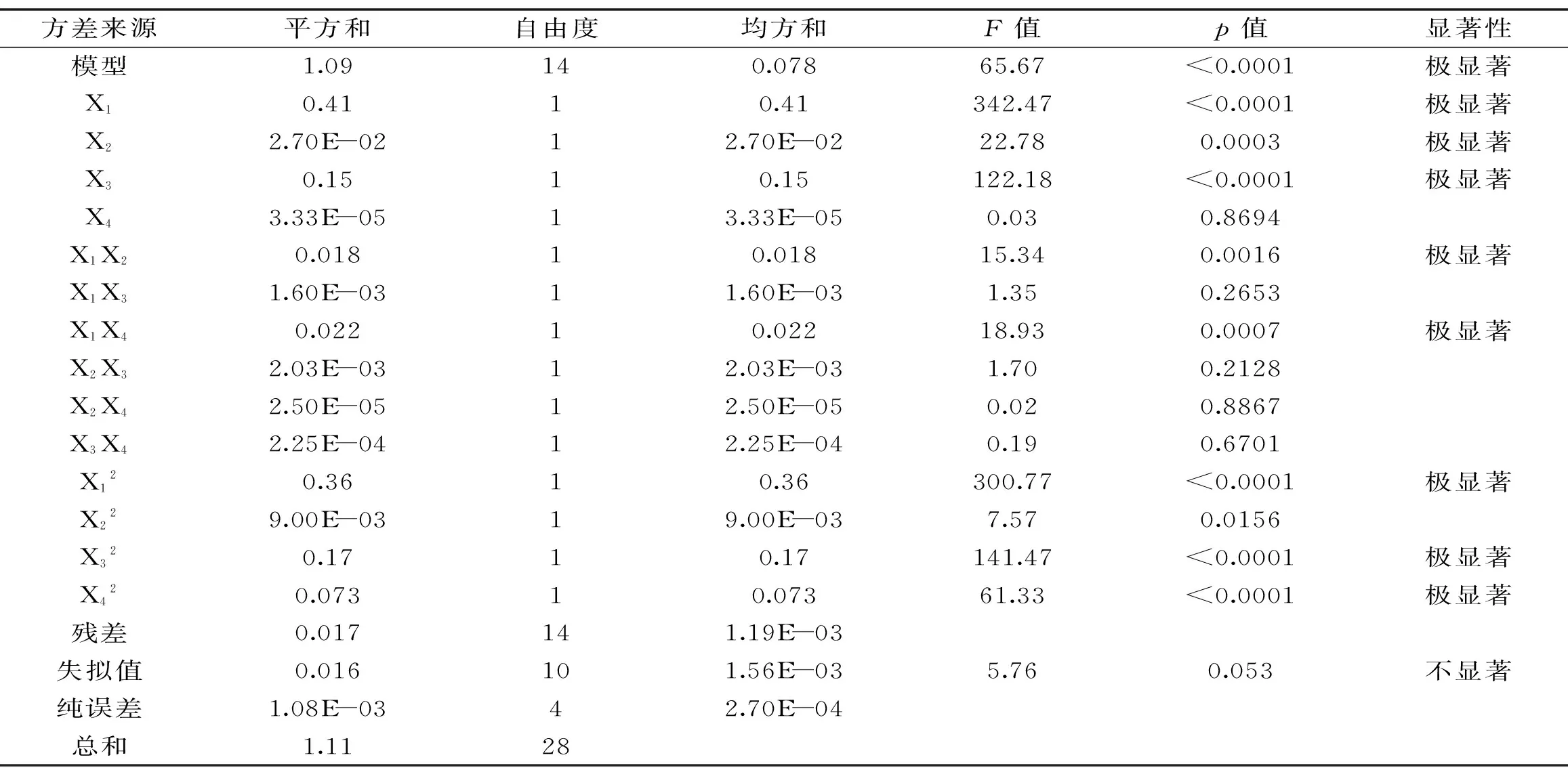
表3 响应面方差分析表Table 3 Variance analysis of response surface methodology
基于二次回归模型进行两因素响应面及等高线绘图,分析乙醇浓度(X1)与提取温度(X2)二因素对总皂苷得率的影响和乙醇浓度(X1)与提取时间(X4)二因素对总皂苷得率的影响(图2),图中显示,二因素均出现先增高后降低的变化趋势,二因素响应曲面在实验范围内出现凸面最高点,说明存在最优水平组合,且等高线图呈椭圆形,长轴、短轴与坐标轴明显不平行,说明X1X2、X1X4交互相作用显著。
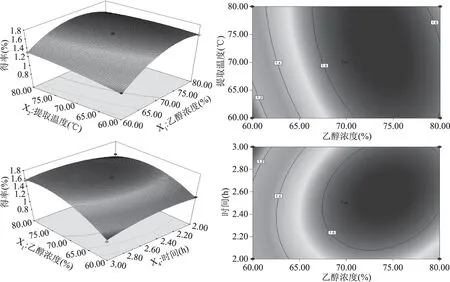
图2 各因素间交互影响的响应面及等高线图Fig.2 Responsive surfaces and contours between factors
2.1.3 最佳工艺条件的确定与验证 通过Design-Expert软件对参数进行优化,得出藜麦麸皮总皂苷提取的最佳工艺参数为:乙醇浓度71.5%、提取温度71.5 ℃、料液比1∶20.75、时间2.45 h,总皂苷得率的预测值为1.699%。
考虑到实际操作情况,将工艺参数调整为乙醇浓度72%、提取温度72 ℃、料液比1∶20.8、时间147 min,在此条件下进行验证实验,重复三次取平均值得到藜麦麸皮总皂苷的得率为1.685%,RSD=0.82%,与软件预测值很接近,说明所建立的响应面模型对藜麦麸皮总皂苷提取工艺具有实际应用价值。
2.2 藜麦麸皮总皂苷的纯化
2.2.1 大孔吸附树脂的筛选 表4列举了四种不同型号树脂的静态吸附率和静态解吸率,可知D101大孔吸附树脂对藜麦麸皮总皂苷的吸附率和解析率均最大,故选择此型号的树脂用于纯化研究。

表4 不同型号树脂对皂苷的吸附率及解吸率Table 4 Adsorption and desorption rate of saponins of 4 types of resin
2.2.2 上样液pH、浓度及上样流速对吸附率的影响 由图3可以看出,随着样液pH和上样液浓度的增大,吸附率呈先上升后下降的趋势,在pH为6,上样液浓度为4 mg/mL时,吸附率最大。整体上吸附率随着上样流速的增大而逐渐降低。皂苷的吸附主要是从溶液中向树脂表面扩散并与树脂空隙中的水分充分交换,这个过程需要一定的时间,如果流速过快,皂苷还来不及扩散,就会发生泄漏,造成样品的流失,因此必须保持一定的上样流速才可以达到最佳效果,流速为0.5 mL/min和1.0 mL/min时吸附率变化并不大,但是流速太低,延长了操作时间,因此综合考虑选择1.0 mL/min(2 BV/h)的流速上样较为适宜。
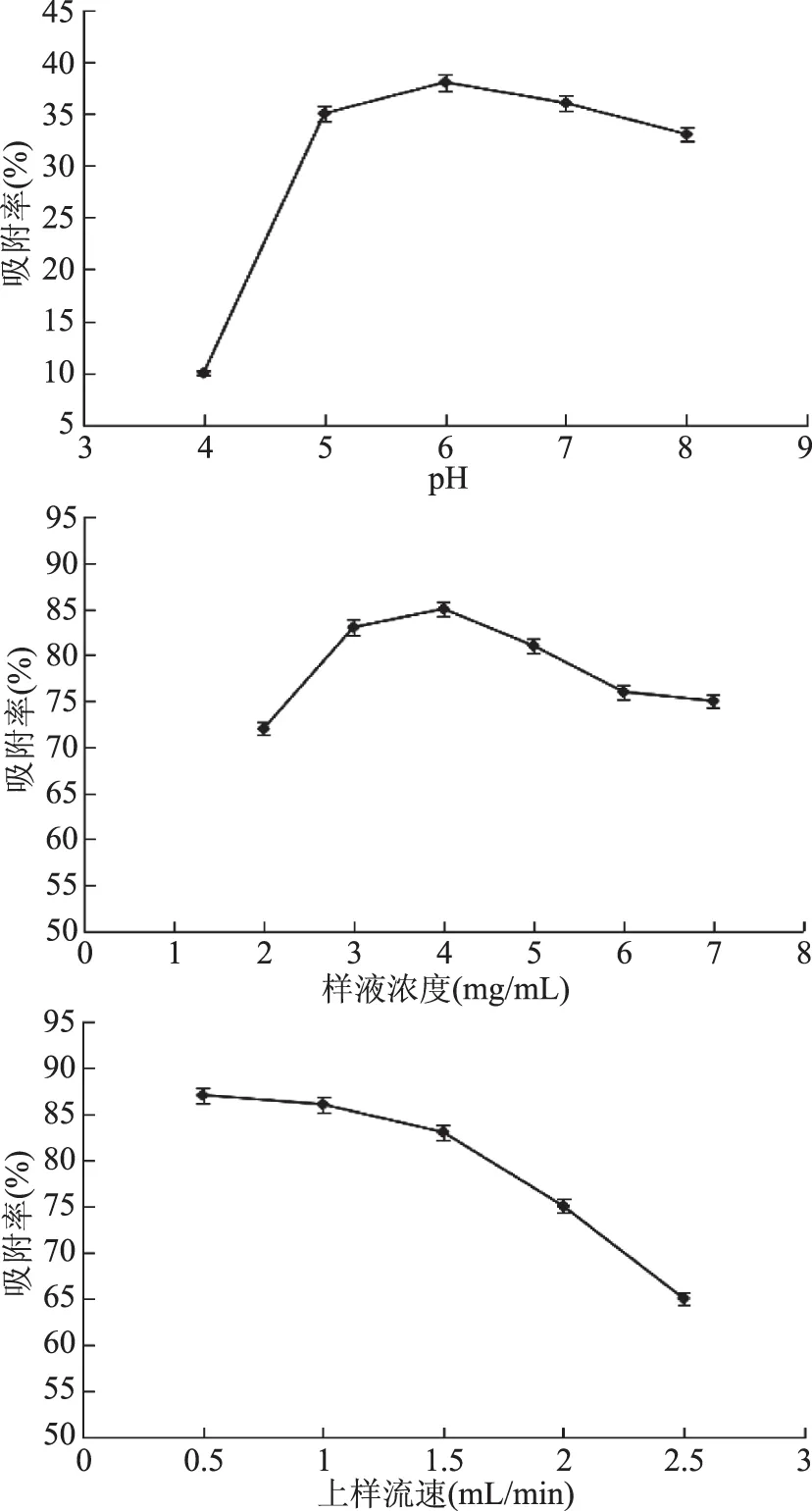
图3 上样液pH、浓度及上样流速对D101大孔吸附树脂吸附率的影响Fig.3 Effect of pH,saponin concentration and sample velocity on the adsorption rate of D101 resin
2.2.3 洗脱流速和洗脱液浓度对解吸率的影响 由图4可以看出,大孔树脂的解吸率随着洗脱流速的增大逐渐降低,流速过快,洗脱性能差,导致洗脱不完全。流速在0.5~1.0 mL/min时解吸率变化很小,从实际情况出发,流速太低,会延长操作时间,因此选择1.0 mL/min(2 BV/h)为最佳洗脱流速。解吸率随着乙醇浓度的增大而逐渐增加,选择浓度为90%的乙醇作为洗脱液进行洗脱。

图4 洗脱流速和洗脱液浓度对解吸率的影响Fig.4 Effect of elution velocity and ionic strength on the desorption rate of saponin
2.2.4 纯化效果 以D101大孔吸附树脂纯化藜麦麸皮总皂苷的粗提物,调节上样液pH为6,上样液中总皂苷浓度为4 mg/mL,上样流速为2 BV/h,上样完成后于洗脱前用蒸馏水洗去水溶性杂质,用90%的乙醇进行洗脱,控制洗脱流速为2 BV/h,收集洗脱液,旋转蒸发浓缩成浸膏后真空干燥为粉末,测定皂苷纯度。计算得出纯化后皂苷的纯度为43.6%,约为纯化前皂苷纯度的2.7倍。
3 结论
采用响应面设计优化得到了藜麦麸皮总皂苷的溶剂回流法提取工艺:乙醇浓度72%、提取温度72 ℃、料液比1∶20.8、时间147 min,在此条件下,皂苷得率达到1.685%。从HPD600、D101、S-8、AB-8 4种大孔吸附树脂中筛选出适合于藜麦麸皮总皂苷纯化的D101型树脂,并对纯化工艺进行了优化,确定了上样浓度4 mg/mL、上样pH6、上样流速2 BV/h、洗脱液乙醇浓度90%、洗脱流速2 BV/h为较优条件,所得总皂苷纯度达到43.6%。上述提取纯化工艺是在实验室条件下获得,工业化应用还有待进行扩大实验,中试条件下如果能采用超声波助溶,提取得率可能会进一步提高,提取时间可能会进一步缩短,另外,对麸皮的处理也很重要,比如采用纤维素酶处理、挤压膨化处理、超微粉碎处理是否会进一步提高提取率还有待于深入研究。
[1]王黎明,马宁,李颂,等. 藜麦的营养价值及其应用前景[J].食品工业科技,2014,35(1):381-389.
[2]贡布扎西,旺姆,张崇玺,等. 南美藜在西藏的生物学特性研究[J].西北农业学报,1994,16(4):43-48.
[3]苗灵香,萌发藜麦成分动态分析及其多酚的研究[D].晋中:山西农业大学,2015.
[4]Abugoch J L E. Quinoa(ChenopodiumquinoaWilld.):composition,chemistry,nutritional,and functional properties[J]. Andvances in Food Nutrition Research,2009(58):1-13.
[5]魏爱春,杨修仕,么杨,等.藜麦营养功能成分及生物活性研究进展[J].食品科学,2015,36(15):272-276.
[6]Stuardo M,Maritin R S. Antifungal properties of quinoa(ChenopodiumquinoaWilld.)alkali treated saponins against Botrytis cinerea[J]. Ind Crops Prod,2008,27(3):296-302.
[7]Hirose Y,Fujita T,Ishii T,et al. Antioxidative properties and flavonoid composition ofChenopodiumquinoaseeds cultivated in Japan[J]. Food Chemistry,2010,119(4):1300-1306.
[8]Woldemichael G M,Wink M. Identification and biological activities of triterpenoid saponins fromChenopodiumquinoa[J]. Agric Food Chem,2001,49(5):2327-2332.
[9]申瑞玲,张文杰,董吉林,等.藜麦的主要营养成分、矿物元素及植物化学物质含量测定[J]. 郑州轻工业学院学报:自然科学版,2015,30(5):17-21.
[10]董晶,张焱,曹赵茹,等. 藜麦总黄酮的超声波法提取及抗氧化活性[J].江苏农业科学,2015,43(4):267-269.
[11]董施彬,宁亚萍,杨喆,等.藜麦总黄酮提取及大孔树脂纯化工艺的研究[J].食品工业科技,2015,36(16):272-278.
[12]孙雪婷,袁俊杰,蒋玉蓉,等. 藜麦种子总黄酮提取及其抗氧化性[J]. 江苏农业科学,2015,43(10):355-358.
[13]任卓伟,倪文杰,刘森.藜麦皂甙的测定研究[J].山西农业科学,2015,43(8):932-935.
[14]刘伟锐,张霞,姜蕊,等. 紫外可见分光光度发测定苣荬菜根部总三萜皂苷的含量[J]. 西北药学杂志,2014,29(6):554-557.
Extractionandpurificationoftotalsaponinsfromquinoabran
XUXiao-qun1,ZHAOWen-ting1,MIAOLing-xiang1,HUONai-rui1,2,*
(1.College of Food Science & Engineering,Shanxi Agricultural University,Jinzhong 030801,China;2. College of Animal Science & Veterinary Medicine,Shanxi Agricultural University,Jinzhong 030801,China)
TS210.1
B
1002-0306(2017)18-0215-06
2017-02-27
许效群(1963-),男,本科,副教授,研究方向:粮油加工,E-mail:13935447190@163.com。
*通讯作者:霍乃蕊(1972-),女,博士,教授,研究方向:生物技术与食品安全,E-mail:tgnrhuo@163.com。
山西省重点研发计划重点项目(201603D21102)。
10.13386/j.issn1002-0306.2017.18.041
